SPECTROMÉTRIE UV / VISIBLE 1- Introduction- - IUT Annecy
SPECTROMÉTRIE UV / VISIBLE 1- Introduction- - IUT Annecy
SPECTROMÉTRIE UV / VISIBLE 1- Introduction- - IUT Annecy
- No tags were found...
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
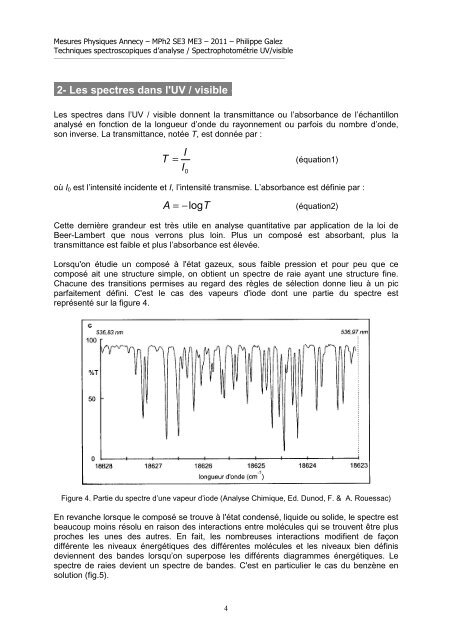
Mesures Physiques <strong>Annecy</strong> – MPh2 SE3 ME3 – 2011 – Philippe GalezTechniques spectroscopiques d’analyse / Spectrophotométrie <strong>UV</strong>/visible______________________________________________________________________________________________2- Les spectres dans l'<strong>UV</strong> / visible--Les spectres dans l’<strong>UV</strong> / visible donnent la transmittance ou l’absorbance de l’échantillonanalysé en fonction de la longueur d’onde du rayonnement ou parfois du nombre d’onde,son inverse. La transmittance, notée T, est donnée par :IT = (équation1)I 0où I 0 est l’intensité incidente et I, l’intensité transmise. L’absorbance est définie par :A = −logT(équation2)Cette dernière grandeur est très utile en analyse quantitative par application de la loi deBeer-Lambert que nous verrons plus loin. Plus un composé est absorbant, plus latransmittance est faible et plus l’absorbance est élevée.Lorsqu'on étudie un composé à l'état gazeux, sous faible pression et pour peu que cecomposé ait une structure simple, on obtient un spectre de raie ayant une structure fine.Chacune des transitions permises au regard des règles de sélection donne lieu à un picparfaitement défini. C'est le cas des vapeurs d'iode dont une partie du spectre estreprésenté sur la figure 4.Figure 4. Partie du spectre d’une vapeur d’iode (Analyse Chimique, Ed. Dunod, F. & A. Rouessac)En revanche lorsque le composé se trouve à l'état condensé, liquide ou solide, le spectre estbeaucoup moins résolu en raison des interactions entre molécules qui se trouvent être plusproches les unes des autres. En fait, les nombreuses interactions modifient de façondifférente les niveaux énergétiques des différentes molécules et les niveaux bien définisdeviennent des bandes lorsqu’on superpose les différents diagrammes énergétiques. Lespectre de raies devient un spectre de bandes. C'est en particulier le cas du benzène ensolution (fig.5).4