You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
Sistem Periodik Unsur<br />
Dalam satu golongan, energi ionisasi akan semakin kecil dari<br />
atas ke bawah<br />
Dalam satu periode, energi ionisasinya semakin besar dari kiri<br />
ke kanan<br />
M<br />
e<br />
n<br />
u<br />
r<br />
u<br />
n<br />
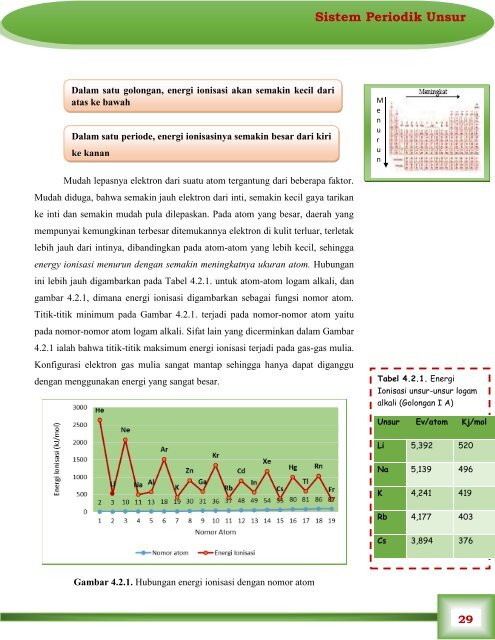
Mudah lepasnya elektron dari suatu atom tergantung dari beberapa faktor.<br />
Mudah diduga, bahwa semakin jauh elektron dari inti, semakin kecil gaya tarikan<br />
ke inti dan semakin mudah pula dilepaskan. Pada atom yang besar, daerah yang<br />
mempunyai kemungkinan terbesar ditemukannya elektron di kulit terluar, terletak<br />
lebih jauh dari intinya, dibandingkan pada atom-atom yang lebih kecil, sehingga<br />
energy ionisasi menurun dengan semakin meningkatnya ukuran atom. Hubungan<br />
ini lebih jauh digambarkan pada Tabel 4.2.1. untuk atom-atom logam alkali, dan<br />
gambar 4.2.1, dimana energi ionisasi digambarkan sebagai fungsi nomor atom.<br />
Titik-titik minimum pada Gambar 4.2.1. terjadi pada nomor-nomor atom yaitu<br />
pada nomor-nomor atom logam alkali. Sifat lain yang dicerminkan dalam Gambar<br />
4.2.1 ialah bahwa titik-titik maksimum energi ionisasi terjadi pada gas-gas mulia.<br />
Konfigurasi elektron gas mulia sangat mantap sehingga hanya dapat diganggu<br />
dengan menggunakan energi yang sangat besar.<br />
Tabel 4.2.1. Energi<br />
Ionisasi unsur-unsur logam<br />
alkali (Golongan I A)<br />
Unsur Ev/atom Kj/mol<br />
Li 5,392 520<br />
Na 5,139 496<br />
K 4,241 419<br />
Rb 4,177 403<br />
Cs 3,894 376<br />
Gambar 4.2.1. Hubungan energi ionisasi dengan nomor atom<br />
29