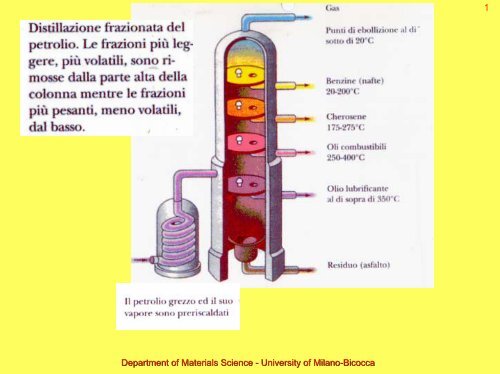
Materiale didattico integrativo - Chimica Organica
Materiale didattico integrativo - Chimica Organica
Materiale didattico integrativo - Chimica Organica
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
Department of Materials Science - University of Milano-Bicocca1
Department of Materials Science - University of Milano-Bicocca2
3ClClC’è forte interazione p-p π: il legame è più forte che non nel caso di unalogeno legato a un carbonio sp 3 . Inoltre, a causa dell’interazione il carboniosp 2 è assai meno elettrofilo che non nel caso di un carbonio sp 3 . Risultato: glialoenuri arilici e vinilici sono assai meno suscettibili di attacchi da parte dinucleofili e si rivelano nei loro confronti relativamente inertiClClClClDepartment of Materials Science - University of Milano-Bicocca
Department of Materials Science - University of Milano-Bicocca4
62catione cicloeptatrienilioo catione tropilioN = 6 sistema π deficientecicloottatetraenil anioneN = 8 Sistema π eccessivoLa regola di Hückel è stata successivamente estesa per definiresistemi antiaromatici quali quelli che, planari e delocalizzati,contengano 4 elettroni π. Il cicloottatetraene se fosse planare,sarebbe antiaromatico. . In realtà il cicloottatetraene non è planare equindi non è antiaromatico: semplicemente è NON AROMATICO EDE’ UN SISTEMA CICLICO INSATURO.cicloottatetraeneDepartment of Materials Science - University of Milano-Bicocca
7DEFINIZIONE REAZIONALESistemi insaturi che mantengono il tipo secondo la definizione di SirRobert Robinson (ca1930)XXElectrophileElectrophileNelle reazioni di addizione elettrofila il sistema NON mantiene il tipoHX ElectrophileElectrophile+ H-XNelle reazioni di sostituzione elettrofila il sistema mantiene il tipoDepartment of Materials Science - University of Milano-Bicocca
Nu8Nu - HNNNelle reazioni di addizione nucleofila il sistema NON mantiene il tipoHNHNa + NH 2-N NH 2+ NaHNelle reazioni di sostituzione nucleofila il sistema mantiene il tipo:reazione di CicibabinDEFINIZIONE MAGNETICASistemi insaturi capaci di sostenere una corrente d'anello quandoimmersi in un campo magneticoDepartment of Materials Science - University of Milano-Bicocca
9La delocalizzazione dei legami π fa si che, quando il sistema sia immerso in uncampo magnetico avvenga interazione con questi generando una “corrente d’anellodanello”che influisce sulle proprietà magnetiche degli atomi che compongono il sistemaaromatico.Department of Materials Science - University of Milano-Bicocca
Department of Materials Science - University of Milano-Bicocca10
Department of Materials Science - University of Milano-Bicocca11
Department of Materials Science - University of Milano-Bicocca12
Department of Materials Science - University of Milano-Bicocca13
in presenza diALOGENOIDRINE14Br 2 + H 2 OHO-Br + HBrACIDO IPOBROMOSOHO-BrBrBrHOHODepartment of Materials Science - University of Milano-Bicocca
15i catalizzatori di idrogenazione sono ingenerale metalli nobili – Pt, Pd, Rd, disolito lavorano a T e pressioneambiente. Il Ni di Raney richiedeTemperature di 80-140°C e pressioneda qualche atmosfera a centinaia diatmosfere.Il Ni Raney si prepara comesotto indicato dalla lega di Raney.Ni-Al + NaOH Ni di Raney + Al(OH) 4 +H 2Lega di Raney 50:50Fessenden:p 429-35piroforico, ha notevole quantità di H 2 adsorbitoIl Pd viene parzialmenteavvelenato da chinolina, BaSO 4.I composti solforati in bassostato di ossidazione sono veleniirreversibiliDepartment of Materials Science - University of Milano-Bicocca
16Gli oli hanno alto contenuto di esteri insaturi, mentre i grassi sono esteriessenzialmente di acidi grassi saturi (Butirrico C4, laurico C12, palmiticoC16, stearico C18, arachico C20)Department of Materials Science - University of Milano-Bicocca
NO! ILPERMANGANATO INAMBIENTE BASICO SIRIDUCE AMANGANATO MnO 3-:BIOSSIDO DIMANGANESE SIFORMA IN AMBIENTENEUTRO (H 2SO 4STECHIOMETRICO.17Il permanganato si riduce a+ Mn 2+ Mn 2+ solo in ambiente acidoe in tali condizioni èfortemente ossidanteIn ambiente acido per H 2SO 4Department of Materials Science - University of Milano-Bicocca
18Dai nitrili + Grignardδ -R 1C N + R 2 MgXR 1C NR 2MgXH 2 OR 2R 1C NH H 2OR 2R 1C H NHOHR 2 C O-NH3R 1Dall’estere acetacetico, alchilazione in ambiente basico, idrolisi e decarbossilazioneOHHOOCH 3BASEOHOOCH 3OR X HROOCH 3H 2 OOHROOHOHDepartment of Materials Science - University of Milano-BicoccaHR
Department of Materials Science - University of Milano-Bicocca19
Carboidrati [es[C 6 (H 2 O) 6 ]20C 6 H 12 O 6C(H 2 O) 6Idrati di carbonioUn esosoLa mutarotazioneDepartment of Materials Science - University of Milano-Bicocca
Department of Materials Science - University of Milano-Bicocca21
Department of Materials Science - University of Milano-Bicocca22
Department of Materials Science - University of Milano-Bicocca23
24NH 2-OHidrossilamminaOssima dell’acetoneRHRC NC NOH Hanti sinOHDepartment of Materials Science - University of Milano-Bicocca
Department of Materials Science - University of Milano-Bicocca25
26Catalizzatori: Pt: : T ambiente e moderata pressione – reazione relativamente lenta;Ni (Raney): alta T (100-150 150 ° C), alta pressione (da qualche a decine diatmosfere); Pd: reazione molto lenta. Tutti non selettivi.Non riducono idoppi legami C=CFessenden:p 551-557Department of Materials Science - University of Milano-Bicocca
27NCNHCH 3NCNHCH 3HNCHNHCH 3HNCHNCH 3Department of Materials Science - University of Milano-BicoccaHCHCH 3
28Stress elettronico del CH 2OHODepartment of Materials Science - University of Milano-Bicocca
cheto-enolicaenolica29OHOLa tautomeria cheto-enolicaenolica viene promossa sia da catalisi acida sia da catalisibasica.Il tautomero enolico è stabilizzato per due ragioni:a) avviene delocalizzazione – e quindi stabilizzazione annullando lo stresselettronico presente nel dichetone (o nel composto dicarbonilico nel caso sitratti ad es dell’estere acetacetico)b) Per la presenza di legame di idrogeno – che nel caso precedente èintramolecolare: in altri casi può essere intermolecolareDepartment of Materials Science - University of Milano-Bicocca
Department of Materials Science - University of Milano-Bicocca30
Si noti come tutte le specie riportate sono più acide del DMSO.Infatti solo per queste specie è possibile ottenere l'anione in DMSOin quantità determinabile e quindi calcolare il pK a Ad esempio iltoluene è molto meno acido del DMSO (pK a , - 42-46): 46): il suo pK a nonpuò essere misurato con esattezza in questo solvente.Sullarilevanzadell'acidità, , riferendoci in particolare alla tabella appena riportata,vanno fatte alcune considerazioni.i) PiridinaFenileLa sostituzione di un anello fenilico conun anello 4-piridico 4passando dal difenilmetano alla 4-benzilpiridina4comporta un incremento di acidità di ben 6 ordini di grandezza!Analogamente si osservi come la 4-amminopiridina 4sia circa10.000 volte più acida dell'anilina.ii) Effetto solvente. In DMSO l'anione derivante dalladeprotonazione del substrato di partenza è presente come ionelibero o, al più, , vicino al controione ma separato da esso da unostrato di molecole di solvente (solventseparated ions).Inoltre sideve considerare che il DMSO, a causa della sua strutturaelettronica, è particolarmente adatto a solvatare il catione,lasciando quindi l'anione sostanzialmente libero da molecole disolvente.Department of Materials Science - University of Milano-Bicocca31
In queste condizioni sono quindi praticamente assenti, o minimizzate, zate, interazioni tral'anione e il solvente. Si può quindi immaginare che specie anioniche, , nelle quali siapresente un'alta densità di carica elettronica su eteroatomi, , vengano megliosolvatate in solventi protici, , i quali, tramite legami di idrogeno, possonoconsiderevolmente stabilizzare la specie carica.Questo è il caso ad esempio degli anioni del nitrometano e del fenolo, i quali inacqua sono notevolmente più stabili che in DMSO, portando ad una aumentodell'acidità dei rispettivi precursori neutri di ben 10-100 100 milioni di volte.32Department of Materials Science - University of Milano-Bicocca
Merita attenzione il dato relativo al malonodinitrile: : il pK, èpraticamente invariato passando dal DMSO a solventi polari qualil'acqua o l'etanolo: pK a (DMSO) = 12, pK a (H 2 O)= 11. Questorisultato è interessante: infatti potrebbe rivelare chenell'anione corrispondente la carica negativa non viene delocalizzata(almeno non particolarmente) sull'atomo di azoto, a differenza di dquanto si dovrebbe avere tenendo conto delle formule di risonanzausualmente riportate nei testi di <strong>Chimica</strong> <strong>Organica</strong>. Questaaffermazione sembrerebbe pertanto confutare la tradizionalevisione del gruppo ciano come forte gruppo elettronattrattoreesercitante un effetto mesomero -M. Recenti studi,basati sullostudio NMR 13 C di un vasto numero di a-cianocarbanioniin DMSO esull'applicazione di relazioni shift 13 C / densità elettronica π hannoconfermato tale ipotesi: la forma chetenimminica non è un buondescrittore della struttura di questi anioni. Alla stessa conclusionehanno condotto le analisi strutturali ai raggi X33Department of Materials Science - University of Milano-Bicocca
Department of Materials Science - University of Milano-Bicocca34
35propiofenoneDi scarso interesse perché reazioniimpetuoseReazione assaienergica: va condottain etere anidroDepartment of Materials Science - University of Milano-Bicocca
36La riduzione concromito di rame,CuCr 2 O 4 è di interesseindustriale e pocoapplicata, così come lariduzione con Na poichépuò dare luogo a diversisottoprodotti. Lariduzione migliore inlaboratorio è con LiAlH 4Department of Materials Science - University of Milano-Bicocca
37H +H 2 NH 2 NCNH 2H 2 NH 2 NCNH 2La guanidina è assai basica ed è uno dei sistemi naturali più basici: questo grazie allaampia delocalizzazione della carica positiva nel corrispondente catione.Department of Materials Science - University of Milano-Bicocca
38AcPAB-OCOOHNH 2p-amminobenzoicofattoreOS NHSITO ACIDOSITO BASICOcrescitaSITO ACIDOdiNH 2SITO BASICOSOO S NNHNH 2SULFATIAZOLODepartment of Materials Science - University of Milano-Bicocca
39R C N + R'MgX R-CO-R' + MgXOH + NH 3Department of Materials Science - University of Milano-Bicocca
Department of Materials Science - University of Milano-Bicocca40
41e 1,2Department of Materials Science - University of Milano-Bicocca
HPreparazione e destino dei sali di diazonio (alchildiazonioe arendiazonio)HONOHHONONO2HNRR'O=NHNRR'42RR'NNRR'HHONNRR'HONNRR'Questo carbocatione subisce il destino che gli è proprio (sostituzione,eliminazione, trasposizione)HH + HO-N=O OHN N OH +HHbaseN=O H 2 O + NO 2 HN NHdiazotatoN N OHNaOH-H +HN=ON N N NN N O - Na +Department of Materials Science - University of Milano-Bicocca
43Fessenden:p 505-508Department of Materials Science - University of Milano-Bicocca
44Acido ipofosforosoRiduzione ad arilidrazine, , ulteriormente riducibili (legame debole N-N) N N)Department of Materials Science - University of Milano-Bicocca
45O -O+NNOHNNHHONNO -HONNOHNNDepartment of Materials Science - University of Milano-Bicocca
46Copulazione con estere acetaceticoO OOCH 2 CH 3H HEstere acetaceticopH debolmentebasicoOHOOCH 2 CH 3NN +Con anilineterziarieH 3 CH 2 COONNHFENILIDRAZONEH 3 CH 2 COOHNNOODepartment of Materials Science - University of Milano-Bicocca
47Fessenden:p 509-515Department of Materials Science - University of Milano-Bicocca
con intermedio di Meisenheimer di Addizione-EliminazioneCondizione necessaria: l’arene deve essere elettronpovero. . Condizione sufficiente:l’arene deve avere il nucleofugo in posizione tale per cui il carbanione è stabilizzatoper delocalizzazione a parziale compenso della perdita di aromaticità.48intermedio di MeisenheimerDepartment of Materials Science - University of Milano-Bicocca
49Meccanismo di eliminazione - addizioneDepartment of Materials Science - University of Milano-Bicocca
γ50Nu - N NuNαNucleofugoNucleofugo = Cl - , Br - , F - , ecc. in posizione α oγN NH 2H +Na + NH 2 -H- H - HNa +N NHNHNNH 2N NHReazione di CicibabinTutte le azine che recano nucleofughi in posizione opportuna subiscono SN Ar peraddizione-eliminazione eliminazione con una grande varietà di nucleofiliDepartment of Materials Science - University of Milano-Bicocca
51L’acidità (pK a ) dipende dal solvente: Fessenden e Fessenden riportano (pK a ) senzaspecificare il solvente: in diversi solventi (H 2 O o DMSO) i (pK a ) possono differire diparecchie unità. Riferirsi perciò sempre ai valori dati in DMSO, i quali, sebbene nontermodinamici sono però assoluti.Il metile dell’acetato d’etile è meno acido delmetile in α al carbonile dell’acetonepercheè ilcarbonile dell’estereestere è meno elettron-attrattoreFessenden:p 690-700Department of Materials Science - University of Milano-Bicocca
52Fessenden:p 705-712CH 3 COCH 2HOCH 3 COCH 2CH 3 CCH 3OOHa caldoOBdiacetonalcol ossido di mesitileDepartment of Materials Science - University of Milano-Bicocca
53A caldo 70°CCH 3OHCHCHCHOOHald crotonicacondensazione crotonicaDepartment of Materials Science - University of Milano-Bicocca
54E’ possibile effettuare Claisen incrociate fraun estere A e un estere B: se entrambi posseggono un H in α al gruppo carbonilicodell’estere estere si formerànno4 prodotti: quelli di autocondensazione di A con A (AA), diB con B (BB), di A (come carbanione ) con B (AB),quello di B (come carbanione) ) conA (BA). Per evitare tutto ciò è necessario a) che uno dei due esteri non posseggaidrigeni in α b) che uno dei due gruppi carbonilici sia estrememente più reattivodell’altro.Department of Materials Science - University of Milano-Bicocca
55Addizione secondo MichaelDepartment of Materials Science - University of Milano-Bicocca
56La riduzione chimica può ancheessere compiuta con altri metalli inambiente acido: Zn, Sn. Inoltre puoanche essere catalitica (3H 2 /NO 2con Pd/C, Pt, Ni-Raney).Department of Materials Science - University of Milano-Bicocca
deprotona57Anione dell’acido carbammicoHO COO HAcido carbonicoCO 2+ H 2 ONH 2 -COOHAcido carbammicoRHN - C O H RNH 2 + H 2 OOAcido N-alchilcarbammicoDepartment of Materials Science - University of Milano-Bicocca
Department of Materials Science - University of Milano-Bicocca58
BASICITA’59dispersioneIl catione dell’ammina terziariaè meno solvatato, quindi menostabilizzatoDepartment of Materials Science - University of Milano-Bicocca
60Stabilizzata per delocalizzazionedel doppietto dell’azoto sull’anellobenzenicoDepartment of Materials Science - University of Milano-Bicocca
Composti aromaticipoliciclici ed eterociclici61OOPORZIONE CHINOIDESTRUTTURACHINOIDEOo-chinoneOp-chinone estruttura p-chinoideFessenden:p 767-774Department of Materials Science - University of Milano-Bicocca
62Fessenden:p 778-789Department of Materials Science - University of Milano-Bicocca
63Reazione di Cicibabin(Tschitschibabin)analogamenteDepartment of Materials Science - University of Milano-Bicocca
Department of Materials Science - University of Milano-Bicocca64
Department of Materials Science - University of Milano-Bicocca65
66H +NHNHNHNHDepartment of Materials Science - University of Milano-Bicocca
67Fessenden:p 961-962Department of Materials Science - University of Milano-Bicocca