Bekijk hoofdstuk 1 - Educatheek.nl
Bekijk hoofdstuk 1 - Educatheek.nl
Bekijk hoofdstuk 1 - Educatheek.nl
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
28 I<strong>nl</strong>eiding Thermodynamica<br />
In dit geval zijn p, v en T de het systeem (het gas) kenmerkende grootheden. Doordat<br />
een toestandsvergelijking geldt, zijn slechts twee van de drie onafhankelijk. Omdat<br />
in beginsel voor elk systeem een toestandsvergelijking is op te stellen is het aantal<br />
onafhankelijke grootheden altijd één minder dan men zou denken.<br />
Van alle verdunde gassen is de toestandsvergelijking:<br />
p·vm = R·T (2.2)<br />
met R = 8,314 510 ± 0,000 070 J/mol·K<br />
Uit de figuren 2.2 en 2.3 blijkt duidelijk dat deze toestandsvergelijking een beperkte<br />
geldigheid heeft. Er zijn twee manieren om aan die beperkte geldigheid te ontkomen.<br />
a. Men definieert een hypothetisch gas:<br />
Een hypothetisch gas dat onder alle omstandigheden voldoet aan de toestandsvergelijking<br />
pvm = RT, noemt men een ideaal gas.<br />
b. Men corrigeert de vergelijking pvm = RT:<br />
Aan de toestandsvergelijking voor een ideaal gas voegt men toe de compressibiliteitsfactor<br />
z:<br />
pvm = zRT (2.3)<br />
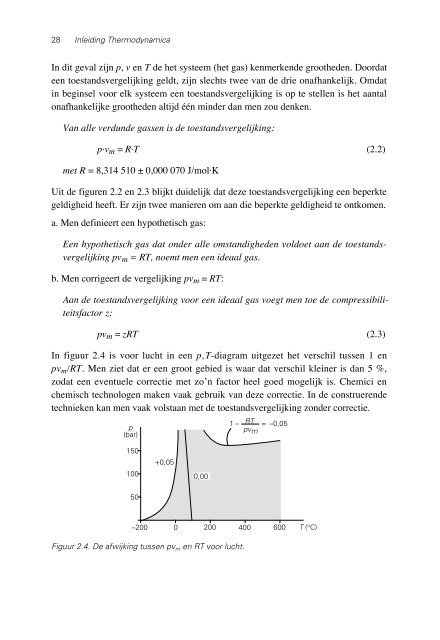
In figuur 2.4 is voor lucht in een p,T-diagram uitgezet het verschil tussen 1 en<br />
pvm/RT. Men ziet dat er een groot gebied is waar dat verschil kleiner is dan 5 %,<br />
zodat een eventuele correctie met zo’n factor heel goed mogelijk is. Chemici en<br />
chemisch technologen maken vaak gebruik van deze correctie. In de construerende<br />
technieken kan men vaak volstaan met de toestandsvergelijking zonder correctie.<br />
p<br />
(bar)<br />
150<br />
100<br />
50<br />
+0,05<br />
0,00<br />
1– RT = –0,05<br />
pvm<br />
–200 0 200 400 600 T (°C)<br />
Figuur 2.4. De afwijking tussen pv m en RT voor lucht.