Bekijk hoofdstuk 1 - Educatheek.nl
Bekijk hoofdstuk 1 - Educatheek.nl
Bekijk hoofdstuk 1 - Educatheek.nl
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
2. Warmteleer 37<br />
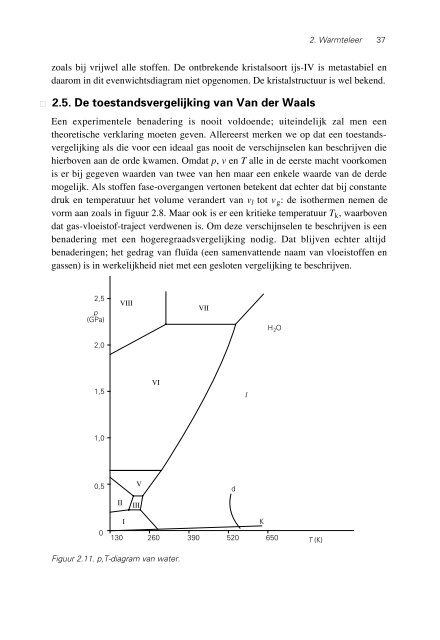
zoals bij vrijwel alle stoffen. De ontbrekende kristalsoort ijs-IV is metastabiel en<br />
daarom in dit evenwichtsdiagram niet opgenomen. De kristalstructuur is wel bekend.<br />
■ 2.5. De toestandsvergelijking van Van der Waals<br />
Een experimentele benadering is nooit voldoende; uiteindelijk zal men een<br />
theoretische verklaring moeten geven. Allereerst merken we op dat een toestandsvergelijking<br />
als die voor een ideaal gas nooit de verschijnselen kan beschrijven die<br />
hierboven aan de orde kwamen. Omdat p, v en T alle in de eerste macht voorkomen<br />
is er bij gegeven waarden van twee van hen maar een enkele waarde van de derde<br />
mogelijk. Als stoffen fase-overgangen vertonen betekent dat echter dat bij constante<br />
druk en temperatuur het volume verandert van vl tot vg: de isothermen nemen de<br />
vorm aan zoals in figuur 2.8. Maar ook is er een kritieke temperatuur Tk, waarboven<br />
dat gas-vloeistof-traject verdwenen is. Om deze verschijnselen te beschrijven is een<br />
benadering met een hogeregraadsvergelijking nodig. Dat blijven echter altijd<br />
benaderingen; het gedrag van fluïda (een samenvattende naam van vloeistoffen en<br />
gassen) is in werkelijkheid niet met een gesloten vergelijking te beschrijven.<br />
2,5<br />
p<br />
(GPa)<br />
2,0<br />
1,5<br />
1,0<br />
0,5<br />
0<br />
VIII<br />
V<br />
II III<br />
VI<br />
130 260 390 520 650<br />
Figuur 2.11. p,T-diagram van water.<br />
I<br />
VII<br />
d<br />
l<br />
K<br />
H 2O<br />
T (K)