Bekijk hoofdstuk 1 - Educatheek.nl
Bekijk hoofdstuk 1 - Educatheek.nl
Bekijk hoofdstuk 1 - Educatheek.nl
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
42 I<strong>nl</strong>eiding Thermodynamica<br />
We vullen deze grootheden in de vergelijking van Van der Waals in:<br />
(π·pk +<br />
Uitwerken geeft ons dan:<br />
a<br />
ω 2 vm‚k 2) (ωvm‚k – b) = Rθ·Tk<br />
De gereduceerde toestandsvergelijking van Van der Waals:<br />
(π + 3<br />
ω<br />
3<br />
2 ) (ω – 1<br />
8<br />
) = θ (2.12)<br />
3<br />
In deze vergelijking komen geen grootheden voor die betrekking hebben op de<br />
eigenschappen van een bepaalde stof. Dat zo’n vergelijking zinvol is, wordt<br />
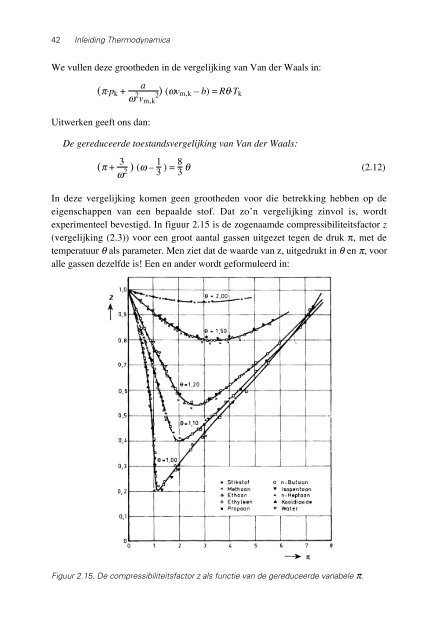
experimenteel bevestigd. In figuur 2.15 is de zogenaamde compressibiliteitsfactor z<br />
(vergelijking (2.3)) voor een groot aantal gassen uitgezet tegen de druk π, met de<br />
temperatuur θ als parameter. Men ziet dat de waarde van z, uitgedrukt in θ en π, voor<br />
alle gassen dezelfde is! Een en ander wordt geformuleerd in:<br />
Figuur 2.15. De compressibiliteitsfactor z als functie van de gereduceerde variabele π.