Samenvatting 1 - Studiant
Samenvatting 1 - Studiant
Samenvatting 1 - Studiant
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
<strong>Samenvatting</strong> Toegepaste Scheikunde Academiejaar 2006-2007<br />
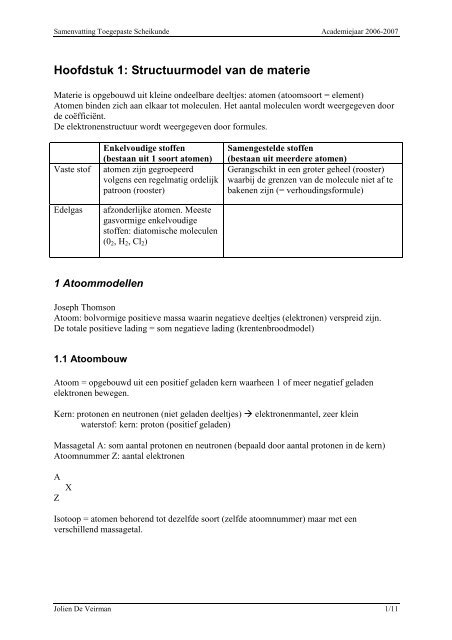
Hoofdstuk 1: Structuurmodel van de materie<br />
Materie is opgebouwd uit kleine ondeelbare deeltjes: atomen (atoomsoort = element)<br />
Atomen binden zich aan elkaar tot moleculen. Het aantal moleculen wordt weergegeven door<br />
de coëfficiënt.<br />
De elektronenstructuur wordt weergegeven door formules.<br />
Vaste stof<br />
Edelgas<br />
Enkelvoudige stoffen<br />
(bestaan uit 1 soort atomen)<br />
atomen zijn gegroepeerd<br />
volgens een regelmatig ordelijk<br />
patroon (rooster)<br />
afzonderlijke atomen. Meeste<br />
gasvormige enkelvoudige<br />
stoffen: diatomische moleculen<br />
(0 2 , H 2 , Cl 2 )<br />
Samengestelde stoffen<br />
(bestaan uit meerdere atomen)<br />
Gerangschikt in een groter geheel (rooster)<br />
waarbij de grenzen van de molecule niet af te<br />
bakenen zijn (= verhoudingsformule)<br />
1 Atoommodellen<br />
Joseph Thomson<br />
Atoom: bolvormige positieve massa waarin negatieve deeltjes (elektronen) verspreid zijn.<br />
De totale positieve lading = som negatieve lading (krentenbroodmodel)<br />
1.1 Atoombouw<br />
Atoom = opgebouwd uit een positief geladen kern waarheen 1 of meer negatief geladen<br />
elektronen bewegen.<br />
Kern: protonen en neutronen (niet geladen deeltjes) elektronenmantel, zeer klein<br />
waterstof: kern: proton (positief geladen)<br />
Massagetal A: som aantal protonen en neutronen (bepaald door aantal protonen in de kern)<br />
Atoomnummer Z: aantal elektronen<br />
A<br />
Z<br />
X<br />
Isotoop = atomen behorend tot dezelfde soort (zelfde atoomnummer) maar met een<br />
verschillend massagetal.<br />
Jolien De Veirman 1/11
<strong>Samenvatting</strong> Toegepaste Scheikunde Academiejaar 2006-2007<br />
1.2 Structuur van de elektronenwolk<br />
1.2.1 Atoommodel van Bohr-Sommerfeld<br />
Elektronen bewegen om de kern heen in cirkelvormige of ellipsvormige banen (= 7 schillen of<br />
7 energieniveaus). De elektronen daarop hebben een welbepaalde energiewaarde, die groter is<br />
naarmate de straal van de baan toeneemt. Een hoofdniveau wordt opgesplitst in n subniveaus<br />
(s, p, d en f subniveau met 2,6,10,14)<br />
schil n aantal e -<br />
K 1 2<br />
L 2 8<br />
M 3 18<br />
N 4 32<br />
schil n Subniveaus aantal e -<br />
K 1 s 2<br />
L 2 sp 2 6<br />
M 3 spd 2 6 10<br />
N 4 spdf 2 6 10 14<br />
1.2.2 Elektronenconfiguratie<br />
= hoe verschillende schillen en subschillen verdeeld zijn<br />
1s<br />
2s 2p<br />
3s 3p 3d<br />
4s 4p 4d 4f<br />
5s 5p 5d 5f<br />
6s 6p 6d 6f<br />
7s 7p 7d 7f<br />
2.1 Periodiek Systeem der Elementen (PSE)<br />
Eigenschappen van elementen worden bepaald door het aantal elektronen op de buitenste<br />
schil. Het atoomnummer komt overeen met het rangnummer in het periodiek systeem<br />
(stijgend rangnummer). Horizontale rij of periode komt overeen met de bepaalde schil.<br />
Elementen waarbij het laatst geplaatste elektron in een gelijksoortig subniveau voorkomt,<br />
staan vertikaal onder mekaar in eenzelfde groep.<br />
Jolien De Veirman 2/11
<strong>Samenvatting</strong> Toegepaste Scheikunde Academiejaar 2006-2007<br />
2.1.1 Hoofdgroepen of a-groepen<br />
Valentie-elektronen: elementen van eenzelfde a-groep hebben eenzelfde aantal elektronen op<br />
de buitenste schil.<br />
s-blok: laatste elektron in s-subschil groepen Ia en IIa<br />
p-blok: laatste elektron in p-subschil groepen IIIa tot groep 0<br />
2.1.2 Nevengroepen of b-groepen<br />
d-blok: laatste elektron in b-subschil groepen Ib en VIII<br />
trapvormige scheidingslijn: links metalen, rechts niet-metalen<br />
2 Chemische binding<br />
Edelgassen zijn chemisch inert en hebben een octetstructuur. Dit is een stabiele configuratie<br />
waarnaar andere atomen streven.<br />
2.1 Ionenbinding<br />
Een metaal geeft elektronen af aan een niet metaal of een niet metaal neemt elektronen op van<br />
een metaal.<br />
2.2 Covalente binding<br />
Binding tussen 2 niet metalen<br />
2.2.1 Gewone covalente binding<br />
Om octetstructuur te krijgen: elektronen gemeenschappelijk stellen. Elk atoom levert dan<br />
evenveel elektronen.<br />
Lewis: stippen als individuele elektronen en strepen voor elektronenparen (Lewis-notatie).<br />
Enkelvoudige binding: het gemeenschappelijk stellen van een elektron om de stabiele<br />
octetstructuur te bereiken. Een niet metaal gaat zoveel gewone covalente vindingen aan als<br />
het elektronen tekort heeft.<br />
Jolien De Veirman 3/11
<strong>Samenvatting</strong> Toegepaste Scheikunde Academiejaar 2006-2007<br />
2.2.2 Covalente binding van het donor-acceptortype<br />
Het gemeenschappelijk elektronenpaar is afkomstig van 1 atoom. Een atoom met een vrij<br />
elektronenpaar (donor) kan dit elektronenpaar gemeenschappelijk stellen met een ander atoom<br />
(acceptor).<br />
2.2.3 Polariteit van moleculen<br />
EN-waarde: capaciteit van een atoom om elektronen in een binding naar zich toe te trekken<br />
Het elektronenpaar verschuift naar het element met de grootste EN-waarde.<br />
Polaire covalente binding<br />
verschuiving sterker naarmate het verschil in EN-waarde groter is.<br />
geeft aanleiding tot polaire moleculen of dipoolmoleculen<br />
Apolaire covalente binding<br />
binding tussen 2 identieke atomen<br />
molecule symmetrische vorm partiële ladingen compenseren elkaar molecule apolair<br />
2.2.4 Oxidatiegetal van een atoom<br />
Oxidatiegetal of oxidatietrap = lading die het atoom in een binding krijgt wanneer de<br />
verschuiving van de bindingselektronen volledig zou zijn.<br />
Ionenbinding<br />
Verschuiving volledig. OG = lading ionen<br />
Polaire covalente binding<br />
Apolaire covalente binding<br />
Geen verschuiving. OG = 0<br />
2.3 Metaalbinding<br />
Metaalrooster: ordelijk gerangschikte positieve metaalionen bijeengehouden door vrije<br />
elektronen.<br />
Jolien De Veirman 4/11
<strong>Samenvatting</strong> Toegepaste Scheikunde Academiejaar 2006-2007<br />
Hoofdstuk 2: Het gedrag van stoffen in water<br />
1 Water als polair oplosmiddel<br />
Polaire stoffen lossen goed op in polaire oplosmiddelen (water, alcohol)<br />
Apolaire stoffen lossen goed op in apolaire oplosmiddelen (hexaan, ether, benzine)<br />
Concentratie van een oplossing: hoeveelheid opgeloste stof aanwezig in een bepaalde<br />
hoeveelheid oplossing.<br />
Volumeprocent: per procent het aantal ml product per 100 ml (alcohol in dranken)<br />
Massaprocent: g/100 g (voedingswaren, mengmeststoffen)<br />
2 Elektrolyten<br />
= samengestelde stoffen die, opgelost in water, uiteenvallen in ionen en daardoor de<br />
elektrische stroom geleiden<br />
3 Anorganische verbindingsklassen<br />
Verbindingsklasse: groep verbindingen die welbepaalde chemische eigenschappen gemeen<br />
hebben.<br />
3.1 Zuren<br />
= elektrolyten die oplost in water H + - ionen (protonen) afsplitsen. Het negatieve ione dat<br />
hierbij ontstaat noemen we de zuurrest.<br />
Indicator: kleurstof die verandert van kleur onder invloed van zuren<br />
bvb. Lakmoes, fenolftaleïne, methyloranje<br />
3.1.1 Binaire zuren<br />
Opgebouwd uit atomen van 2 elementen: waterstof + niet-metaal (-ide)<br />
HCl: waterstofchloride<br />
HBr: waterstofbromide<br />
Jolien De Veirman 5/11
<strong>Samenvatting</strong> Toegepaste Scheikunde Academiejaar 2006-2007<br />
3.1.2 Ternaire zuren<br />
Opgebouwd uit atomen van 3 elementen: waterstof + niet-metaal + zuurstof = oxozuren<br />
Formule Triviale naam Systematische naam<br />
H 2 SO 4 zwavelzuur waterstofsulfaat<br />
HNO 3 salpeterzuur waterstofnitraat<br />
H 3 PO 4 fosforzuur waterstoffosfaat<br />
H 2 CO 3 koolzuur waterstofcarbonaat<br />
3.2 Hydroxiden<br />
= elektrolyten die in water OH - -ionen (hydroxide-ionen) kunnen afsplitsen en basische of<br />
alkalische oplossingen vormen<br />
pH-waarde is afhankelijk van de concentratie H + en OH - -ionen<br />
3.3 Zouten<br />
Splitsen in een positief ion en een negatief zuurrestion<br />
3.4 Oxiden<br />
3.5 Chemische reactie<br />
= stoffen bij elkaar brengen andere stoffen worden gevormd<br />
Atoomsoorten blijven bewaard, de atomen herschikken zich enkel<br />
Uitgangsstoffen: reagentia<br />
Nieuw gevormde stoffen: reactieproducten<br />
Wet van Lavoisier: één of meer reagentia één of meer reactieproducten<br />
Jolien De Veirman 6/11
<strong>Samenvatting</strong> Toegepaste Scheikunde Academiejaar 2006-2007<br />
4 Hardheid van water<br />
Uitgedrukt in hardheidsgraden. Franse hardheidsgraden.<br />
1° FH = 10g gevormde CaCO 3 per m³ (1000 l water)<br />
Hard water: + 15° FH<br />
Verwering = onder invloed van water vast gesteente afbreken<br />
Erosie = materiaal wordt door stromend water of wind weggevoerd<br />
Kwaliteitsnormen drinkwater<br />
- aangenaam om te drinken<br />
- niet schadelijk voor de gezondheid<br />
- geen pathogene organismen bevatten<br />
- comfortabel in gebruik bvb. niet te hard<br />
blijvende hardheid: sulfaten en chloriden<br />
tijdelijke hardheid: meest voorkomend (warmwaterkraan, wasmachine, koffiezet)<br />
Mg 2+ en Ca 2+ -ionen in water opgelost verhitten van water ionen verdwijnen <br />
ketelsteen verwijderen met zuren<br />
5 Zure neerslag<br />
Zie milieukunde 2 FM<br />
Jolien De Veirman 7/11
<strong>Samenvatting</strong> Toegepaste Scheikunde Academiejaar 2006-2007<br />
Hoofdstuk 3: Metalen<br />
Enkelvoudige stoffen: goud en zilver<br />
Samengestelde stoffen: mineralen die voorkomen in ertsen (mineralen + andere gesteenten, de<br />
zogenaamde ‘ganggesteenten’)<br />
Erts fysisch proces : ganggesteente<br />
mineraal<br />
chemisch proces metaal<br />
1 Redoxreacties<br />
= reactie die gepaard gaat met de overdracht van elektronen van een reductor naar een<br />
oxidator. (verandering van oxidatiegetallen)<br />
Oxidatie: elektronenafgave (verhoging OG)<br />
Oxidator: oxideert een andere stof en wordt zelf gereduceerd<br />
Reductie: elektronenopname (verlaging OG)<br />
Reductor: reduceert een andere stof en wordt zelf geoxideerd<br />
Het aantal elektronen dat bij de oxidatie wordt afgegeven = aantal elektronen dat bij de<br />
reductie wordt opgenomen. De elektronenbalans moet in evenwicht zijn voor het opstellen<br />
van de reactievergelijking.<br />
2 Spanningsreeks van de metalen.<br />
Metalen worden gerangschikt volgens dalend reducerend vermogen<br />
K Na Ca Mg Al Zn Fe<br />
Sterke reductoren <br />
Oxideren, roesten<br />
gemakkelijk<br />
H² Cu Ag Hg Pt Au<br />
Zwakke reductoren <br />
Reageert niet met zuur<br />
3 Metallurgie van ijzer<br />
4 Andere belangrijke metalen<br />
5 Corrosie van metalen<br />
= aantasting van metalen als gevolg van chemische of fysische processen (roesten)<br />
Bescherming:<br />
- elektrolytische bescherming: op stalen constructies een ander metaal aanbrengen (zink)<br />
- legeren: corrosie tegengaan door middel van roestvrij staal (chroom, nikkel)<br />
- deklagen: verf<br />
Jolien De Veirman 8/11
<strong>Samenvatting</strong> Toegepaste Scheikunde Academiejaar 2006-2007<br />
Hoofdstuk 4: Verbranding<br />
1 Energetische aspecten van een chemische reactie<br />
Chemische reactie energie-uitwisseling<br />
Exo-energetische reactie Endo-energetische reactie<br />
U komt vrij wordt opgeslorpt<br />
U reactieproduct laag hoog<br />
U reagentia hoog laag<br />
Voorbeeld verbranding voedsel fotosynthese<br />
Activeringsenergie U a : energie die toegevoegd moet worden om een reactie op gang te<br />
brengen.<br />
2 Organische verbindingsklassen<br />
Vitalisme: levende organismen<br />
Wöhler: uit organische stof bekomt men ureum<br />
koolstofketens of koolstofringen<br />
4 enkelvoudige koolstofbindingen<br />
Tetraëder: bindingshoeken van 109°28’<br />
2.1 Koolwaterstoffen<br />
2.1.1 Acyclische of alifatische KWS<br />
Open koolstofketen<br />
A. Alkanen<br />
Verzadigd, enkele bindingen. C n H 2n + 2<br />
I. Overtakte ketens<br />
CH 4 methaan gas<br />
C 2 H 6 ethaan gas<br />
C 3 H 8 propaan gas<br />
C 4 H 10 butaan gas<br />
Jolien De Veirman 9/11
<strong>Samenvatting</strong> Toegepaste Scheikunde Academiejaar 2006-2007<br />
II. Vertakte ketens<br />
Alkylgroep: atoomgroep met 1 waterstofatoom minder dan het oorspronkelijke atoom<br />
CH 3 – CH – CH3<br />
l<br />
CH 3<br />
propaan<br />
methyl<br />
Positie alkylgroep: alkylgroep nummeren om de kleinst mogelijke nummers te krijgen<br />
B. Alkenen en alkynen<br />
Alkenen: Onverzadigde KWS<br />
2-voudige binding C n H 2n<br />
Alkynen: 3-voudige binding C n H 2n-2<br />
2.1.2 Alicyclische KWS<br />
Ringkoolstofatomen<br />
2.1.3 Aromatische KWS<br />
Benzeenring: zesring met afwisselend dubbele binding<br />
2.2 Koolstofverbindingen met karakteristieke groepen<br />
2.2.1 Alcoholen<br />
Hydroxylgroep (OH-groep)<br />
2.2.2 Carbonzuren<br />
Carboxylgroep (COOH)<br />
2.2.3 Ketonen<br />
Carbonylgroep tussen 2 koolstofatomen<br />
2.2.4 Aldehyden<br />
Aldehydegroep (CHO)<br />
Jolien De Veirman 10/11
<strong>Samenvatting</strong> Toegepaste Scheikunde Academiejaar 2006-2007<br />
3 Fossiele brandstoffen<br />
3.1 Energie uit de grond<br />
Steenkool, aardolie en aardgas<br />
Hoofdbestanddeel: methaan<br />
Verbrandingswarmte: hoeveelheid energie die vrijkomt bij de volledige verbranding van 1<br />
mol van een stof<br />
3.2 Energie voor transport<br />
Aardolie kan door gefractioneerde destillatie gescheiden worden in verschillende fracties.<br />
- LPG (Liquid Petroleum Gas): mengsel propaan en butaan<br />
- Benzine: mengsel KWS van 6 tot 12 koolstofatomen<br />
- Cracking: hogere KWS (hogere fractie omzetten in moleculen dmv katalysator)<br />
Voortijdige ontbranding: kloppen van de moto rendementsverlies<br />
Kwaliteit van benzine hangt af van het octaangetal<br />
- heptaan: slechte brandstof, waarde 0<br />
- iso-octaan: klopvaste brandstof, waarde 100<br />
Octaangetal opdrijven door een antiklopmiddel (tetraethyllood)<br />
Reforming: onvertakte bindingen worden katalytisch in vertakte isomeren omgezet.<br />
Kerosine: vliegtuigen<br />
Gasolie en lichte stookolie: dieselmotoren<br />
Zware stookolie: industriële ovens, scheepvaartmotoren<br />
4 Vuur en brand<br />
Branddriehoek: brandstof (hout, papier, vloeistof, gas), dizuurstof, warmte (vlam, vonk, hitte)<br />
Brand vermijden = het uit elkaar houden van deze 3 elementen<br />
Brand blussen = het doorbreken van deze driehoek<br />
Kan gebeuren door:<br />
- wegnemen van de brandstof<br />
- wegnemen van dizuurstof<br />
- afkoeling<br />
Explosie = snelle reactie die een grote hoeveelheid energie en gasvormige producten<br />
vrijmaakt hoge druk<br />
Jolien De Veirman 11/11