Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
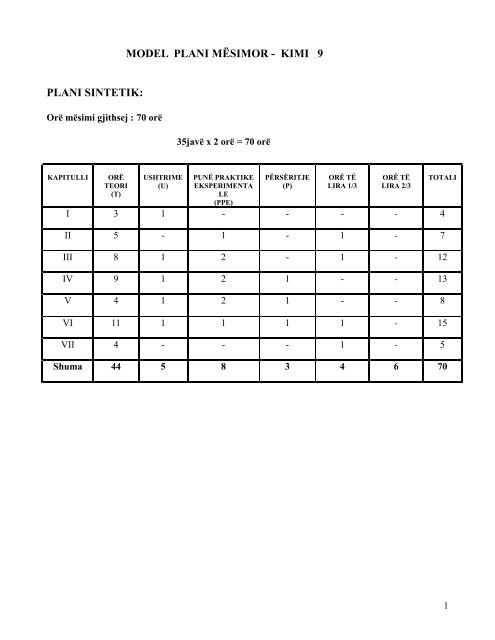
<strong>PLANI</strong> SINTETIK:<br />
Orë mësimi gjithsej : 70 orë<br />
KAPITULLI<br />
ORË<br />
TEORI<br />
(T)<br />
<strong>MODEL</strong> <strong>PLANI</strong> <strong>MËSIMOR</strong> - <strong>KIMI</strong> 9<br />
USHTRIME<br />
(U)<br />
35javë x 2 orë = 70 orë<br />
PUNË PRAKTIKE<br />
EKSPERIMENTA<br />
LE<br />
(PPE)<br />
PËRSËRITJE<br />
(P)<br />
ORË TË<br />
LIRA 1/3<br />
ORË TË<br />
LIRA 2/3<br />
I 3 1 - - - ‐ 4<br />
II 5 - 1 - 1 ‐ 7<br />
III 8 1 2 - 1 ‐ 12<br />
IV 9 1 2 1 - ‐ 13<br />
V 4 1 2 1 - ‐ 8<br />
VI 11 1 1 1 1 ‐ 15<br />
VII 4 - - - 1 ‐ 5<br />
TOTALI<br />
Shuma 44 5 8 3 4 6 70<br />
1
Nr<br />
1<br />
2<br />
3<br />
4<br />
Planifikimi vjetor me objektiva:<br />
Kapitulli<br />
Kapitulli I<br />
Energjia<br />
dhe<br />
reaksionet<br />
kimike<br />
4 orë<br />
( 3T, 1U)<br />
Objektivat e kapitullit<br />
1-Të jap konceptin e energjisë.<br />
2-Të shpjegojë format e energjisë.<br />
3-Të argumentojë ndryshimin midis<br />
nxehtësisë dhe temperaturës<br />
1-Të përkufizojë energjinë së<br />
brendshme.<br />
2-Të dallojë reaksionet ekzotermike<br />
nga reaksionet endotermike.<br />
3-Të argumentojë sasinë e<br />
nxehtësisë që thithet ose çlirohet në<br />
një reaksion si ndryshim të energjisë<br />
së brendshme të produkteve me atë<br />
të reaktantëve.<br />
1-Të përkufizojë efektin termik të<br />
reaksionit.<br />
2-Të dallojë barazimet termokimike<br />
nga barazimet kimike.<br />
3-Të bëjë interpretimin molar të<br />
barazimeve termokimike.<br />
1-Të shkruajë barazimet<br />
termokimike<br />
2-Të përcaktojë reaksionet nëse janë<br />
ekzo apo endotermike<br />
3-Të njehsojë sasinë e nxehtësisë që<br />
thithet ose çlirohet gjatë reaksioneve<br />
5 1-Të përkufizojë numrin e oksidimit<br />
Kapitulli II 2-Të shpjegojë konceptin numër<br />
oksidimi duke analizuar lidhjet<br />
6<br />
Reaksionet<br />
e oksidoreduktimit<br />
7 orë<br />
kimike midis atomeve në një<br />
molekulë.<br />
3-Të argumentojë ndryshimin midis<br />
n.o dhe valencës së një elementi.<br />
1-Të njohë rregullat për përcaktimin<br />
(5T, 1PPE)<br />
+ 1orë e lirë<br />
e n.o të një elementi në një<br />
substancë të thjeshtë apo të përbërë.<br />
2-Të zbatojë rregullat për vendosjen<br />
e n.o në përbërje dyjare.<br />
3-Të zbatojë rregullat për vendosjen<br />
e n.o në përbërje trijare.<br />
7<br />
1-Të njehsojë n.o të një elementi në<br />
një substancë të thjeshtë apo të<br />
përbërë.<br />
2-Të zbatojë duke përdorur rregullat<br />
kryesore njehsimin e n.o në përbërje<br />
të ndryshme.<br />
O<br />
r<br />
ë<br />
2<br />
3<br />
4<br />
1<br />
1<br />
2<br />
3<br />
Temat për çdo orë<br />
Energjia.<br />
Reaksionet ekzotermike<br />
dhe endotermike.<br />
Barazimet termokimike<br />
dhe nxehtësia e<br />
reaksionit kimik.<br />
Ushtrime mbi barazimet<br />
termokimike dhe<br />
nxehtësinë e reaksionit<br />
kimik.<br />
Numri i oksidimit.<br />
Valenca dhe numri i<br />
oksidimit.<br />
Rregullat për njehsimin e<br />
numrit të oksidimit.<br />
Njehsime me numrin e<br />
oksidimit.<br />
Materiali<br />
burimor<br />
teksti<br />
internet<br />
ushtrime<br />
teksti<br />
teksti<br />
teksti<br />
Mjetet<br />
mësimore<br />
tabela<br />
modele të<br />
molekulave<br />
2
8<br />
9<br />
10<br />
11<br />
12<br />
13<br />
14<br />
Orë e lirë<br />
1/3<br />
Kapitulli III<br />
Elektrokimia<br />
12 orë<br />
(8T, 1U, 2PPE)<br />
+ 1 orë e lirë<br />
1-Të dallojë një reaksion redoks nga<br />
një reaksion joredoks.<br />
2-Të interpretojë procesin e oksidimit<br />
dhe reduktimit.<br />
3-Të argumentojë procesin e<br />
oksidimit dhe procesin reduktimit në<br />
termin e humbjes ose fitimit të<br />
elektroneve.<br />
1-Të barazojë reaksione të thjeshta<br />
redoks.<br />
2-Të ndërtojë skemën elektronike<br />
duke u bazuar në skemën e dhënies<br />
dhe marjes së elektroneve.<br />
3- Të caktojë koeficientet në<br />
barazimet e reaksioneve redoks sipas<br />
bilancit elektronik dhe atomik.<br />
1-Të zbatojë rregullat e vendosjes së<br />
n.o në përbërjet dyjare dhe trijare.<br />
2-Të barazojë reaksione të thjeshta<br />
redoks.<br />
3-Të vendosë koeficientët në<br />
reaksionet redoks sipas bilancit<br />
elektronik dhe atomik.<br />
1-Të zbatojë njohuritë marra në<br />
praktikën laboratorike.<br />
2-Të përcaktojë në reaksionet e<br />
dhëna oksiduesin dhe reduktuesin<br />
1- Të përkufizojë termat<br />
elektrokimi,element galvanik,<br />
elektrolizë.<br />
2-Të përshkruajë procesin e<br />
përcjellshmërisë elektrike te metalet.<br />
3-Të argumentojë pse metalet e<br />
ngurtë e përcjellin rrymën elektrike.<br />
1-Të përshkruajë përcjellshmërinë<br />
elektrike në lëngje.<br />
2-Të dallojë përcjellshmërinë<br />
metalike nga përcjellshmëria<br />
elektrolitike.<br />
3-Të argumentojë ndryshimin midis<br />
përcjellshmërisë jonike nga ajo<br />
elektrolitike.<br />
1-Të përshkruajë aktivitetin e<br />
metaleve sipas aftësisë së tyre për të<br />
lëshuar elektronet.<br />
2-Të krahasojë vetitë reduktuese të<br />
metaleve sipas vendit që zënë në<br />
rradhën e aktivitetit.<br />
3-Të argumentojë aktivitetin e<br />
metaleve sipas vendit që zënë në<br />
rradhën e aktivitetit.<br />
4<br />
5<br />
1<br />
Reaksione<br />
oksido–reduktimi.<br />
Barazimi i koeficientëve<br />
në reaksionet redoks.<br />
Ushtrime.<br />
6 Punë praktike<br />
eksperimentale:<br />
Reaksione<br />
oksido-reduktimi.<br />
1<br />
2<br />
3<br />
Elektrokimia.<br />
Përcjellshmëria<br />
elektrike në trupat e<br />
ngurtë.<br />
Përcjellshmëria<br />
elektrike në lëngje.<br />
Rradha e aktivitetit të<br />
metaleve.<br />
teksti<br />
teksti<br />
teksti<br />
teksti<br />
teksti<br />
mjetet e<br />
P. lab<br />
tabela<br />
skema<br />
3
15<br />
16<br />
17<br />
18<br />
19<br />
20<br />
1-Të përshkruajë ndërtimin e një<br />
elementi galvanik.<br />
2-Të shpjegojë funksionimin e një<br />
elementi galvanik.<br />
3-Të shkruajë gjysmëreaksionet që<br />
ndodhin në secilën elektrodë dhe<br />
reaksionin e përgjithshëm.<br />
1-Të përshkruajë ndërtimin e disa<br />
lloje baterish që përdoren në jetën e<br />
përditshme.<br />
2-Të tregojë përdorimet praktike të<br />
baterive të ndryshme<br />
3-Të tregojë dëmet që shkaktojnë në<br />
mjedis bateritë.<br />
1-Të përshkruajë ndërtimin e<br />
elektrolizerit.<br />
2-Të shpjegojë procesin e elektrolizës<br />
së substancave në gjendje të shkrirë.<br />
3-Të tregojë ngjashmëritë dhe<br />
ndryshimet midis elektrolizës dhe<br />
elementit galvanik.<br />
1-Të njohë rregullat e shkarkimit të<br />
joneve të tretësirave ujore gjatë<br />
elektrolizës.<br />
2-Të përshkruajë elektrolizën e<br />
tretësirave ujore të elektrolitëve të<br />
ndryshëm.<br />
3-Të interpretojë rradhën e<br />
shkarkimit të joneve në tretësirat<br />
ujore të elektrolitëve.<br />
1-Të paraqesë produktet e<br />
elektrolizës së tretësirave ujore me<br />
elektroda aktive dhe pasive.<br />
2-Të përshkruajë procesin e veshjes<br />
elektrolitike të metaleve.<br />
3-Të tregojë ndryshimet e<br />
elektrolizës së tretësirave ujore me<br />
elektroda inerte dhe me elektroda<br />
aktive.<br />
1-Të tregojë drejtimin e lëvizjes së<br />
elektroneve në një reaksion redoks.<br />
2-Të përcaktojë ≠ e masës së<br />
elektrodave gjatë funksionimit të<br />
elementit galvanik.<br />
3-Të paraqesë produktet e<br />
elektrolizës së tretësirave ujore me<br />
elektroda inerte.<br />
4-Të njehsojë sasitë e produkteve të<br />
përftuara gjatë elektrolizës së<br />
substancave të ≠<br />
4<br />
5<br />
6<br />
7<br />
8<br />
9<br />
Elementi galvanik.<br />
Bateritë.<br />
Elektroliza esubstancave<br />
në gjendje të shkrirë.<br />
Elektroliza e tretësirave<br />
ujore.<br />
Elektroliza me anodë të<br />
tretshme.Veshja<br />
elektrolitike e metaleve.<br />
Ushtrime për elementin<br />
galvanik dhe<br />
elektrolizën.<br />
teksti<br />
internet<br />
teksti<br />
teksti<br />
teksti<br />
materiale<br />
ndihmëse<br />
bateri të<br />
ndryshme<br />
aparat<br />
elektrolize<br />
4
21<br />
22<br />
23<br />
24<br />
25<br />
26<br />
27<br />
28<br />
Orë e lirë<br />
1/3<br />
Kapitulli IV<br />
Përbërjet<br />
organike.<br />
Hidrokarburet<br />
e ngopur,<br />
alkanet,<br />
cikloalkanet<br />
13 orë<br />
(9T,1U, 2PPE,<br />
1P)<br />
1-Të zbatojë njohuritë teorike në<br />
praktikën laboratorike.<br />
2-Të shkathtësohet në ndërtimin e<br />
një elementi galvanik<br />
3-Të përshkruajë elementët<br />
përbërës të tij.<br />
1-Të ngrejë aparatin Hoffman.<br />
2-Të kryejë eksperimentin e<br />
elektrolizës.<br />
3-Të paraqesë produktet e<br />
elektrolizës së ujit.<br />
1-Të listojë disa ngjashmëri dhe<br />
dallime midis elementit galvanik<br />
dhe elektrolizës.<br />
2-Të tregojë që proceset<br />
elektrokimike kanë të përbashkët<br />
reaksionet redoks.<br />
3-Të krahasojë ndryshimet midis<br />
funksionimit të elementit galvanik<br />
me atë të elektrolizës.<br />
1-Të përshkruajë historinë e<br />
lindjes së kimisë organike.<br />
2-Të tregojë rëndësinë e kimisë<br />
organike në jetën e përditshme.<br />
1-Të zbatojë praktikisht zbulimin<br />
e karbonit në përbërjet organike.<br />
2- Të demonstrojë zbulimin e H<br />
dhe N në përbërjet organike.<br />
3-Të shpjegojë si bëhet analiza<br />
cilësore dhe sasiore e një<br />
përbërjeje organike.<br />
1-Të përshkruajë veçoritë e<br />
elementit karbon.<br />
2-Të dallojë lidhjet njëfishe,<br />
dyfishe, trefishe midis atomeve të<br />
karbonit në përbërjet organike.<br />
3-Të krahasojë përbërjet organike<br />
me ato inorganike.<br />
1-Të listojë llojet e skeleteve<br />
karbonike.<br />
2-Të ndërtojë disa arkitektura<br />
skeletesh karbonike me atome të<br />
njëjtë apo të ndryshëm në<br />
molekulë.<br />
3-Të krahasojë formulat<br />
molekulare me ato të strukturës.<br />
1-Të klasifikojë hidrokarburet.<br />
2-Të shpjegojë pse alkanet janë<br />
hidrokarbure të ngopur.<br />
3-Të shkruajë formulën<br />
molekulare dhe atë të strukturës së<br />
alkaneve kur jepet numri i<br />
atomeve të karbonit.<br />
10<br />
11<br />
2<br />
1<br />
2<br />
3<br />
4<br />
5<br />
Punë praktike<br />
eksperimentale:<br />
Ndërtimi i një elementi<br />
galvanik.<br />
Punë praktike<br />
eksperimentale:<br />
Elektroliza e ujit.<br />
Përsëritje:<br />
Kapitulli II dhe III.<br />
Hyrje në kiminë<br />
organike.<br />
Punë praktike<br />
eksperimentale:<br />
Hetimi i elementëve në<br />
përbërjet organike.<br />
Lidhjet kimike të<br />
karbonit në molekulat<br />
organike.<br />
Skeleti karbonik, llojet e<br />
skeleteve<br />
Alkanet, hidrokarbure të<br />
ngopur.<br />
teksti<br />
teksti<br />
internet<br />
teksti<br />
mjetet e<br />
P. lab<br />
mjetet e<br />
P. lab<br />
tabela<br />
mjetet e<br />
P. lab<br />
modele<br />
skeletesh<br />
karboni<br />
5
29<br />
30<br />
31<br />
32<br />
1-Të japë kuptimin e radikaleve.<br />
2-Të emërtojë radikalet alkilike.<br />
3-Të emërtojë alkanet me varg të<br />
degëzuar kur jepet formula e<br />
strukturës.<br />
4-Të shkruajë formulën e<br />
strukturës kur jepet emri i alkanit.<br />
1-Të përkufizojë termin izomer.<br />
2-Të shkruajë dhe emërtojë<br />
struktura të cikloalkaneve.<br />
3-Të shkruajë formulat e<br />
strukturës të izomerëve të një<br />
alkani të dhënë.<br />
1-Të përshkruajë vetitë fizike të<br />
alkaneve.<br />
2-Të dallojë izomeret e vargut nga<br />
izomeret e pozicionit.<br />
3-Të tregojë nëpërmjet<br />
reaksioneve vetitë kimike të<br />
alkaneve.<br />
1-Të listojë dy lloje të CFC-ve dhe<br />
përdorimet praktike të tyre<br />
2- Të tregojë ndikimin e CFC-ve<br />
në hollimin e shtresës së ozonit.<br />
3- Të diskutojë për masat<br />
mbrojtëse ndaj ndotjes së ajrit nga<br />
CFC-të.<br />
33 1-Të tregojë përbërësit kryesorë të<br />
naftës.<br />
2-Të përshkruajë procesin e<br />
nxjerrjes së nënprodukteve të<br />
naftës<br />
3-Të tregojë masat mbrojtëse të<br />
34<br />
35<br />
36<br />
ajrit nga përdorimi i naftës.<br />
1-Të emërtojë alkanet kur jepet<br />
formula e strukturës.<br />
2-Të shkruajë formulat e<br />
strukturës kur jepet emri i alkanit.<br />
3-Të shkruajë barazimet ku<br />
shprehen vetitë kimike të<br />
alkaneve.<br />
1-Të gatitë metanin në laborator.<br />
2-Të tregojë produktet e djegies së<br />
metanit<br />
3-Të tregojë pse Br2 dhe KMnO4<br />
nuk veprojnë me alkanet.<br />
1-Të paraqesë formulën e<br />
përgjithshme të alkaneve.<br />
2-Të dallojë izomeret e vargut nga<br />
izomeret e pozicionit.<br />
3-Të tregojë me anë të reaksioneve<br />
vetitë kimike të alkaneve.<br />
6<br />
7<br />
8<br />
9<br />
10<br />
Alkanet me varg të<br />
degëzuar. Radikalet<br />
alkilike.<br />
Izomeria. Izomeria e<br />
vargut. Cikloalkanet<br />
Vetitë fizike dhe kimike<br />
të alkaneve.<br />
Klorofluorokarbonet ose<br />
CFC-të.<br />
Nafta.<br />
11 Ushtrime mbi alkanet.<br />
12 Punë praktike<br />
eksperimentale:<br />
Gatitja dhe vetitë e<br />
metanit.<br />
13<br />
Përsëritje.<br />
teksti<br />
teksti<br />
teksti<br />
internet<br />
internet<br />
materiale<br />
ndihmëse<br />
teksti<br />
tabela<br />
skema e<br />
nxjerrje<br />
s<br />
së<br />
naftës<br />
mjetet e<br />
P. lab<br />
6
37 Kapitulli V 1-Të tregojë pse alkenet janë<br />
hidrokarbure të pangopur.<br />
1<br />
38<br />
Hidrokarburet 2-Të emërtojë alkenet duke<br />
e pangopur. zbatuar rregullat e emërtimit.<br />
Hidrokarburet 3-Të shkruajë formulën e<br />
aromatik strukturës të alkenit kur jepet emri<br />
8 orë i tij.<br />
1-Të përkufizojë reaksionet e<br />
(4T,1U,2PPE,<br />
1P)<br />
eleminimit ,adicionit,<br />
polimerizimit.<br />
2-Të tregojë mënyrat e gatitjes së<br />
alkeneve.<br />
3-Të shkruajë reaksionet kimike<br />
karakteristike të alkeneve.<br />
1-Të gatitë etenin në laborator<br />
39<br />
2-Të kryejë eksperimentin e<br />
djegies së etenit<br />
3-Të kryejë eksperimentin<br />
veprimit të etenit me Br2 dhe<br />
KMnO4<br />
1-Të thotë formulën e<br />
40<br />
përgjithshme të alkineve.<br />
2-Të emërtojë alkinet duke zbatuar<br />
rregullat e emërtesës.<br />
3-Të shkrujë formulat e strukturës<br />
së izomerëve kur jepet formula<br />
molekulare<br />
4-Të shkruajë reaksionet kimike<br />
karakteristike të alkineve.<br />
4<br />
41<br />
1-Të shkruajë formulat e<br />
strukturës kur jepet emri.<br />
2-Të shkruajë barazimet ku<br />
shprehen vetitë kimike të<br />
alkaneve,alkeneve,alkineve<br />
3-Të shkrujë formulat e strukturës<br />
së izomerëve kur jepet formula<br />
molekulare<br />
1-Të përfitojë në mënyrë<br />
5<br />
42<br />
eksperimentale etinin.<br />
2-Të kryejë eksperimente për<br />
vetitë e etinit<br />
3-Të shkruajë reaksionet kimike të<br />
etinit.<br />
1-Të tregojë mënyrën e gatitjes së<br />
6<br />
43<br />
benzenit në industri.<br />
2-Të emërtojë disa homologë të<br />
benzenit.<br />
3-Të shpjegojë strukturën e<br />
benzenit.<br />
4-Të shkruajë reaksionet e<br />
zëvendësimit në ciklin e benzenit<br />
7<br />
Hidrokarburet e<br />
pangopur. Alkenet.<br />
2 Gatitja dhe vetitë e<br />
alkeneve<br />
3 Punë praktike<br />
eksperimentale:<br />
Gatitja dhe vetitë e etenit<br />
Alkinet.<br />
Ushtrime dhe problema.<br />
Punë praktike<br />
eksperimentale:<br />
Gatitja dhe vetitë e etinit.<br />
Hidrokarburet<br />
aromatike.<br />
teksti<br />
teksti<br />
teksti<br />
materiale<br />
ndihmëse<br />
teksti<br />
mjetet e<br />
P. Lab<br />
mjetet e<br />
P. Lab<br />
7
44<br />
45<br />
46<br />
47<br />
48<br />
49<br />
50<br />
Kapitulli VI<br />
Substancat<br />
organike që<br />
përmbajnë<br />
karbon,<br />
hidrogjen dhe<br />
oksigjen<br />
15 orë<br />
(11T,1PPE,1U,1P)<br />
+ 1orë e lirë<br />
1-Të paraqesë formulën e<br />
përgjithshme të alkeneve,alkineve.<br />
2-Të krahasojë alkanet, alkenet,<br />
alkinet në bazë të lidhjeve kimike.<br />
3-Të ndërtojë një tabelë ku të<br />
jepen ngjashmëritë dhe ndryshimet<br />
midis tyre.<br />
1-Të përshkruajë rolin që ka grupi<br />
funksionor në përbërjet organike.<br />
2-Të shkruajë formulën e<br />
përgjithshme të alkoleve të ngopur<br />
3-Të klasifikojë alkolet në bazë të<br />
llojit të karbonit, radikalit dhe<br />
numrit të grupeve OH.<br />
4-Të emërtojë alkolet kur jepet<br />
formula strukturore dhe anasjelltas<br />
1-Të përshkruajë vetitë fizike të<br />
alkoleve.<br />
2-Të tregojë mënyrën e gatitjes së<br />
alkoleve.<br />
3-Të tregojë veti kimike të<br />
alkoleve me anë të reaksioneve<br />
kimike.<br />
1-Të përshkruajë disa veti të<br />
metanolit,etanolit,glicerinës.<br />
2-Të tregojë gatitjen e metanolit<br />
dhe etanolit.<br />
3-Të tregojë përdorimet dhe dëmet<br />
që shkaktojnë.<br />
1-Të përshkruajë vetitë fizike të<br />
fenoleve.<br />
2-Të emërtojë fenolet kur jepet<br />
formula dhe anasjelltas.<br />
3-Të argumentojë vetitë kimike të<br />
fenoleve.<br />
1-Të shkruajë formulën e<br />
përgjithshme të aldehideve dhe<br />
ketoneve.<br />
2-Të emërtojë përfaqësuesit më të<br />
thjeshtë të aldehideve dhe<br />
ketoneve.<br />
3- Të shkruajë formulat e<br />
aldehideve dhe ketoneve izomere.<br />
1-Të tregojë mënyrën e gatitjes së<br />
aldehideve dhe ketoneve.<br />
2-Të shkruajë reaksionet e<br />
oksidimit të alkoleve parësorë dhe<br />
dytësorë.<br />
3-Të diskutojë rëndësinë e<br />
metanalit, përdorimet dhe dëmet<br />
që shkakton.<br />
8<br />
1<br />
2<br />
3<br />
4<br />
5<br />
6<br />
Përsëritje.<br />
Grupet funksionore.<br />
Alkolet.<br />
Gatitja dhe vetitë e<br />
alkoleve.<br />
Përfaqësues të alkoleve.<br />
Fenolet.<br />
Aldehidet dhe ketonet.<br />
Gatitja dhe vetitë e<br />
aldehideve dhe<br />
ketoneve.Metanali.<br />
teksti<br />
teksti<br />
internet<br />
teksti<br />
teksti<br />
teksti<br />
Tabela<br />
Tabela<br />
tabela<br />
8
51<br />
52<br />
53<br />
54<br />
55<br />
56<br />
57<br />
58<br />
1-Të përcaktojë grupin funksionor.<br />
2-Të klasifikojë acidet<br />
karboksilike sipas radikalit.<br />
3-Të shkruajë formulat e<br />
strukturës së acideve kur jepet<br />
emri dhe anasjelltas.<br />
1-Të përshkruajë gatitjen acidit<br />
etanoik.<br />
2-Të shkruajë formulat e acideve<br />
lyrore kur jepet emri.<br />
3-Të shkruajë reaksionet e gatitjes<br />
së acidit etanoik.<br />
1-Të shkruajë formulën e<br />
përgjithshme të estereve.<br />
2-Të shkruajë barazimin e gatitjes<br />
së estereve kur jepet emri.<br />
3-Të emërtojë esteret kur jepet<br />
formula dhe anasjelltas.<br />
1-Të klasifikojë lyrat sipas<br />
prejardhjes së tyre.<br />
2-Të shkruajë formulat e acideve<br />
lyrore.<br />
3-Të shkruajë formulën e një<br />
trigliceridi.<br />
1-Të tregojë përbërjen e sapuneve<br />
dhe detergjentëve sintetikë.<br />
2-Të shpjegojë vetitë larëse të<br />
sapunit.<br />
3-Të shkruajë barazimin e<br />
formimit të sapuneve.<br />
4- Të diskutojë ndikimin në mjedis<br />
të detergjenteve.<br />
1-Të kryejë gatitjen e sapunit në<br />
laborator.<br />
2-Të provojë eksperimentalisht<br />
tretshmërinë e lyrave.<br />
3-Të kryejë tretjen e sapuneve në<br />
ujë.<br />
1-Të shkruajë formulat e<br />
strukturës kur jepet emri i<br />
përbërjes.<br />
2-Të emërtojë përbërjen kur jepet<br />
formula e strukturës.<br />
3-Të njehsojë masën dhe vëllimin<br />
e gazeve në reaksionet kimike.<br />
1-Të identifikojë grupin fuksionor<br />
në përbërjet organike.<br />
2-Të interpretojë shkallën e<br />
oksidimit duke kaluar nga alkanet<br />
tek acidet.<br />
3-Të shkruajë barazimet ku<br />
shprehen lidhjet gjinore midis<br />
përbërjeve organike.<br />
7<br />
8<br />
9<br />
10<br />
11<br />
12<br />
13<br />
14<br />
Acidet karboksilike<br />
Acidi etanoik. Acidet<br />
lyrore.<br />
Esteret.<br />
Lyrat<br />
Sapunet dhe detergjentët<br />
Punë praktike<br />
eksperimentale:<br />
Vetitë e lyrave dhe<br />
sapuneve<br />
Ushtrime dhe problema<br />
Përsëritje<br />
internet<br />
teksti<br />
teksti<br />
internet<br />
materiale<br />
ndihmëse<br />
tabela<br />
Tabela<br />
mjetet e<br />
P. Lab<br />
9
59<br />
60<br />
61<br />
62<br />
63<br />
64<br />
Orë e lirë<br />
1/3<br />
Kapitulli VII<br />
Aminoacidet.<br />
Proteinat.<br />
Karbohidratet.<br />
5 orë<br />
(4T)<br />
+ 1orë e lirë<br />
Orë e lirë<br />
1/3<br />
65 Orë e lirë<br />
2/3<br />
66 Orë e lirë<br />
2/3<br />
67 Orë e lirë<br />
2/3<br />
68 Orë e lirë<br />
2/3<br />
69 Orë e lirë<br />
2/3<br />
70 Orë e lirë<br />
2/3<br />
1-Të përcaktojë grupet<br />
funksionore në përbërjet organike.<br />
2-Të shkruajë reaksionet të<br />
kalimit nga alkol-aldehid-acid.<br />
3-Të zgjidhë problema në lidhje<br />
me masën ,molin.<br />
1-Të shkruajë formulën e<br />
përgjithshme të aminoacideve.<br />
2-Të tregojë grupet funksionore të<br />
aminoacideve.<br />
3-Të shkruajë barazimin kimik të<br />
formimit të një dipeptidi.<br />
4-Të argumentojë pse aminoacidet<br />
shfaqin veti amfotere.<br />
1-Të përshkruajë formimin e<br />
lidhjes peptidike.<br />
2-Të tregojë vetitë e proteinave.<br />
3-Të diskutojë rëndësinë e<br />
proteinave për jetën.<br />
1-Të përshkruajë vetitë e<br />
karbohidrateve.<br />
2-Të klasifikojë e karbohidratet në<br />
mono-, di- dhe polisaharide.<br />
3-Të shkruajë formulat e<br />
strukturës dhe të përgjithshme të<br />
glukozit, fruktozit.<br />
1-Të tregojë përbërsit e<br />
disakarideve<br />
2-Të shkruajë formulën e sakarozit<br />
dhe barazimin e formimit të tij.<br />
3-Të dallojë celulozën nga<br />
amidoni.<br />
1-Të tregojë grupet funksionore të<br />
aminoacideve.<br />
2-Të shkruajë formulat e<br />
strukturës së glukozit, fruktozit.<br />
3-Të zgjidhë problema në lidhje<br />
me masën, molin.<br />
Dikustim për proceset<br />
elektrokimike<br />
3<br />
1<br />
2<br />
3<br />
4<br />
4<br />
Ushtrime<br />
Aminoacidet<br />
Proteinat<br />
Karbohidratet<br />
Disakaridet.<br />
Polisakaridet<br />
Ushtrime<br />
5 Esse: Proceset<br />
elektrokimike në industri<br />
dhe jetën e përditshme.<br />
Njohja me temën e projektit. 6 Mirdita jetë. Jo alkolit!<br />
Sistemimi i materialeve të<br />
mbledhura<br />
7 Mirdita jetë. Jo alkolit!<br />
Prezantimi i punime të bëra nga<br />
grupet e nxënësve<br />
8 Mirdita jetë.Jo alkolit!<br />
Kontrolli i njohurive 9 Test semestral<br />
Kontrolli i njohurive 10 Test vjetor<br />
teksti<br />
teksti<br />
teksti<br />
teksti<br />
materiale<br />
ndihmëse<br />
internet<br />
materiale<br />
ndihmëse<br />
internet<br />
Tabela<br />
10
Tema: Reaksionet redoks<br />
Objektivat:Në fund të orës së mësimit nxënës-i/ja:<br />
Modele të planifikimit të një ore mësimi<br />
Niveli bazë:<br />
-Të dallojë një reaksion redoks nga një reaksion joredoks.<br />
Niveli mesatar:<br />
-Të pë rcaktojë procesin e oksidimit dhe procesin reduktimit në termin e humbjes ose fitimit të<br />
elektroneve si dhe në termin e ndryshimit të numrit të oksidimit .<br />
Niveli lartë:<br />
-Të identifikojë agjentin oksidues dhe reduktues në një reaksion redoks .<br />
Fjalë kyçe: reaksion redoks, oksidim, reduktim, agjent reduktues, agjent oksidues.<br />
Struktura e mësimit:<br />
Fazat e Strategjitë mësimore Kohëzgjatja e Organizimi i nxënësve<br />
strukturës<br />
veprimtarisë<br />
P Diskutim për njohuritë<br />
10<br />
paraprake<br />
′<br />
Grupe të mëdha<br />
nxënësish<br />
N Veprimtari me lexim të<br />
drejtuar(VLD)<br />
25<br />
P Tabela e koncepteve 10 Grupe me nga 3 nxënës<br />
Parashikimi: Diskutim për njohuritë paraprake<br />
Zhvillimi i mësimit<br />
Në këtë fazë u kërkoj nxënësve që të vendosin në reaksionet e mëposhtme numrat e oksidimit:<br />
NaOH + HCl = NaCl + H2<br />
Fe + CuSO4 = FeSO4 + Cu<br />
Nxënësit vendosin numrat e oksidimit në reaksionet e dhëna:<br />
+1-2+1 +1-1 +1-1 +1-2<br />
NaOH + HCl = NaCl + H2O<br />
0 +2+6-2 +2+6-2 0<br />
Fe + CuSO4 = FeSO4 + Cu<br />
Mësuesi: Analizoni a kanë ndryshuar numrat e oksidimit të elementeve në reaktantët dhe në produktet,<br />
para dhe pas reaksionit?<br />
Nxënësi: Në reaksionin e parë n.o të elementeve në reaktantët dhe produktet nuk kanë ndryshuar, kurse<br />
në reaksionin e dytë numrat e oksidimit kanë ndryshuar.<br />
11
Ndërtimi i kuptimit: Veprimtari me lexim të drejtuar(VLD)<br />
Në këtë fazë u kërkoj nxënësve të hapin librat dhe të lexojnë paragrafin e parë.Pasi është lexuar<br />
paragrafi i parë shtrohen pyetjet për diskutim:<br />
Mësuesi: Ç’quajmë reaksion redoks<br />
Nxënësi 1 përgjigjet: Reaksionet kimike që shoqërohen me kalime ose zhvendosje elektronesh quhen<br />
reaksione oksido-reduktimi ose reaksione redoks.<br />
Mësuesi: Ku dallohen reaksionet redoks nga reaksionet joredoks<br />
Nxënësi 2 përgjigjet: Në reaksionet redoks kemi ndryshim të numrave të oksidimit në reaktantët dhe<br />
produktet, kurse në reaksionet joredoks nuk kemi ndryshim të numrave të oksidimit.<br />
Lexohet paragrafi tjetër: Pasi është lexuar paragrafi shtrohen pyetjet për diskutim:<br />
Mësuesi: Cilët janë proceset që ndodhin në një reaksion redoks?<br />
Nxënësi 3 përgjigjet: Në reaksionet redoks ndodhin njëkohësisht dy procese:oksidimi dhe reduktimi.<br />
Mësuesi:Ç’është oksidimi?<br />
Nxënësi 4 përgjigjet: Procesi i dhënies së elektroneve quhet oksidim dhe shoqërohet me rritje të numrit<br />
të oksidimit.<br />
Mësuesi:Ç’është reduktimi?<br />
Nxënësi 5 përgjigjet: Procesi i marrjes së elektroneve quhet reduktim dhe shoqërohet me zvogëlim të<br />
numrit të oksidimit.<br />
Lexohet paragrafi tjetër: Pasi është lexuar paragrafi shtrohen pyetjet për diskutim:<br />
Mësuesi: Në reaksionin e dhënë kush është oksiduar dhe kush është reduktuar?<br />
Nxënësi 6 përgjigjet: Në reaksionin e mësipërm elementët hekur dhe bakër kanë ndryshuar numrat e<br />
oksidimit.Hekuri është oksiduar sepse e ka rritur n.o, kurse bakri është reduktuar sepse e ka zvogëluar<br />
n.o.<br />
Mësuesi: Ç’quajmë agjent oksidues dhe agjent reduktues?<br />
Nxënësi 7 përgjigjet: Substancat, atomet ose jonet e të cilave oksidohen quhen agjent reduktues.<br />
Substancat, atomet ose jonet e të cilave reduktohen quhen agjent oksidues.<br />
Mësuesi: Si mëndoni a mund të ketë reaksione që të ndodh vetëm procesi i oksidimit ose i reduktimit<br />
Nxënësi 8 përgjigjet: Nuk mund të ketë reaksione që të ndodh vetëm procesi i oksidimit ose vetëm<br />
procesi i reduktimit.Procesi i oksidimit zhvillohet gjithmonë në prani të një procesi reduktimi dhe<br />
anasjelltas.<br />
Kjo fazë mbaron pasi kanë dalë pergjigjet e të gjitha pyetjeve.<br />
Përforcimi: Tabela e koncepteve<br />
Mësuesi ndërton në dërrasën e zezë tabelën. U kërkoj nxënësve të plotësojnë tabelën:<br />
Reaksioni<br />
(Vendosni n.o)<br />
Zn + HCl → ZnCl2 + H2<br />
H2S + O 2 → SO2 + H2O<br />
Substanca që oksidohet<br />
dhe reduktohet<br />
Skema<br />
elektronike<br />
Agjenti<br />
oksidues<br />
Agjenti<br />
reduktues<br />
Vlerësimi i nxënësve<br />
Në fund mësuesi bën vlerësimin e nxënësve që kanë qënë pjesmarrës më aktiv në diskutime dhe në<br />
përgjigjet e tyre<br />
12
Tema: Elementi galvanik<br />
Objektivat : Në fund të orës së mësimit nxënës-i/ja:<br />
Niveli bazë:<br />
-Të përshkruajë ndërtimin e elementit galvanik.<br />
Niveli mesatar:<br />
-Të shpjegojë nëpërmjet skemës së elementit galvanik funksionimin e tij.<br />
Niveli lartë:<br />
- Të shkruajë gjysëmreaksionet që zhvillohen në elektroda dhe reaksionin e përgjithshëm.<br />
Fjalë kyçe : element galvanik, anodë, katodë, urë kripe.<br />
Mjetet : skema të elementit galvanik<br />
Struktura e mësimit :<br />
Fazat e<br />
strukturës<br />
Strategjitë mësimore Kohëzgjatja e<br />
veprimtarisë<br />
Organizimi i nxënësve<br />
P Di /Dua të di/Mësova 10 ′<br />
Grupe të mëdha<br />
N Di /Dua të di/Mësova 25 nxënësish<br />
P Tabela e koncepteve 10 Grupe me nga 3 nxënës<br />
Parashikimi : (Di/Dua të di/Mësova)<br />
Zhvillimi i mësimit<br />
Mësuesi ndërton në dërrasën e zezë tabelën e mëposhtme:<br />
Di Dua të di Mësova<br />
Mësuesi u drejtohet nxënësve të vëzhgojnë eksperimentin:<br />
Marrim një pllakë zinku e zhysim në tretësirën e sulfatit të bakrit.Ç’vini re? Ç’ngjyrë merr pllaka e<br />
zinkut? Si mendoni a ka ndodhur reaksion kimik?<br />
Një nxënës shkruan në dërrasë barazimin e reaksionit:<br />
Zn + CuSO4 = ZnSO4 + Cu<br />
Mësuesi u drejtohet nxënësve t’u përgjigjen pyetjeve të mëposhtme me anë të të cilave shqyrtohen<br />
informacione nga mësimet e kaluara të cilat lidhen me mësimin e ri.<br />
1. Vendosni n.o dhe përcaktoni a është reaksion redoks?<br />
2. Shkruani proceset që ndodhin.<br />
3. Tregoni lëvizjen e elektroneve.<br />
4. Si mendoni të dyja proceset oksidimi dhe reduktimi a ndodhin në të njëjtën enë?<br />
5. A prodhohet energji?<br />
13
Nxënësit vendosin përgjigjet e pyetjeve në tabelën në kolonën Di<br />
Di Dua të di Mësova<br />
Vendos numrat e oksidimit.<br />
0 +2+6-2 +2+6-2 0<br />
Zn + CuSO4 = ZnSO4 + Cu<br />
-Reaksioni është një reaksion<br />
redoks sepse kemi ndryshim të<br />
numrave të oksidimit.<br />
- Në këtë reaksion zinku<br />
oksidohet,kurse bakri reduktohet.<br />
Proceset<br />
Zn – 2e - → Zn 2+ (oksidim)<br />
Cu 2+ + 2e - →Cu (reduktim)<br />
Elektronet kalojnë nga pllaka e<br />
zinkut tek jonet e bakrit.<br />
Të dyja proceset oksidimi dhe<br />
reduktimi ndodhin në të njëjtën<br />
enë.<br />
Nuk prodhohet energji.<br />
Ndërtimi i kuptimit: Di/Dua të di/Mësova<br />
Në stadin e kësaj faze u jap nxënësve informacionin se për të prodhuar energji elektrike ky reaksion<br />
mund të kryhet në një aparat, i cili mundëson zhvillimin e të dy proceseve të ndarë nga njeri–tjetri, ku<br />
kalimi i elektroneve mund të bëhet me anën e një përcjellësi.Ky aparat quhet element galvanik.<br />
Nxënësit plotësojnë kolonën “Dua të di”me pyetje se si është ndërtuar elementi galvanik?<br />
Mësuesi: Jap informacionin se çfarë ndodh kur procesin e oksidimit dhe të reduktimit i ndajmë nga<br />
njeri- tjetri.<br />
Shpjegoj se ç’ndodh në gotën ku zhys një pllakë zinku dhe në tretësirë ka jonet zink?<br />
Jonet zink kalojnë nga pllaka në tretësirë dhe në pllakë mbeten elektronet duke i dhënë asaj ngarkesë<br />
negative.<br />
Pyes nxënësit: Ç’ndodh me përqëndrimin e joneve Zn 2+ dhe SO4 2- në tretësirë?<br />
Mësuesi: Shkruaj reaksionin që ndodh në pllakën e zinkut: Zn – 2e - → Zn 2+ (oksidim) anoda (-)<br />
Mësuesi: Si lëvizin elektronet?<br />
Nxënësi përgjigjet:Elektronet lëvizin me anë të telit përcjellës nga pllaka e Zn tek pllaka e Cu.<br />
Shpjegoj se ç’ndodh në gotën ku zhys një pllakë bakri dhe në tretësirë ka jonet bakër.<br />
Jonet bakër Cu 2+ që formohen nga shpërbashkimi i sulfatit të bakrit shkojnë drejt pllakës së bakrit dhe<br />
marrin secili nga dy elektrone që vijnë nëpërmjet telit përcjellës dhe kthehen në atome Cu.<br />
Mësuesi: Shkruaj reaksionin që ndodh në pllakën e bakrit: Cu 2+ + 2e - → Cu (reduktim) katoda (+)<br />
Pyes nxënësit: Ç’ndodh me përqëndrimin e joneve Cu 2+ dhe SO4 2- në tretësirë?<br />
Pse nuk kemi prodhim të rrymës elektrike?<br />
Jepni përgjigje.<br />
Mësuesi: Mbyllja e qarkut bëhet me anë të urës së kripës.<br />
Prodhohet rrymë elektrike praninë e së cilës e tregon shigjeta e voltmetrit. Ky aparat quhet element<br />
galvanik.<br />
14
Mësuesi: Shkruhen në dërrasë gjysëmreaksionet:<br />
Anodë (-): Zn - 2e - → Zn 2+ (oksidim)<br />
Katodë (+): Cu 2+ + 2e - → Cu (reduktim)<br />
Reaksioni i përgjithshëm :<br />
Zn + Cu 2+ = Zn 2+ + Cu<br />
Në stadin e fundit nxënësit plotësojnë tabelën në kolonën mësova me njohuritë rreth elementit<br />
galvanik.<br />
Di Dua të di Mësova<br />
Vendos numrat e oksidimit.<br />
0 +2+6-2 +2+6-2 0<br />
Zn + CuSO4 = ZnSO4 + Cu<br />
-Reaksioni është një reaksion<br />
redoks sepse kemi ndryshim të<br />
numrave të oksidimit.<br />
- Në këtë reaksion zinku<br />
oksidohet,kurse bakri reduktohet.<br />
Proceset:<br />
Zn – 2e - → Zn 2+ (oksidim)<br />
Cu 2+ + 2e - →Cu (reduktim)<br />
-Elektronet kalojnë nga pllaka e<br />
zinkut tek jonet e bakrit.<br />
Të dyja proceset oksidimi dhe<br />
reduktimi ndodhin në të njëjtën<br />
enë.<br />
Nuk prodhohet energji.<br />
Cili është funksioni i elementit<br />
galvanik?<br />
Cili metal përbën anodën, po<br />
katodën?<br />
Si lëvizin elektronet në qarkun e<br />
jashtëm?<br />
Ç’ndodh në pllakën e zinkut?<br />
Pse zvogëlohet masa e saj?<br />
Ç’ndodh në pllakën e bakrit?<br />
Pse rritet masa e saj?<br />
Sa funksionon elementi galvanik?<br />
Elementi galvanik bën<br />
shndërrimin e energjisë<br />
kimike në energji elektrike<br />
Metali më aktiv përbën<br />
anodën dhe metali më pak<br />
aktiv përbën katodën.<br />
Zinku në rradhën e aktivitetit<br />
gjendet para bakrit, pra është<br />
më aktiv dhe përbën<br />
anodën,kurse pllaka e bakrit<br />
përbën katodën.<br />
Elektronet lëvizin në qarkun<br />
e jashtëm nga anoda drejt<br />
katodës.<br />
Në pllakën e zinkut ndodh<br />
procesi i oksidimit. Jonet<br />
zink Zn 2+ kalojnë në tretësirë,<br />
kështu pllaka e zinkut do të<br />
hollohet duke zvogëluar<br />
masën e saj .<br />
A(-): Zn –2e - → Zn 2+<br />
Në pllakën e bakrit ndodh<br />
procesi i reduktimit.<br />
Elektroda e bakrit e rrit<br />
masën, sepse jonet bakër<br />
Cu 2+ kalojnë nga tretësira në<br />
pllakë ku reduktohen në<br />
atome Cu 0 .<br />
K(+): Cu 2+ + 2e - →Cu<br />
Elementi galvanik do të<br />
vazhdojë të funksionojë deri<br />
sa pllaka e zinkut Zn(anoda)<br />
të tretet plotësisht<br />
15
Përforcimi: Tabela e koncepteve<br />
Plotësoni tabelën e mëposhtme:<br />
Elementi<br />
galvanik<br />
hekur - bakër<br />
bakër- argjend<br />
Përcaktoni<br />
Anoda Katoda<br />
Procesi<br />
në anodë<br />
Procesi<br />
në<br />
katodë<br />
Reaksioni<br />
i<br />
përgjithshëm<br />
Vlerësimi i nxënësve<br />
Në fund mësuesi bën vlerësimin e nxënësve që kanë qënë pjesmarrës më aktiv në diskutime dhe në<br />
përgjigjet e tyre.<br />
16
Tema: Alkinet<br />
Objektivat: Në fund të orës së mësimit nxënës-i/ja:<br />
Niveli bazë:<br />
-Të emërtojë alkinet duke zbatuar rregullat e emërtesës.<br />
Niveli mesatar:<br />
-Të shkruajë formulën e strukturës kur jepet emri i alkinit.<br />
Niveli lartë:<br />
-Të shkruajë reaksionet kimike karakteristike të alkineve.<br />
Fjalë kyçe : alkin, lidhje trefishe.<br />
Mjetet : modele të strukturave të alkineve(duke përdorur topa të vegjël plasteline për atomet e karbonit,<br />
hidrogjenit dhe fije shkrepëse për lidhjet midis tyre)<br />
Struktura e mësimit :<br />
Fazat e<br />
strukturës<br />
Strategjitë mësimore Kohëzgjatja e<br />
veprimtarisë<br />
Organizimi i nxënësve<br />
P Parashikim me terma<br />
10<br />
paraprake<br />
′<br />
Grupe të mëdha<br />
nxënësish<br />
N Veprimtari me lexim të<br />
drejtuar(VLD)<br />
25<br />
P Ditari dy pjesësh 10 Grupe me nga 3 nxënës<br />
Parashikimi : Parashikimi me terma paraprake<br />
Zhvillimi i mësimit<br />
Paraqes në dërrasën e zezë termat: alkin CnH2n-2, hidrokarbur i pangopur,lidhje trefishe midis atomeve<br />
të karbonit.<br />
Pasi ndaj klasën në grupe u kërkoj nxënësve të bëjnë më shumë parashikime duke u bazuar edhe në<br />
pyetjet:<br />
Sa atome hidrogjen kanë alkinet në krahasim me alkenet dhe alkanet?<br />
Si është formuar lidhja trefishe?<br />
Në fund të fazës nxënësit japin parashikimet që kanë bërë.<br />
Ndërtimi i kuptimit: Veprimtari me lexim të drejtuar(VLD)<br />
Në këtë fazë u kërkoj nxënësve të hapin librat dhe të lexojnë paragrafin e parë.Pasi është lexuar<br />
paragrafi i parë shtrohen pyetjet për diskutim:<br />
17
Mësuesi: Krahasoni formulat e përgjithshme të alkaneve, alkeneve dhe alkineve<br />
Nxënësi 1 përgjigjet: Formula e alkaneve është CnH2n+2 , formulën e alkeneve është CnH2n dhe<br />
formula e alkineve CnH2n-2. Alkinet kanë 4 hidrogjene më pak se alkanet dhe 2 hidrogjene më pak se<br />
alkenet.<br />
Mësuesi: Si mendoni ju alkinet janë hidrokarburë të ngopur?<br />
Nxënësi 2 përgjigjet: Jo alkinet nuk janë hidrokarburë të ngopur, sepse kanë lidhje trefishe dhe kanë<br />
më pak hidrogjene se alkanet.<br />
Mësuesi: Si është ndërtuar lidhja trefishe<br />
Nxënësi 3 përgjigjet: Lidhja trefishe është e përbërë nga një lidhje sigma dhe dy lidhje pi.<br />
Lexohet paragrafi tjetër: Emërtimi i alkineve. Pasi është lexuar paragrafi shtrohen pyetjet për diskutim:<br />
1-Si kryhet emërtimi i alkineve me varg normal.<br />
5<br />
CH3 4<br />
CH2 3<br />
CH2 2<br />
C<br />
1<br />
CH pentin-1<br />
2-Si kryhet emërtimi i alkineve me varg të degëzuar.<br />
5<br />
CH3 4<br />
CH2 3<br />
CH<br />
CH 3<br />
2<br />
C<br />
1<br />
CH<br />
metil-3-pentin-1<br />
Lexohet paragrafi tjetër: Gatitja e etinit. Pasi është lexuar paragrafi shtrohen pyetjet për diskutim:<br />
1-Si gatitet etini?<br />
2-Shkruani barazimin e reaksionit<br />
Lexohet paragrafi tjetër: Vetitë e etinit. Pasi është lexuar paragrafi shtrohen pyetjet për diskutim:<br />
1-Cilët janë reaksionet kryesore të alkineve?<br />
2-Pse alkinet japin reaksione adicioni?<br />
3-Shkruani reaksionin e adicionit të bromit, hidrogjenit tek etini.<br />
4- Si emërtohet produkti që formohet nga adicioni i një moli HCl tek etini.<br />
Kjo fazë mbaron pasi kanë dalë përgjigjet e të gjitha pyetjeve.<br />
Përforcimi: Ditari dy pjesësh<br />
Gjatë kësaj faze përdor ditarin dypjesësh. Ndaj tabelën në dy kolona.Në kolonën komente shënohen<br />
konceptet kryesore të cilat plotësohen nga nxënësit me njohuritë që morrën.<br />
Të dhëna mbi alkinet Komente<br />
Struktura<br />
Emërtimi<br />
-Kanë praninë enjë lidhjeje trefishe<br />
-Zgjidhet vargu më i gjatë që ka lidhjen trefishe.<br />
-Numërtohet vargu duke filluar nga lidhja trefishe që<br />
është më afër.<br />
- rrënja alk + prapashtesën –in + pozicioni lidhjes<br />
trefishe<br />
18
Gatitja e etinit<br />
Vetitë e etinit<br />
Detyrë :Plotësoni skemat<br />
CH ≡ CH + 2H2 → CH ≡ CH + Br2 →<br />
CH ≡ CH + H2 → CH ≡ CH + HCl →<br />
-nëse ka radikale emri radikalit, pozicioni dhe emri i<br />
alkinit të përcaktuar më parë.<br />
Gatitet nga veprimi i karburit të kalciumit me ujin.<br />
CaC2 +H2O→C2H2 + Ca(OH)2<br />
Reaksionet e veprimit me H2, Br2, HCl.<br />
CH≡CH + H2→ CH2 ═ CH2<br />
CH2 ═ CH2 + H2 → CH3 − CH3<br />
CH≡CH + 2Br2 → CHBr2 − CHBr2<br />
CH≡CH + HCl→ CH2 ═ CHCl<br />
Vlerësimi i nxënësve<br />
Në fund mësuesi bën vlerësimin e nxënësve që kanë qënë pjesmarrës më aktiv në diskutime dhe në<br />
përgjigjet e tyre.<br />
19
Tema: Gatitja dhe vetitë e alkoleve<br />
Objektivat:Në fund të orës së mësimit nxënës-i/ja:<br />
Niveli bazë:<br />
1-Të përshkruajë mënyrën e gatitjes së alkoleve nga bashkëveprimi i halogjenalkaneve me baza të<br />
tretshme.<br />
2-Të tregojë dy veti fizike të alkoleve, temperaturën e vlimit dhe tretshmërinë në ujë.<br />
Niveli mesatar:<br />
1-Të shpjegojë tretshmërinë e alkoleve në ujë.<br />
2-Të shkruajë barazimet kimike të gatitjes së alkoleve.<br />
Niveli lartë:<br />
1- Të shkruajë barazimet kimike ku shprehen vetitë kimike të alkoleve.<br />
2- Të argumentojë pse alkolet shfaqin veti acide më të dobëta se uji.<br />
Fjalë kyçe: halogjenalkan, tretshmëri, alkolat.<br />
Struktura e mësimit:<br />
Fazat e Strategjitë mësimore Kohëzgjatja e Organizimi i nxënësve<br />
strukturës<br />
veprimtarisë<br />
E Diskutim për njohuritë<br />
10<br />
paraprake<br />
′<br />
Grupe të mëdha<br />
nxënësish<br />
R Veprimtari me lexim të<br />
drejtuar(VLD)<br />
25<br />
R Ditari dy pjesësh 10 Grupe me nga 3 nxënës<br />
Parashikimi: Diskutim për njohuritë paraprake<br />
Zhvillimi i mësimit<br />
Në fillim të kësaj faze ndaj klasën në grupe. Secilit grup i shpërndaj fleta formati me ushtrime që kanë<br />
lidhje me klasifikimin e alkoleve dhe emërtimin e tyre. U kërkoj nxënësve që në përbërjet e dhëna të<br />
klasifikojnë alkolet dhe t’i emërtojnë ato.<br />
Mësuesi: Cili është grupi funksionor i alkoleve?<br />
Nxënësi: Grupi funksionor i alkoleve është grupi hidroksid-OH.<br />
Mësuesi: Si klasifikohen alkolet sipas vendosjes së grupit hidroksid -OH?<br />
Nxënësi: Alkolet klasifikohen në alkole parësore, dytësore dhe tretësore.<br />
Mësuesi: Si emërtohen alkolet?<br />
Nxënësi: Emërton alkolin e dhënë.<br />
Ndërtimi i kuptimit: Veprimtari me lexim të drejtuar(VLD)<br />
Në këtë fazë u kërkoj nxënësve të hapin librat dhe të lexojnë paragrafin e parë.Pasi është lexuar<br />
paragrafi i parë shtrohen pyetjet për diskutim:<br />
20
Mësuesi: A treten alkolet në ujë?<br />
Nxënësi 1 përgjigjet: Alkolet treten në ujë.<br />
Mësuesi: Ku duhet kërkuar shkaku i tretjes së alkolit në ujë.<br />
Nxënësi 2 përgjigjet: Alkolet formojnë lidhje hidrogjenore edhe me molekulat e ujit.Ky është shkaku<br />
që ato treten mirë në ujë.<br />
Lexohet paragrafi tjetër: Pasi është lexuar paragrafi shtrohen pyetjet për diskutim:<br />
Mësuesi: Cilët janë produktet që formohen nga veprimi i alkoleve me metalet alkalin (Na,K).<br />
Nxënësi 3 përgjigjet: Nga veprimi i alkoleve me natriumin metalik formohen kripra që quhen alkolate<br />
dhe çlirohet gazi hidrogjen.Shkruan barazimin e reaksionit.<br />
Mësuesi: Pse alkolatet shpërbëhen nga uji?<br />
Nxënësi 4 përgjigjet: Uji zhvendos alkolin nga kripa dhe shfaq veti “acide” më të forta se alkoli.<br />
Shkruan barazimin e reaksionit.<br />
Mësuesi: Cilët janë produktet që formohen nga bashkëveprimi i alkoleve me acide halogjenhidrikë.<br />
Nxënësi 5 përgjigjet: Nga bashkëveprimi i alkoleve me acide halogjenhidrikë formohen<br />
halogjenalkane. Shkruan barazimin e reaksionit.<br />
Mësuesi: Tregoni produktet e djegies së alkoleve?<br />
Nxënësi 6 përgjigjet: Produktet e djegies së alkoleve janë dioksidi i karbonit dhe uji.<br />
Kjo fazë mbaron pasi kanë dalë përgjigjet e të gjitha pyetjeve.<br />
Përforcimi: Ditari dy pjesësh<br />
Gjatë kësaj faze përdor ditarin dypjesësh. Ndaj tabelën në dy kolona.Në kolonën komente shënohen<br />
konceptet kryesore të cilat plotësohen nga nxënësit me njohuritë që morrën.<br />
Gatitja dhe vetitë e alkoleve Komente<br />
Gatitet nga veprimi i halogjenalkaneve me baza<br />
Gatitja<br />
alkaline<br />
C2H5Cl + NaOH→ C2H5OH + NaCl<br />
Tretshmëria në ujë<br />
Vetitë e alkoleve:<br />
a-Veprimi me Na<br />
b- Veprimi me acidet halogjenhidrikë<br />
c- Shpërbërja e alkolateve nga uji<br />
d- Djegia e alkoleve<br />
Alkolet formojnë lidhje hidrogjenore me<br />
molekulat e ujit. Ky është shkaku që ato<br />
treten mirë në ujë.<br />
C2H5OH + Na → C2H5ONa + ½ H2<br />
C2H5OH + HCl → C2H5Cl + H2O<br />
C2H5ONa + H2O → C2H5OH + NaOH<br />
C2H5OH + 3O2 → 2CO2 + 3H2O<br />
Vlerësimi i nxënësve<br />
Në fund mësuesi bën vlerësimin e nxënësve që kanë qënë pjesmarrës më aktiv në diskutime dhe në<br />
përgjigjet e tyre.<br />
21
Modele ushtrimesh të zgjidhura për kapitullin “Energjia dhe reaksionet kimike”<br />
Shembull 1<br />
Barazimi termokimik i shpërbërjes së karbonatit të kalciumit është :<br />
CaCO3(ng) = CaO(ng) + CO2(g) ΔH = + 178 kJ<br />
Të gjendet sasia e karbonatit të shpërbërë nëse përdoren 290 kJ.<br />
Zgjidhje<br />
Të dhëna: m = ? MCaCO3 = 100g/mol masa e një moli = 100g<br />
CaCO 3<br />
Së pari, duke u mbështetur në barazimin termokimik arsyetojmë për të gjetur sa mol karbonat<br />
kalciumi shpërbëhet kur përdoret një sasi energjie prej 290 kJ<br />
Arsyetojmë : kur shpërbëhet 1 mol karbonat kalciumi CaCO3 përdoret 178 kJ<br />
x mol karbonat kalciumi CaCO3 shpërbëhet kur përdoret 290kJ<br />
1mol<br />
x 290kJ<br />
x = = 1,<br />
6 mol CaCO3<br />
178 kJ<br />
Së dyti, kthejmë molet në gram<br />
m = n x M = 1,6 mol x 100 g/mol = 160g CaCO3<br />
Përgjigje : Kur shpërbëhet 160 g CaCO3 përdoret një sasi energjie prej 290 kJ.<br />
Shembull 2<br />
Barazimi termokimik i djegies së karbonit është :<br />
C(ng) + O2(g) = CO2(g) ΔH = - 393,5 kJ<br />
Njehsoni sasinë e nxehtësisë që çlirohet nga djegia e 48g karbon?<br />
Zgjidhje<br />
Të dhëna: m C = 48g M C = 12g/mol masa e një moli karbon = 12g<br />
Së pari, shkruajmë barazimin e reaksionit të djegies së karbonit.<br />
C + O2 = CO2<br />
Së dyti, gjejmë sasinë e nxehtësisë që çlirohet nga djegia e 48g C.<br />
Arsyetojmë : kur vepron 12 g karbon çlirohet 393,5 kJ<br />
po kur vepron 48 g karbon ç’sasi çlirohet x kJ<br />
48g<br />
x 393,<br />
5 kJ<br />
x = = 1574 kJ<br />
12<br />
Përgjigje : Kur digjen 48g karbon çlirohet një sasi nxehtësie prej 1574 kJ.<br />
22
Shembull 3<br />
Përcaktoni reaksionet e mëposhtme nëse janë ekzotermike apo endotermike<br />
C(ng) + O2(g) = CO2(g) ΔH = - 393,5 kJ (reaksion ekzotermik)<br />
CaCO3(ng) = CaO(ng) + CO2(g) ΔH = + 178 kJ (reaksion endotermik)<br />
S(ng) + O2(g) = SO2(g) ΔH = - 297 kJ (reaksion ekzotermik)<br />
CO(g) + 1/2 O2(g) = CO2(g) ΔH = - 283 kJ (reaksion ekzotermik)<br />
2H2O(l) → 2H2(g) + O2(g) ΔH = + 572 kJ (reaksion endotermik)<br />
Shembull 4<br />
Ndërtoni grafikun e këtij reaksioni e një reaksioni ekzotermik dhe endotermik me të gjitha të dhënat si:<br />
Ep, Er, ∆H, Ea.<br />
a) 2SO2 + O2 → 2SO3<br />
b) 2KClO3(ng) = 2KCl(ng) + 3O2(g)<br />
Zgjidhje<br />
Reaksioni i parë meqënëse është reaksion djegie atëhere ky është një reaksion që shoqërohet me çlirim<br />
energjie në trajtë nxehtësie. Efekti termik i reaksionit ∆H është negative.<br />
Në këtë çast mësuesi duhet të qartësojë para nxënësve, përse efekti termik ka shenjë negative, pra është<br />
më i vogël se zero.<br />
Mësuesi u rikujton nxënësve se në një reaksion ekzotermik energjia e substancave që marrin pjesë në<br />
reaksion është më e madhe se energjia e produkteve të reaksionit.<br />
Mësuesi shkruan në dërrasë formulën e efektit termik:<br />
∆H = Ep- Er , meqënëse Er > Ep kjo sjell që shënja e ∆H të dalë negative.<br />
Mësuesi i del për detyrë që të shpjegojë dhe analizojë, që nxehtësia që çlirohet gjatë këtij reaksioni<br />
ekzotermik, një pjesë e saj i shkon reaktantëve për të bërë të mundur zhvillimin e reaksionit deri në<br />
shndërrimin e reaktantëve në produkte dhe pjesa tjetër e energjisë së tepërt i kalon mjedisit, prandaj ky<br />
reaksion shoqërohet me çlirim nxehtësie.<br />
Reaksioni i dytë, meqënëse është reaksion shpërbërjeje, është një reaksion që shoqërohet me thithje<br />
ose marrje energjie në trajtë nxehtësie nga mjedisi. Efekti termik i reaksionit ∆H është pozitiv.<br />
Në këtë çast mësuesi duhet të qartësojë para nxënësve, përse efekti termik ka shenjë pozitive, pra është<br />
më i madh se zero.<br />
Mësuesi u rikujton nxënësve se në një reaksion endotermik energjia e substancave që marrin pjesë në<br />
reaksion është më e vogël se energjia e produkteve të reaksionit.<br />
23
Mësuesi shkruan në dërrasë formulën e efektit termik:<br />
∆H = Ep- Er , meqënëse Er < Ep kjo sjell që shënja e ∆H të dalë pozitive.<br />
Mësuesi i del për detyrë që të shpjegojë dhe analizojë përsëri, që nxehtësia që thithet gjatë këtij<br />
reaksioni endotermik, i shkon reaktantëve për të bërë të mundur zhvillimin e reaksionit deri në<br />
shndërrimin e reaktantëve në produkte, në këtë moment mësuesi duhet të theksojë që këto reaksione<br />
kërkojnë energji të vazhdueshme deri në përfundimin e reaksionit. Në rast se për një moment e<br />
ndërpresim energjinë që i jepet reaktantëve reaksioni ndalet.<br />
Mësuesi duke patur parasysh të gjitha parametrat, që u diskutuan për reaksionin ekzotermik dhe<br />
endotermik ndërton grafikët me të gjitha të dhënat përkatëse.<br />
24
Modele ushtrimesh të zgjidhura për kapitullin “Reaksionet e oksido-reduktimit”<br />
Shembull 1<br />
Përcaktoni nëse, reaksionet e mëposhtme janë redoks apo jo:<br />
Zgjidhje<br />
+2-1 +1+6-2 +2+6-2 +1-1<br />
a) BaCl 2 + H 2 SO 4 → BaSO 4 + HCl (reaksion joredoks)<br />
0 +3 -2 +3 -2 0<br />
b) Al + Fe 2 O 3 → Al 2 O 3 + Fe (reaksion redoks)<br />
+2-1 +1-2+1 +2 -2 +1 +1 -1<br />
c) FeCl 2 + NaOH → Fe(OH) 2 + NaCl (reaksion joredoks)<br />
-3 +1 0 0 +1 -2<br />
d) NH 3 + O 2 → N 2 + H 2 O (reaksion redoks)<br />
0 +2 +6-2 +3 +6 -2 0<br />
e) Al + CuSO 4 → Al 2 (SO 4 ) 3 + Cu (reaksion redoks)<br />
Shembull 2<br />
Përcaktoni cilët nga atomet ose jonet janë oksiduar dhe cilët janë reduktuar, cilët sillen si<br />
agjent reduktues dhe cilët sillen si agjent oksidues .(Mbi shigjetë shënoni numrin e<br />
elektroneve (e–) që largon ose merr).<br />
a) N -3 → N +5<br />
Zgjidhje<br />
N -3 – 8e - → N +5<br />
Cu +2<br />
b) Cu +2<br />
→ Cu0 c) S -2 +4<br />
→ S<br />
(oksidohet) sillet si agjent reduktues<br />
+ 2e - → Cu 0 (reduktohet)sillet si agjent oksidues<br />
S -2 – 6e - → S +4<br />
(oksidohet) sillet si agjent reduktues<br />
Mn +7 + 5e - → Mn 2+ (reduktohet)sillet si agjent oksidues<br />
Fe +2 – 1e - → Fe +3<br />
(oksidohet) sillet si agjent reduktues<br />
d) Mn +7 → Mn 2+ e) Fe +2 → Fe 3+<br />
25
Shembull 3<br />
Vendosni koeficientët në reaksionin e mëposhtëm:<br />
FeCl2 + Cl2 → FeCl3<br />
Zgjidhje<br />
1.Caktojmë numrat e oksidimit të secilit element mbi simbolet përkatëse<br />
+2 -1 0 +3 -1<br />
FeCl2 + Cl2 → FeCl3<br />
2. Identifikojmë oksidusin dhe reduktusin dhe ndërtojmë skemën elektronike<br />
2 Fe 2+ -1e - → Fe 3+ (oksidohet )<br />
1 Cl2 0 +2·1e - → 2Cl -1 (reduktohet)<br />
3.Njehsojmë numrin e elektroneve të dhëna nga reduktuesi dhe të marra nga oksiduesi.<br />
Barazojmë numrin e elektroneve të dhëna dhe të marra duke përdorur sh.v.p .Sh.v.p e 2 dhe 1 është 2.<br />
Faktorët janë 2 për hekurin Fe dhe 1 për klorin Cl.<br />
2 Fe 2+ -1e - → Fe 3+ (oksidohet )<br />
1 Cl2 0 +2·1e - → 2Cl -1 (reduktohet)<br />
.Faktorët e gjetur janë koeficientë dhe vendosen përpara formulave të substancave përkatëse në<br />
barazimin e dhënë.<br />
2FeCl2 + Cl2 → 2FeCl3<br />
5.Kontrollojmë nëse numri i atomeve për secilin element është i barabartë në të dyja anët e barazimit.<br />
Meqënëse numri i atomeve është i njëjtë në të dy anët e barazimit heqim shigjetën dhe vendosim<br />
shenjën e barazimit.<br />
Shembull 4<br />
2FeCl2 + Cl2 = 2FeCl3<br />
Vendosni koeficientët në reaksionin e mëposhtëm:<br />
C + H2 SO4 → CO2 + SO2 + H2O<br />
Zgjidhje<br />
1.Caktojmë numrat e oksidimit të secilit element mbi simbolet përkatëse.<br />
0 +1+6-2 +4-2 +4-2 +1-2<br />
C + H2 SO4 → CO2 + SO2 + H2O<br />
26
2. Identifikojmë oksidusin dhe reduktusin dhe ndërtojmë skemën elektronike.<br />
C 0 - 4e - → C +4 (oksidohet)<br />
S +6 + 2e - → S +4 (reduktohet)<br />
3.Njehsojmë numrin e elektroneve të dhëna nga reduktuesi dhe të marra nga oksiduesi.<br />
Barazojmë numrin e elektroneve të dhëna dhe të marra duke përdorur sh.v.p .Sh.v.p e 4 dhe 2 është 4.<br />
Faktorët janë 1 për karbonin dhe 2 për squfurin.<br />
1 C 0 - 4e - → C +4 (oksidohet)<br />
2 S +6 + 2e - → S +4 (reduktohet)<br />
4. Faktorët e gjetur janë koeficientë dhe vendosen përpara formulave të substancave përkatëse në<br />
barazimin e dhënë.<br />
C + 2H2SO4 → CO2 + 2SO2 + H2O<br />
5.Kontrollojmë nëse numri i atomeve për secilin element është i barabartë në të dyja anët e barazimit.<br />
Numri i atomeve C dhe S është i njëjtë në të dyja anët .Për të rregulluar numrin e atomeve hidrogjen<br />
dhe oksigjen vendosim koeficientin 2 para molekulës së ujit.<br />
Meqënëse numri i atomeve është i njëjtë në të dy anët e barazimit heqim shigjetën dhe vendosim<br />
shenjën e barazimit.<br />
C + 2H2SO4 = CO2 + 2SO2 + 2H2O<br />
27
Modele ushtrimesh të zgjidhura për kapitullin “Elektrokimia”<br />
Shembull 1<br />
Në cilin drejtim do të zhvendosen elektronet në reaksionet e mëposhtme:<br />
b) Cu + 2AgNO3 = Cu(NO3)2 + 2Ag<br />
c) Zn + Cu(NO3) 2 = Zn(NO3)2 + Zn<br />
Zgjidhje<br />
Në rastin e parë elektronet zhvendosen nga atomi i bakrit tek jonet e argjendit. Bakri gjendet para<br />
argjendit në rradhën e aktivitetit, pra është më aktiv dhe shfaq veti reduktuese më të forta se argjendi,<br />
domethënë i lëshon më me lehtësi elektronet e shtresës së jashtme.<br />
Në rastin e dytë elektronet zhvendosen nga atomi i zinkut tek jonet e bakrit. Zinku gjendet para bakrit<br />
në rradhën e aktivitetit, pra është më aktiv dhe shfaq veti reduktuese më të forta se bakri, domethënë i<br />
lëshon më me lehtësi elektronet e shtresës së jashtme.<br />
Shembull 2<br />
Nё elementin galvanik: Zn/Zn 2+ // Cu 2+ /Cu<br />
Pёrcaktoni :<br />
a) Cila nga elektrodat ёshtё katoda dhe cila ёshtё anoda?<br />
b) Shkruani gjysёmreaksionet nё çdo elektrodё.<br />
c) Shkruani reaksionin e pёrgjithshёm.<br />
d) Cili është drejtimi i lëvizjes së elektroneve?<br />
Zgjidhje<br />
a) Zinku gjendet para bakrit në rradhën e aktivitetit, pra është më aktiv dhe shfaq veti reduktuese më<br />
të<br />
forta se bakri. Zinku duke qënë një metal aktiv lëshon me lehtësi elektronet e shtresës së jashtme, në<br />
elektrodën e zinkut krijohet një dendësi më e madhe me elektrone, në krahasim me elektrodën e metalit<br />
të bakrit. Kjo është arsyeja që elektroda e zinkut përbën Anodën, e ngarkuar negativisht, kurse<br />
elektroda e bakrit përbën Katodën e ngarkuar pozitivisht. Zinku oksidohet, kurse bakri reduktohet.<br />
b) Gjysmëreaksionet që ndodhin në elektroda:<br />
Anodë : Zn →Zn 2+ + 2e - (oksidim)<br />
Katodë : Cu 2+ + 2e - →Cu (reduktim)<br />
c) Reaksioni i përgjithshëm:<br />
Zn + Cu 2+ = Cu + Zn 2+<br />
28
d) Meqënëse në elektrodën që përcaktuam si anodë ka një dendësi më të madhe me elektrone, në<br />
krahasim me elektrodën që u përcaktua si katodë, elektronet marrin një drejtim të caktuar nga anoda në<br />
katodë.<br />
Shembull 3<br />
Cilët janë produktet e elektrolizës së bromurit të kalciumit CaBr2 të shkrirë?<br />
Çfarë çlirohet në anodë dhe në katodë? Shkruani reaksionet.<br />
Zgjidhje<br />
Në kripën e shkrirë CaBr2 gjenden jonet:<br />
CaBr2 → Ca 2+ + 2Br –<br />
Në katodë do të reduktohen jonet Ca 2+ , procesi shoqërohet me marrje elektronesh dhe zvogëlim të<br />
numrit të oksidimit , ndërsa në anodë do të oksidohen jonet bromur Br – , procesi shoqërohet me dhënie<br />
elektronesh dhe rritje të numrit të oksidimit.<br />
Proceset që ndodhin në elektroda janë:<br />
Katodë (-) Ca 2+ + 2e – → Ca (reduktim)<br />
Anodë (+) 2Br – → Br2 + 2e – (oksidim)<br />
Reaksioni i përgjithshëm:<br />
CaBr2 = Ca + Br2<br />
Produktet e elektrolizës së bromurit të kalciumit CaBr2 janë: në katodë depozitohet kalcium metalik<br />
dhe në anodë çlirohet brom gaz Br2.<br />
Shembull 4<br />
Shkruani reaksionet që ndodhin në elektroda inerte gjatë elektrolizës së tretësirës ujore të sulfatit të<br />
bakrit CuSO4.<br />
Cilat janë produktet e elektrolizës?<br />
Zgjidhje<br />
Në tretësirën ujore të sulfatit të bakrit gjenden jonet:<br />
CuSO4 → Cu 2+ + SO4 2–<br />
H2O ↔ H + + OH -<br />
Jonet që gjenden në tretësirë: jonet bakër Cu 2+ , jonet sulfat SO4 2– , jonet hidrogjen H + ,(që në ujë janë<br />
gjithmonë jone hidron H3O + ) dhe jonet hidroksid OH – .<br />
29
Në katodë do të reduktohen jonet Cu 2+ sepse janë më aktiv, marrin më me lehtësi elektronet në<br />
krahasim me jonet e hidrogjenit, ndërsa në anodë do të oksidohen jonet hidroksid OH – të ujit, të cilët<br />
japin më me lehtësi elektronet në krahasim me jonet sulfat.<br />
Proceset që ndodhin në elektroda janë:<br />
Katodë (-) : 2Cu 2+ + 4e – → 2Cu (reduktim)<br />
Anodë (+) : 4OH – → 2H2O + O2 + 4e – (oksidim)<br />
Reaksioni i përgjithshëm:<br />
2CuSO4 + 2H2O = 2Cu + O2 + 2H2SO4<br />
Në tretësirë mbeten jonet H + dhe SO4 2– . Meqënëse në tretësirë mbeten johe hidron mjedisi ka karakter<br />
acid.<br />
Produktet e elektrolizës së tretësirës ujore të CuSO4 janë: në katodë depozitohet bakër metalik dhe<br />
në anodë çlirohet gazi oksigjen.<br />
Shembull 5<br />
Shkruani reaksionet që ndodhin gjatë elektrolizës së tretësirës ujore të sulfatit të natriumit Na2SO4 me<br />
elektroda inerte.<br />
Cilat janë produktet e elekrolizës?<br />
Zgjidhje<br />
Në tretësirën ujore të sulfatit të natriumit gjenden jonet:<br />
Na2SO4→ 2Na + + SO4 2–<br />
H2O ↔ H + + OH -<br />
Jonet që gjenden në tretësirë janë jonet natrium Na + , jonet sulfat SO4 2– , jonet hidrogjen H + dhe jonet<br />
hidroksid OH – .<br />
Në katodë do të reduktohen jonet H + sepse janë më aktiv, marrin më me lehtësi elektronet në krahasim<br />
me jonet e natriumit Na + , ndërsa në anodë do të oksidohen jonet hidroksid OH – të ujit, të cilët japin më<br />
me lehtësi elektronet në krahasim me jonet sulfat.<br />
Proceset që ndodhin në elektroda janë:<br />
Katodë (-) : 4H + + 4e – → 2H2 (reduktim)<br />
Anodë (+) : 4OH – → 2H2O + O2 + 4e – (oksidim)<br />
Reaksioni i përgjithshëm:<br />
2H2O = 2H2 + O2<br />
Meqënëse në tretësirë mbetën jonet natrium Na + dhe jonet sulfat SO4 2– , të cilët nuk mundet t’i japin<br />
ujit as karakter acid, as karakter bazik, mjedisi që krijohet është asnjanës. Elektrolizës i nënshtrohet<br />
vetëm uji.<br />
30
Produktet e elektrolizës së tretësirës ujore të Na2SO4 janë: në katodë çlirohet gaz hidrogjen dhe në<br />
anodë çlirohet gaz oksigjen.<br />
Shembull 6<br />
Gjatë elektrolizës së nitratit të argjendit AgNO3 në anodë u çliruan 5,6 l oksigjen. Ç’sasi argjendi<br />
grumbullohet në katodë?<br />
Zgjidhje<br />
Të dhëna: VO2= 5,6 l , mAg = ?<br />
Nitrati i argjendit AgNO3 në tretësirë ujore shpërbashkohet sipas skemës:<br />
AgNO3 → Ag + + NO3 –<br />
Uji shpërbashkohet sipas skemës :<br />
H2O ↔ H + + OH –<br />
Jonet që gjenden në tretësirë: jonet argjend Ag + , jonet nitrat NO3 – , jonet hidrogjen H + dhe jonet<br />
hidroksid OH – .<br />
Drejt katodës drejtohen jonet Ag + dhe jonet H + . Nga këto dy jone në katodë shkarkohen jonet argjend<br />
Ag + sepse në rradhën e aktivitetit gjenden poshtë hidrogjenit, kjo do të thotë se jonet e argjendit<br />
reduktohen më me lehtësi se jonet e hidrogjenit.<br />
Drejt anodës drejtohen jonet NO3 – dhe jonet OH – . Nga këto dy jone në anodë shkarkohen jonet OH -<br />
sepse janë më aktiv se jonet nitrat NO3 – , kjo do të thotë se jonet hidroksid oksidohen më me lehtësi se<br />
jonet nitrat.<br />
Proceset që ndodhin në elektroda janë:<br />
Katodë (–): 4Ag + + 4e – → 4Ag (reduktim)<br />
Anodë (+) : 4OH – → 2H2O + O2 + 4e – (oksidim)<br />
Reaksioni i përgjithshëm:<br />
4AgNO3 + 2H2O = 4Ag + O2 + 4HNO3<br />
Produktet e elektrolizës janë: në katodë grumbullohet argjend Ag metalik ,kurse në anodë çlirohet gaz<br />
O2. Në tretësirë mbeten jonet H + dhe NO3 – . Meqënëse në tretësirë mbeten jone hidrogjen mjedisi ka<br />
karakter acid.<br />
Kthejmë në mole 5,6 l oksigjen<br />
1molO<br />
2<br />
22,<br />
4 lO2<br />
=<br />
x molO2<br />
5,<br />
6 lO2<br />
⇒ x = 0,25 mol O2<br />
Nga barazimi ndërtojmë raportin në mole midis argjendit dhe oksigjenit:<br />
4 mol Ag x mol Ag<br />
= ⇒ x =1 mol Ag<br />
1 mol O 0,<br />
25 mol O<br />
2<br />
2<br />
31
Gjejmë sasinë në gram të argjendit Ag:<br />
m = n ·M = 1 mol ·108 g/mol =108g Ag<br />
Përgjigje: Gjatë elektrolizës së tretësirës ujore të nitratit argjendit AgNO3, kur në anodë çlirohen 5,6l<br />
oksigjen, në katodë depozitohet 108 g argjend metalik.<br />
32
Modele ushtrimesh të zgjidhura për kapitullin “Kimia organike”<br />
Shembull 1<br />
Shkruani formulёn e strukturёs sё dimetil -2,3 heksani.<br />
Zgjidhje<br />
a. Përcaktojmë skeletin karbonik me vargun më të gjatë, që e tregon rrënja e fjalës heksan,heks= 6.<br />
Ndёrtojmё vargun me 6 atome karboni dhe i numёrtojmё ato:<br />
1 2 3 4 5 6<br />
C C C C C C<br />
b.Vendosim radikalet nё pozicinet 2dhe 3.<br />
1 2 3 4 5 6<br />
C C C C C C<br />
CH 3<br />
CH 3<br />
c. Plotёsojmё formulёn me atomet e hidrogjenit nё mёnyrё qё valenca e çdo atomi karboni tё<br />
jetё katër.<br />
1 2 3 4 5 6<br />
CH CH<br />
CH 3<br />
Shembull 2<br />
CH3<br />
CH 3<br />
CH 2<br />
CH 2<br />
CH 3<br />
Shkruani formulat e strukturës së izomerëve të pentanit me formulë shume C5H12.<br />
Zgjidhje<br />
1.a Së pari,nxirrni, nga emri pentan, vargun karbonik më të gjatë të kësaj përbërjeje,e cila ka 5 atome<br />
karboni:<br />
1 2 3 4 5<br />
C C C C C<br />
b. Plotësoni të gjitha valencat e çdo atomi karbon,të vargut karbonik,me atome hidrogjeni<br />
në mënyrë që karboni të jetë gjithmonë 4 valent:<br />
1 2 3 4 5<br />
CH3 CH2 CH2 CH3 CH 2 n- pentani<br />
33
2.a Shkruhet vargu me katër atome karboni në të cilën lidhet një radikal në karbonin<br />
më të afërt të skajit<br />
C<br />
4<br />
C<br />
3<br />
C<br />
2<br />
C<br />
1<br />
C<br />
b. Plotësoni të gjitha valencat e çdo atomi karbon,të vargut karbonik,me atome hidrogjeni<br />
në mënyrë që karboni të jetë gjithmonë 4 valent:<br />
4<br />
CH3 3<br />
CH2 CH 3<br />
2<br />
CH<br />
1<br />
CH3 metil -2- butani<br />
3.a Shkruhet vargu me tre atome karboni në të cilën lidhen dy radikale në karbonin 2<br />
C<br />
3<br />
2<br />
1<br />
C C C<br />
C<br />
b. Plotësoni të gjitha valencat e çdo atomi karbon,të vargut karbonik,me atome hidrogjeni<br />
në mënyrë që karboni të jetë gjithmonë 4 valent:<br />
Shembull 3<br />
3<br />
CH3 CH3 2<br />
C<br />
CH 3<br />
1<br />
CH3 Shkruani formulat e strukturës:<br />
a) dimetil -2, 2 - butani<br />
b) metil - 3- heksani<br />
c) tetrametil -2, 3,4,6 - heptani<br />
d) etil -4-dimetil -2,4 - heptani<br />
Zgjidhje<br />
CH 3<br />
dimetil-2,2-propani<br />
1 2 3 4<br />
a) CH C CH<br />
3 2 CH3 dimetil-2,2-butani<br />
CH 3<br />
34
2<br />
CH 2<br />
1<br />
CH 3<br />
3 4 5 6<br />
b) CH3 CH CH2 CH2 CH3 metil- 3 - hekzani<br />
7<br />
c)<br />
CH 3<br />
6<br />
CH<br />
CH 3<br />
5<br />
CH 2<br />
4<br />
CH<br />
CH 3<br />
CH 2<br />
3 2 1<br />
CH CH CH3 CH 3<br />
7<br />
5<br />
4<br />
3<br />
d) CH3 CH CH 2 2 C CH2 Shembull 4<br />
CH 3<br />
CH 3<br />
CH 3<br />
2 1<br />
CH CH3 CH 3<br />
tetrametil-2,3,4,6-heptani<br />
etil-4-dimetil-2,4-heptani<br />
Shkruani përbërjet izomere që formohen nga veprimi i metil -2-butanit me klorin :<br />
Zgjidhje<br />
CH3 CH2 CH CH3 + Cl2 CH3 CH2 CH CH2 Cl + HCl<br />
CH 3<br />
CH 3<br />
metil-2- butani klor-1-metil-2 –butani<br />
Nga veprimi i metil-2-butanit me klorin formohen 4 izomerë pozicioni:<br />
a.<br />
c.<br />
4<br />
CH3 3 2 1<br />
CH CH 2 CH 2 Cl<br />
CH 3<br />
4<br />
CH 3<br />
3<br />
CH<br />
CH 3<br />
2<br />
CH<br />
klor-1-metil-2 butani klor-2-metil-3-butani<br />
b.<br />
Cl<br />
1<br />
CH 3<br />
4 3 2 1<br />
4 3 2 1<br />
d.<br />
CH3 CH CH2 CH2 C<br />
CH 3<br />
CH 2<br />
CH 3<br />
Cl<br />
klor-2-metil-2 butani<br />
CH 3<br />
CH 3<br />
klor-1-metil-3-butani<br />
Cl<br />
35
Shembull 5<br />
Cila është formula molekulare e njё alkani ,nëse 0,2 mole tё tij e kanё masёn 8,8 gram.<br />
Zgjidhje<br />
Të dhëna : n = 0,2 mol m = 8,8 g formula = ?<br />
Gjejmë masën e 1 moli alkan:<br />
meqënëse 0,2 mol alkan e kanë masën 8,8g<br />
1 mol alkan e ka masën x g<br />
1mol<br />
· 8,<br />
8g<br />
x = = 44g<br />
0,<br />
2mol<br />
Formula e përgjithshme e alkanit është CnH2n+2:<br />
C + = 44<br />
n 2n H<br />
2<br />
Zëvendësojmë C dhe H me masat atomike të krahasuara 12 dhe 1 dhe gjejmë sa është vlera numerike e<br />
“n”:<br />
12n + 2n = 42<br />
14n = 42 ⇒ n = 3<br />
Pra, formula e alkanit do të ketë 3 atome karboni: C3H8<br />
Shembull 6<br />
Shkruani formulat e strukturës dhe emërtoni të gjitha alkenet izomerë me formulë molekulare C5H10.<br />
Zgjidhje<br />
a)<br />
b)<br />
5 4 3 2<br />
CH3 CH2 CH2 CH<br />
5<br />
4<br />
CH 3 CH 2 CH CH<br />
4 3 2 1<br />
c) CH3 CH2 C CH2 CH 3<br />
4 3 2 1<br />
d) CH3 CH C CH3 CH 3<br />
4 3 2 1<br />
e)<br />
CH3 CH CH CH2 CH 3<br />
3<br />
2<br />
1<br />
CH 2<br />
1<br />
CH3 penten-1<br />
metil-2-buten-1<br />
metil-2-buten-2<br />
metil-3-buten-1<br />
penten-2<br />
36
Shembull 7<br />
Shkruani formulat e strukturës së këtyre alkeneve:<br />
a) dimetil -2, 5 - hekzen -3<br />
b) trimetil -2, 3,3 - penten -1<br />
c) trimetil -2, 3, 4 -hekzen-3<br />
d) dimetil - 2, 3- buten -1<br />
Zgjidhje<br />
a)<br />
6<br />
CH 3<br />
CH 3<br />
5<br />
CH<br />
CH 3<br />
5 4 3 2<br />
b) C C<br />
CH 3<br />
CH 2<br />
4 3 2<br />
CH CH CH<br />
CH 3<br />
CH 3<br />
CH 3<br />
6 5 4 3<br />
c) C C<br />
CH 2<br />
CH 3<br />
4 3 2<br />
d) C C<br />
CH 3<br />
Shembull 8<br />
CH 3<br />
CH 3<br />
CH 3<br />
1<br />
CH 3<br />
1<br />
CH 2<br />
2<br />
CH<br />
CH 3<br />
CH 3<br />
1<br />
1<br />
CH 3<br />
CH 3<br />
Një përzierje prej 2 molesh metan dhe eten adicionojnë 32 g brom. Cila është përbërja në përqindja e<br />
secilit gaz në këtë përzierje?<br />
Zgjidhje<br />
Të dhëna: m Br = 32 g n përzierjes = 2 mol % e secilit gaz =?<br />
2<br />
Metani është një hidrokarbur i ngopur ai nuk vepron me bromin. Eteni është hidrokarbur i pangopur ai<br />
vepron me bromin.<br />
a) Gjejmë numrin e moleve të bromit:<br />
m 32g<br />
n =<br />
= =<br />
M 160g/mol<br />
0,2 mol Br2<br />
37
) Shkruajmë barazimin e reaksionit:<br />
C2H4 + Br2 → C2H4Br2<br />
c) Ndërtojmë raportin midis etenit dhe bromit:<br />
1mol<br />
C 2H<br />
1mol<br />
Br<br />
2<br />
4<br />
xmol C 2H<br />
=<br />
0,2mol Br<br />
x = 0,2 mol C2H4<br />
4<br />
2<br />
Numri i moleve të etenit është n = 0,2 mol<br />
C2H<br />
4<br />
Numri i moleve të metanit është n = 2- 0,2 = 1,8 mol<br />
Përqindjet e secilit gaz janë :<br />
1,<br />
8<br />
% CH 4 = ⋅100<br />
= 90%<br />
2<br />
% C 2 H 4<br />
0,<br />
2<br />
= ⋅100<br />
= 10%<br />
2<br />
Shembull 9<br />
Sa gram brom adicionon 1l eten?<br />
Zgjidhje<br />
Të dhëna: 1l<br />
VC H<br />
= = ?<br />
2 4<br />
Br<br />
2<br />
CH 4<br />
a) Shkruajmë barazimin e reaksionit<br />
CH2 = CH2 + Br2 → CH2Br − CH2Br<br />
m = 28g<br />
/ mol<br />
MC 2H<br />
4<br />
b) Ndërtojmë raportin midis etenit dhe bromit:<br />
1molC2<br />
H<br />
1molBr<br />
2<br />
4<br />
22,<br />
4l<br />
C 2H<br />
=<br />
160g<br />
Br<br />
2<br />
4<br />
1l<br />
C2<br />
H<br />
=<br />
xg Br<br />
160g<br />
· 1l<br />
x = = 7,<br />
142g<br />
Br2<br />
22,<br />
4l<br />
Për të adicionuar 1l eten nevojiten 7,142 g brom.<br />
2<br />
4<br />
M Br 2<br />
= 160g<br />
/ mol<br />
Vm= 22,4l<br />
38
Shembull 10<br />
3,6 gr H2O adicionohen tek një alken dhe përftohen 12 gr alkol. Cila është formula e alkenit?<br />
a) eten b) buten -1 c) propen d) buten -2<br />
Zgjidhje<br />
Të dhëna: mH 2 O<br />
= 3,6 g malkolit = 12 g formula =?<br />
Shkruajmë barazimin e adicionit të ujit tek alkeni:<br />
CnH2n + H2O → CnH2n + 1OH<br />
Gjejmë numrin e moleve të ujit:<br />
n H2 O<br />
=<br />
m<br />
M<br />
=<br />
3,6g<br />
18g/mol<br />
=<br />
0,2 mol<br />
Ndërtojmë raportin në mole midis alkolit dhe ujit:<br />
1mol<br />
alkol x mol alkol<br />
= ⇒ x= 0,2 mol alkol<br />
1mol<br />
H O 0,2 mol H O<br />
2<br />
2<br />
0,2 mol alkol kanë masën 12 g .Gjejmë masën molare të alkolit:<br />
m 12 g<br />
M alkoolit = = = 60g<br />
/ mol<br />
n 0,<br />
2 mol<br />
Nga formula e përgjithshme përcaktojmë -n :<br />
CnH2n + 1OH = 60 g/mol<br />
Zëvendësojmë C, H dhe O me masat atomike të krahasuara 12, 1 dhe 16 dhe gjejmë sa është vlera<br />
numerike e “n”:<br />
12 n + 2n +1+ 16+1 = 60<br />
14n = 60-18<br />
14n = 42 ⇒ n = 3<br />
Formula e alkenit është CnH2n = C3H2·3 = C3H6 ,pra propeni<br />
Alternativa c<br />
Shembull 11<br />
Sa litra oksigjen nevojiten pёr djegien e 5,6 litra eten?<br />
Zgjidhje<br />
Të dhëna: Voksigjenit = ? Vetenit = 5,6l<br />
39
Shkruajmë barazimin e reaksionit të djegies së etenit :<br />
C2H4 + 3O2 → 2CO2 + 2H2O<br />
Ndërtojmë raportin midis etenit dhe oksigjenit:<br />
1molC2<br />
H<br />
3molO<br />
2<br />
4<br />
22,<br />
4l<br />
C2<br />
H<br />
=<br />
67,<br />
2l<br />
O<br />
5,<br />
6l<br />
· 67,<br />
2l<br />
x = 16,<br />
8l<br />
22,<br />
4l<br />
2<br />
4<br />
5,<br />
6l<br />
C2<br />
H<br />
=<br />
xl O<br />
= O2<br />
Për djegien e 5,6 litra eten nevojiten 16,8 litra oksigjen.<br />
Shembull 12<br />
2<br />
4<br />
Shkruani formulat e strukturës dhe emërtoni të gjitha alkinet izomere me formulë molekulare C5H8.<br />
Zgjidhje<br />
a)<br />
b)<br />
5 4 3 2<br />
CH3 CH2 CH2 C<br />
5 4 3 2<br />
CH3 CH2 C C<br />
4 3 2 1<br />
c) CH3 CH C CH<br />
CH 3<br />
Shembull 13<br />
1<br />
1<br />
CH<br />
CH 3<br />
pentin-1<br />
pentin-2<br />
metil-3-butin-1<br />
Ç’sasi karbur kalciumi CaC2 duhet të veprojë me ujin që të çlirohen 1,12 litra etin në kushte<br />
normale(K.N).<br />
Zgjidhje<br />
Të dhëna: V C = 1,12l mCaC2 = ?<br />
2<br />
2H<br />
Shkruajmë barazimin e reaksionit:<br />
CaC2 + 2H2O → C2H2 + Ca(OH)2<br />
Gjejmë numrin e moleve të etinit :<br />
40
1,<br />
12l<br />
nC H = = 0,<br />
05 mol<br />
2 2 22,<br />
4l<br />
/ mol<br />
Nga barazimi ndërtojmë raportin në mole midis karburit të kalciumit dhe etinit:<br />
mol CaC 2 x mol CaC2<br />
= sjell që x = 0,05 mol CaC2<br />
1<br />
1 mol C H<br />
Kthejmë molet në gram:<br />
2<br />
2<br />
0,<br />
05 mol C H<br />
m = n·M = 0,05 mol. 64g/mol = 32g CaC2<br />
2<br />
2<br />
Përgjigje: Që të çlirohen 1,12l etin nevojiten 32g karbur kalciumi CaC2.<br />
Shembull 14<br />
Shkruani reaksionet e veprimit tё propinit me:<br />
a)1mol Br2 b) 2mol HCl c) 1mol H2 d) H2O e) 2mol H2<br />
Zgjidhje<br />
CH 3<br />
C<br />
propin<br />
Shembull 15<br />
CH<br />
Br 2<br />
2HCl<br />
H 2<br />
H 2O<br />
2H 2<br />
CH 3<br />
CH 3<br />
CH 3<br />
CH 3<br />
CH 3<br />
C<br />
Br<br />
Cl<br />
C<br />
Cl<br />
CH<br />
C<br />
O<br />
CH 2<br />
CH<br />
Br<br />
CH 3<br />
CH 2<br />
CH 3<br />
dibrom-1,2-propen<br />
CH 3<br />
diklor-2,2-propani<br />
propeni<br />
propanon<br />
propan<br />
Ç’sasi etini përftohet nga veprimi i 120 g karbur kalciumi me pastërti 50% me ujin?<br />
Zgjidhje<br />
Të dhëna: V C = ? mCaC2<br />
2H<br />
= 120 g pastërti = 50 %<br />
2<br />
Shkruajmë barazimin e reaksionit:<br />
CaC2 + 2H2O → C2H2 + Ca(OH)2<br />
41
Gjejmë sasinë e karburit të kalciumit që gjendet në 120g CaC2 me pastërti 50%:<br />
50<br />
100<br />
⋅120 = 60g CaC2<br />
Nga barazimi ndërtojmë raportin në mole midis karburit të kalciumitdhe etinit:<br />
1mol<br />
CaC<br />
1 mol C H<br />
2<br />
64g<br />
CaC<br />
96g<br />
CaC<br />
2<br />
2<br />
2<br />
= =<br />
⇒ x = 33,6l C2H2<br />
2 22,<br />
4l<br />
C2<br />
H 2 xlC2<br />
H 2<br />
Nga veprimi i 120 g karbur kalciumi me pastërti 50% me ujin përftohet 33,6l etin<br />
Shembull 16<br />
Shkruani formulat e strukturës të izomerëve të alkoleve me formulë molekulare C5H12O.<br />
Zgjidhje<br />
a)<br />
5<br />
CH3 4<br />
CH2 3<br />
CH2 pentanol-1<br />
c)<br />
5 4<br />
CH3 CH2 2<br />
CH2 1<br />
CH2 3 2 1<br />
CH CH CH 2 3<br />
OH<br />
pentanol-3<br />
4 3 2<br />
e) CH CH2 g)<br />
CH 3<br />
4<br />
CH3 CH 3<br />
metil-3-butanol-1<br />
3<br />
CH<br />
CH 3<br />
2<br />
CH<br />
1<br />
CH2 1<br />
CH3 OH<br />
metil-3-butanol-2<br />
OH<br />
OH<br />
5 4 3 2 1<br />
b) CH3 CH2 CH2 CH CH3 pentanol-2<br />
4 3 2<br />
d) CH<br />
CH 3<br />
f)<br />
h)<br />
4<br />
CH3 3<br />
CH3 CH 2<br />
CH 3<br />
OH<br />
metil-2-butanol-1<br />
3<br />
CH2 CH3 2<br />
CH<br />
1<br />
CH2 1<br />
CH3 OH<br />
metil-2-butanol-2<br />
CH3 2 1<br />
C CH2 CH 3<br />
OH<br />
dimetil-2,2-propanol-1<br />
OH<br />
42
Shembull 17<br />
Shkruani barazimet e këtyre shndërrimeve kimike:<br />
C2H6 → C2H5Cl → C2H5-OH → C2H5-ONa → C2H5-OH<br />
Zgjidhje<br />
a) CH3-CH3 + Cl2 ⎯⎯→ hv<br />
b) C2H5Cl + NaOH ⎯ ⎯→<br />
° t<br />
CH3-CH2-Cl + HCl<br />
C2H5-OH + NaCl<br />
c) C2H5-OH + Na ⎯ ⎯→ C2H5-ONa + ½ H2<br />
d) C2H5-ONa + H2O ⎯ ⎯→ C2H5-OH + NaOH<br />
Shembull 18<br />
Sa gram propanol-1 vepron me natriumin metalik, në qoftë se gjatë reaksionit çlirohen 5,6 litra<br />
hidrogjen në kushte normale(K.N).<br />
Zgjidhje<br />
Të dhëna: mpropanol = ? Vm = 22,4l M -CH<br />
-CH<br />
-OH<br />
= 60g/mol VH2 = 5,6l<br />
Shkruajmë barazimin e reaksionit:<br />
CH3 2 2<br />
CH3-CH2-CH2-OH + Na ⎯ ⎯→ CH3-CH2-CH2-ONa + ½ H2↑<br />
Gjejmë numrin e moleve të hidrogjenit:<br />
V 5,6 l<br />
n H = = = 0,25 mol<br />
2 Vm<br />
22,4 l/mol<br />
Nga barazimi ndërtojmë raportin në mole midis propanolit dhe hidrogjenit:<br />
1mol propanol x mol propanol<br />
= ⇒ x = 0,5 mol etanol<br />
0,5 mol H 0,25 mol H<br />
2<br />
2<br />
Kthejmë molet në gramë :<br />
m = n·M = 0,5 mol·60g/mol = 30g propanol<br />
Përgjigje:Nëse gjatë reaksionit çlirohen 5,6 litra hidrogjen nevojiten 30 gram propanol-1.<br />
43
Shembull 19<br />
Shkruani formulat e strukturës së aldehideve izomere me formulë molekulare C5H10O dhe i emërtoni<br />
ato.<br />
Zgjidhje<br />
a)<br />
CH 3<br />
b) CH<br />
c)<br />
CH 3<br />
CH 3<br />
d) CH 3<br />
CH2 CH2 CH2 C<br />
CH 2<br />
CH 3<br />
CH CH 2<br />
CH 3<br />
CH 3<br />
C<br />
CH 3<br />
C<br />
H<br />
Gjithsej janë 4 izomerë.<br />
Shembull 20<br />
C<br />
C<br />
O<br />
H<br />
O<br />
H<br />
O<br />
H<br />
pentanal<br />
metil-2-butanali<br />
metil-3-butanali<br />
O dimetil-2,2-propanali<br />
Shkruani formulat e strukturës së ketoneve izomere me formulë molekulare C5H10O dhe i emërtoni ato.<br />
Zgjidhje<br />
CH 3<br />
a) CH2 C CH3 b) CH 3<br />
c)<br />
CH 3<br />
CH 2<br />
CH 2<br />
C CH 2<br />
O<br />
CH C CH 3<br />
CH 3<br />
O<br />
Gjithsej janë 3 izomerë.<br />
O<br />
CH 3<br />
pentanon-2<br />
pentanon-3<br />
metil-3-butanon<br />
44
Shembull 21<br />
Rruga industriale e përftimit të propanonit nis nga propeni. Paraqitni me anën e barazimeve kimike<br />
këtë rrugë, duke ditur se sinteza e propanonit nga propeni kryhet në dy shkallë.<br />
Zgjidhje<br />
Së pari: propeni me ujë, në prani të katalizatorit H2SO4, jep propanol-1:<br />
CH 3<br />
CH<br />
CH2 + H2O CH 3<br />
CH<br />
CH 3<br />
propen<br />
OH<br />
propanol-2<br />
Së dyti: propanol-2 vepron me një oksidues dhe shndërrohet në propanon:<br />
CH 3<br />
CH + CuO CH C<br />
3 CH3 + Cu + H2O OH<br />
propanol-2<br />
Shembull 22<br />
CH 3<br />
O<br />
propanon<br />
Oksidimi i butanon-2, duke e valuar me tretësirën permanganat kaliumi KMnO4, çon në formimin e tri<br />
lloje acidesh. Shkruani formulat e strukturës të këtyre acideve.<br />
Zgjidhje<br />
Ketonet oksidohen më me vështirësi se aldehidet, gjatë oksidimit të ketoneve këputet vargu karbonik<br />
dhe përftohen dy, tri ose katër acide, kjo varet nga struktura e ketonit.<br />
Kur grupi karbonilik është në pozicion simetrik ndodh vetëm një këputje dhe formohen dy lloj<br />
acidesh, nëse grupi karbonilik është në pozicion asimetrik ndodhin dy këputje para dhe pas grupit<br />
karbonilik dhe formohen disa lloj acidesh.<br />
Këputja para grupit karbonilik<br />
KMnO 4<br />
a) CH C CH3 CH +<br />
3 CH2 CH 2 COOH HCOOH<br />
vlim 3<br />
acid propanoik acid metanoik<br />
butanon<br />
O<br />
Këputja pas grupit karbonilik<br />
b) C CH3 CH 3<br />
CH 2<br />
butanon<br />
O<br />
KMnO 4<br />
vlim<br />
2<br />
COOH<br />
acid etanoik<br />
CH 3<br />
45
Shembull 23<br />
Shkruani barazimet kimike të këtyre shndërrimeve:<br />
klor-1-propan → propanol → propanal → acid propanoik<br />
Zgjidhje<br />
CH3−CH2−CH2−Cl + NaOH → CH3−CH2−CH2−OH + NaCl<br />
klor-1-propan propanol-1<br />
CH3−CH2−CH2−OH + CuO → CH3−CH2−CHO + Cu + H2O<br />
propanol-1 propanal<br />
CH3−CH2−CHO + 2AgOH → CH3−CH2−COOH + 2Ag + H2O<br />
propanal acid propanoik<br />
Shembull 24<br />
Cila është formula e aldehidit kur 0,2 mol aldehid e kanë masën 11,6g.<br />
Zgjidhje<br />
Të dhëna: n = 0,2 mol m = 11,6g formula =?<br />
Formula e aldehidit është CnH2nO:<br />
Gjejmë masën molare<br />
m 11,6g<br />
M = = = 58g/mol<br />
n 0,2 mol<br />
Duke pasur parasysh formulën e përgjithshme të aldehidit kemi: CnH2nO<br />
Zëvendësojmë C , H dhe O me masat atomike të krahasuara 12, 1 ,16 dhe gjejmë sa është vlera<br />
numerike e “n”:<br />
12n + 2n +16 = 58<br />
14n = 42 ⇒ n = 3<br />
Pra, formula e aldehidit do të ketë 3 atome karboni: C3H6O propanal.<br />
Shembull 25<br />
Sa duhet të jetë vëllimi i ajrit për djegien e plotë të 5,8 gram propanon?<br />
Zgjidhje<br />
Të dhëna : Vajrit=?; mpropanon = ? ; M O = 32g/mol ; Vm=22,4l<br />
2<br />
46
Shkruajmë barazimin e reaksionit:<br />
2 CO CH3 + 8 O2 6CO2<br />
+ 6H2O<br />
CH 3<br />
Duke u mbështetur në barazimin e mësipërm njehsojmë vëllimin e O2, që nevojitet për djegien e 5,8<br />
gram propanon.<br />
Ndërtojmë raportin në mole midis propanonit dhe oksigjenit:<br />
2 mol C3H<br />
6O<br />
116g C3H<br />
6O<br />
5,8g C3H<br />
6O<br />
=<br />
=<br />
8 mol O 179,2 l O x l O<br />
2<br />
5,<br />
8g<br />
⋅179,<br />
2l<br />
x =<br />
=<br />
116g<br />
2<br />
8,<br />
96<br />
l O<br />
Njehsojmë vëllimin e ajrit:<br />
1<br />
VO<br />
= V<br />
2 ajrit Vajrit = 5VO = 5×<br />
8,<br />
96 l = 44,<br />
8 l<br />
2 5<br />
Për djegien e 5,8g propanon nevojiten 44,8 litra ajër.<br />
Shembull 26<br />
2<br />
2<br />
Shkruani formulat e strukturës të të gjitha acideve alkanoike me 5 atome karboni. I emërtoni ato.<br />
Zgjidhje<br />
a)<br />
5<br />
CH3 4<br />
CH2 3<br />
CH2 2<br />
CH2 1<br />
C<br />
O<br />
OH<br />
acid pentanoik<br />
4 3<br />
CH2 b) CH 3<br />
4 3<br />
2<br />
CH<br />
CH 3<br />
c) CH3 CH CH2 3<br />
d) CH 3<br />
CH 3<br />
CH3 2 1<br />
C<br />
CH 3<br />
C<br />
2<br />
O<br />
1<br />
C<br />
1<br />
C<br />
OH<br />
Pra, gjithsej janë 4 izomerë.<br />
O<br />
OH<br />
O<br />
OH<br />
acidi metil-2-butanoik<br />
acidi metil-3-butanoik<br />
acidi dimetil-2,2-propanoik<br />
47
Shembull 27<br />
Sa litra hidrogjen, në kushte normale(K.N), prodhohen nga veprimi i 500 ml tretësirë 0,5M acidi<br />
etanoik me zinkun.<br />
Zgjidhje<br />
Të dhëna: Vacidit = 500 ml CM = 0,5M VH2 = ?<br />
Shkruajmë barazimin e reaksionit:<br />
2CH3COOH + Zn → (CH3COO)2Zn + H2↑<br />
Gjejmë numrin e moleve të CH3COOH:<br />
n<br />
CM = ⇒ n = CM<br />
⋅V<br />
= 0,<br />
5 mol / l ⋅ 0,<br />
5l<br />
= 0,<br />
25 mol<br />
V<br />
Ndërtojmë raportin në mole midis acidit dhe hidrogjenit :<br />
2mol CH 3COOH<br />
0,25 mol CH 3COOH<br />
= x = 0,125 mol H2<br />
1mol<br />
H<br />
x mol H<br />
2<br />
Gjejmë vëllimin e hidrogjenit:<br />
V<br />
n =<br />
V<br />
⇒ V = n ⋅VM<br />
= 0,<br />
125mol<br />
⋅ 22,<br />
4l<br />
/ mol = 2,8 l<br />
M<br />
Shembull 28<br />
Emërtoni esteret:<br />
a) HCOO CH2 CH3 c)<br />
CH 3<br />
COO<br />
CH 2<br />
e) CH3 COO C2H5 CH<br />
CH 3<br />
2<br />
CH 3<br />
b) CH3 CH2 CH 3<br />
d) CH 2<br />
CH 2 COO C 2H 5<br />
COO<br />
C2H5 COO CH3 Zgjidhje<br />
a) metanoat etili b) butanoat etili c) etanoat izobutili<br />
d) propanoat izopropili e) etanoat etili f) propanoat metili<br />
f)<br />
CH<br />
CH 3<br />
CH 3<br />
48
1.Një element reduktohet nëse:<br />
a) merr elektrone<br />
b) jep elektrone<br />
c) n.o të tij rritet<br />
d) jep protone<br />
2. Një substancë është oksiduar nëse:<br />
a) jep elektrone dhe rrit n.o të saj<br />
b) merr elektrone dhe rrit n.o të saj<br />
c) merr elektrone dhe zvogëlon n.o të saj<br />
d) jep elektrone dhe zvogëlon n.o të saj<br />
3. Numri i oksidimit të manganit tek KMnO4 është:<br />
a) -7<br />
b) + 6<br />
c) +7<br />
d) -3<br />
Testi 1<br />
4. Në cilën nga përbërjet e mëposhtme klori ka n.o + 7:<br />
a) Cl2O<br />
b) KClO3<br />
c) HClO4<br />
d) HCl<br />
5. Cili reaksion ndodh në anodën inerte gjatë elektrolizës së MgCl2 të shkrirë:<br />
a) Mg - 2e - → Mg 2+<br />
b) 2Cl - -2e - → Cl2<br />
c) Mg 2+ + 2e - → Mg<br />
d) Cl2 + 2e - → 2Cl –<br />
6. Gjatë procesit të elektrolizës së tretësirës ujore ZnCl2 në katodë prodhohet:<br />
a) Zn<br />
b) H2<br />
c) Cl2<br />
d) O2<br />
7. Në reaksionin: Zn + H2SO4 = ZnSO4 + H2<br />
a) hidrogjeni është reduktuar<br />
b) hidrogjeni është oksiduar<br />
c) squfuri është reduktuar<br />
d) squfuri është oksiduar<br />
49
8. Në një element galvanik anoda është elektroda në të cilën:<br />
a) ndodh reduktimi dhe ka shenjë negative<br />
b) ndodh oksidimi dhe ka shenjë pozitive<br />
c) ndodh reduktimi dhe ka shenjë pozitive<br />
d) ndodh oksidimi dhe ka shenjë negative<br />
9. Cili nga reaksionet e mëposhtme nuk është një reaksion redoks:<br />
2H2 + O2 = 2H2O<br />
C + O2 = CO2<br />
2Al + 3Cl2 = 2AlCl3<br />
CaCO3 = CaO + CO2<br />
10. E saktё apo e gabuar:<br />
____ Elektroliza ёshtё procesi i shndёrrimit tё energjisё elektrike nё energji kimike.<br />
____ Nё anodё ndodh proçesi i reduktimit.<br />
____ Gjatё funksionimit tё elementit galvanik anoda e zvogёlon masёn dhe katoda e rrit masёn.<br />
____ Elementi galvanik funksionon pёr aq kohё sa ekziston anoda.<br />
11. Në tabelën e mëposhtme:<br />
Plotësoni: numrin e elektroneve (e - ) të dhëna ose të marra,procesin dhe llojin e agjentit reduktues<br />
ose agjentit oksidues.<br />
Numri i e - të dhëna ose të<br />
marra<br />
0 +2<br />
Cu ? → Cu<br />
+7 +2<br />
Mn ? → Mn<br />
-2 +6<br />
S ? → S<br />
12. Në reaksionin redoks:<br />
Zn + HCl → ZnCl2 + H2<br />
Përcaktoni:<br />
a) numrat e oksidimit,<br />
b) skemën e këmbimit elektronik,<br />
c) koefiçientët në barazimin redoks.<br />
Procesi Agjent<br />
50
13. Nё elementin galvanik: Zn / Zn 2+ // Cu 2+ / Cu.<br />
Pёrcaktoni :<br />
a) Cila nga elektrodat ёshtё katoda dhe cila ёshtё anoda<br />
b) Shkruani gjysёmreaksionet nё çdo elektrodё.<br />
c) Shkruani reaksionin e pёrgjithshёm.<br />
d) Sa është është rritur masa e katodës nëse nëse masa e anodës është zvogëluar me 26gram.<br />
14. Përshkruani proceset që zhvillohen në elektroda gjatë elektrolizës së tretësirës ujore ZnSO4:<br />
a) Jonet që gjenden në tretësirë.<br />
b) Skema e shkarkimit të joneve.<br />
c) Reaksionin i përgjithshëm.<br />
d) Reaksionin e mjedisit në elektrolizer.<br />
e) Vëllimin e gazit që çlirohet në anodë nëse në katodë depozitohet 13 g Zn .<br />
51
1. Formula e pёrgjithshme e alkaneve ёshtё:<br />
a) CnHn<br />
b) CnH2n<br />
c) CnH2n-2<br />
d) CnH2n+2<br />
2. Cila nga pёrbёrjet e mёposhtme ёshtё njё alken:<br />
a) C3H8<br />
b) C3H4<br />
c) C3H6<br />
d) C2H2<br />
Testi 2<br />
3. 4,2 gr propen veprojnë me klorin Cl2 gaz në kushte normale(KN).Vëllimi i klorit është:<br />
a) 1,12 l<br />
b) 11,2 l<br />
c) 22,4 l<br />
d) 2,24 l<br />
4. Plotёsoni fjalitё e mёposhtme:<br />
a) Pёrbёrjet izomere kanё formulё molekulare tё _______ por formulё strukture tё _________.<br />
b) Reaksionet gjatё tё cilave dy substanca njera prej tё cilave ka lidhje shumёfishe bashkohen dhe<br />
formojnё njё pёrbёrje tё vetme quhen reaksione _________________________.<br />
c) Reaksionet gjatё tё cilit zёvendёsohet njё atom ose njё grup atomik me njё atom apo njё grup<br />
atomik tjetёr quhen reaksione _________________________.<br />
d) Produktet e djegies së hidrokarbureve janë ____________________dhe ________________<br />
e) Nga hidrogjenimi i alkeneve formohen ___________________________.<br />
5. Gjeni nëse emërtimi etil- 2- butani është i saktë apo i gabuar.<br />
6. Emërto përbërjet e mëposhtme:<br />
a)<br />
CH 3<br />
CH3 CH3 C C<br />
CH 3 CH 3<br />
CH 2<br />
CH 3<br />
52
) CH3 CH2 C CH2 c)<br />
CH 3<br />
CH<br />
CH 3<br />
CH 3<br />
C C<br />
CH 3 CH 3<br />
CH<br />
7. Plotёsoni barazimet e reaksioneve dhe pёrcaktoni tipin e reaksionit:<br />
CH3 ─ CH2 ─ CH2─ CH3 → ________________ + H2<br />
CH3 ─ CH3 + Cl2 → _____________ + HCl<br />
CH3 ─ CH ═ CH2 + H2O → ___________________<br />
C4H10 + O2 → __________ + ______________<br />
CH3 ─CH = CH2 + H2 → __________________<br />
CH3 ─C ≡CH + 2H2 → ____________________<br />
CH3─CH2OH ___________ + H2O<br />
8. Shkruani formulat e strukturёs tё:<br />
a) buten –1<br />
b) dimetil– 3,4-heptani<br />
c) metil-4-pentin-2<br />
9. Gjeni formulёn molekulare tё njё alkani nëse 0,2 mole tё tij e kanё masёn 8,8 gram.<br />
10. Sa gram brom adicionohet nga 67,2 litra etin në kushte normale(K.N)?<br />
53
1. Cila prej substancave të mëposhtme ёshtё alkol:<br />
a) C2 H5OH<br />
b) CH3 ─ CHO<br />
c) CH3 ─ COOH<br />
d) CH3 ─ CO ─ CH3<br />
2.Grupi funksionor i ketoneve ёshtё:<br />
a) ─ CHO<br />
b) ─ CO ─<br />
c) ─ COOH<br />
d) ─ OH<br />
3. Cili ёshtё emri i acidit:<br />
CH 3<br />
CH3 C CH CH2<br />
CH 3<br />
CH 3<br />
a. acid heptanoik<br />
b. acid trimetil 2,3 ,3- pentanoik<br />
c.acidi trimetil 3,4,4 -pentanoik<br />
d. acidi trimetil -3,4,4 -butanoik<br />
4.Cili nga emërtimet është i gabuar:<br />
a) pentanol -2<br />
b) dimetil -2,2 – propanol -1<br />
c) dimetil -2,2 - propanol -2<br />
d) metil – 2- butanol -1<br />
COOH<br />
5. Cila nga përbërjet e mëposhtme është fenol :<br />
a) C6H5 - CH3<br />
b) C6H5 -NH2<br />
c) C6H5OH<br />
d) C6H5COOH<br />
Testi 3<br />
54
6. Plotёsoni fjalitё e mёposhtme:<br />
a) Nga oksidimi i alkoleve parёsore formohen___________________________.<br />
b) Alkolet dhe fenolet veprojnё me natriumin metalik dhe çlirojnё ___________.<br />
c) Nga oksidimi i aldehideve formohen _______________________________.<br />
d) Grupi funksionor i acideve karboksilike ёshtё _____________________.<br />
e) Nga oksidimi i alkoleve dytёsore formohen _____________________________.<br />
7. Nё pohimet e mёposhtme vendosni e saktё apo e gabuar:<br />
______ Aldehidet japin reaksionin e pasqyrёs.<br />
______ Nga oksidimi i alkoleve parёsore formohen ketone.<br />
______ Nga oksidimi i aldehideve formohen acide karboksilike.<br />
______ Aldehidet dhe ketonet janё pёrbёrje izomere .<br />
______ Alkolatet shpёrbёhen nga uji.<br />
8. Shkruani formulat e strukturёs tё :<br />
a) propanol -2<br />
b) dimetil – 2,3 -butanali<br />
c) pentanon-2<br />
d)acidi dimetil – 2,2 –propanoik<br />
9. Plotёsoni reaksionet dhe emёrtoni produktet :<br />
c)<br />
a) CH3 ─ CH2OH + HCl →<br />
b) CH3─CH2OH + Na →<br />
CH 3<br />
C CH 3<br />
+ H 2<br />
d) CH3 O<br />
CH + CuO<br />
OH<br />
CH 3<br />
e) C 6H5OH + NaOH →<br />
f) CH3 ─ CH2─ CHO + AgOH →<br />
55
10. Shkruani barazimet e reaksioneve pёr shndёrrimet e mёposhtme. Emёrto substancat e shënuara me<br />
shkronjat A,B,C,D .<br />
CH2 = CH2<br />
+ HCl<br />
+ NaOH<br />
+ CuO<br />
+ AgOH<br />
⎯ ⎯⎯ →A⎯⎯⎯→B⎯⎯→<br />
⎯ C ⎯⎯⎯→D<br />
11. Sa gram etanal duhet tё veprojnё me hidroksidin e argjendit pёr tё formuar 54 gram argjend.<br />
56