- Page 1 and 2: UDŽBENICI SVEUČILIŠTA U SPLITU M
- Page 3 and 4: Zahvala Zahvaljujem mojim dragim ko
- Page 5 and 6: 4.1.2.2. Talište .................
- Page 7 and 8: 10. DODATAK 176 10.1. ODREðIVANJE
- Page 9 and 10: Ako je stupanj polimerizacije nizak
- Page 11 and 12: Pojedini makromolekulni lanci mogu
- Page 13 and 14: Zasićene elastomerne makromolekule
- Page 15 and 16: 2. Struktura polimera Struktura tva
- Page 17 and 18: x i n M Σn M i i = 2.3 i i Zbrajan
- Page 19 and 20: 2.1.2. Broj tipova ponavljanih jedi
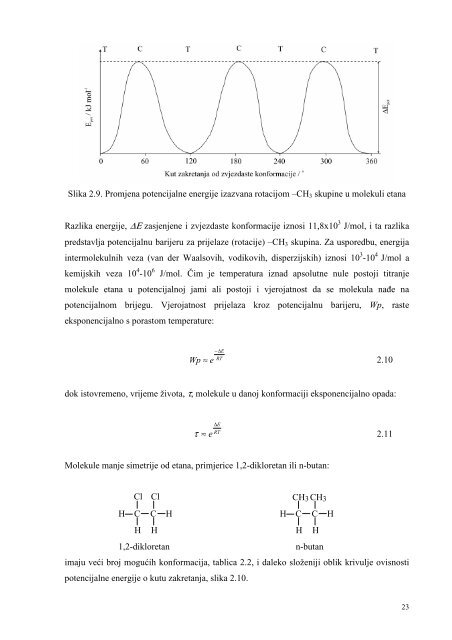
- Page 21 and 22: UHMW) koristi se za polietilen rela
- Page 23 and 24: Ljestvaste makromolekule Makromolek
- Page 25 and 26: • Neregularne veze nastaju ako se
- Page 27 and 28: Ako se makromolekule sastoje od dul
- Page 29: Slika 2.7. Shematski prikaz molekul
- Page 33 and 34: fleksibilnost makromolekule. Samo u
- Page 35 and 36: Slika 2.13. Prostorni prikaz segmen
- Page 37 and 38: meñumolekulno djelovanje. U toj ko
- Page 39 and 40: Slika 2.18. Prikaz spiralnih konfor
- Page 41 and 42: ne zapaža. Polimerne kinetičke je
- Page 43 and 44: aspodjela relaksacijskih vremena. T
- Page 45 and 46: Uobičajeno je da se makromolekule
- Page 47 and 48: Meñusoban odnos kristalnih i amorf
- Page 49 and 50: Najčešći strukturni oblici polim
- Page 51 and 52: metakrilat) i polistiren (oba su am
- Page 53 and 54: kroz više faznih stanja izmeñu kr
- Page 55 and 56: Slika 3.13. Fazni prijelazi prvog r
- Page 57 and 58: Slika 3.15. Shematski prikaz umrež
- Page 59 and 60: 4. Fizička i fazna stanja Fazna st
- Page 61 and 62: • čvrsto • kapljevito. Meñuti
- Page 63 and 64: Slika 4.3. Ovisnost specifičnog vo
- Page 65 and 66: premještanje centra mase makromole
- Page 67 and 68: Staklište polimera ovisi o više
- Page 69 and 70: karakterizira viši T g . U monosup
- Page 71 and 72: T g /°C T t /°C Polimeri s gipkim
- Page 73 and 74: Utjecaj omekšavala na termomehani
- Page 75 and 76: Slika 4.12. Ovisnost modula elasti
- Page 77 and 78: U novije vrijeme Boyer je izradio k
- Page 79 and 80: - ako je T m
- Page 81 and 82:
5. Kemijska svojstva polimera 5. 1.
- Page 83 and 84:
- inicijaciju, koja se najčešće
- Page 85 and 86:
Intenzitet razgradnog procesa ovisi
- Page 87 and 88:
Slika 5.2. Krivulja toplinske razgr
- Page 89 and 90:
Oksidacijska razgradnja polimera od
- Page 91 and 92:
Moguća je i rekombinacija slobodni
- Page 93 and 94:
Mnogi konstrukcijski polimeri, uklj
- Page 95 and 96:
kontrolirati količinom karbonilnih
- Page 97 and 98:
Osjetljivost polimera na ionizacijs
- Page 99 and 100:
itno utječu na mehanička svojstva
- Page 101 and 102:
5.1.9. Biorazgradnja Obzirom na raz
- Page 103 and 104:
U širem smislu biopolimerima se sm
- Page 105 and 106:
Makromolekule sa strukturama koje i
- Page 107 and 108:
5.2.1.1. Izražavanje toplinske pos
- Page 109 and 110:
Slika 5.7. Shema procesa gorenja po
- Page 111 and 112:
elemenata, primjerice fosfora ili b
- Page 113 and 114:
praktičnih razloga prvi stupanj u
- Page 115 and 116:
6. Permeacija polimera Prijenos tva
- Page 117 and 118:
gdje P pokazuje koliko cm 3 permean
- Page 119 and 120:
dobra barijerna svojstva. Suprotno,
- Page 121 and 122:
Slika 6.3. Dijagram sorpcije u ovis
- Page 123 and 124:
hlañenjem materijala pri velikom t
- Page 125 and 126:
Slika 7.1. Shematski prikaz djelova
- Page 127 and 128:
7.2. Modeli viskoelastičnih svojst
- Page 129 and 130:
Na krivulji ovisnosti recipročne v
- Page 131 and 132:
Slika 7.5. Relaksacija naprezanja 1
- Page 133 and 134:
Ispitivanjem puzanja dobije se uvid
- Page 135 and 136:
Slika 7.11. Izokroni σ-ε dijagram
- Page 137 and 138:
7.3.3. Elastični postefekt Ako se
- Page 139 and 140:
ispitnog tijela, kao i njegovo prod
- Page 141 and 142:
Pojava hladnog razvlačenja može s
- Page 143 and 144:
7.4.2. Značajke ovisnosti rastezno
- Page 145 and 146:
Žilavi polimeri bez granice razvla
- Page 147 and 148:
Slika 7.23. Krivulje rastezno napre
- Page 149 and 150:
Slika 7.24. Krivulja naprezanje-ist
- Page 151 and 152:
- ispitivanje puzanja - ispitivanje
- Page 153 and 154:
Povećanje žilavosti dogaña se č
- Page 155 and 156:
statički ili dinamički. Ispitivan
- Page 157 and 158:
količina topline koja se zbog male
- Page 159 and 160:
Temperatura omekšavanja po Vicatu
- Page 161 and 162:
Gornja lijeva strana krivulje preds
- Page 163 and 164:
Treba istaknuti da vlakna imaju vrl
- Page 165 and 166:
uzduž lanaca nego izmeñu njih. Sl
- Page 167 and 168:
c p ( T ) = (1 −ψ ) c ( T ) + ψ
- Page 169 and 170:
gdje je ф f volumni udjel punila,
- Page 171 and 172:
8.7. Toplinska prodornost Toplinska
- Page 173 and 174:
Dielektrična svojstva su: - permit
- Page 175 and 176:
elektron donor) a druga negativno n
- Page 177 and 178:
9.4. Elektriti Zagrijani polimer, p
- Page 179 and 180:
Slika 9.4. Elektronske vrpce konjug
- Page 181 and 182:
odnosno postizanje vodljivosti pra
- Page 183 and 184:
10. Dodatak 10.1. Odreñivanje stru
- Page 185 and 186:
simetrično rastezanje asimetrično
- Page 187 and 188:
ezultirat će intenzivnom vrpcom u
- Page 189 and 190:
C-H vibracije u (-CH 2 -) skupini 1
- Page 191 and 192:
6. torzija gdje su: I-rastezanje, S
- Page 193 and 194:
Tablica 10.3. Ovisnosti valnog broj
- Page 195 and 196:
Slika 10.4. Rasklopljiva ćelija; 1
- Page 197 and 198:
3400 i 3300 cm -1 . Pri tome spojev
- Page 199 and 200:
Struktura makromolekule (identifika
- Page 201 and 202:
Primjerice, u spektru mješavine po
- Page 203 and 204:
Termooksidacijom se u polienske lan
- Page 205 and 206:
10.1.2. Ultraljubičasta i vidljiva
- Page 207 and 208:
Slika 10.9. UV-VIS spektar dehidrok
- Page 209 and 210:
mjerenja odreñenog svojstva u ovis
- Page 211 and 212:
- umreženju (otvrdnjavanju) - vulk
- Page 213 and 214:
Na temelju vrijednosti tališta mo
- Page 215 and 216:
Slika 10.18. Usporedba DSC krivulja
- Page 217 and 218:
10.2.2. Termogravimetrijska analiza
- Page 219 and 220:
predeksponencijalni faktor /min -1
- Page 221 and 222:
10.3. Kratice najčešćih polimera
- Page 223 and 224:
11. Literatura 1. P. Flory, Princip
- Page 225 and 226:
42. N. Grassie, Development in Poly
- Page 227:
83. P. J. Haines, Thermal Methods o