Teil 5
Teil 5
Teil 5
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
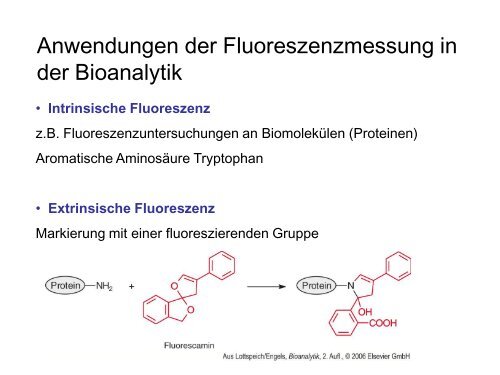
Anwendungen der Fluoreszenzmessung in<br />
der Bioanalytik<br />
• Intrinsische Fluoreszenz<br />
z.B. Fluoreszenzuntersuchungen an Biomolekülen (Proteinen)<br />
Aromatische Aminosäure Tryptophan<br />
• Extrinsische Fluoreszenz<br />
Markierung mit einer fluoreszierenden Gruppe
Immunhistochemie, Immuncytochemie
Immunglobulin G<br />
Antigenbindungsstelle<br />
(Paratop)<br />
Antigenbindungsstelle<br />
(Paratop)
Immunhistochemie, Immuncytochemie
Untersuchung der Dynamik von Molekülen<br />
in lebenden Zellen<br />
Zellteilung<br />
Zellwachstum<br />
Signaltransduktion<br />
Messung der Diffusionsgeschwindigkeit<br />
Markierung mit dem Grün Fluoreszierenden Protein (GFP)
Grün fluoreszierendes Protein (GFP)<br />
Nobelpreis für Chemie 2008:<br />
Osamu Shimomura, Martin Chalfie und Roger Y. Tsien<br />
Für Entdeckung und Entwicklung des Grün Fluoreszierenden Proteins<br />
Aequorea victoria<br />
• Einführen des GFP Gens in zelluläre DNA<br />
• Kopplung des GFP Gens an das Gen, das<br />
man untersuchen möchte („Chimäres Protein“)
Fluoreszenz-Resonanz-Energietransfer<br />
(FRET)<br />
Die Energie eines angeregten Fluorophors, der als Donor bezeichnet<br />
wird, wird strahlungslos auf einen zweiten, als Akzeptor bezeichneten<br />
Fluorophor übertragen. Der Akzeptor gibt statt des Donors die Energie in<br />
Form von Fluoreszenzlicht ab.<br />
Voraussetzungen:<br />
Das Emissionsspektrum des Donors muss mit dem Absorptionsspektrum<br />
des Akzeptors überlappen.
Fluoreszenz-Resonanz-Energietransfer<br />
(FRET)<br />
Der Prozess erfolgt nur bei Abständen im Bereich weniger nm,<br />
wobei die Effizienz der Übertragung sehr empfindlich vom Abstand<br />
zwischen Donor und Akzeptor abhängt.<br />
Kein FRET-Signal FRET-Signal
Fluoreszenz-Resonanz-Energietransfer<br />
(FRET)<br />
Die Intensität des FRET Signals nimmt mit der 6. Potenz des<br />
Abstands beider Fluorophore ab:<br />
I <br />
Information über inter- und intramolekulare Abstände<br />
Nachweis von Wechselwirkungen zwischen<br />
• Protein-Protein<br />
• Protein-Nukleinsäure<br />
• Nukleinsäure-Nukleinsäure<br />
1<br />
r<br />
6