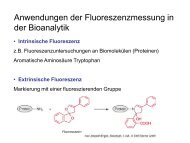
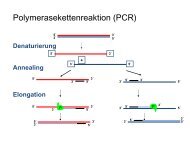
Teil 2 - Institut für Analytische Chemie
Teil 2 - Institut für Analytische Chemie
Teil 2 - Institut für Analytische Chemie
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
Elektrolyte<br />
• Elektrolyte leiten in wässriger Lösung Strom.<br />
• Zu den Elektrolyten zählen Säuren, Basen und Salze, denn<br />
• diese alle liegen in wässriger Lösung zumindest teilweise in Ionenform vor.<br />
• Das Ostwaldsche Verdünnungsgesetz beschreibt den Dissoziationsgrad von<br />
schwachen Elektrolyten, also den Anteil der freien <strong>Teil</strong>chen in einer Lösung mit<br />
Hilfe des Massenwirkungsgesetzes. Gemäß dieser Beziehung nimmt der<br />
Dissoziationsgrad α mit abnehmender Einwaagekonzentration c 0 (steigender<br />
Verdünnung) zu. Daher sind auch schwache Elektrolyte bei hinreichender<br />
Verdünnung praktisch vollständig dissoziiert. Der Zusammenhang wurde von<br />
Wilhelm Ostwald entdeckt.<br />
(aus: Goldenberg, SOL)
„Eigendissoziation“ des Wassers<br />
Auch in chemisch reinem Wasser lässt sich eine geringe Leitfähigkeit messen. Der Grund hier<strong>für</strong> ist die<br />
„Eigendissoziation“ des Wassers in Hydronium- und Hydroxid-Ionen.<br />
Für diese Reaktion gilt das Massenwirkungsgesetz:<br />
H 2O + H 2O H 3O + + OH –<br />
Das Gleichgewicht der Reaktion liegt stark auf der linken Seite, und die Gleichgewichtskonstante K hat somit<br />
einen sehr kleinen Wert. In einer wässrigen Lösung ist H 2O im Überschuss vorhanden ([H 2O] = 1000 g/l / 18<br />
g/mol = 55,5 mol/l). Die H 2O -Konzentration bleibt deshalb konstant, und der Nenner kann in die Konstante K mit<br />
einbezogen werden.<br />
K · [H 2O] 2 = K W = [H 3O + ]·[OH – ] = 10 -14 mol 2 /l 2<br />
Die bei gegebener Temperatur konstante Grösse K W kann durch Leitfähigkeitsmessungen bestimmt werden und<br />
wird als Ionenprodukt des Wassers bezeichnet.<br />
(aus: Goldenberg, SOL)
Säuren und Basen<br />
Die Lowry-Brønsted-Definition <strong>für</strong> Säuren und Basen wird heute allgemein<br />
verwendet:<br />
Säuren geben Protonen ab: Protonendonatoren<br />
Basen nehmen Protonen auf: Protonenakzeptoren<br />
Allgemein gilt:<br />
Säure-Base-Reaktionen sind Protonenübertragungsreaktionen<br />
Die Hydronium-Ionen-Konzentration wird meist nur als<br />
Wasserstoffionenkonzentration [H + ] bezeichnet.<br />
(aus: Goldenberg, SOL)
Stärke von Säuren und Basen<br />
• Säuren und Basen dissoziieren in Wasser nicht vollständig, sondern liegen auch als<br />
undissoziierte Moleküle vor. Der Dissoziationsgrad hängt von der Säurestärke ab. Betrachten wir<br />
das Dissoziationsgleichgewicht einer Säure HA (<strong>für</strong> Basen gilt dasselbe):<br />
HA + H 2O H 3O + + A –<br />
• Für starke Säuren liegt das Gleichgewicht weit auf der rechten Seite, d.h. die Säure liegt nahezu<br />
vollständig als H 3O + und A – vor. Sie ist vollständig dissoziiert. Eine schwache Säure dagegen ist<br />
nur zu einem geringen <strong>Teil</strong> dissoziiert und liegt zum grössten <strong>Teil</strong> als HA vor.<br />
• Auch <strong>für</strong> die Dissoziationsreaktionen gilt das Massenwirkungsgesetz.<br />
K<br />
[H3O<br />
] [A ]<br />
[H O] [HA]<br />
• 2<br />
Da sich in verdünnter Lösung die Konzentration des Wassers kaum ändert, wird sie in die<br />
Konstante einbezogen.<br />
K<br />
[H ] [A<br />
[HA]<br />
]<br />
(aus: Goldenberg, SOL)
Stärke von Säuren und Basen<br />
Analog wird bei den Basen vorgegangen:<br />
B + H 2O HB + + OH –<br />
K<br />
[HB ] [OH<br />
[B ]<br />
• Die Konstanten werden mit K s (<strong>für</strong> die Säuren) und K b (<strong>für</strong> die<br />
Basen) bezeichnet. Sie sind ein Maß <strong>für</strong> die Stärke der<br />
jeweiligen Säure.<br />
• Üblicherweise verwendet man die negativen dekadischen<br />
Logarithmen (p-Werte) pK s und pK b.<br />
Die Angabe der Zahlenwerte ist nur <strong>für</strong> schwache Säuren und Basen sinnvoll, da starke in verdünnter<br />
wässriger Lösung immer in Form der korrespondierenden Base/Säure vorliegen.<br />
-<br />
]<br />
(aus: Goldenberg, SOL)
Konjugierte Säure-Basepaare 1<br />
Bei der Dissoziation einer Säure wie HCl nimmt H 2O ein Proton auf. H 2O reagiert also als Base:<br />
HCl + H 2O -> H 3O + + Cl –<br />
Säure 1 Base 2<br />
Die Protonenabgabe einer Säure oder die Protonenaufnahme einer Base ist eine reversible<br />
Reaktion. Bei HCl reagiert bei der Rückreaktion das Chlorid-Ion als Base und das Hydronium-<br />
Ion als Säure:<br />
H 3O + + Cl – -> HCl + H 2O<br />
Säure 2 Base 1<br />
Es stellt sich ein Gleichgewicht zwischen Hin- und Rückreaktion ein. HCl und Cl – sind ein<br />
konjugiertes Säure-BasePaar, ebenso H 3O + und H 2O. Durch die Doppelpfeile wird<br />
ausgedrückt, dass Hin- und Rückreaktion gleichzeitig ablaufen:<br />
HCl + H 2O H 3O + + Cl –<br />
Säure 1 Base 2 Säure 2 Base 1<br />
H 3O + konjugierte Säure der Base H 2O<br />
Cl – konjugierte Base der Säure HCl<br />
Ein konjugiertes Säure-Base-Paar unterscheidet sich also um ein Proton.<br />
(aus: Goldenberg, SOL)
Konjugierte Säure-Basepaare 2<br />
Beispiel <strong>für</strong> Basen: Bei Ammoniak wird bei der Rückreaktion das Ammonium-Ion zur<br />
Säure und das Hydroxid-Ion zur Base:<br />
NH 3 + H 2O OH – + NH 4 +<br />
Base 1 Säure 2 Base 2 Säure 1<br />
NH 4 + konjugierte Säure der Base NH3<br />
OH – konjugierte Base der Säure H 2O (!)<br />
Die allgemeinen Schreibweisen lauten demnach:<br />
HA + H 2O H 3O+ + A –<br />
B + H 2O HB + + OH –<br />
(aus: Goldenberg, SOL)
Berechnung der Protonenkonzentration<br />
Kennt man die Konzentration der H 3O + -Ionen, so lässt sich über das Ionenprodukt die Konzentration der<br />
OH – -Ionen berechnen und umgekehrt. Wenn zum Beispiel in einer Messung eine H 3O + -Konzentration<br />
von 10 -5 mol/l ermittelt wurde, so berechnet sich folgende OH – -Konzentration:<br />
Die Konzentration der Hydronium- bzw. der Hydroxidionen ist das Maß, ob und wie stark eine Lösung<br />
sauer, basisch oder neutral ist.<br />
In einer neutralen Lösung sind H 3O + - und OH – -Konzentration gleich gross. Die Gleichung <strong>für</strong> das<br />
Ionenprodukt lässt sich dann als K W = [H 3O + ] 2 schreiben und man erhält die Beziehung:<br />
(aus: Goldenberg, SOL)
Der pH-Wert<br />
• Der pH-Wert wird als negativer dekadischer Logarithmus der H 3O + -Ionenkonzentration definiert.<br />
pH = - log [H3O + ]<br />
• Auf dieser Definition basiert die pH-Skala. Ihre Anwendung <strong>für</strong> wässrige Lösungen reicht von pH = 0<br />
([H 3O + ] = 1 mol/l = 10 0 mol/l) bis pH = 14 ([H 3O + ] = 10 -14 mol/l).<br />
• Sinkt der pH-Wert in einer Lösung um eine Einheit (um 1,0), bedeutet das aufgrund der<br />
logarithmischen Skala, dass sich die Hydronium-Ionenkonzentration um den Faktor 10 erhöht hat<br />
und umgekehrt.<br />
• Der pOH-Wert ist analog als negativer dekadischer Logarithmus der OH – -Ionenkonzentration<br />
definiert.<br />
pOH = - log [OH – ]<br />
• pH und pOH hängen über das Ionenprodukt des Wassers zusammen. Bildet man den negativen<br />
Logarithmus des Ionenprodukts, erhält man<br />
- log K W = - log ([H 3O + ]·[OH – ]) = - log 10 -14 , pH + pOH = 14<br />
(aus: Goldenberg, SOL)
Starke Säuren und Basen<br />
pH-Berechnungen<br />
• Eine starke Säure liegt in wässriger Lösung fast ausschliesslich in dissoziierter Form<br />
vor (Gleichgewicht vollständig auf der rechten Seite).<br />
• Allgemein gilt daher <strong>für</strong> starke Säuren:<br />
• Für starke Basen gilt entsprechend:<br />
HA + H 2O => H 3O + + A –<br />
pH = - log [HA]<br />
pOH = - log [B], bzw. pH = 14 + log [B]<br />
(aus: Goldenberg, SOL)
Proteolyse von Säuren<br />
(aus: Otto, p53)
pH-Berechnungen<br />
(aus: Otto, p54)
Proteolyse mehrprotoniger Säuren<br />
(aus: Otto, p56)
Abhängigkeit Ladung-pH<br />
• Ampholyte sind Substanzen, die sowohl als Säure als auch als Base<br />
reagieren können, als Beispiel ist hier die Aminosäure Glycin angeführt.
Proteolyse von Ampholyten<br />
(aus: Otto, p58)
Neutralisation<br />
• Säuren und Basen reagieren miteinander in exothermer Reaktion unter Bildung<br />
von Wasser. Die Reaktion von Salzsäure und Natronlauge ergibt<br />
HCl + NaOH NaCl + H 2O<br />
• Da sowohl die Salzsäure als auch die Natronlauge in wässriger Lösung nur in Form<br />
ihrer Ionen vorliegen, ist die eigentlich Reaktion<br />
H 3O + + OH - 2 H 2O<br />
die Bildung von Wasser, deren Gleichgewicht ganz auf der rechten Seite liegt. Sind<br />
die Mengen der einander neutralisierenden starken Säuren und Basen bei einer<br />
Neutralisation äquivalent, verschwinden die sauren und basischen Eigenschaften,<br />
es bleibt eine neutrale Salzlösung zurück.<br />
(aus: Goldenberg, SOL)
Verlauf einer Titrationskurve<br />
(aus: Otto, p69)
Neutralisation schwacher Säuren<br />
• Neutralisiert man statt einer starken Säure eine schwache Säure mit Natronlauge, so weist<br />
die Lösung keinen neutralen pH-Wert auf, sondern reagiert basisch.<br />
• z.B. reagiert das Anion der Essigsäure (CH 3COOH) Acetat (CH 3COO - ):<br />
CH 3COO – + H 2O CH 3COOH + OH –<br />
zu einem geringen aber nicht mehr vernachlässigbaren Anteil mit Wasser. Es entstehen OH – -<br />
Ionen und der pH steigt etwas an.<br />
• Die Stärke der Base Acetation lässt sich aus derjenigen der konjugierten Essigsäure<br />
berechnen:<br />
pK b (Acetat) + pK s (Essigsäure) = 14<br />
(aus: Goldenberg, SOL)
Titration einer schwachen Säure<br />
Zu Beginn:<br />
Titrationsgrad zwischen 0 und 1:<br />
Am Äquivalenzpunkt:<br />
Halbe Neutralisation: pH=pK S
Titration von Essigsäure mit NaOH
Titration von Ammoniak mit HCl<br />
(aus: Otto, p70)
Pufferlösungen<br />
Allgemein werden Lösungen, deren pH-Wert sich bei der Zugabe von Säure oder Base nur wenig<br />
verändert, als Pufferlösungen bezeichnet. Sie enthalten ein konjugiertes Säure-Base-Paar, wobei die<br />
Säure OH – -Ionen neutralisiert, die Base H 3O + -Ionen.<br />
Pufferlösungen lassen sich herstellen, indem man<br />
* schwache Säuren mit ihrem Salz (z.B. der Acetatpuffer aus Essigsäure und Natriumacetat)<br />
bzw.<br />
* schwache Basen mit ihrem Salz (z.B. der Ammoniumpuffer aus Ammoniumchlorid und Ammoniak)<br />
mischt.<br />
Sind beide Spezies in genügend grosser Konzentration vorhanden, reagiert der Acetatpuffer<br />
folgendermassen:<br />
Pufferung der Zugabe starker Säuren<br />
H 3O + + CH 3COO – CH 3COOH + H 2O<br />
Die zugegebene starke Säure reagiert vollständig zu CH 3COOH. Dass der pH-Wert sich dennoch geringfügig<br />
ändert, hat mit dem Effekt zu tun, dass die gebildete Essigsäure wiederum (zu einem geringen Anteil)<br />
dissoziieren kann.<br />
Pufferung der Zugabe starker Basen<br />
OH – + CH 3COOH CH 3COO – + H 2O<br />
(aus: Goldenberg, SOL)
Pufferlösungen<br />
(aus: Goldenberg, SOL)
Pufferkapazität<br />
Die Pufferkapazität β ist ein Maß <strong>für</strong> die Aufnahmefähigkeit einer<br />
Pufferlösung <strong>für</strong> starke Säuren bzw. Basen.<br />
Die maximale Pufferkapazität liegt bei pH=pK S.<br />
Der typische Einsatzbereich liegt bei pH=pK S ± 1<br />
(aus: Otto, p65)
Der Phosphatpuffer<br />
Wichtige anorganische Puffer<br />
Das Dihydrogenphosphation ist eine schwache Säure mit einem pKs von etwa 7. Daher kann man<br />
durch Mischung von Dihydrogenphosphat und Hydrogenphosphat einen Puffer im<br />
physiologischen Bereich erzeugen. Um einen pH von 7,4 zu erzielen, müssen nach der<br />
Puffergleichung<br />
[HPO4<br />
]<br />
pH pK s log<br />
-<br />
[H2PO4<br />
]<br />
die beiden Ionenarten im Verhältnis<br />
vorliegen.<br />
2-<br />
[HPO4 2-<br />
2PO4<br />
[H<br />
]<br />
]<br />
2, 5<br />
2-<br />
(aus: Goldenberg, SOL)
Titration mehrprotoniger Säuren<br />
(aus: Otto, p73)
Puffer-Systeme<br />
(aus: Lehninger, Principles of Biochemistry, Freeman)
CO 2 löst sich aus der Atmosphäre<br />
in Wasser. Schwache Basen<br />
können schon so zu einem<br />
bestimmten <strong>Teil</strong> durch die<br />
Kohlensäure gebunden sein.<br />
Abhilfe: Entgasen durch<br />
Unterdruck und Ultraschall<br />
Effekte von Kohlendioxid
Indikatoren: Methylorange<br />
(aus: Otto, p74)
Indikatoren: Phenolphtalein<br />
Ein menschliches Auge kann Farben unterscheiden, wenn die<br />
Konzentrationsverhältnisse der beiden Indikatorformen etwa<br />
Im Verhältnis 1:10 vorliegen.<br />
(aus: Otto, p75)
pH-Indikatoren<br />
(aus: Jander Blasius Lehrbuch der<br />
analytischen und präparativen<br />
anorganischen <strong>Chemie</strong>,<br />
S.Hirzel Verlag, 59)
Oxidation und Reduktion<br />
• Die Begriffe Oxidation und Reduktion beschreiben chemische<br />
Vorgänge, bei denen Elektronen von einem Reaktionspartner<br />
auf den anderen transferiert werden.<br />
• Der die Elektronen abgebende Elektronendonator wird dabei<br />
oxidiert, der sie aufnehmende Elektronenakzeptor wird<br />
reduziert. Der Elektronendonator ist in dieser Reaktion das<br />
Reduktionsmittel, der Akzeptor das Oxidationsmittel.<br />
• Da bei jeder dieser Reaktionen sowohl eine Oxidation als auch<br />
eine Reduktion stattfindet, spricht man von Redoxreaktionen.<br />
(aus: Goldenberg, SOL)
Redoxreaktionen können in die Oxidations- und Reduktions-<strong>Teil</strong>reaktion aufgespalten<br />
werden:<br />
z.B. die Bildung von Wasser aus den Elementen<br />
in zwei <strong>Teil</strong>gleichungen<br />
1.Oxidation von Wasserstoff:<br />
2. Reduktion von Sauerstoff:<br />
Redoxgleichungen<br />
2 H 2 + O 2 2 H 2O<br />
H 2 => 2 H + + 2 e -<br />
(x 2 zu multiplizieren)<br />
O 2 + 4 e - + 4 H + => 2 H 2O<br />
(aus: Goldenberg, SOL)
Oxidationszahl<br />
• Die Oxidationszahl gibt die formale Ladung des jeweiligen Atoms an. Aus<br />
der Differenz der Oxidationszahlen vor und nach der Reaktion ist<br />
ersichtlich, wieviele Elektronen das Atom (bzw. Ion) aufgenommen oder<br />
abgegeben hat.<br />
• Bei Elementen ist die Oxidationszahl stets = 0<br />
• Bei einfachen Ionen entspricht die Oxidationszahl der Ladung des Ions<br />
• Bei Molekülen muss die formale Ladung jedes Atoms bestimmt werden.<br />
Die Bindungselektronen werden dem Atom mit der größeren<br />
Elektronegativität zugeordnet. Nun wird die Valenzelektronenzahl des<br />
Atoms in der Verbindung mit der Zahl der Außenelektronen im neutralen<br />
Atom verglichen. Die Differenz ergibt die formale Ladung des Atoms in der<br />
Verbindung und diese ist gleich der Oxidationszahl.<br />
(aus: Goldenberg, SOL)
Fällungsreaktionen <strong>für</strong> Gravimetrie und Titrimetrie<br />
(aus: Otto, p81)
(aus: Jander Blasius p54)
Löslichkeitskonstante K L +<br />
(aus: Otto, p82)
(aus: Otto, p83)
Berechnung der Sättigungskonzentration c sa<br />
(aus: Otto, p84)
Beeinflussung von Fällungsgleichgewichten<br />
• Gleichionige Zusätze: Löslichkeit des schwerlöslichen Salzes wird reduziert<br />
(Anwendung des MWG)<br />
• Fremdionige Zusätze: Löslichkeit kann durch Veränderung der Ionenstäre<br />
erhöht werden. Es kann zu Komplexbildungen kommen, auch Protolyse<br />
oder Kopplung an pH<br />
(aus:Schwedt, p98)
Sulfidfällung: Abhängigkeit der S 2- Konzentration von pH<br />
(aus: Jander Blasius p73)
Sulfidfällung abhängig vom pH<br />
(aus: Otto, p88)
Gravimetrie<br />
(aus:Schwedt, p101)
Gravimetische Analyse<br />
(aus:Schwedt, p102)
Nachtrag Chemometrie:<br />
Autokorrelationsfunktion<br />
Das Rauschen von Messvorgängen kann zeitlich definierten Schwankungen<br />
unterliegen (zB. Stromverbrauch in frühen Morgenstunden).<br />
Unter Autokorrelation versteht man allgemein die Korrelation der Glieder einer<br />
Zeitreihe und ermöglicht die Berechnung wie sich die Korrelation zwischen zwei<br />
Werten einer Reihe ändert, wenn sich deren Abstand ändert.<br />
Anwendungsbeispiel: Ermittlung von minimalen Probennahmeintervallen zur<br />
Überwachung von zB. Abwasserreinigungsanlagen. Der minimale<br />
Probennahmeabstand ist erreicht, wenn die erhaltenen Messwerte gerade nicht<br />
mehr korrelieren.