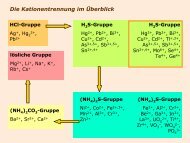
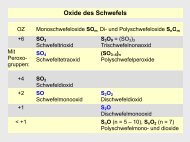
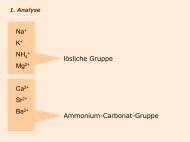
Säuren und Basen
Säuren und Basen
Säuren und Basen
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
<strong>Säuren</strong> <strong>und</strong> <strong>Basen</strong>
Was ist eine Säure?<br />
<strong>Säuren</strong> sind Reinstoffe, deren wässrige Lösungen<br />
Indikatoren charakteristisch färben. <strong>Säuren</strong> erhöhen die<br />
elektrische Leitfähigkeit beim Lösen in Wasser.<br />
Stoffname<br />
Summenformel<br />
Chlorwasserstoff<br />
HCl<br />
Schwefelsäure H 2 SO 4<br />
Salpetersäure HNO 3<br />
Phosphorsäure H 3 PO 4<br />
Blausäure<br />
HCN<br />
Schwefelwasserstoff<br />
H 2 S<br />
Essigsäure<br />
H 3 CCOOH<br />
Citronensäure HOOC COOH<br />
HO COOH
Was ist eine Base ?<br />
<strong>Basen</strong> sind Reinstoffe deren wässrige Lösungen Indikatoren<br />
charakteristisch färben. <strong>Basen</strong> erhöhen die elektrische<br />
Leitfähigkeit beim Lösen in Wasser.<br />
Stoffname<br />
Summenformel<br />
Natriumhydroxid<br />
NaOH<br />
Kaliumhydroxid<br />
KOH<br />
Ammoniak NH 3<br />
Natriumacetat<br />
H 3 CCOONa
Indikatoren<br />
Indikator<br />
Farbe im pH (Umschlag)<br />
Sauren Alkalischen<br />
Phenolrot gelb rot 6,4...8,2<br />
Phenolphtalein farblos rot 8,2...9,8<br />
Methylrot rot gelb 4,4...6,2<br />
Lackmus rot blau 5,0...8,0<br />
Thymolblau rot gelb 1,2...2,8<br />
Universal - Indikator versch. versch. versch.
Indikatoren<br />
– H +<br />
HInd Ind –<br />
+ H +<br />
protonierte<br />
Form<br />
deprotonierte<br />
Form<br />
Farbe gelb blau<br />
Mischfarbe<br />
im Umschlagsbereich<br />
grün
Phenophthalein<br />
O<br />
O<br />
Na + – OOC<br />
H<br />
O<br />
+ 2 NaOH<br />
H<br />
HO<br />
H<br />
OH<br />
- 2 H 2 O<br />
H<br />
O – Na +
Lackmus
Methylrot
Das Konzept der elektrolytischen Dissoziation<br />
<strong>Säuren</strong> dissoziieren in Wasser in<br />
Wasserstoff-Kationen <strong>und</strong> Säurerest-<br />
Anionen<br />
Die Wasserstoff-Kationen sind<br />
entscheidend für die Säuremerkmale.<br />
<strong>Basen</strong> sind Verbindungen, die in<br />
Wasser Hydroxid-Anionen <strong>und</strong><br />
Metall-Kationen bilden.<br />
Die Hydroxid-Anionen sind<br />
entscheidend für den<br />
<strong>Basen</strong>charakter.<br />
Svante Arrhenius (1859 - 1927)
Welche Ionen bilden sich beim Lösen einer Säure?<br />
Dissoziation:<br />
H Cl H + + Cl –<br />
H<br />
H + + O<br />
H<br />
H<br />
+<br />
O<br />
H<br />
H<br />
Hydroxonium-Ion<br />
HCl + H 2 O H 3 O + + Cl –
Welche Ionen bilden sich beim Lösen einer Base?<br />
Dissoziation eines Hydroxid-Salzes:<br />
NaOH H 2O Na + (aq) + – O H (aq)
Nachteile der Arrhenius-Theorie<br />
‣ Theorie ist auf wässrige Lösungen beschränkt<br />
‣ Basisches Verhalten von Verbindungen, welche keine<br />
OH-Gruppen enthalten (z.B. NH 3 ) kann nicht erklärt<br />
werden.<br />
‣ Es müssen Verbindungen postuliert werden (z.B.<br />
NH 4 OH), welche nicht existent sind.
Das Protonen-Donator-Akzeptor-Konzept<br />
Johannes Nicolaus<br />
Brønsted (1879 - 1947)<br />
Thomas Martin Lowry<br />
(1874 - 1936)<br />
<strong>Säuren</strong> sind Teilchen, die Protonen abgeben<br />
(Protonendonatoren)<br />
<strong>Basen</strong> sind Teilchen, die Protonen aufnehmen<br />
(Protonenakzeptoren)
Kennzeichen von Säure- <strong>und</strong> Base-Lösungen<br />
Alle sauren Lösungen enthalten einen Überschuss an<br />
Hydroxonium-Ionen<br />
Moleküle, die bei einer Reaktion Protonen an andere<br />
Teilchen abgeben, werden als Protonendonatoren<br />
bezeichnet. (lat. donare = spenden)<br />
Alle alkalischen Lösungen enthalten einen Überschuss an<br />
Hydroxid-Ionen.<br />
Moleküle, die bei einer Reaktion Protonen von anderen<br />
Teilchen aufnehmen, werden als Protonenakzeptoren<br />
bezeichnet. (lat. accipere = aufnehmen)
Brønsted-<strong>Säuren</strong> <strong>und</strong> -<strong>Basen</strong><br />
Jedes Teilchen, dass als Brønsted-Säure wirken möchte,<br />
benötigt die Anwesenheit einer Brønsted-Base.<br />
HCl + H 2 O H 3 O + + Cl –<br />
H<br />
H N<br />
H<br />
Base<br />
H<br />
H<br />
+ O H N<br />
H<br />
H<br />
Säure<br />
H<br />
+<br />
+ – O H
Säure-Base-Reaktionen ohne Wasser<br />
Bildung von Ammoniumchlorid:<br />
H<br />
H<br />
+<br />
H<br />
N<br />
+ H Cl H N<br />
H<br />
+ Cl –<br />
H<br />
H<br />
Säure-Base-Reaktionen sind nicht auf das wässrige Medium<br />
beschränkt.
Konjugierte Säure-Base-Paare<br />
Säure-Base-Reaktionen sind reversibel:<br />
HCl + H 2 O H 3 O + + Cl –<br />
NH 3 + H 2 O NH 4 + + OH –<br />
HCl + H 2 O H 3 O + + Cl –<br />
NH 3 + H 2 O NH 4 + + OH –
Konjugierte Säure-Base-Paare<br />
Dynamisches Gleichgewicht:<br />
HCl + H 2 O H 3 O + + Cl –<br />
Säure (1) Base (2) Säure (2) Base (1)
Anhydride<br />
CO 2 + H 2 O H 2 CO 3<br />
H 2 CO 3 + H 2 O HCO 3 – + H 3 O +<br />
CaO + H 2 O Ca 2+ + 2 OH –
Neutralisation<br />
Neutralisation:<br />
Vereinigung von Wasserstoffionen einer Säure mit den<br />
Hydroxidionen einer Base zu Wasser<br />
H 3 O + + Cl – + Na + + OH – Na + + Cl – + 2 H 2 O<br />
Säure Base Salz Wasser<br />
Hydrolyse:<br />
Umkehrung der Neutralisation<br />
Reaktion eines Salzes mit Wasser unter Bildung einer Säure<br />
<strong>und</strong> einer Base
Ionenprodukt des Wassers<br />
H 2 O + H 2 O H 3 O + + OH -<br />
+ −<br />
[ HO<br />
3 ] ⋅[ OH]<br />
[ HO<br />
2 ] ⋅[ HO<br />
2 ]<br />
=<br />
K c<br />
⇔<br />
+ −<br />
[ HO<br />
3 ] ⋅[ OH]<br />
2<br />
[ HO<br />
2 ]<br />
=<br />
K c<br />
⇔<br />
+ −<br />
[ HO<br />
3 ] ⋅ [ OH] = Kc<br />
⋅[ HO<br />
2 ]<br />
2<br />
[H 2 O] ≈ konstant<br />
[ ] [ ]<br />
+ −<br />
H3O<br />
⋅ OH = K c ⋅ [ H2O]<br />
[ H ] [ ]<br />
+ −<br />
3O<br />
⋅ OH = K w<br />
2<br />
ges<br />
K W = 10 –14 mol 2 L –2
Temperaturabhängigkeit des Ionenproduktes<br />
K w 12 × 10 -14<br />
10<br />
8<br />
6<br />
4<br />
2<br />
0<br />
0 10 15 20 25 30 40 50 60<br />
t [°C]<br />
Bei 24°C beträgt die<br />
Konzentration an<br />
Hydroxonium- <strong>und</strong><br />
Hydroxidionen<br />
10 –14 mol2·L –2<br />
Die Konzentration an<br />
einer der beiden<br />
Ionensorten beträgt<br />
10 –7 mol·L –1<br />
[<br />
+<br />
]<br />
2<br />
[<br />
+<br />
]<br />
3<br />
w<br />
3<br />
HO = K ⇒ HO = K<br />
w
Wann reagiert eine Lösung sauer, wann basisch?<br />
Saure Lösung:<br />
[ ] [ ]<br />
+ −7<br />
−<br />
H O > 10 > OH<br />
3<br />
Alkalische Lösung:<br />
[<br />
+<br />
]<br />
−7<br />
HO<br />
[<br />
−<br />
OH]<br />
3<br />
< 10
Der pH-Wert<br />
pH =−lg [H 3 O + ]<br />
saure Lösung: pH < 7<br />
alkalische Lösung: pH > 7<br />
neutrale Lösung: pH = 7
Der pOH-Wert<br />
pOH =−lg [OH - ]<br />
pH + pOH = pK w = 14
Der pH-Wert<br />
[H 3 O ] 10 10 10 10 10 10 10 10 10 10 10 10 10 10 10<br />
[OH - ] 10 -14 10 -13 10 -12 10 -11 10 -10 10 -9 10 -8 10 -7 10 -6 10 -5 10 -4 10 -3 10 -2 10 -1 10 0<br />
pH 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14<br />
pOH 14 13 12 11 10 9 8 7 6 5 4 3 2 1 0<br />
sauer<br />
neutral<br />
alkalisch
Die Säure- <strong>und</strong> Base-Konstante<br />
Die Stärke einer Säure oder einer Base ist durch ihre<br />
Neigung zur Protonenaufnahme oder -abgabe<br />
gekennzeichnet.<br />
HA A - + H +<br />
Die Stärke von <strong>Säuren</strong> <strong>und</strong> <strong>Basen</strong> lässt sich nicht absolut<br />
sondern nur relativ bestimmen. Bezugsgröße ist Wasser:<br />
HA + H 2 O A - + H 3 O + B + H 2 O BH + + OH -
Die Säure- <strong>und</strong> Base-Konstante<br />
Starke <strong>Säuren</strong> <strong>und</strong> <strong>Basen</strong><br />
HA + H 2 O A - + H 3 O + B + H 2 O BH + + OH -<br />
Schwache <strong>Säuren</strong> <strong>und</strong> <strong>Basen</strong><br />
HA + H 2 O A - + H 3 O + B + H 2 O BH + + OH -
Die Säure- <strong>und</strong> Base-Konstante<br />
HA + H 2 O A - + H 3 O + B + H 2 O BH + + OH -<br />
[<br />
+<br />
] [<br />
−<br />
HO ]<br />
3<br />
⋅ A<br />
[ HA] ⋅ [ H O]<br />
2<br />
=<br />
K c<br />
[<br />
+<br />
] [<br />
−<br />
HO ]<br />
3<br />
⋅ A<br />
K [ H O]<br />
c 2<br />
[ HA] = ⋅ = K S<br />
[<br />
+<br />
] [<br />
−<br />
BH ⋅ OH ]<br />
[ B] ⋅ [ H O]<br />
2<br />
= ′<br />
K c<br />
[<br />
+<br />
BH ] [<br />
−<br />
⋅ OH ]<br />
[ B]<br />
[ ]<br />
= K′ ⋅ H O = K<br />
c<br />
2<br />
B
Die Säure- <strong>und</strong> Base-Konstante<br />
HA + H 2 O A – + H 3 O + A – + H 2 O HA + OH –<br />
K<br />
S<br />
=<br />
[ A<br />
− ] ⋅ [ H O<br />
+<br />
]<br />
[ HA]<br />
3<br />
[ ] [<br />
−<br />
HA OH ]<br />
K = ⋅<br />
B −<br />
[A ]<br />
K<br />
S<br />
⋅ K =<br />
B<br />
[ A ] ⋅[ H O ]<br />
[ HA]<br />
⋅<br />
[ HA] ⋅[ OH ]<br />
[<br />
−<br />
A ]<br />
− + −<br />
3<br />
[ ] [<br />
−]<br />
K ⋅ K = H O + ⋅ OH<br />
S<br />
B<br />
3<br />
K ⋅ S<br />
K = B<br />
K<br />
W<br />
pK + pK = pK<br />
S B W
Die Säure- <strong>und</strong> Base-Konstante<br />
pK S(H2S) = 7.04<br />
pK B(H2S) = 6.96<br />
pK S(CH3COOH) = 4.75<br />
pK B(CH3COOH) = 9.25<br />
pK S(NH 3) = 9.25<br />
pK B(NH 3) = 4.75<br />
pK = 14 W
Die Säure- <strong>und</strong> Base-Konstante<br />
sehr starke Säure (Base) pK S (pK B ) ≤ -1.74<br />
starke Säure (Base) - 1.74 < pK S (pK B ) ≤ 4.5<br />
schwache Säure (Base) 4.5 < pK S (pK B ) ≤ 9.5<br />
sehr schwache Säure (Base) 9.5 < pK S (pK B ) ≤ 15.74<br />
extrem schwache Säure (Base) pK S (pK B ) ≥ 15.74
Pufferlösungen<br />
Mischungen aus gleichen Anteilen einer schwachen Säure<br />
<strong>und</strong> ihrer korrespondierenden Base oder aus einer<br />
schwachen Base <strong>und</strong> ihrer korrespondierenden Säure<br />
werden Pufferlösungen genannt.<br />
Sie sind in der Lage sowohl H + -als auch OH – -Ionen zu<br />
binden <strong>und</strong> halten den daher den pH-Wert in weiten<br />
Konzentrationsbereichen konstant.<br />
Eine wässrige Lösung, die trotz Zugabe einer starken Säure<br />
oder Base den pH-Wert in gewissen Grenzen stabilisiert,<br />
wird als Puffer oder Pufferlösung bezeichnet.
Pufferformel - Henderson-Hasselbalch-Gleichung<br />
A – + H +<br />
HA + OH –<br />
HA<br />
A – + H 2 O<br />
[H + ] · [A – ]<br />
[HA]<br />
= K S [H + ] = [HA]<br />
[A – ]<br />
· K S<br />
[H + ] = K S pH = pK S<br />
Henderson-Hasselbalch<br />
pH = pK S + lg [A– ]<br />
[HA]
Das Elektronen-Donator-Akzeptor-Konzept<br />
<strong>Säuren</strong> sind Elektronenpaar-<br />
Akzeptoren.<br />
<strong>Basen</strong> sind Elektronenpaar-<br />
Donatoren.<br />
Cl<br />
Cl<br />
Cl Al<br />
Cl<br />
+ Cl – Cl Al<br />
Cl<br />
Lewis-SäureLewis-Base<br />
Cl<br />
–<br />
Gilbert Newton Lewis (1875 - 1946)
Beispiele für Lewis-<strong>Säuren</strong> <strong>und</strong> -<strong>Basen</strong><br />
Lewis-<strong>Säuren</strong><br />
(Elektronenpaar-Akzeptoren)<br />
Lewis-<strong>Basen</strong><br />
(Elektronenpaar-Donatoren)<br />
BF 3 F –<br />
AlH 3<br />
H 2 O<br />
SO 3 OH –<br />
H + NH 3<br />
Fe 2+ CN –
Lewis-Säure-Base-Komplexe<br />
Lewis-Säure + Lewis-Base Säure-Base-Komplex<br />
S + :B S:B<br />
Säure-Base-Komplex = Säure-Base-Adukt = Koordinationsverbindung =<br />
Elektronenpaar-Akzeptor-Donator-Komplex<br />
Lewis-Säure-Base-Komplex Lewis-Säure Lewis-Base<br />
NaCl Na + Cl –<br />
[Fe(CN) 6 ]<br />
–<br />
4 Fe 2+ CN –<br />
[Ag(OH) 2 ] – Ag + OH –<br />
H 2 SO 4 SO 3 H 2 O
Stärke von Lewis-<strong>Säuren</strong> <strong>und</strong> <strong>Basen</strong><br />
Elemente sind umso saurer, je positiver <strong>und</strong> je kleiner sie sind<br />
Elemente sind umso basischer, je negativer <strong>und</strong> je größer sie sind<br />
AlCl 3 < AlCl 2+ < AlCl 2+ < Al 3+<br />
H 2 O < OH – < O 2–<br />
Säurestärke<br />
<strong>Basen</strong>stärke