Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
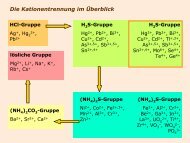
HSAB-Prinzip
<strong>Säure</strong>n und <strong>Base</strong>n<br />
-Das Konzept der elektrolytischen Dissoziation -<br />
Svante Arrhenius (1859 - 1927)<br />
<strong>Säure</strong>n dissoziieren in in Wasser in in<br />
Wasserstoff-Kationen und <strong>Säure</strong>rest-<br />
Anionen<br />
Die Die Wasserstoff-Kationen sind<br />
entscheidend für für die die <strong>Säure</strong>merkmale.<br />
<strong>Base</strong>n sind Verbindungen, die die in in<br />
Wasser Hydroxid-Anionen und<br />
Metall-Kationen bilden.<br />
Die Die Hydroxid-Anionen sind<br />
entscheidend für für den<br />
<strong>Base</strong>ncharakter.
<strong>Säure</strong>n und <strong>Base</strong>n<br />
-Welche Ionen bilden sich beim Lösen einer <strong>Säure</strong> -<br />
Dissoziation:<br />
H Cl H + + Cl –<br />
H + + O<br />
H<br />
H<br />
H<br />
O<br />
H<br />
H<br />
+<br />
Hydroxonium-Ion<br />
HCl + H 2O H 3O + + Cl –
Neutralisation<br />
-Begriffsbildung -<br />
Neutralisation:<br />
Vereinigung von Wasserstoffionen einer <strong>Säure</strong> mit den Hydroxidionen einer <strong>Base</strong> zu<br />
Wasser<br />
MOH + HR MR + H 2 O<br />
<strong>Base</strong> + <strong>Säure</strong> Salz + Wasser<br />
OH - + H 3 O + 2 H 2 O<br />
Hydrolyse:<br />
Umkehrung der Neutralisation<br />
Reaktion eines Salzes mit Wasser unter Bildung einer <strong>Säure</strong> und einer <strong>Base</strong>
<strong>Säure</strong>n und <strong>Base</strong>n<br />
-Nachteile der Arrhenius-Theorie -<br />
• Theorie ist auf wässrige Lösungen beschränkt<br />
• Basisches Verhalten von Verbindungen, welche keine OH-Gruppen enthalten (z.B.<br />
NH 3 ) kann nicht erklärt werden.<br />
• Es müssen Verbindungen postuliert werden (z.B. NH 4 OH), welche nicht existent<br />
sind.
<strong>Säure</strong>n und <strong>Base</strong>n<br />
-Das Protonen-Donator-Akzeptor-Konzept -<br />
Johannes Nicolaus<br />
Brønsted (1879 - 1947)<br />
Thomas Martin Lowry<br />
(1874 - 1936)<br />
<strong>Säure</strong>n sind sind Teilchen, die die Protonen abgeben (Protonendonatoren)<br />
<strong>Base</strong>n sind Teilchen, die Protonen aufnehmen (Protonenakzeptoren)<br />
---> keine Abspaltung von OH –<br />
<strong>Base</strong>n sind Teilchen, die Protonen aufnehmen (Protonenakzeptoren)<br />
---> keine Abspaltung von OH –
<strong>Säure</strong>n und <strong>Base</strong>n<br />
-Kennzeichen von sauren und basischen Lösungen -<br />
Alle sauren Lösungen enthalten einen Überschuss an<br />
Hydroxonium-Ionen<br />
Moleküle, die bei einer Reaktion Protonen an andere<br />
Teilchen abgeben, werden als Protonendonatoren<br />
bezeichnet. (lat. donare = spenden)<br />
Alle alkalischen Lösungen enthalten einen Überschuss an<br />
Hydroxid-Ionen.<br />
Moleküle, die bei einer Reaktion Protonen von anderen<br />
Teilchen aufnehmen, werden als Protonenakzeptoren<br />
bezeichnet. (lat. accipere = aufnehmen)
<strong>Säure</strong>n und <strong>Base</strong>n<br />
- Brønsted <strong>Säure</strong>n und <strong>Base</strong>n -<br />
Jedes Teilchen, dass als Brønsted-<strong>Säure</strong> wirken möchte,<br />
benötigt die Anwesenheit einer Brønsted-<strong>Base</strong>.<br />
HCl + H2O H3O + + Cl –<br />
H<br />
<strong>Säure</strong> <strong>Base</strong>
<strong>Säure</strong>n und <strong>Base</strong>n<br />
- Elektronenpaar-Donator-Akzeptor-Konzept -<br />
Gilbert Newton <strong>Lewis</strong> (1875 - 1946)<br />
<strong>Säure</strong>n sind Elektronenpaar-<br />
Akzeptoren.<br />
<strong>Base</strong>n sind Elektronenpaar-<br />
Donatoren.<br />
Cl<br />
Cl<br />
Al<br />
Cl<br />
+ Cl –<br />
<strong>Lewis</strong>-<strong>Säure</strong><strong>Lewis</strong>-<strong>Base</strong><br />
Cl<br />
Cl<br />
Al<br />
Cl<br />
Cl<br />
–
<strong>Lewis</strong>-<strong>Säure</strong>n und <strong>Base</strong>n<br />
- Beispiele -<br />
<strong>Lewis</strong>-<strong>Säure</strong>n <strong>Lewis</strong>-<strong>Base</strong>n<br />
(Elektronenpaar-Akzeptoren) (Elektronenpaar-Donatoren)<br />
BF3 AlH3 SO3 F –<br />
H 2 O<br />
OH –<br />
H + NH 3<br />
Fe 2+ CN –
<strong>Lewis</strong>-<strong>Säure</strong>n und <strong>Base</strong>n<br />
- <strong>Lewis</strong>-<strong>Säure</strong>-<strong>Base</strong>-<strong>Komplexe</strong> -<br />
<strong>Lewis</strong>-<strong>Säure</strong> + <strong>Lewis</strong>-<strong>Base</strong> <strong>Säure</strong>-<strong>Base</strong>-Komplex<br />
S + :B S:B<br />
<strong>Säure</strong>-<strong>Base</strong>-Komplex = <strong>Säure</strong>-<strong>Base</strong>-Adukt = Koordinationsverbindung =<br />
Elektronenpaar-Akzeptor-Donator-Komplex<br />
<strong>Lewis</strong>-<strong>Säure</strong>-<strong>Base</strong>-Komplex <strong>Lewis</strong>-<strong>Säure</strong> <strong>Lewis</strong>-<strong>Base</strong><br />
NaCl Na + Cl –<br />
[Fe(CN) 6] 4 – Fe 2+ CN –<br />
[Ag(OH) 2] – Ag + OH –<br />
H 2SO 4 SO 3 H 2O
Stärke von <strong>Lewis</strong>-<strong>Säure</strong>n und <strong>Base</strong>n<br />
Elemente sind umso saurer, je positiver und je kleiner sie sind<br />
Elemente sind umso basischer, je negativer und je größer sie sind<br />
AlCl 3 < AlCl 2 + < AlCl 2+ < Al 3+<br />
H 2O < OH – < O 2–<br />
<strong>Säure</strong>stärke<br />
<strong>Base</strong>nstärke
<strong>Lewis</strong>-<strong>Säure</strong>n und <strong>Base</strong>n<br />
- Stärke von <strong>Lewis</strong>-<strong>Säure</strong>n und <strong>Base</strong>n -<br />
Können <strong>Lewis</strong>-<strong>Säure</strong>n und <strong>Base</strong>n gemäß ihrer Stärke in eine Aciditätsreihe<br />
oder Basizitätsreihe eingeordnet werden?<br />
<strong>Lewis</strong>-<strong>Säure</strong>-<strong>Base</strong> Komplex ist umso stabiler, je acider die <strong>Lewis</strong>-<strong>Säure</strong> S<br />
und je basischer die <strong>Lewis</strong>-<strong>Base</strong> :B ist????<br />
(CH3) 2O–BF3 ist stabiler als (CH3) 2S–BF3 schwach stark<br />
stark stark<br />
(CH 3) 2S–BH 3 ist stabiler als (CH 3) 2O–BH 3<br />
Einteilung ist nicht möglich<br />
Widerspruch!
<strong>Lewis</strong>-<strong>Säure</strong>n und <strong>Base</strong>n<br />
- HSAB-Konzept von R. G. Pearson -<br />
“Harte“ <strong>Lewis</strong>-<strong>Säure</strong>n und <strong>Base</strong>n “Weiche“ <strong>Lewis</strong>-<strong>Säure</strong>n und <strong>Base</strong>n<br />
Schwer polarisierbar Leicht polarisierbar<br />
Bindung hat mehr Bindung hat mehr<br />
ionischen Charakter (CaF 2) kovalenten Charakter (HgI 2)<br />
Stabile <strong>Lewis</strong>-<strong>Säure</strong>-<strong>Base</strong>-<strong>Komplexe</strong>:<br />
Harte <strong>Lewis</strong>-<strong>Säure</strong> + harte <strong>Lewis</strong>-<strong>Base</strong><br />
(H 3C) 2O: + BF 3 --> (H 3C) 2OBF 3 (hart/hart)<br />
Weiche <strong>Lewis</strong>-<strong>Säure</strong> + weiche <strong>Lewis</strong>-<strong>Base</strong><br />
(H 3C) 2S: + BH 3 --> (H 3C) 2SBH 3 (weich/weich)<br />
Weniger stabile <strong>Lewis</strong>-<strong>Säure</strong>-<strong>Base</strong>-<strong>Komplexe</strong>:<br />
Harte <strong>Lewis</strong>-<strong>Säure</strong> + weiche <strong>Lewis</strong>-<strong>Base</strong><br />
Weiche <strong>Lewis</strong>-<strong>Säure</strong> + harte <strong>Lewis</strong>-<strong>Base</strong><br />
HSAB-Prinzip: principle of hard and soft acids and bases
Eigenschaften:<br />
<strong>Lewis</strong>-<strong>Säure</strong>n und <strong>Base</strong>n<br />
- Eigenschaften von <strong>Lewis</strong>-<strong>Säure</strong>n -<br />
Akzeptoratom der harten <strong>Säure</strong>n Akzeptoratom der weichen <strong>Säure</strong><br />
kleine räumliche Ausdehnung große räumliche Ausdehnung<br />
hohe positive Ladung kleine positive Ladung<br />
keine nichtbindenden Valenzelektronen freie Valenzelektronen<br />
(Kationen mit abgeschlossener (Kationen ohne Edelgas-<br />
s 2 p 6 -Edelgasschale) konfiguration, bevorzugt d 10 )<br />
harte <strong>Lewis</strong>-<strong>Säure</strong>n weiche <strong>Lewis</strong>-<strong>Säure</strong>n<br />
H + Ni 2+ Cu + Zn 2+ Ga 3+ Ge 2+<br />
Li + Be 2+ B 3+ C 4+ Pd 2+ Ag + Cd 2+ In 3+ Sn 2+<br />
Na + Mg 2+ Al 3+ Si 4+ Pt 2+ Au + Hg 2+ Tl 3+ Pb 2+<br />
K + Ca 2+ Sc 3+ Ti 4+<br />
auch hart: Lanthanoiden, Actinoiden (obwohl f-Elektronen in der äußeren Schale)<br />
auch hart: kleine Metallkationen, mit hoher Ladung und weniger als d 10 , Cr 3+ , Fe 3+ , Co 3+
harte <strong>Säure</strong>n<br />
<strong>Lewis</strong>-<strong>Säure</strong>n und <strong>Base</strong>n<br />
- Ionenradius -<br />
Bei steigendem Ionenradius nimmt die Härte ab, die Weichheit zu:<br />
Ionenradius<br />
Härte<br />
weiche <strong>Säure</strong>n<br />
nimmt zu<br />
Li + > Na + > K + > Rb + > Cs +<br />
nimmt ab<br />
Bei steigendem Ionenradius nimmt die Weichheit zu, die Härte ab:<br />
Ionenradius<br />
Härte<br />
nimmt zu<br />
Cu + > Ag + > Au +<br />
Zn 2+ > Cd 2+ > Hg 2+<br />
nimmt ab<br />
> = ist härter als<br />
> = ist härter als
<strong>Lewis</strong>-<strong>Säure</strong>n und <strong>Base</strong>n<br />
- Ladung und Oxidationsgrad -<br />
Mit steigender Ladung nimmt die Härte zu:<br />
Ladung<br />
Härte<br />
nimmt zu<br />
Na + < Mg 2+ < Al 3+ < Si 4+<br />
nimmt zu<br />
Je niedriger die Oxidationsstufe, desto weicher:<br />
Oxidationsstufe<br />
Härte<br />
nimmt zu<br />
Cu + < Cu 2+<br />
Fe 0 < Fe 2+ < Fe 3+<br />
Ni 0 < Ni 2+ < Ni 4+<br />
RS + < RSO + < RSO 2 +<br />
nimmt zu<br />
< = ist weicher als<br />
(weniger hart als)<br />
< = ist weicher als<br />
(weniger hart als)
<strong>Lewis</strong>-<strong>Säure</strong>n und <strong>Base</strong>n<br />
- Einfluss von Liganden -<br />
Je mehr Ladung der Ligand auf das Akzeptoratom überträgt,<br />
desto kleiner wird dessen positive Ladung,<br />
desto weicher wird die <strong>Lewis</strong>-<strong>Säure</strong>.<br />
BH 3 = B 3+ + 3 H – ⇒ neutraler ⇒ weicher<br />
BF 3 = B 3+ + 3 F – ⇒ positiver ⇒ härter<br />
BF 3 = harte <strong>Lewis</strong>-<strong>Säure</strong> (F = stark elektronegativer Ligand, zieht die<br />
Elektronen an sich, nimmt dem Zentrum also Elektronendichte weg)<br />
BH 3 = weiche <strong>Lewis</strong>-<strong>Säure</strong> (H überträgt negative Ladung auf Zentralatom,<br />
führt also zu einer höheren Elektronendichte am Zentrum)
<strong>Lewis</strong>-<strong>Säure</strong>n und <strong>Base</strong>n<br />
- Eigenschaften von <strong>Lewis</strong>-<strong>Base</strong>n -<br />
Donatoratome der <strong>Lewis</strong>-<strong>Base</strong>n sind umso härter,<br />
je kleiner der Radius (S2– > I – ) (Schwefeldianion ist kleiner als Iodidanion),<br />
je elektronegativer (Cl – > S2– ) (Chlor ist elektronegativer als Schwefel),<br />
je höher die Oxidationsstufe (SO3 > S2– ) (im Schwefeltrioxid OZ +VI, im<br />
Sulfiddianion OZ -II)<br />
> = ist härter als<br />
Donatoratome in <strong>Lewis</strong>-<strong>Base</strong>n:<br />
hart weich<br />
F > O > >N, Cl > Br, H > S, C > I, Se > P, Te > As > Sb
<strong>Lewis</strong>-<strong>Säure</strong>n und <strong>Base</strong>n<br />
- Eigenschaften von <strong>Lewis</strong>-<strong>Base</strong>n -<br />
Die Ladung besitzt weniger Einfluss auf die Härte oder Weichheit einer<br />
<strong>Base</strong>:<br />
O 2– ≈ OH – ≈ H 2O S 2– ≈ HS –<br />
Auch der Einfluss von Liganden ist gering:<br />
PR 3 ≈ P(OR) 3
Beispiel 1:<br />
<strong>Lewis</strong>-<strong>Säure</strong>n und <strong>Base</strong>n<br />
- Stabilität von <strong>Komplexe</strong>n -<br />
Mg 2+ , Ca 2+ , Al 3+ bilden in der Natur überwiegend Oxide, Carbonate, Sulfate<br />
(hart / hart)<br />
Cu + , Hg 2+ , Pb 2+ bilden in der Natur überwiegend Sulfide<br />
(weich / weich)<br />
Beispiel 2:<br />
Hohe Oxidationsstufen von Metallkationen nur in Fluor- und<br />
Sauerstoffderivaten: SF 6, IF 7, PtF 6, CuF 4 – , ClO4 – , XeO6 4– , MnO4 – , OsO4 –<br />
(hart / hart)<br />
Beispiel 3:<br />
Stabile <strong>Komplexe</strong> der weichen Übergangsmetallkationen in niedrigen Oxi-<br />
dationsstufen nur mit weichen <strong>Base</strong>n wie CO, CN – , PR 3<br />
Ni(CO) 4, [Cr(CN) 6] 6– (weich / weich)
<strong>Lewis</strong>-<strong>Säure</strong>n und <strong>Base</strong>n<br />
- Stabilität von <strong>Komplexe</strong>n -<br />
Vorhersage der ablaufenden Reaktionen bei doppelten <strong>Lewis</strong>-<strong>Säure</strong>-<strong>Base</strong>-<br />
Umsetzungen:<br />
Beispiele:<br />
S : B + S‘ : B‘ ---> S : B‘ + S‘ : B<br />
Aqua-<strong>Komplexe</strong> der harten <strong>Säure</strong>n Li + oder Ca 2+ bilden mit der harten <strong>Lewis</strong>-<br />
<strong>Base</strong> F – schwerlösliche Fluoride<br />
Weiche <strong>Base</strong> NH 3 verdrängt die harte <strong>Base</strong> H 2O in Komplexliganden mit<br />
weichen Metallkationen wie [Cu(OH 2) 4] 2+<br />
Aluminium fällt nicht als Sulfid, sondern bildet das Hydroxid!
<strong>Lewis</strong>-<strong>Säure</strong>n und <strong>Base</strong>n<br />
- starke <strong>Säure</strong>n und starke <strong>Base</strong>n -<br />
Neben der Härte und Weichheit muss natürlich auch die Stärke der <strong>Säure</strong>n<br />
und <strong>Base</strong>n berücksichtigt werden:<br />
H + H – → H 2<br />
hart weich<br />
stark stark<br />
Elemente sind umso saurer, je positiver und je kleiner sie sind<br />
Elemente sind umso basischer, je negativer und je größer sie sind<br />
<strong>Säure</strong>stärke<br />
AlCl 3 < AlCl 2 + < AlCl 2+ < Al 3+<br />
<strong>Base</strong>nstärke<br />
H 2O < OH – < O 2–
HSAB-Prinzip<br />
HSAB-Prinzip gilt besonders bei schwachen <strong>Säure</strong>n und <strong>Base</strong>n<br />
Hydrate, Ammoniakate<br />
Starke <strong>Säure</strong> und starke <strong>Base</strong> geben immer einen stabilen Komplex<br />
Schwache <strong>Säure</strong> und schwache <strong>Base</strong>: stabiler Komplex nur bei<br />
weich / weich und hart / hart<br />
Al 2S 3 + 3 HgO Al 2O 3 + 3 HgS + ∆H<br />
stark / stark stark / stark<br />
hart / weich weich / hart hart / hart weich / weich