Seltene Elemente der Schwefelwasserstoff-Gruppe und Salzsäure ...
Seltene Elemente der Schwefelwasserstoff-Gruppe und Salzsäure ...
Seltene Elemente der Schwefelwasserstoff-Gruppe und Salzsäure ...
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
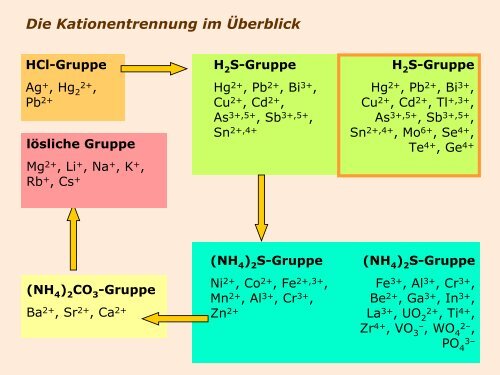
Die Kationentrennung im Überblick<br />
HCl-<strong>Gruppe</strong><br />
Ag + , Hg 2<br />
2+<br />
,<br />
Pb 2+<br />
lösliche <strong>Gruppe</strong><br />
Mg 2+ , Li + , Na + , K + ,<br />
Rb + , Cs +<br />
H 2<br />
S-<strong>Gruppe</strong><br />
Hg 2+ , Pb 2+ , Bi 3+ ,<br />
Cu 2+ , Cd 2+ ,<br />
As 3+,5+ , Sb 3+,5+ ,<br />
Sn 2+,4+<br />
H 2<br />
S-<strong>Gruppe</strong><br />
Hg 2+ , Pb 2+ , Bi 3+ ,<br />
Cu 2+ , Cd 2+ , Tl +,3+ ,<br />
As 3+,5+ , Sb 3+,5+ ,<br />
Sn 2+,4+ , Mo 6+ , Se 4+ ,<br />
Te 4+ , Ge 4+<br />
(NH 4<br />
) 2<br />
CO 3<br />
-<strong>Gruppe</strong><br />
Ba 2+ , Sr 2+ , Ca 2+<br />
(NH 4<br />
) 2<br />
S-<strong>Gruppe</strong><br />
Ni 2+ , Co 2+ , Fe 2+,3+ ,<br />
Mn 2+ , Al 3+ , Cr 3+ ,<br />
Zn 2+<br />
(NH 4<br />
) 2<br />
S-<strong>Gruppe</strong><br />
Fe 3+ , Al 3+ , Cr 3+ ,<br />
Be 2+ , Ga 3+ , In 3+ ,<br />
La 3+ , UO 2<br />
2+<br />
, Ti 4+ ,<br />
Zr 4+ , VO 3–<br />
, WO 4<br />
2–<br />
,<br />
PO 4<br />
3–
<strong>Schwefelwasserstoff</strong>gruppe mit selteneren <strong>Elemente</strong>n<br />
Hg 2+ , Pb 2+ , Bi 3+ , Cu 2+ , Cd 2+ , As 3+,5+ , Sb 3+,5+ , Sn 2+,4+ ,<br />
Mo 6+ , Se 4+ , Te 4+
<strong>Schwefelwasserstoff</strong>gruppe mit selteneren <strong>Elemente</strong>n<br />
Oxidation mit Wasserstoffperoxid, dann Reduktion mit HI, H 2 S<br />
HgS, PbS, Bi 2 S 3 , CuS, CdS, Sb 2 S 3 , SnS 2 , MoS 3 , Se, Te,<br />
As 2 S 3<br />
digerieren mit (NH 4<br />
) 2<br />
S bzw.<br />
(NH 4<br />
) 2<br />
S x<br />
SbS 4<br />
3–<br />
, SnS 3<br />
2–<br />
, MoS 4<br />
2–<br />
, Se x S y<br />
2–<br />
Te x S y<br />
2–<br />
, AsS 4<br />
3–<br />
Es bleiben zurück:<br />
HgS, PbS, Bi 2 S 3 , CuS, CdS
<strong>Schwefelwasserstoff</strong>gruppe mit selteneren <strong>Elemente</strong>n<br />
SbS 4<br />
3–<br />
, SnS 3<br />
2–<br />
, MoS 4<br />
2–<br />
, Se x S y<br />
2–<br />
Te x S y<br />
2–<br />
, AsS 4<br />
3–<br />
verd. H 2<br />
SO 4<br />
Sb 2 S 5 , SnS 2 , MoS 3 , Se, Te, As 2 S 5<br />
konz. HCl<br />
Sb 5+ , Sn 4+<br />
(NH 4 ) 2 CO 3<br />
AsS 4<br />
3–<br />
, AsO 3 S 3–<br />
MoS 3 , Se, Te<br />
HCl/HNO 3<br />
,<br />
verd. HCl<br />
[MoO 2 ] 2+ ,<br />
SeO 3<br />
2–<br />
TeO 3<br />
2–<br />
konz.<br />
HCl/Zn<br />
Mo<br />
Se<br />
Te
<strong>Schwefelwasserstoff</strong>gruppe mit selteneren <strong>Elemente</strong>n<br />
HgS, PbS, Bi 2 S 3 , CuS, CdS<br />
HNO 3<br />
, ∆T<br />
HgS<br />
Pb 2+ , Bi 3+ , Cu 2+ , Cd 2+ H 2<br />
SO 4<br />
PbSO 4<br />
wie bekannt
Molybdän<br />
Molybdänblau<br />
Vorprobe: Abrauchen mit konzentrierter Schwefelsäure<br />
tiefblaue, kolloide Lösung hydratisierter Mischoxide<br />
MoO 3 +xH<br />
MoO 3-x (OH) x
Molybdän<br />
Ammoniummolybdatophosphat<br />
12 MoO 2 2+ + H 2 PO 4 – + 3 NH 4 + + 12 H 2 O<br />
(NH 4 ) 3 [P(Mo 3 O 10 ) 4 · x H 2 O)] + 4 H 2 O<br />
gelb<br />
NH 4 Cl/KCl, Na 2 HPO 4
Molybdän<br />
Hexathiocyanatomolybdat<br />
2 MoO 2 2+ + 8 H + + 3 Sn 2+ + 18 Cl – + 12 SCN –<br />
2 [Mo(SCN) 6 ] 3– + 3 [SnCl 6 ] 2– + 4 H 2 O<br />
rot
Molybdän<br />
Peroxomolybdat<br />
MoO 4 2– + 4 H 2 O 2<br />
Mo(O 2 ) 4 2– + 4 H 2 O<br />
2 MoO 2 2+ + 4 H 2 O 2 + H 2 O<br />
[(H 2 O)(O 2 ) 2 (O)MoOMo(O)(O 2 ) 2 (H 2 O)] 2– + 6 H +<br />
je nach pH-Wert kirschrot bis gelb, Zersetzung beim Erwärmen<br />
(alkalisch: rot, sauer: gelb)
Molybdän<br />
Strukturen ausgewählter Peroxomolybdate<br />
O<br />
O<br />
O<br />
O<br />
Mo<br />
O<br />
O<br />
O<br />
O<br />
2 –<br />
O<br />
O<br />
O<br />
OH O 2<br />
O Mo Mo O<br />
O<br />
O<br />
H 2 O<br />
O<br />
O<br />
O<br />
2 –<br />
Mo(O 2 ) 4<br />
2–<br />
[Mo 3 O 2 (O 2 ) 4 (H 2 O) 2 ] 2–
Molybdän<br />
Ethylxanthogenat-Chelat<br />
Xanthogenate sind Dithiokohlensäure-O-ester<br />
O<br />
C<br />
HO OH<br />
HO<br />
S<br />
C<br />
SH
Molybdän<br />
Ethylxanthogenat-Chelat<br />
S<br />
–<br />
MoO 2 2+ + 2<br />
H 5 C 2 O<br />
C<br />
S<br />
S<br />
O<br />
S<br />
H 5 C 2 O<br />
C Mo C OC 2 H 5<br />
S<br />
O<br />
S<br />
dunkel-rotviolett
Selen <strong>und</strong> Tellur<br />
Beide fallen elementar bei <strong>der</strong> <strong>Schwefelwasserstoff</strong>gruppe:<br />
Selen - rot<br />
Tellur - schwarz<br />
Durch Oxidation mit HNO 3 entstehen Selenige Säure <strong>und</strong><br />
Tellurige Säure: (Selenate(IV) <strong>und</strong> Tellurate(IV)):<br />
3 Se + 4 HNO 3 + H 2 O 3 H 2 SeO 3 + 4 NO<br />
3 Te + 4HNO 3 + H 2 O 3 H 2 TeO 3 + 4 NO
Selen <strong>und</strong> Tellur<br />
Bildung von Selen- <strong>und</strong> Tellurkationen<br />
Se 8 + 3 H 2 SO 4<br />
Se 8 2+ + 2 HSO 4 – + SO 2 + 2 H 2 O<br />
4 Te + 3 H 2 SO 4 Te 4 2+ + 2 HSO 4 – + SO 2 + 2 H 2 O<br />
Te<br />
Te<br />
2+<br />
Se<br />
Se<br />
Se<br />
2+<br />
6 π<br />
Se<br />
Se<br />
Te<br />
Te<br />
Se<br />
Se<br />
Se<br />
rot<br />
grün
Selen <strong>und</strong> Tellur<br />
Reduktion von Se(IV)<br />
SeO 3 2– + 4 I – + 6 H +<br />
Se + 2 I 2 + 3 H 2 O<br />
Te(IV) bildet ein Hexaiodotellurat-Dianion.<br />
S<br />
H 2 SeO 3 +<br />
H 2 N NH 2<br />
Se + SO 2 + CO + 2 NH 3<br />
Tellurige Säure bildet einen gelben Nie<strong>der</strong>schlag, <strong>der</strong> sich bei<br />
Hydrolyse grün färbt.
Die Kationentrennung im Überblick<br />
HCl-<strong>Gruppe</strong><br />
Ag + , Hg 2<br />
2+<br />
,<br />
Pb 2+<br />
lösliche <strong>Gruppe</strong><br />
Mg 2+ , Li + , Na + , K + ,<br />
Rb + , Cs +<br />
H 2<br />
S-<strong>Gruppe</strong><br />
Hg 2+ , Pb 2+ , Bi 3+ ,<br />
Cu 2+ , Cd 2+ ,<br />
As 3+,5+ , Sb 3+,5+ ,<br />
Sn 2+,4+<br />
H 2<br />
S-<strong>Gruppe</strong><br />
Hg 2+ , Pb 2+ , Bi 3+ ,<br />
Cu 2+ , Cd 2+ , Tl +,3+ ,<br />
As 3+,5+ , Sb 3+,5+ ,<br />
Sn 2+,4+ , Mo 6+ , Se 4+ ,<br />
Te 4+ , Ge 4+<br />
(NH 4<br />
) 2<br />
CO 3<br />
-<strong>Gruppe</strong><br />
Ba 2+ , Sr 2+ , Ca 2+<br />
(NH 4<br />
) 2<br />
S-<strong>Gruppe</strong><br />
Ni 2+ , Co 2+ , Fe 2+,3+ ,<br />
Mn 2+ , Al 3+ , Cr 3+ ,<br />
Zn 2+<br />
(NH 4<br />
) 2<br />
S-<strong>Gruppe</strong><br />
Fe 3+ , Al 3+ , Cr 3+ ,<br />
Be 2+ , Ga 3+ , In 3+ ,<br />
La 3+ , UO 2<br />
2+<br />
, Ti 4+ ,<br />
Zr 4+ , VO 3–<br />
, WO 4<br />
2–<br />
,<br />
PO 4<br />
3–
HCl-<strong>Gruppe</strong><br />
Salpetersaure Lösung, HCl-Zugabe:<br />
AgCl, Hg 2 Cl 2 , PbCl 2<br />
Nie<strong>der</strong>schlag abfiltrieren, mit heißem Wasser digerieren:<br />
AgCl, Hg 2 Cl 2 , Pb 2+<br />
Ammoniak zugeben:<br />
[Ag(NH 3 ) 2 ] + <strong>und</strong> Hg, Hg(NH 2 )Cl<br />
Salzsäure zugeben: AgCl
Silber<br />
Reduktion<br />
2 Ag + + Cu 2 Ag + Cu 2+<br />
2 Ag + + HCOH + H 2 O 2 Ag + HCOOH + 2 H +
Silber<br />
Schwerlösliches Salz<br />
2 Ag + 2–<br />
+ CrO 4<br />
3 Ag + 3–<br />
+ PO 4<br />
3 Ag + 3–<br />
+ AsO 4<br />
Ag + + Cl –<br />
Ag 2 CrO 4<br />
Ag 3 PO 4<br />
Ag 3 AsO 4<br />
AgCl