ammoniumsulfid.pdf
ammoniumsulfid.pdf
ammoniumsulfid.pdf
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
2. und 3. Analyse<br />
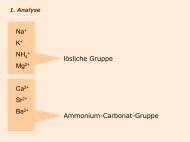
2. Analyse<br />
Zn 2+ , Mn 2+ , Fe 2+ , Fe 3+ , Cr 3+ , Al 3+<br />
3. Analyse<br />
Zn 2+ , Mn 2+ , Fe 2+ , Fe 3+ , Cr 3+ , Al 3+<br />
Co 2+ , Ni 2+ + einfache Anionen
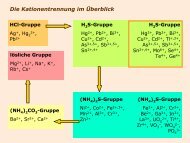
Die Kationentrennung im Überblick<br />
HCl-Gruppe<br />
Ag + , Hg 2 2+ ,<br />
Pb 2+<br />
lösliche Gruppe<br />
Mg 2+ , Li + , Na + , K + ,<br />
Rb + , Cs +<br />
(NH 4 ) 2 CO 3 -Gruppe<br />
Ba 2+ , Sr 2+ , Ca 2+<br />
H 2 S-Gruppe<br />
Hg 2+ , Pb 2+ , Bi 3+ ,<br />
Cu 2+ , Cd 2+ ,<br />
As 3+,5+ , Sb 3+,5+ ,<br />
Sn 2+,4+<br />
(NH 4 ) 2 S-Gruppe<br />
Ni 2+ , Co 2+ , Fe 2+,3+ ,<br />
Mn 2+ , Al 3+ , Cr 3+ ,<br />
Zn 2+<br />
H 2 S-Gruppe<br />
Hg 2+ , Pb 2+ , Bi 3+ ,<br />
Cu 2+ , Cd 2+ , Tl +,3+ ,<br />
As 3+,5+ , Sb 3+,5+ ,<br />
Sn 2+,4+ , Mo 6+ , Se 4+ ,<br />
Te 4+ , Ge 4+<br />
(NH 4 ) 2 S-Gruppe<br />
Fe 3+ , Al 3+ , Cr 3+ ,<br />
Be 2+ , Ga 3+ , In 3+ ,<br />
La 3+ , UO 2 2+ , Ti 4+ ,<br />
Zr 4+ , VO 3 – , WO4 2– ,<br />
PO 4 3–
Trennungsgang (NH 4) 2S<br />
1. Substanz lösen, erst Wasser, dann HCl (evtl. H 2 O 2 )<br />
2. Mit NH 4 Cl versetzen (verhindert Mg-Fällung),<br />
ammoniakalisch machen und mit (NH 4 ) 2 S kochen.<br />
Ni 2 S 3 /NiS, Co 2 S 3 /CoS, FeS, MnS, Al(OH) 3 , Cr(OH) 3 ,ZnS<br />
3. Abtrennung von Nickel und Cobalt durch kalte 2 m HCl<br />
4. Mit H 2 O 2 oxidieren und alkalischer Sturz (30% NaOH/H 2 O 2 )<br />
Fe(OH) 3 , MnO(OH) 2<br />
[Al(OH) 4 ] – , CrO 4 2– , [Zn(OH)4 ] 2–<br />
5. Kochen mit NH 4 Cl (Erniedrigung der OH – -Konzentration)<br />
Al(OH) 3<br />
CrO 4 2– , [Zn(NH3 ) 6 ] 2+<br />
6. Ansäuern mit Essigsäure, Chromat- und Zinksulfid-Fällung
Trennungsgang (NH 4) 2S<br />
1. Substanz lösen, erst Wasser, dann HCl (evtl. H 2 O 2 )<br />
2. Mit NH 4 Cl versetzen (verhindert Mg-Fällung), ammoniakalisch<br />
machen und mit (NH 4 ) 2 S kochen.<br />
Ni 2 S 3 /NiS, Co 2 S 3 /CoS, FeS, MnS, Al(OH) 3 , Cr(OH) 3 ,ZnS<br />
3. Abtrennung von Nickel und Cobalt durch kalte 2 m HCl<br />
4. Mit H 2 O 2 oxidieren und alkalischer Sturz (30% NaOH/H 2 O 2 )<br />
Fe(OH) 3 , MnO(OH) 2<br />
[Al(OH) 4 ] – , CrO 4 2– , [Zn(OH)4 ] 2–<br />
5. Kochen mit NH 4 Cl (Erniedrigung der OH – -Konzentration)<br />
Al(OH) 3<br />
CrO 4 2– , [Zn(NH3 ) 6 ] 2+<br />
6. Ansäuern mit Essigsäure, Chromat- und Zinksulfid-Fällung
Trennungsgang (NH 4) 2S<br />
NiS, CoS, Ni 2S 3, Co 2S 3
Nickel<br />
wasserhaltige Nickelsalze sind zumeist grün gefärbt,<br />
wasserfreie Nickelsalze sind gelblich gefärbt
Vorproben und Nachweise auf Nickel<br />
Phosphorsalz- und Boraxperle<br />
NaNH 4HPO 4<br />
3 NaPO 3 + 3 NiSO 4<br />
NaPO 3 + NiSO 4<br />
Na 2B 4O 7 + NiSO 4<br />
NaPO 3 + NH 3 + H 2O<br />
in der Kälte braun, in der Hitze gelb bis rubinrot<br />
(Oxidationsflamme)<br />
Na 3PO 4 + Ni 3(PO 4) 2 + 3 SO 3<br />
NaNiPO 4 + SO 3<br />
NaPO 3 · NiO<br />
2 NaBO 2 + Ni(BO 2) 2 + SO 3
Borax<br />
O<br />
O B<br />
O<br />
O<br />
B O<br />
O B<br />
B O<br />
O<br />
O<br />
2 –<br />
Na 2B 4O 7 · 10 H 2O ≡ Na 2[B 4O 5(OH) 4] · 8 H 2O
Lösen des Nickelsulfids<br />
– +<br />
3 Ni2S3 + 4 NO3 + 16 H<br />
Ni 2S 3 + 11 H 2O 2<br />
6 Ni 2+ + 4 NO + 9 S + 8 H 2O<br />
2 Ni 2+ 2– +<br />
+ 10 H2O + 3 SO4 + 2 H
Nachweise für Nickel<br />
Bis(diacetyldioxim)nickel, (Bis(dimethylglyoxim)nickel),<br />
Tschugajeffs Reagenz<br />
H3C C<br />
CH3 C<br />
O<br />
HO N N OH<br />
H3C N<br />
Diacetyldioxim<br />
H 3C<br />
OH<br />
N<br />
H 3C N<br />
OH<br />
H 3C<br />
Störung: Oxidationsmittel, Fe 3+ , (Co 2+ ), Cu 2+<br />
H<br />
Ni<br />
O<br />
N<br />
N N<br />
O O<br />
H<br />
rot<br />
CH 3<br />
CH 3
Cobalt<br />
wasserhaltige Cobaltsalze sind zumeist rosa gefärbt,<br />
wasserfreie Cobaltsalze sind blau gefärbt
Vorproben und Nachweise auf Cobalt<br />
Phosphorsalz- und Boraxperle<br />
NaNH 4HPO 4<br />
3 NaPO 3 + 3 CoSO 4<br />
NaPO 3 + CoSO 4<br />
Na 2B 4O 7 + CoSO 4<br />
NaPO 3 + NH 3 + H 2O<br />
Na 3PO 4 + Co 3(PO 4) 2 + 3 SO 3<br />
NaCoPO 4 + SO 3<br />
NaPO 3 · CoO<br />
2 NaBO 2 + Co(BO 2) 2 + SO 3<br />
blau
Lösen des Cobaltsulfids<br />
– +<br />
3 Co2S3 + 4 NO3 + 16 H<br />
Co 2S 3 + 11 H 2O 2<br />
6 Co 2+ + 4 NO + 9 S + 8 H 2O<br />
2 Co 2+ 2– +<br />
+ 10 H2O + 3 SO4 + 2 H
Nachweise für Cobalt<br />
Cobaltthiocyanat, Tetrathiocyanatocobaltsäure<br />
neutral<br />
sauer<br />
Co 2+ + 2 SCN –<br />
Co 2+ + 4 SCN – + 2 H +<br />
Nachweis von Cobalt neben Nickel!<br />
Störung: Fe 3+ , Bildung von Eisenrhodanid<br />
Co(SCN) 2<br />
H 2[Co(SCN) 4]<br />
blau in Wasser und organischen<br />
Lösungsmitteln
Trennungsgang (NH 4) 2S<br />
1. Substanz lösen, erst Wasser, dann HCl (evtl. H 2 O 2 )<br />
2. Mit NH 4 Cl versetzen (verhindert Mg-Fällung), ammoniakalisch<br />
machen und mit (NH 4 ) 2 S kochen.<br />
Ni 2 S 3 /NiS, Co 2 S 3 /CoS, FeS, MnS, Al(OH) 3 , Cr(OH) 3 ,ZnS<br />
3. Abtrennung von Nickel und Cobalt durch kalte 2 m HCl<br />
4. Mit H 2 O 2 oxidieren und alkalischer Sturz (30% NaOH/H 2 O 2 )<br />
Fe(OH) 3 , MnO(OH) 2<br />
[Al(OH) 4 ] – , CrO 4 2– , [Zn(OH)4 ] 2–<br />
5. Kochen mit NH 4 Cl (Erniedrigung der OH – -Konzentration)<br />
Al(OH) 3<br />
CrO 4 2– , [Zn(NH3 ) 6 ] 2+<br />
6. Ansäuern mit Essigsäure, Chromat- und Zinksulfid-Fällung
Trennungsgang (NH 4) 2S<br />
Fe(OH) 3, MnO(OH) 2
Eisen<br />
[Fe(OH) 6] 2+ farblos<br />
[Fe(OH) 6] 3+ fast farblos<br />
FeO 4 2– rot<br />
FeO(OH) rotbraun<br />
Fe(OH) 2<br />
weiß
Eisen<br />
Berliner Blau - Turnbulls Blau<br />
Fe 2+ + [Fe(CN) 6] 3–<br />
K + + Fe 3+ 4 –<br />
+ [Fe(CN) 6]<br />
K + + Fe 2+ 3 –<br />
+ [Fe(CN) 6]<br />
4 Fe 3+ 4 –<br />
+ 3 [Fe(CN) 6]<br />
4 Fe 2+ 3 –<br />
+ 4 [Fe(CN) 6]<br />
Fe 3+ + [Fe(CN) 6] 4–<br />
K[FeFe(CN) 6]<br />
K[FeFe(CN) 6]<br />
lösliches Berliner Blau<br />
Fe 4[Fe(CN) 6] 3<br />
unlösliches Berliner Blau<br />
Fe 4[Fe(CN) 6] 3 + [Fe(CN) 6] 4–<br />
Unlösliches Turnbulls Blau
Eisen<br />
Eisenthiocyanat, Eisenrhodanid<br />
Fe 3+ + 3 SCN –<br />
Fe(SCN) 3
Mangan<br />
Mn (VII) violett<br />
Mn (VI) tiefgrün<br />
Mn (V) blau<br />
Mn (IV) braun<br />
Mn (III) granatrot<br />
Mn (II) rosa<br />
Basizität der Oxide in Wasser nimmt mit steigender Wertigkeit<br />
ab und die Acidität zu: MnO Base-Anhydrid, MnO 2 amphoter,<br />
Mn 2O 7 Säure-Anhydrid.<br />
Besonders stabil: Mn(II), isoelektronisch zu Fe(III),<br />
halbbesetzte 3d-Schale; MnO 4 – ist ein starkes Oxidationsmittel.
Vorproben und Nachweise auf Mangan<br />
Phosphorsalz- und Boraxperle<br />
NaNH 4HPO 4<br />
3 NaPO 3 + 3 MnSO 4<br />
NaPO 3 + MnSO 4<br />
Na 2B 4O 7 + MnSO 4<br />
NaPO 3 + NH 3 + H 2O<br />
Na 3PO 4 + Mn 3(PO 4) 2 + 3 SO 3<br />
NaMnPO 4 + SO 3<br />
NaPO 3 · MnO<br />
2 NaBO 2 + Mn(BO 2) 2 + SO 3<br />
violett
Vorproben und Nachweise auf Mangan<br />
Oxidationsschmelze<br />
Reaktion eines Mangansalzes mit Na 2CO 3 und KNO 3<br />
Mn 2+ – 2–<br />
+ 2 NO3 + 2 CO3<br />
Mn 2+ –<br />
+ 4 NO2 2– –<br />
MnO4 + 2 NO2 + 2 CO2<br />
2–<br />
MnO4 + 4 NO<br />
grün<br />
Bei Säurezusatz disproportioniert Mn(VI):<br />
2– +<br />
3 MnO4 + 4 H<br />
–<br />
2 MnO4 + MnO2 + 2 H2O violett
Nachweise für Mangan<br />
Oxidation zu Permanganat<br />
in saurer Lösung<br />
2 Mn 2+ + 5 PbO 2 + 4 H +<br />
– 2+<br />
2 MnO4 + 5 Pb + 2 H2O<br />
2 Mn 2+ 2– – 2– +<br />
+ 5 S2O8 + 8 H2O 2 MnO4 + 10 SO4 + 16 H<br />
Störung: Reduktionsmittel wie Cl – , Br – , I – (Entfernung in Form<br />
der Silbersalze)
Nachweise für Mangan<br />
Oxidation zu Permanganat<br />
in alkalischer Lösung<br />
2Mn 2+ +5Br2 16 OH –<br />
+<br />
– –<br />
2MnO4 +10Br +8H2O<br />
Störung: Chrom-Salze, Bildung von gelb gefärbtem Chromat.
Trennungsgang (NH 4) 2S<br />
1. Substanz lösen, erst Wasser, dann HCl (evtl. H 2 O 2 )<br />
2. Mit NH 4 Cl versetzen (verhindert Mg-Fällung), ammoniakalisch<br />
machen und mit (NH 4 ) 2 S kochen.<br />
Ni 2 S 3 /NiS, Co 2 S 3 /CoS, FeS, MnS, Al(OH) 3 , Cr(OH) 3 , ZnS<br />
3. Abtrennung von Nickel und Cobalt durch kalte 2 m HCl<br />
4. Mit H 2 O 2 oxidieren und alkalischer Sturz (30% NaOH/H 2 O 2 )<br />
Fe(OH) 3 , MnO(OH) 2<br />
[Al(OH) 4 ] – , CrO 4 2– , [Zn(OH)4 ] 2–<br />
5. Kochen mit NH 4 Cl (Erniedrigung der OH – -Konzentration)<br />
Al(OH) 3<br />
CrO 4 2– , [Zn(NH3 ) 6 ] 2+<br />
6. Ansäuern mit Essigsäure, Chromat- und Zinksulfid-Fällung
Trennungsgang (NH 4) 2S<br />
Al(OH) 3
Nachweise für Aluminium<br />
Thenards Blau<br />
Al2O3 +Co(NO3) 2 2NO2<br />
+ ½ O2 +CoAl2O4
Cobaltpigmente<br />
Cobaltviolett Cobaltblau Rinmanns Grün<br />
Co 3(PO 4) 2 + Mg 3(PO 4) 2 CoAl 2O 4 (Thenards Blau) ZnCo 2O 4
Claude Monet: Der Spaziergang, Ölfarben, 1875
Nachweise für Aluminium<br />
Cäsiumalaun<br />
Al 3+ + Cs + 2–<br />
+ 2 SO4 + 12 H2O CsAl(SO4) 2 · 12 H2O Alaune (Doppelsalze): M(I)M(III)(SO 4) 2 · 12 H 2O.<br />
M(I) z.B. K, Na, NH 4, Tl, M(III) z.B. Al, Ti, Mn, In, Fe, Cr, V.
Nachweise für Aluminium<br />
Alizarin S-Farblack<br />
O<br />
O<br />
OH<br />
OH<br />
SO 3Na<br />
1,2-Dihydroxy-anthrachinon-3-sulfonsäure<br />
Störung: Fe, Cr, Ti. Niederschläge der Erdalkali-Farblacke sind<br />
in Essigsäure löslich.
Nachweise für Aluminium<br />
Morin-Komplexverbindung<br />
HO<br />
OH<br />
O<br />
O<br />
OH OH<br />
OH<br />
[2',3,4',5,7-Pentahydroxyflavon, 2-(2,4-Dihydroxyphenyl)-<br />
3,5,7-trihydroxy- 4H-1-benzopyran-4-on].<br />
Störung: Besonders Silicate
Nachweise für Aluminium<br />
Chinalizarin-Farblack<br />
HO<br />
HO<br />
O<br />
O<br />
OH<br />
OH<br />
Chinalizarin (1,2,5,8-Tetrahydroxyanthrachinon)
Trennungsgang (NH 4) 2S<br />
1. Substanz lösen, erst Wasser, dann HCl (evtl. H 2 O 2 )<br />
2. Mit NH 4 Cl versetzen (verhindert Mg-Fällung), ammoniakalisch<br />
machen und mit (NH 4 ) 2 S kochen.<br />
Ni 2 S 3 /NiS, Co 2 S 3 /CoS, FeS, MnS, Al(OH) 3 , Cr(OH) 3 , ZnS<br />
3. Abtrennung von Nickel und Cobalt durch kalte 2 m HCl<br />
4. Mit H 2 O 2 oxidieren und alkalischer Sturz (30% NaOH/H 2 O 2 )<br />
Fe(OH) 3 , MnO(OH) 2<br />
[Al(OH) 4 ] – , CrO 4 2– , [Zn(OH)4 ] 2–<br />
5. Kochen mit NH 4 Cl (Erniedrigung der OH – -Konzentration)<br />
Al(OH) 3<br />
CrO 4 2– , [Zn(NH3 ) 6 ] 2+<br />
6. Ansäuern mit Essigsäure, Chromat- und Zinksulfid-Fällung
Trennungsgang (NH 4) 2S<br />
CrO 4 2- , [Zn(NH3 ) 6 ] 2+
Chrom-“Spektrum“<br />
Cr 2O 7 2– orange<br />
Cr(V) rot<br />
Cr(IV) grün<br />
[Cr(H 2O) 6] 3+ violett<br />
[Cr(H 2O) 6] 2+ blau<br />
CrO 4 2– gelb<br />
Cr(V) blauschwarz<br />
Cr(IV) blauschwarz<br />
Cr(OH) 6 3– tiefgrün<br />
Cr(OH) 2<br />
dunkelbraun<br />
pH = 0<br />
pH = 14
Nachweis als Chromat<br />
Oxidation mit Wasserstoffperoxid<br />
2 Cr 3+ + 3 H 2O 2 + 10 OH –<br />
Oxidation mit Peroxodisulfaten<br />
2–<br />
2 CrO4 + 8 H2O<br />
2 Cr 3+ 2– 2– 2– +<br />
+ 3 S2O8 + 7 H2O Cr2O7 + 6 SO4 + 14 H<br />
2– +<br />
CrO4 + 2 H<br />
2– +<br />
CrO4 + H<br />
–<br />
2 HCrO4 2–<br />
Cr2O7 + H2O<br />
–<br />
HCrO4 2–<br />
Cr2O7 + H2O
Nachweise für Chrom<br />
Oxidationsschmelze<br />
– 2–<br />
Cr2O3 + 3 NO3 + 2 CO3<br />
2– –<br />
2 CrO4 + 3 NO2 + 2 CO2
Nachweise für Chrom<br />
Schwerlösliche Chromate<br />
2 Ba 2+ 2–<br />
+ Cr2O7 + H2O 2 BaCrO4 + 2 H +<br />
2– +<br />
CrO4 + 2 Ag<br />
gelb<br />
Ag 2CrO 4<br />
braunrot<br />
Auch Hg 2+ , Pb 2+ bilden gelbe (Pb) und orange (Hg) Chromate.
Nachweise für Chrom<br />
Chromperoxid<br />
2–<br />
Cr2O7 + 4 H2O2 + 2 H +<br />
4 CrO(O 2) 2 + 12 H +<br />
O<br />
O<br />
O<br />
Cr<br />
2 CrO(O 2) 2 + 5 H 2O<br />
4 Cr 3+ + 6 H 2O + 7 O 2<br />
O<br />
O
Zink<br />
Zink(II)salze sind farblos
Vorproben und Nachweise auf Zink<br />
Rinmanns Grün<br />
ZnO + 2 Co(NO 3) 2<br />
ZnCo 2O 4 + 4 NO 2 + 1/2 O 2<br />
grün<br />
Störung: Schwermetallverbindungen die farbige Oxide bilden.<br />
Thenards Blau (Aluminium)
Nachweise für Zink<br />
Kaliumzinkhexacyanoferrat / Zinkhexacyanoferrat<br />
Mit gelbem Blutlaugensalz<br />
3 Zn 2+ + 2 K + + 2 [Fe(CN) 6] 4–<br />
Mit rotem Blutlaugensalz<br />
3 Zn 2+ + 2 [Fe(CN) 6] 3–<br />
K 2Zn 3[Fe(CN) 6] 2<br />
schmutzigweiß , löslich in konz. HCl und 5 m NaOH<br />
Störung: Metall-Dikationen, insbesondere Cd 2+ , Mn 2+<br />
Zn 3[Fe(CN) 6] 2<br />
braungelb, schwerlöslich in verdünnten Säuren