Chalkogene - Teil 2
Chalkogene - Teil 2
Chalkogene - Teil 2
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
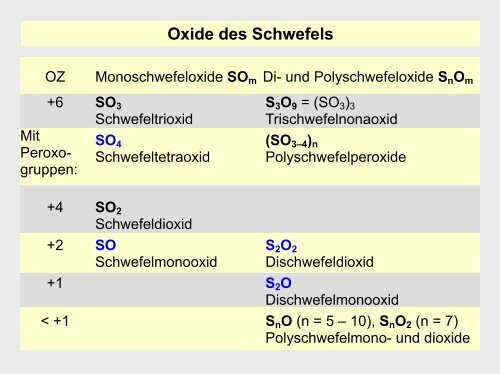
Oxide des Schwefels<br />
OZ Monoschwefeloxide SOm Di- und Polyschwefeloxide SnOm<br />
+6<br />
Mit<br />
Peroxogruppen:<br />
SO3<br />
Schwefeltrioxid<br />
SO4<br />
Schwefeltetraoxid<br />
+4 SO2<br />
Schwefeldioxid<br />
+2 SO<br />
Schwefelmonooxid<br />
S3O9 = (SO3)3<br />
Trischwefelnonaoxid<br />
(SO3–4)n<br />
Polyschwefelperoxide<br />
S2O2<br />
Dischwefeldioxid<br />
+1 S2O<br />
Dischwefelmonooxid<br />
< +1 SnO (n = 5 – 10), SnO2 (n = 7)<br />
Polyschwefelmono- und dioxide
Darstellung von Schwefeldioxid SO 2<br />
Methode t [°C] Hf [kJ]<br />
aus Schwefel:<br />
1 /8 S8 + O2 SO2<br />
aus Sulfiden:<br />
2 FeS2 + 5 1 /2 O2 Fe2O3 + 4 SO2<br />
3 FeS2 + 8 O2 Fe3O4 + 6 SO2<br />
aus Schwefelwasserstoff:<br />
2 H2S + 3 O2 2 SO2 + 2 H2O<br />
2 H2S + SO2 3 S + 2 H2O<br />
1200 – 1600 – 297<br />
650 – 850<br />
650 – 800<br />
1200<br />
350<br />
– 1655<br />
– 2370<br />
– 1037<br />
– 147
Darstellung von Schwefeldioxid SO 2<br />
Methode t [°C] Hf [kJ]<br />
aus Sulfaten:<br />
CaSO4 + C CaSO3 + CO<br />
CaSO3 CaO + SO2<br />
CaSO4 + C CaO + SO2 + CO<br />
aus Säuren:<br />
H2SO3 H2O + SO2<br />
H2SO4 + Cu CuO + SO2 + H2O<br />
aus Schwefeltrioxid:<br />
2 SO3 + 1 /8 S8 3 SO2<br />
900<br />
1200<br />
1400 + 394
Eigenschaften von Schwefeldioxid SO 2<br />
Farbloses, giftiges Gas<br />
nicht brennbar, stechender Geruch<br />
Siedepunkt: –10°C, Schmelzpunkt: –75.5°C<br />
Sehr gut löslich in Wasser: 1 Liter Wasser löst 40 Liter SO 2<br />
(bei 20°C)<br />
119.5°
Eigenschaften von Schwefeldioxid SO 2<br />
Reduktionsmittel:<br />
PbO 2 + SO 2<br />
Cl 2 + SO 2<br />
F 2 + SO 2<br />
PbSO 4<br />
SO 2Cl 2<br />
SO 2F 2
Verwendung von Schwefeldioxid SO 2<br />
Herstellung von Schwefelsäure<br />
Herstellung schwefelhaltiger Verbindungen<br />
nichtwässriges Lösungsmittel<br />
Reduktionsmittel im Hüttenwesen<br />
Kühlmittel<br />
Desinfektionsmittel (Bier- und Weinfässer)<br />
Konservierung von Lebensmitteln („Schwefeln“)<br />
Schädlingsbekämpfungsmittel<br />
(Nagetiere, Kücheninsekten)
Darstellung von Schwefeltrioxid SO 3<br />
SO 2 + ½ O 2<br />
Verläuft nur mit Katalysatoren<br />
Im Labor:<br />
2 NaHSO 4<br />
T<br />
– H 2O<br />
SO 3 + Na 2SO 4<br />
exotherm<br />
SO3 + 99 kJ<br />
endotherm<br />
Na 2S 2O 7<br />
T T<br />
2 SO 3 + Na 2O
Eigenschaften von Schwefeltrioxid SO 3<br />
Feststoff in drei Modifikationen<br />
Siedepunkt: 45°C<br />
Schmelzpunkt: -Form 62°C, -Form 32°C, -Form 17°C<br />
O<br />
S<br />
O O<br />
D 3h<br />
O<br />
S O<br />
O<br />
O<br />
O<br />
S<br />
O<br />
O<br />
O<br />
O S O S O S O S<br />
O O O O O O O<br />
O<br />
S<br />
O
Oxidationsmittel<br />
Eigenschaften von Schwefeltrioxid SO 3<br />
1 /8 S 8 + 2 SO 3<br />
2 HI + SO 3<br />
SCl 2 + SO 3<br />
P 4 + 10 SO 3<br />
PCl 3 + SO 3<br />
3 SO 2<br />
I 2 + H 2O + SO 2<br />
SOCl 2 + SO 2<br />
P 4O 10 + 10 SO 2<br />
POCl 3 + SO 2
Eigenschaften von Schwefeltrioxid SO 3<br />
Mit Wasser entsteht Schwefelsäure:<br />
SO 3 + H 2O H 2SO 4 + 74 kJ
Eigenschaften von Schwefeltrioxid SO 3<br />
Starke Lewissäure:<br />
-<br />
O<br />
O<br />
S P<br />
O<br />
+<br />
SO 3 · PPh 3<br />
-<br />
O<br />
O<br />
H<br />
S N<br />
O<br />
H<br />
+<br />
SO 3 · NH 3<br />
H
Eigenschaften von Schwefeltrioxid SO 3<br />
Starke Lewissäure:<br />
O<br />
O<br />
S<br />
O<br />
O<br />
O S<br />
O<br />
O<br />
O S<br />
O<br />
O<br />
2– 2–<br />
SO4 · 2 SO3 = S3O10 2 –<br />
O<br />
O S O<br />
O<br />
2 –<br />
SO3 · O 2– 2–<br />
= SO4
+ 2 H2SO2<br />
+ 4 H2SO3<br />
+ 6 H2SO4<br />
+ 6 H2SO5<br />
Sauerstoffsäuren - Monoschwefelsäuren<br />
O<br />
HO<br />
O<br />
O<br />
O<br />
S OH<br />
S<br />
OH<br />
OH<br />
O<br />
S<br />
OH<br />
OH<br />
S<br />
O<br />
OH<br />
OH<br />
Sulfoxylsäure<br />
Schwefel(II)säure<br />
Schweflige Säure<br />
Schwefel(IV)säure<br />
Schwefelsäure<br />
Schwefel(VI)säure<br />
Peroxo-<br />
schwefel(VI)säure<br />
Sulfoxylate<br />
Sulfate(II)<br />
Sulfite<br />
Sulfate(IV)<br />
Sulfate<br />
Sulfate(VI)<br />
Peroxo-<br />
sulfate(VI)
+ 2 H2S2O3<br />
+ 3 H2S2O4<br />
+ 4 H2S2O5<br />
Sauerstoffsäuren - Dischwefelsäuren<br />
S<br />
O S<br />
OH<br />
O<br />
O<br />
O<br />
S<br />
S<br />
S<br />
OH<br />
OH<br />
OH<br />
S<br />
O<br />
O<br />
OH<br />
OH<br />
Thioschwefelsäure<br />
Dischwefel(II)säure<br />
Dithionige Säure<br />
Dischwefel(III)säure<br />
Dischweflige Säure<br />
Dischwefel(IV)säure<br />
Thiosulfate<br />
Disulfate(II)<br />
Dithionite<br />
Disulfate(III)<br />
Disulfite<br />
Disulfate(IV)
+ 5 H2S2O6<br />
+ 6 H2S2O7<br />
+ 6 H2S2O8<br />
Sauerstoffsäuren - Dischwefelsäuren<br />
O<br />
O<br />
O<br />
O<br />
O<br />
O<br />
S<br />
OH<br />
S<br />
O<br />
OH<br />
S<br />
O<br />
OH<br />
O<br />
S<br />
O<br />
O<br />
O<br />
S<br />
O<br />
OH<br />
O<br />
S<br />
OH<br />
O<br />
Dithionsäure<br />
Dischwefel(V)säure<br />
Dischwefelsäure<br />
Dischwefel(VI)säure<br />
Peroxodi-<br />
schwefel(VI)säure<br />
OH<br />
Dithionate<br />
Disulfate(V)<br />
Disulfate<br />
Disulfate(VI)<br />
Peroxodi-<br />
sulfate(VI)
OZ: +5, 0, –2<br />
H2Sn+2O3<br />
OZ: +5, 0<br />
H2Sn+2O6<br />
Sauerstoffsäuren - Polyschwefelsäuren<br />
O<br />
O<br />
O<br />
S<br />
O<br />
S<br />
OH<br />
OH<br />
(S) n<br />
(S) n<br />
O<br />
S<br />
S H<br />
O<br />
OH<br />
Polysulfan-<br />
monosul-<br />
fonsäure<br />
Polythion-<br />
säure<br />
Polysulfanmono-<br />
sulfonate<br />
Polythionat
Darstellung:<br />
Schweflige Säure H 2 SO 3<br />
SO 2 + H 2O H 2SO 3<br />
In wässriger Lösung erfolgt nahezu vollständige<br />
Dissoziation:<br />
–<br />
H2SO3 + H2O HSO3 + H3O +<br />
– 2–<br />
HSO3 + H2O SO3 + H3O +<br />
Hydrogensulfite und Sulfite
Schweflige Säure H 2 SO 3<br />
Sulfite disproportionieren beim Erhitzen:<br />
+ IV + VI – II<br />
2– T<br />
4 SO 3<br />
2– 2–<br />
3 SO4 + S<br />
In konzentrierter Lösung erfolgt Kondensation:<br />
–<br />
2 HSO3 2–<br />
S2O5 + H2O<br />
Disulfit (Pyrosulfit)
O<br />
S<br />
OH<br />
O –<br />
S<br />
O O<br />
O<br />
S<br />
O<br />
Bildung von Disulfit<br />
O –<br />
H<br />
– OH<br />
S + OH<br />
O O<br />
–<br />
O O – S<br />
O<br />
S<br />
O<br />
O –<br />
+ H 2O
Schweflige Säure - Eigenschaften<br />
Mäßig starke Reduktionsmittel:<br />
saure Lösung<br />
2– + –<br />
SO2 (aq) + 2 H2O SO4 + 4 H + 2 e<br />
2– + –<br />
2 SO2 (aq) + 2 H2O S2O6 + 4 H + 2 e<br />
alkalische Lösung<br />
2– –<br />
SO3 + 2 OH<br />
H 2SO 3 + ½ O 2<br />
2–<br />
SO4 + H2O + 2 e –<br />
H 2SO 4<br />
E 0 = + 0.16 V<br />
E 0 = + 0.57 V<br />
E 0 = – 0.94 V
Schweflige Säure - Reduktionswirkung<br />
Reduktion von Halogenen:<br />
I 2 + H 2SO 3 + H 2O 2 I – + H 2SO 4 + 2 H +<br />
Reduktion von Metallkationen:<br />
2 Au 3+ + 3 H 2SO 3 + 3 H 2O 2 Au + 3 H 2SO 4 + 6 H +<br />
Reduktion von Metall- und Nichtmetalloxiden:<br />
2–<br />
2 CrO4 + H2SO3 + 10 H +<br />
–<br />
IO3 + 3 H2SO3 2 Cr 3+ + 3 H 2 SO 4 + 5 H 2 O<br />
I – + 3 H 2SO 4
Reduktion von Schwefliger Säure<br />
Gelingt nur mit starken Reduktionsmitteln:<br />
H 2SO 3 + 4 Fe 2+ + 4 H + 1 / 8 S 8 + 4 Fe 3+ + 3 H 2O<br />
2 H 2SO 3 + 2 Na H 2S 2O 4 + 2 OH – + 2 Na +<br />
–<br />
2 H2SO3 + 4 HCO2 Dithionige Säure<br />
H 2SO 3 + 3 Zn + 6 HCl H 2S + 3 ZnCl 2 + 3 H 2O<br />
2 H 2SO 3 + 6 SnCl 2 + 18 HCl SnS 2 + 5 H 2[SnCl 6] + 6 H 2O<br />
SnS 2 + 4 HCl 2 H 2S + SnCl 4<br />
2–<br />
H2S2O3 + 2 C2O4 + 3 H2O<br />
Thioschwefelsäure
HO<br />
O<br />
S OH<br />
Derivate der Schwefligen Säure<br />
+<br />
H<br />
O<br />
O<br />
S O H<br />
O<br />
O<br />
S OH<br />
Schweflige Säure Protonenwanderung Sulfonsäure<br />
– O<br />
O<br />
S OH<br />
– O<br />
O<br />
–<br />
S O<br />
O<br />
H<br />
O<br />
S O –<br />
Hydrogensulfit-Anion Protonenwanderung Sulfonat-Anion<br />
H<br />
H
O<br />
Derivate der Schwefligen Säure<br />
+ X – , – OH –<br />
HO S OH<br />
X S<br />
+ OH – , – X –<br />
Schweflige Säure Sulfinsäure<br />
+OH – , – X –<br />
X<br />
O<br />
O<br />
S<br />
OH<br />
+X – , – OH –<br />
X<br />
Thionylverbindung
Darstellung:<br />
Große Affinität zu Wasser:<br />
Thionylchlorid<br />
SO 2 + PCl 5<br />
SO 2 + Cl 2 + SCl 2<br />
SO 3 + Cl 2 + 2 SCl 2<br />
SOCl 2 + POCl 3<br />
2 SOCl 2<br />
3 SOCl 2<br />
SOCl 2 + H 2O SO 2 + 2 HCl
SO 2 + ½ O 2<br />
Schwefelsäure H 2 SO 4<br />
SO 3 + H 2O H 2SO 4 + 74 kJ<br />
exotherm<br />
SO3 + 99 kJ<br />
endotherm
SO -Ausbeute [%]<br />
3<br />
Temperatur- und Druckabhängigkeit der SO 3 -Ausbeute<br />
100<br />
80<br />
60<br />
40<br />
1 bar 10 bar<br />
SO -Bildung<br />
3<br />
SO -Zerfall<br />
3<br />
400 500 600 700<br />
Temperatur [°C]<br />
SO -Ausbeute [%]<br />
3<br />
10 Vol-% SO 2 , 10.9 Vol-% O 2 , 79.9 Vol-% N 2<br />
100<br />
80<br />
60<br />
40<br />
SO -Bildung<br />
3<br />
SO -Zerfall<br />
3<br />
400 500 600 700<br />
Temperatur [°C]
Das Bleikammerverfahren<br />
N 2O 3 + SO 2<br />
2 NO + ½ O 2<br />
SO 2 + ½ O 2<br />
2 NO + SO 3<br />
N 2O 3<br />
SO 3<br />
(2 NO + ½ O 2 NO + NO 2 N 2O 3)
Das Kontaktverfahren<br />
V 2O 5 + SO 2<br />
V 2O 4 + ½ O 2<br />
SO 2 + ½ O 2<br />
V 2O 4 + SO 3<br />
V 2O 5<br />
SO 3
1.<br />
2.<br />
3.<br />
4.<br />
SO + O + N<br />
2 2 2<br />
Katalysator<br />
SO<br />
3<br />
450°C<br />
620°C<br />
450°C<br />
510°C<br />
450°C<br />
475°C<br />
430°C<br />
450°C<br />
Wärmetauscher
SO 3 -Ausbeute [%]<br />
100<br />
80<br />
60<br />
40<br />
20<br />
0<br />
Horde 4 (98%)<br />
Horde 3 (95 %)<br />
Horde 2<br />
(90 %)<br />
400 500 600 700<br />
Temperatur [°C]
Gewinnung von Schwefelsäure<br />
SO 3 + H 2SO 4<br />
H 2S 2O 7<br />
H 2S 2O 7 + H 2O 2 H 2SO 4<br />
SO 3 + H 2O H 2SO 4
H 2SO 4 + SO 3<br />
H 2SO 4 + 2 SO 3<br />
H 2SO 4 + 3 SO 3<br />
Schwefeltrioxid und Schwefelsäure<br />
H 2S 2O 7<br />
H 2S 3O 10<br />
H 2S 4O 13<br />
Dischwefelsäure<br />
Trischwefelsäure<br />
Tetraschwefelsäure
[Mio t]<br />
40<br />
30<br />
20<br />
10<br />
0<br />
H 2 SO 4 -Produktion<br />
1950 1960 1970 1980 1990<br />
USA<br />
Russland<br />
Deutschland<br />
England<br />
Frankreich<br />
Italien<br />
Belgien<br />
Ostasien<br />
Australien
[Mio t]<br />
100<br />
90<br />
80<br />
70<br />
60<br />
50<br />
40<br />
30<br />
20<br />
10<br />
0<br />
H 2 SO 4 -Produktion<br />
Welt<br />
1950 1960 1970 1980 1990
Eigenschaften der Schwefelsäure<br />
Wasserfreie Schwefelsäure: farblose, ölige, schwere<br />
Flüssigkeit (d = 1.83 g/cm 3 )<br />
Schmelzpunkt: 10.4 °C, (98%-ige nur noch 3°C)<br />
große Affinität zu Wasser<br />
große Oxidationskraft<br />
Eigendissoziation:<br />
H 2SO 4 + H 2SO 4<br />
+ –<br />
H3SO4 + HSO4
Eigenschaften der Schwefelsäure<br />
tiefere<br />
Temperaturen<br />
H 2SO 4<br />
hohe<br />
Temperaturen<br />
SO 3 +H 2O<br />
338°C 450°C
H 2SO 4<br />
Eigenschaften der Schwefelsäure<br />
H + –<br />
+ HSO4 1. Dissoziation 2. Dissoziation<br />
Hydrogensulfate und Sulfate<br />
2 H + 2–<br />
+ SO4
Eigenschaften der Schwefelsäure<br />
HF + H 2SO 4<br />
PH 3 + H 2SO 4<br />
H 3PO 4 + H 2SO 4<br />
H 5IO 6 + H 2SO 4<br />
H 3CCOOH + H 2SO 4<br />
(H 3C) 2CO + H 2SO 4<br />
H2F + –<br />
+ HSO4 + –<br />
PH4 + HSO4<br />
+ –<br />
P(OH) 4 + HSO4<br />
+ –<br />
I(OH) 6 + HSO4<br />
+ –<br />
H3C(OH) 2 + HSO4<br />
(H3C) 2COH + –<br />
+ HSO4
HNO 3 + 2 H 2SO 4<br />
H 2SO 4 + HNO 3<br />
+<br />
H O NO2 H<br />
Nitriersäure<br />
+<br />
NO2 + H3O + –<br />
+ 2 HSO4 HSO 4<br />
+<br />
–<br />
+ H O NO2<br />
+<br />
H2O + NO2 H
+<br />
+<br />
+ O N O<br />
H<br />
H<br />
NO 2<br />
Nitriersäure<br />
B – HB +<br />
+<br />
NO 2<br />
H<br />
H<br />
NO 2
H 2C<br />
HC<br />
H 2C<br />
Glycerin<br />
OH<br />
OH<br />
OH<br />
Wärme oder Schlag<br />
+ 3 HNO 3<br />
Nitriersäure<br />
H 2SO 4<br />
– 3 H 2 O<br />
H 2C<br />
HC<br />
H 2C<br />
O<br />
O<br />
O<br />
NO 2<br />
NO 2<br />
NO 2<br />
1 ½ N 2 + 3 CO 2 + 2 ½ H 2O + ¼ O 2
2 KHSO 4<br />
T<br />
Fe + H 2SO 4<br />
2 NaOH + H 2SO 4<br />
Na 2CO 3 + H 2SO 4<br />
BaCl 2 + Na 2SO 4<br />
2– –<br />
SO3 + 2 OH<br />
Sulfate<br />
– H 2O K 2S 2O 7<br />
T<br />
– SO 3<br />
FeSO 4 + H 2<br />
K 2SO 4<br />
Na 2SO 4 + 2 H 2O<br />
Na 2SO 4 + CO 2 + H 2O<br />
BaSO 4 + 2 NaCl<br />
2–<br />
SO4 + H2O + 2 e –
2– + –<br />
SO4 + 2 H + 2 e<br />
Oxidationswirkung<br />
2–<br />
SO3 + H2O<br />
H 2SO 4 + C SO 2 + H 2O + CO<br />
2 H 2SO 4 + 1 / 8 S 8<br />
Cu + 2 H 2SO 4<br />
3 SO 2 + 2 H 2O<br />
CuSO 4 + SO 2 + H 2O
2 HI + H 2SO 4<br />
H 2S + H 2SO 4<br />
Oxidationswirkung<br />
I 2 + SO 2 + 2 H 2O<br />
1 /8 S 8 + SO 2 + 2 H 2O
Verdünnte Schwefelsäure<br />
M + H 2SO 4 (aq) M II SO 4 + H 2<br />
2 H + + 2 e –<br />
M M 2+ + 2 e –<br />
H 2
O<br />
Derivate der Schwefelsäure<br />
+ X – , – OH –<br />
HO S OH<br />
X S<br />
+ OH – , – X –<br />
O<br />
O O<br />
X<br />
O<br />
S<br />
OH<br />
Schwefelsäure Sulfonsäure<br />
+OH – , – X –<br />
O<br />
+X – , – OH –<br />
X<br />
Sulfurylverbindung
Fluorsulfonsäure<br />
SO 3 + HF HSO 3F<br />
HSO 3F + H 2O H 3O + SO 3F –
H 2SO 4 + PCl 5<br />
Chlorsulfonsäure<br />
SO 3 + HCl HSO 3Cl<br />
HSO 3Cl + POCl 3 + HCl<br />
HSO 3Cl + H 2O H 2SO 4 + HCl
Sulfurylchlorid SO 2 Cl 2<br />
SO 2 + Cl 2<br />
S 2Cl 2 + Cl 2 + O 2<br />
SO 2Cl 2<br />
Kat.<br />
Kat.<br />
SO 2Cl 2<br />
2 SO 2Cl 2<br />
T<br />
2 HSO3Cl SO2Cl2 + H2SO4 + H 2O<br />
– HCl<br />
HSO 3Cl<br />
+ H 2O<br />
– HCl<br />
H 2SO 4
Thioschwefelsäure - Thiosulfate<br />
ClSO 3H + H 2S H 2S 2O 3 + HCl<br />
H 2S 2O 3<br />
Na 2SO 3 + 1 / 8 S 8<br />
> 0 °C<br />
100°C /H 2O<br />
H 2S + SO 3<br />
Na 2S 2O 3
Der fotografische Prozess<br />
Belichten<br />
lichtempfindlicher Film<br />
Belichten<br />
lichtempfindliches Papier<br />
Entwickeln und Fixieren<br />
Negativ-Film<br />
Entwickeln und Fixieren
Der fotografische Prozess<br />
• Erzeugung einer lichtempfindlichen Schicht auf einem<br />
Trägermaterial<br />
• Belichtung der lichtempfindlichen Schicht zum Erhalten einer<br />
latenten Abbildung<br />
• Entwicklung der latenten Abbildung zum Negativ<br />
• Fixierung des Negativs<br />
• Belichtung des Negativs zum Positiv
Der fotografische Prozess<br />
Belichtung der lichtempfindlichen Schicht zum Erhalten einer latenten<br />
Abbildung<br />
h · + AgX Ag + ½ X 2 (X = Cl, Br, I)<br />
X – + h · ½ X 2 + e –<br />
Ag + + e –<br />
Ag
Entwicklung der<br />
latenten Abbildung zum<br />
Negativ<br />
Der fotografische Prozess<br />
2 AgBr + 2 OH – +<br />
OH<br />
OH<br />
Hydrochinon<br />
2 Ag + 2 H 2O + 2 Br – +<br />
O<br />
O<br />
p-Benzochinon
Fixierung<br />
AgBr + 2 Na 2S 2O 3<br />
Der fotografische Prozess<br />
Na 3[Ag(S 2O 3) 2] + NaBr
Iodometrische Bestimmung von Oxidationsmitteln<br />
Fe 3+<br />
KI<br />
2 Fe 3 + + 2 I –<br />
I 2<br />
Fe 2+<br />
2 Fe 2+ + I 2<br />
Na S O<br />
2 2 3<br />
2– 2– –<br />
2 S2O3 + I2 S4O6 + 2 I<br />
I –
KI 3<br />
Iodometrische Bestimmung von Reduktionsmitteln<br />
S 2–<br />
KI + I 2<br />
KI 3<br />
S 2– + I 2<br />
I 2<br />
S 8<br />
I –<br />
1 /8 S 8 + 2 I –<br />
Na S O<br />
2 2 3<br />
2– 2– –<br />
2 S2O3 + I2 S4O6 + 2 I<br />
I –