Falk Gastro-Kolleg Darm - Dr. Falk Pharma GmbH
Falk Gastro-Kolleg Darm - Dr. Falk Pharma GmbH
Falk Gastro-Kolleg Darm - Dr. Falk Pharma GmbH
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
<strong>Falk</strong><br />
<strong>Gastro</strong>-<strong>Kolleg</strong><br />
<strong>Darm</strong><br />
Morbus Crohn – Update<br />
Zusammenfassung<br />
Der Morbus Crohn kann den gesamten <strong>Gastro</strong>intestinaltrakt betreffen, meist besteht ein<br />
segmentaler Befall. Die häufigsten Lokalisationen sind terminales Ileum und Kolon.<br />
Leitsymptome des M. Crohn sind Bauchschmerzen und Durchfall. Extraintestinale<br />
Manifestationen und Komplikationen können das klinische Bild komplizieren. Die<br />
Diagnostik beruht neben der klinischen Untersuchung und Labortests im Wesentlichen<br />
auf endoskopischen und bildgebenden Verfahren. Grundpfeiler der Behandlung des M.<br />
Crohn ist die medikamentöse Therapie, die zur Remissionsinduktion bei akuten Erkrankungsschüben<br />
und zum Remissionserhalt eingesetzt wird. Der Einsatz der Medikamente<br />
(Mesalazin, Budesonid, systemisch wirksame Glukokortikoide, Azathioprin/6-Mercaptopurin,<br />
Methotrexat, Infliximab, Adalimumab) sollte entsprechend der Leitlinien der<br />
Deutschen Gesellschaft für Verdauungs- und Stoffwechselkrankheiten (DGVS) erfolgen.<br />
Therapieziel ist eine steroidfreie Remission des M. Crohn und die Vermeidung von<br />
Komplikationen und Folgeschäden. Ergänzende Therapieformen sind die Ernährungstherapie<br />
und bei psychischen Problemen die Psychotherapie. Beim Versagen der<br />
konservativen Therapie oder bei Komplikationen sind chirurgische Maßnahmen indiziert.<br />
Besondere Behandlungsaspekte bieten Patienten mit Fisteln, insbesondere perianalen<br />
Fisteln, sowie Patienten mit extraintestinalen Manifestationen und Komplikationen.<br />
Besondere Anforderungen werden an die Therapie in der Schwangerschaft gestellt.<br />
Prof. <strong>Dr</strong>. V. Groß<br />
Medizinische Klinik II<br />
Klinikum St. Marien<br />
Mariahilfbergweg 7<br />
92224 Amberg<br />
Schlüsselwörter<br />
Morbus Crohn | Diagnostik | medikamentöse Therapie | Chirurgie |<br />
chronisch entzündliche <strong>Darm</strong>erkrankungen (CED)<br />
Fragebeantwortung unter<br />
www.falkfoundation.de<br />
<strong>Falk</strong> <strong>Gastro</strong>-<strong>Kolleg</strong><br />
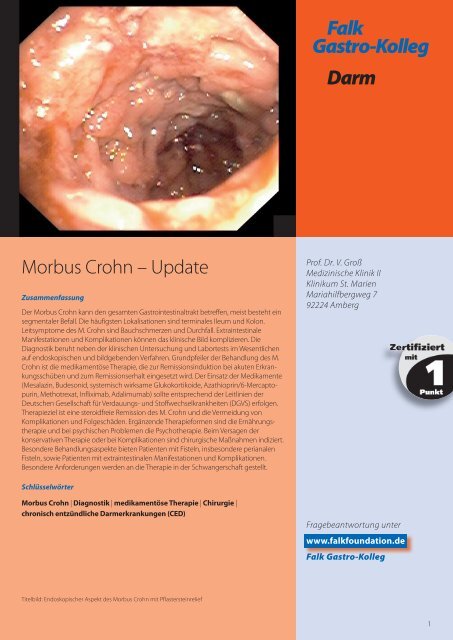
Titelbild: Endoskopischer Aspekt des Morbus Crohn mit Pflastersteinrelief<br />
1
Morbus Crohn – Update<br />
1. Definition<br />
Der Morbus Crohn wurde erstmals 1932 von Crohn, Ginzburg und Oppenheimer als<br />
Enteritis regionalis des terminalen Ileums beschrieben. Der M. Crohn ist durch<br />
eine chronische, die gesamte <strong>Darm</strong>wand erfassende Entzündung charakterisiert, die<br />
sich in die Umgebung ausbreiten kann. Durch die wandüberschreitende Entzündung<br />
kann es zu Adhäsionen von <strong>Darm</strong>schlingen, Fistelbildungen und Abszessen kommen.<br />
Der M. Crohn kann alle Abschnitte des Magen-<strong>Darm</strong>-Trakts erfassen. Der Befall ist<br />
meist segmental, seltener kontinuierlich. Zusätzlich können extraintestinale Manifestationen<br />
auftreten.<br />
2. Epidemiologie<br />
Die Inzidenz des M. Crohn beträgt in Deutschland ca. 5 Neuerkrankungen pro<br />
100.000 Einwohner/Jahr. Die Prävalenz liegt bei 100–200 pro 100.000 Einwohner.<br />
P Inzidenz ca. 5/100.000,<br />
Prävalenz ca. 100–200/100.000<br />
Die Erstmanifestation liegt typischerweise zwischen dem 15. und 40. Lebensjahr,<br />
der M. Crohn kann jedoch prinzipiell in jedem Alter auftreten. Frauen sind etwas häufiger<br />
betroffen als Männer. Es besteht eine familiäre Häufung mit deutlich erhöhtem<br />
Erkrankungsrisiko für Verwandte ersten Grades von Patienten mit chronisch entzündlicher<br />
<strong>Darm</strong>erkrankung (CED). Das Lebenszeitrisiko für Kinder und Geschwister<br />
Erkrankter beträgt ca. 9%; wenn beide Elternteile erkrankt sind sogar 30%. Raucher<br />
haben ein erhöhtes Risiko, an einem M. Crohn zu erkranken.<br />
3. Ätiologie und Pathophysiologie<br />
Ätiologie und Pathophysiologie des M. Crohn sind nicht vollständig geklärt. Die Daten<br />
sprechen für eine multifaktorielle Genese, wobei genetische Faktoren und Umweltfaktoren<br />
jeweils zu ca. 50% zur Erkrankungsmanifestation beitragen.<br />
P Es besteht eine genetische<br />
Prädisposition.<br />
Für eine genetische Prädisposition spricht neben der familiären Häufung die hohe<br />
Konkordanzrate des M. Crohn bei eineiigen Zwillingen (ca. 60%) im Vergleich zu zweieiigen<br />
Zwillingen (ca. 4–8%).<br />
Durch molekulargenetische Methoden wurden verschiedene Suszeptibilitätsgene für<br />
den M. Crohn identifiziert. Von großer Bedeutung ist das NOD2 (CARD15)-Gen auf<br />
Chromosom 16. CARD15 gehört zur Familie der intrazellulären Proteine, die eine<br />
wichtige Rolle bei der unspezifischen Abwehr bakterieller Pathogene spielen. Während<br />
der Wildtyp des CARD15 eine Aktivierung des Immunsystems durch bakterielles<br />
Lipopolysaccharid und Peptidoglykan induziert, besitzen die mit dem M. Crohn assoziierten<br />
Varianten diese Fähigkeit nicht.<br />
Risiko für den Morbus Crohn in Abhängigkeit von den<br />
3 wesentlichen Mutationen von CARD15<br />
P CARD15 ist das wichtigste<br />
Suszeptibilitätsgen.<br />
Tab. 1<br />
Genotyp<br />
Relatives Morbus-Crohn-Risiko<br />
Wildtyp 1<br />
Einfach heterozygot 3<br />
Gemischt heterozygot 44<br />
Homozygot 38<br />
2
Die Varianten von CARD15 sind mit einem bestimmten Phänotyp des M. Crohn assoziiert.<br />
Dieser ist durch ein jüngeres Alter bei Diagnosestellung, eine Ileumbeteiligung,<br />
einen fibrostenosierenden Verlauf sowie eine erhöhte Wahrscheinlichkeit für eine<br />
Ileozökalresektion und ein erhöhtes Risiko für postoperative Komplikationen charakterisiert.<br />
Als weitere Suszeptibilitätsgene für den M. Crohn wurden der Interleukin-23-<br />
Rezeptor (Variante Arg381Gln reduziert das M. Crohn-Risiko um circa zwei <strong>Dr</strong>ittel)<br />
und das für die Autophagie und die Verarbeitung intrazellulärer Bakterien wichtige<br />
ATG16L1-Gen (Variante T300A erhöht das M. Crohn-Risiko um den Faktor 1,65) identifiziert.<br />
Die genetischen Untersuchungen zeigen, dass offensichtlich Störungen der unspezifischen<br />
Körperabwehr sowie der Aktivierung des Immunsystems für den M. Crohn<br />
prädisponieren.<br />
Umweltfaktoren, die das Risiko für den M. Crohn erhöhen, sind ein hoher Hygienestandard<br />
in der Kindheit, Rauchen sowie eine stattgehabte Appendektomie. Die<br />
Einnahme oraler Kontrazeptiva wird kontrovers bewertet, stellt jedoch höchstens<br />
einen geringen Risikofaktor dar. Ein Einfluss frühkindlicher Infektionen, insbesondere<br />
der Masernvirus-Infektion, wird diskutiert, ist jedoch nicht belegt. Gleiches gilt für eine<br />
Infektion mit Mycobacterium paratuberculosis, deren pathogenetische Rolle nicht<br />
gesichert ist.<br />
P Umweltfaktoren beeinflussen<br />
die Erkrankungsmanifestation.<br />
Psychische Faktoren (Stress, seelische Belastung) haben bei manchen Patienten<br />
wahrscheinlich einen Einfluss auf den Krankheitsverlauf, werden im Allgemeinen<br />
jedoch nicht als alleinige Auslöser des M. Crohn angesehen.<br />
Für diätetische Faktoren (raffinierte Zucker, Omega-3-Fettsäuren etc.) gibt es trotz<br />
zahlreicher Hypothesen keine gesicherten Erkenntnisse bezüglich ihrer Bedeutung<br />
für die Entstehung des M. Crohn.<br />
4. Klinik<br />
Der M. Crohn kann den gesamten <strong>Gastro</strong>intestinaltrakt betreffen. Meist besteht ein<br />
segmentaler Befall.<br />
Befallsmuster des Morbus Crohn<br />
P Typisch ist eine segmentale,<br />
diskontinuierliche Entzündung.<br />
Tab. 2<br />
Ösophagus 0–1%<br />
Magen 2–3%<br />
Duodenum 2–3%<br />
Proximaler Dünndarm 5–10%<br />
Terminales Ileum 25–40%<br />
Ileum und Kolon 40–55%<br />
Kolon 15–35%<br />
Nur Rektum 15–25%<br />
Diskontinuierlicher Befall ca. 85%<br />
3
Leitsymptome des M. Crohn sind Bauchschmerzen und Durchfall. Im Krankheitsverlauf<br />
sind fast alle Patienten davon betroffen. Fieber, Gewichtsverlust und Symptome<br />
der Mangelernährung können hinzukommen. Blutungen sind deutlich seltener als bei<br />
der Colitis ulcerosa, können in manchen Fällen jedoch auch klinisch führend sein. Ein<br />
häufiges Problem ist der perianale Befall. Perianale Manifestationen des M. Crohn sind<br />
Fisteln, Fissuren, Ulzerationen und Abszesse.<br />
Klinische Symptome des Morbus Crohn bei Erstmanifestation<br />
P Leitsymptome sind<br />
Bauchschmerzen und Durchfall.<br />
Tab. 3<br />
Bauchschmerzen 77%<br />
Diarrhö 73%<br />
Gewichtsverlust 54%<br />
Fieber 35%<br />
Anämie 27%<br />
Blutungen 22%<br />
Analfisteln 16%<br />
Im klinischen Verlauf können als Komplikationen bevorzugt Fisteln und Abszesse<br />
(penetrierender Verlaufstyp) oder Stenosen (strikturierender Verlaufstyp) auftreten.<br />
Klinisch fallen Patienten mit Stenosen durch Schmerzen nach der Nahrungsaufnahme<br />
auf. Meist besteht ein lange kompensierter chronischer Subileus. Ein akuter Ileus ist<br />
seltener.<br />
Der M. Crohn ist eine chronisch rezidivierende Erkrankung, die durch akute Schübe<br />
und Remissionsphasen charakterisiert ist. Epidemiologische Untersuchungen zeigen,<br />
dass knapp die Hälfte der Patienten mit M. Crohn im Verlauf von 10 Jahren eine abnehmende<br />
Krankheitsaktivität aufweisen, während circa ein <strong>Dr</strong>ittel unter rezidivierenden<br />
Schüben und circa ein Fünftel unter einer chronisch aktiven Erkrankung leiden<br />
(Abb. 1).<br />
Verlauf des Morbus Crohn über 10 Jahre<br />
Abb. 1<br />
IBSEN-Studie: alle Patienten mit neu diagnostiziertem Morbus Crohn<br />
in Teilen von Südost-Norwegen 1990–1993 prospektiv erfasst<br />
und nachverfolgt (n = 237)<br />
43%<br />
3%<br />
0<br />
10 Jahre<br />
0<br />
10 Jahre<br />
19% 32%<br />
0<br />
10 Jahre<br />
0<br />
10 Jahre<br />
Solberg et al., Clin <strong>Gastro</strong>enterol Hepatol 2007; 5: 1430–1438<br />
4
Im Verlauf der Erkrankung führen bei mehr als der Hälfte der Crohn-Patienten extraintestinale<br />
Manifestationen zu zusätzlichen Beschwerden. Extraintestinale<br />
Manifestationen sind entzündliche Veränderungen außerhalb des <strong>Gastro</strong>intestinaltrakts,<br />
die in Zusammenhang mit der zugrunde liegenden <strong>Darm</strong>entzündung stehen.<br />
Bei den Gelenkmanifestationen muss man zwischen Arthralgien, der peripheren<br />
Arthritis Typ I (pauciartikulär, Befall weniger großer Gelenke in Assoziation mit einer<br />
Aktivität des M. Crohn), der peripheren Arthritis Typ II (polyartikulär, Befall mehrerer<br />
kleiner peripherer Gelenke unabhängig von der Aktivität des M. Crohn) und der<br />
axialen Arthritis einschließlich der Sacroileitis und der ankylosierenden Spondylitis<br />
unterscheiden. Gelenkmanifestationen finden sich bei ca. 30% der Patienten; sie<br />
stellen die häufigste extraintestinale Manifestation dar. Hautmanifestationen werden<br />
von 2–15% der Patienten berichtet. Die häufigste Hautmanifestation ist das<br />
Erythema nodosum. Das Pyoderma gangraenosum ist seltener. Entzündliche Augenveränderungen<br />
können bei Patienten mit M. Crohn in allen Abschnitten des Auges<br />
auftreten, meist findet sich jedoch eine Uveitis anterior (Iritis/Iridozyklitis) oder eine<br />
Episkleritis. Die klinisch bedeutungsvollste Manifestation im Bereich der Leber und<br />
der Gallenwege ist die primär sklerosierende Cholangitis (PSC). Die Prävalenz der<br />
PSC korreliert mit einem Befall des Dickdarms. Pankreatitiden treten bei Patienten<br />
mit M. Crohn gehäuft auf. Pankreatitiden sind von asymptomatischen Hyperamylasämien<br />
und Hyperlipasämien zu unterscheiden, die bei ca. 14% der Patienten mit CED<br />
auftreten können und in der Regel keine klinische Relevanz besitzen. Als seltenere<br />
extraintestinale Manifestationen wurden asymptomatische Beteiligungen der Lungen,<br />
des Herzens, der Nieren, autoimmunhämolytische Anämien sowie neurologische<br />
Manifestationen und Vaskulitiden beschrieben.<br />
Häufige extraintestinale Manifestationen des Morbus Crohn<br />
P Extraintestinale Manifestationen<br />
sind häufig.<br />
P Am häufigsten ist die<br />
Gelenkbeteiligung.<br />
Tab. 4<br />
Gelenkmanifestationen<br />
Hautmanifestationen<br />
Augenmanifestationen<br />
Leber/Galle<br />
• Arthralgien<br />
• Arthritiden/Synovialitiden<br />
• Spondylarthropathien<br />
• Erythema nodosum<br />
• Pyoderma gangraenosum<br />
• Konjunktivitis<br />
• Episkleritis<br />
• Iritis/Iridozyklitis<br />
• Primär sklerosierende Cholangitis<br />
Abzugrenzen von den extraintestinalen Manifestationen des M. Crohn sind die extraintestinalen<br />
Komplikationen. Dazu zählen Gallensteine (durch den gestörten<br />
enterohepatischen Kreislauf der Gallensäuren bei Ileumbefall) und Nierensteine<br />
(Oxalatsteine). Häufig findet sich eine Anämie, die multifaktoriell bedingt ist (Blutverluste,<br />
Eisenmangel, chronischer Entzündungsprozess). Gelegentlich kann der Anämie<br />
ein Vitamin-B 12 -Mangel bei funktionellem Ausfall der Vitamin-B 12 -Resorption im Ileum<br />
zugrunde liegen. Häufig sind ferner Osteopenie und Osteoporose (multifaktoriell<br />
bedingt durch Mangel an Kalzium, Vitamin D, chronischen Entzündungsprozess).<br />
5
5. Diagnostik<br />
Eine einzelne Untersuchung als Goldstandard für die Diagnosestellung des M. Crohn<br />
gibt es nicht. Die Diagnose setzt sich aus Anamnese, klinischem Erscheinungsbild und<br />
einer Kombination aus laborchemischen, sonografischen, endoskopischen, histologischen<br />
und radiologischen Befunden zusammen.<br />
P Wesentliche diagnostische<br />
Methoden sind Labor, Ultraschall,<br />
Endoskopie, MRT.<br />
Die klinischen Symptome des M. Crohn können, wie oben dargestellt, vielfältig sein.<br />
Eine komplette Anamnese sowie eine gründliche körperliche Untersuchung sind<br />
die Basis der Diagnostik.<br />
Die initiale Labordiagnostik sollte entsprechend den Leitlinien das C-reaktive Protein<br />
und ein Blutbild beinhalten. Mikrobiologische Tests auf infektiöse Durchfallerreger<br />
inklusive Clostridium-difficile-Toxin werden empfohlen. Bei akuten entzündlichen<br />
Schüben unter immunsuppressiver Therapie sollte eine Diagnostik zum Ausschluss<br />
einer CMV-Infektion erfolgen. Im Einzelfall können aufgrund der Anamnese (z. B. Auslandsaufenthalt)<br />
oder der Klinik (z. B. Zeichen der Mangelernährung, Exsikkose) weitere<br />
laborchemische Untersuchungen notwendig sein. Die quantitative Bestimmung<br />
eines Leukozytenmarkers im Stuhl (z. B. Calprotectin) kann in der Abgrenzung nichtentzündlicher<br />
Ursachen der gastrointestinalen Beschwerden hilfreich sein, wird aufgrund<br />
der begrenzten Sensitivität und Spezifität jedoch nicht generell empfohlen.<br />
Bei Verdacht auf einen M. Crohn gehören der transabdominelle Ultraschall, die Ileokoloskopie<br />
mit Biopsien sowie eine erweiterte Dünndarmdiagnostik zu den Basisuntersuchungen.<br />
Der transabdominelle Ultraschall erlaubt die Beurteilung der <strong>Darm</strong>wanddicke, insbesondere<br />
auch im Dünndarm, der durch die konventionelle Endoskopie nicht einsehbar<br />
ist. Mithilfe der Dopplersonografie kann der Nachweis einer vermehrten<br />
Vaskularisierung in entzündeten <strong>Darm</strong>abschnitten erfolgen. Die <strong>Darm</strong>wandsonografie<br />
ist geeignet, Lokalisation, Befallsmuster und Länge des betroffenen <strong>Darm</strong>abschnitts<br />
sowie Komplikationen wie Abszesse, Fisteln und Stenosen nachzuweisen.<br />
P Die <strong>Darm</strong>sonografie ist eine<br />
wichtige Basisuntersuchung.<br />
Abb. 2<br />
Sonografie bei Morbus Crohn mit Power-Doppler<br />
Bei der Ileokoloskopie ist auf aphthöse Läsionen, längliche fissurale, zum Teil landkartenartig<br />
konfluierende Ulzera, Pflastersteinrelief und Stenosen zu achten. Die<br />
Befunde sind typischerweise diskontinuierlich verteilt. Eine besondere Beachtung<br />
verdienen perianale Läsionen. Biopsien sollen aus mindestens 5 verschiedenen anatomischen<br />
Segmenten des gesamten Kolons einschließlich des Rektums und des terminalen<br />
Ileums erfolgen, auch aus makroskopisch unauffälliger Schleimhaut.<br />
6
Abb. 3<br />
Endoskopischer Aspekt<br />
des Morbus Crohn<br />
Histologisch spezifisch, wenn auch nicht pathognomonisch, ist der bioptische Nachweis<br />
von epitheloidzelligen Granulomen, der jedoch nur bei circa einem <strong>Dr</strong>ittel der<br />
Patienten gelingt. Histopathologisch ist eine diskontinuierliche Störung der Kryptenarchitektur<br />
in Kombination mit einer diskontinuierlichen entzündlichen Infiltration<br />
der Mukosa durch Entzündungszellen charakteristisch.<br />
Im Rahmen der Primärdiagnostik sowie beim Auftreten von Symptomen des oberen<br />
<strong>Gastro</strong>intestinaltrakts wird auch die Ösophagogastroduodenoskopie einschließlich<br />
Biopsien empfohlen, um eine Beteiligung des oberen <strong>Gastro</strong>intestinaltrakts nachzuweisen.<br />
Bezüglich der erweiterten Dünndarmdiagnostik wird zusätzlich zur Ultraschalluntersuchung<br />
ein weiteres Verfahren, bevorzugt die Magnetresonanztomografie (MRT),<br />
empfohlen. Sie hat den Vorteil, ohne Strahlenbelastung auszukommen. Die MRT zeigt<br />
nicht nur die Lokalisation und die Ausdehnung des M. Crohn, sondern liefert zusätzliche<br />
Informationen über Wandverdickungen und entzündliche Reaktionen des umgebenden<br />
Gewebes und stellt Fisteln und Abszesse dar. Die Computertomografie<br />
(CT) liefert ähnliche Informationen, geht jedoch mit einer Strahlenbelastung einher<br />
und ist daher in der Regel dem Notfall vorbehalten. Das konventionelle Enteroklysma<br />
nach Sellink sollte nur noch in Ausnahmefällen erfolgen.<br />
P Die MRT hat das konventionelle<br />
Enteroklysma nach Sellink abgelöst.<br />
Die Kapselendoskopie und die verschiedenen Verfahren der Enteroskopie (z. B.<br />
Doppelballon, Singleballon) erweitern seit Kurzem das Repertoire der Dünndarmdiagnostik.<br />
Die Kapselendoskopie erfordert allerdings eine Vordiagnostik zum Ausschluss<br />
von Stenosen. Die Kapselendoskopie ist bezüglich der Detektion von Crohn-<br />
Läsionen sensitiver als die MRT des Dünndarms, insbesondere im Fall kleiner Läsionen.<br />
Die Enteroskopie ermöglicht in ausgewählten Fällen eines ausschließlichen Dünndarmbefalls<br />
die Diagnosestellung des M. Crohn durch Biopsieentnahme.<br />
Eine radiologische Methode zur Kolondarstellung muss nur dann zum Einsatz<br />
kommen, wenn das Kolon aufgrund von Stenosen endoskopisch nicht einsehbar ist.<br />
Der endorektale Ultraschall und die MRT des kleinen Beckens sind gleichwertig<br />
sensitive Verfahren zur Diagnostik, Klassifikation und Verlaufskontrolle perianaler<br />
Fisteln und Abszesse. Die endorektale Ultraschalluntersuchung kann allerdings auf<br />
Probleme stoßen (Stenosen, Schmerzen), sodass die MRT für den Patienten komfortabler<br />
ist.<br />
Zur Bestimmung der Erkrankungsaktivität des M. Crohn wurden verschiedene Indizes<br />
entwickelt. Der gebräuchlichste ist der Crohn‘s Disease Activity Index (CDAI), der<br />
vor allem klinische Parameter berücksichtigt.<br />
7
Crohn’s Disease Activity Index (CDAI nach Best et al.)<br />
Tab. 5<br />
Variable<br />
Multiplikationskoeffizient<br />
1. Anzahl der weichen Stühle in der letzten Woche 2<br />
2. Grad der Bauchschmerzen (Summe über 1 Woche)<br />
(keine = 0; gering = 1; mäßig = 2;<br />
schwer bis unerträglich = 3)<br />
3. Beeinträchtigung des Allgemeinbefindens<br />
(Summe über 1 Woche) (keine = 0; gering = 1;<br />
mäßig = 2; erheblich = 3; unerträglich = 4)<br />
4. Anzahl aktueller mit Morbus Crohn assoziierter Symptome<br />
(als assoziierte Symptomkategorien gelten:<br />
– Gelenkschmerzen/Arthritis<br />
– Erythema nodosum; Stomatitis aphthosa<br />
– Temperatur > 37,5 °C in der letzten Woche<br />
– Iritis/Uveitis; Pyoderma gangraenosum;<br />
Analfissur/Analfisteln/Abszesse; andere Fisteln)<br />
5<br />
7<br />
20<br />
5. Symptomatische Durchfallbehandlung (ja = 1; nein = 0) 30<br />
6. Resistenz im Abdomen (nein = 0; fraglich = 2; sicher = 5) 10<br />
7. Hämatokrit<br />
(Frauen: 42 – aktueller HKT; Männer: 47 – aktueller HKT)<br />
(Vorzeichen beachten!)<br />
8. Gewicht (1 – Gewicht/Standardgewicht)<br />
(bei Übergewicht Vorzeichen beachten!)<br />
6<br />
100<br />
Der Wert jeder Variablen (1–8) wird mit dem jeweiligen Koeffizienten multipliziert.<br />
Der Aktivitätsindex ergibt sich aus der Gesamtsumme der einzelnen Endwerte.<br />
Ein Index < 150 zeigt eine ruhende, > 150 eine aktive Erkrankung an.<br />
In der klinischen Praxis kommt man jedoch in der Regel ohne Berechnung des CDAI<br />
aus und orientiert sich an der klinischen Symptomatik, den Laborparametern und den<br />
Befunden der bildgebenden Verfahren (Ultraschall, Endoskopie, Radiologie).<br />
6. Therapie<br />
Wesentlicher Bestandteil der Behandlung von Patienten mit M. Crohn ist die medikamentöse<br />
Therapie. Die medikamentöse Therapie wird zur Remissionsinduktion bei<br />
aktiver Erkrankung sowie zur Remissionserhaltung eingesetzt. Beim Versagen der medikamentösen<br />
Therapie oder beim Auftreten von konservativ nicht zu behandelnden<br />
Komplikationen sind operative Maßnahmen indiziert. Zusätzlich zur medikamentösen<br />
und operativen Therapie spielt die Ernährungstherapie eine wichtige Rolle.<br />
Für manche Patienten ist die Psychotherapie von Bedeutung. Besondere Behandlungsaspekte<br />
bieten Patienten mit Fisteln, insbesondere perianalen Fisteln, Patienten<br />
mit extraintestinalen Manifestationen und extraintestinalen Komplikationen sowie<br />
schwangere Patientinnen.<br />
P Wesentlicher Bestandteil der Behandlung<br />
ist die medikamentöse Therapie.<br />
Für die Behandlung des M. Crohn existieren nationale (DGVS) und europäische Leitlinien<br />
(ECCO Consensus on the Management of Crohn‘s Disease).<br />
8
6.1 Akuter Schub<br />
Bei der Therapie des akuten Schubes sind die Lokalisation der Erkrankung und die<br />
Schwere des Schubes zu berücksichtigen.<br />
6.1.1 Ileozökaler Befall<br />
Bei vorwiegend ileozökalem Befall und leichter bis mäßig schwerer Entzündungsaktivität<br />
stellt Budesonid (Tagesdosis 9 mg) die bevorzugte Behandlung dar. Budesonid<br />
induziert eine Remission in ca. 55–60% der Fälle, bei leichten Schüben in bis zu<br />
70% der Fälle. Im direkten Vergleich erwies sich Budesonid Mesalazin überlegen. Die<br />
Studiendaten zu Mesalazin sind uneinheitlich; der Therapieeffekt ist begrenzt. Systemisch<br />
wirksame Glukokortikoide kommen bei Versagen von Budesonid zum Einsatz.<br />
Eine hoch dosierte Therapie mit konventionellen Glukokortikoiden (Startdosis in<br />
der Regel 60 mg Prednisolon-Äquivalent pro Tag) induziert in ca. 65–80% der Fälle<br />
eine Remission. Verglichen mit Budesonid haben systemisch wirksame Glukokortikoide<br />
signifikant mehr Nebenwirkungen (ca. 60% der Patienten mit steroidassoziierten<br />
Nebenwirkungen vs. ca. 30% unter Budesonid). Im Vergleich zu systemisch wirksamen<br />
Glukokortikoiden wird Budesonid in einer gleichbleibenden Tagesdosis von 9 mg gegeben.<br />
In der Phase der Therapiebeendigung beträgt die tägliche Gabe dann 6 mg<br />
Budesonid über 1–2 Wochen.<br />
Bei hoher Entzündungsaktivität ist primär eine Behandlung mit systemisch<br />
wirksamen Glukokortikoiden durchzuführen (Startdosis in der Regel 60 mg Prednisolon-Äquivalent/Tag,<br />
alternativ 1 mg/kg KG, wöchentliche Reduktion in 10 mg-<br />
Schritten bis zu einer Tagesdosis von 30 mg/Tag, danach wöchentliche Reduktion in<br />
5 mg-Schritten).<br />
Steroidstoßtherapie<br />
P Beim leichten bis mäßig schweren<br />
Schub wird primär Budesonid<br />
empfohlen.<br />
P Beim schweren Schub werden<br />
primär systemisch wirksame<br />
Glukokortikoide empfohlen.<br />
Tab. 6<br />
Woche<br />
Prednisolon-Äquivalent<br />
1 60 mg<br />
2 50 mg<br />
3 40 mg<br />
4 30 mg<br />
5 25 mg<br />
6 20 mg<br />
7 15 mg<br />
8–ca. 12<br />
10/5 mg<br />
Bei nicht ausreichendem Ansprechen auf systemisch wirksame Glukokortikoide<br />
sollten Immunsuppressiva eingesetzt werden. Medikament der Wahl ist Azathioprin<br />
(Tagesdosis 2–2,5 mg/kg KG) oder das bei uns eher unübliche 6-Mercaptopurin<br />
(Tagesdosis 1–1,5 mg/kg KG). Bei Unverträglichkeit von Azathioprin/6-Mercaptopurin<br />
kann Methotrexat (25 mg/Woche i.m.) eingesetzt werden. Nachteil der klassischen<br />
Immunsuppressiva ist ihr langsamer Wirkungseintritt. Falls aufgrund einer hohen Entzündungsaktivität<br />
und schwerer Symptomatik eine rasche Remissionsinduktion erforderlich<br />
ist, sollten nach Ausschluss einer Operationsindikation und der entsprechenden<br />
Kontraindikationen primär anti-TNF-α-Antikörper eingesetzt werden. Dafür stehen<br />
Infliximab (5 mg/kg KG i. v.-Infusion in den Wochen 0, 2, 6, dann 5 mg/kg KG 8-wöchentlich)<br />
und Adalimumab (80/40 mg s. c. in den Wochen 0/2, dann 40 mg 2-wöchentlich)<br />
zur Verfügung. Durch die anti-TNF-Therapie können Remissionsraten von<br />
ca. 45% und Besserungsraten von ca. 70% erreicht werden.<br />
P Azathioprin ist das Immunsuppressivum<br />
der Wahl.<br />
9
Antibiotika sollten bei Patienten zum Einsatz kommen, bei denen der Verdacht auf<br />
eine infektiöse Komplikation besteht. Bevorzugte Antibiotika sind Ciprofloxacin und<br />
Metronidazol.<br />
Abbildung 4 zeigt den Therapiealgorithmus beim akuten M. Crohn.<br />
Therapie des akuten Morbus Crohn<br />
Abb. 4<br />
Leichter bis mäßig schwerer Schub<br />
Schwerer Schub<br />
Therapie<br />
⎧<br />
⎪<br />
⎩<br />
Mesalazin,<br />
Sulfasalazin<br />
⎫<br />
⎪<br />
⎭<br />
Budesonid<br />
Steroidstoßtherapie<br />
Ansprechen<br />
Remission<br />
ja nein ja nein ja nein<br />
OP?<br />
ja<br />
nein<br />
Immunsuppressiva<br />
Anti-TNF-α-Antikörper<br />
6.1.2 Colitis Crohn<br />
Patienten mit leichter bis mäßiger Krankheitsaktivität können mit Sulfasalazin<br />
oder systemisch wirksamen Glukokortikoiden behandelt werden. Bei distalem Befall<br />
können begleitend Klysmen oder Schaumpräparate mit Steroiden oder Mesalazin<br />
eingesetzt werden.<br />
Für Patienten mit hoher Krankheitsaktivität gelten dieselben Therapieprinzipien<br />
wie beim Ileozökalbefall.<br />
6.1.3 Ausgedehnter Dünndarmbefall<br />
Patienten mit ausgedehntem Dünndarmbefall sollten primär mit systemisch wirksamen<br />
Glukokortikoiden behandelt werden. Da bei diesen Patienten eine Mangelernährung<br />
droht, sollte bei mäßiger bis schwerer Krankheitsaktivität frühzeitig eine<br />
immunsuppressive Therapie nach denselben Prinzipien wie beim Ileozökalbefall eingeleitet<br />
werden. Ferner sollte frühzeitig eine enterale Ernährungstherapie in Betracht<br />
gezogen werden.<br />
P Beim ausgedehnten Dünndarmbefall<br />
frühzeitig immunsuppressive<br />
Therapie empfohlen.<br />
6.1.4 Befall von Ösophagus und Magen<br />
Bei symptomatischem Befall von Ösophagus und Magen kommen primär systemisch<br />
wirksame Glukokortikoide zum Einsatz, bei gastroduodenalem Befall additiv Protonenpumpeninhibitoren.<br />
Der frühzeitige Einsatz von Immunsuppressiva ist zu erwägen.<br />
Hierfür gelten dieselben Prinzipien wie beim Ileozökalbefall.<br />
10
6.2 Chronisch aktiver, steroidabhängiger oder steroidrefraktärer Verlauf<br />
Von Steroidabhängigkeit wird gesprochen, wenn das Steroid nicht innerhalb von<br />
4 Monaten nach Therapiebeginn vollständig ausgeschlichen werden kann, ohne dass<br />
es zu einem Rezidiv kommt oder wenn innerhalb von 3 Monaten nach Beendigung<br />
der Steroidtherapie ein Rezidiv auftritt. Steroidrefraktär ist der Verlauf, wenn trotz<br />
systemischer Steroidtherapie (mindestens 0,75 mg/kg Prednisolon-Äquivalent/Tag)<br />
über mindestens 4 Wochen eine aktive Erkrankung besteht. In diesen Fällen ist eine<br />
immunsuppressive Therapie indiziert.<br />
Medikament der ersten Wahl ist Azathioprin (Tagesdosis 2–2,5 mg/kg KG). Die Wirksamkeit<br />
beim chronisch aktiven Verlauf ist sehr gut belegt. Etwa 60–70% der Patienten<br />
erreichen mit Azathioprin eine Remission. Bei gastrointestinaler Unverträglichkeit von<br />
Azathioprin ist ein Therapieversuch mit 6-Mercaptopurin (Tagesdosis 1–1,5 mg/kg<br />
KG) gerechtfertigt, außer im Fall der Pankreatitis. Die Therapie sollte langfristig (mindestens<br />
4 Jahre) erfolgen. In seltenen Fällen kann unter Azathioprin eine schwere Leukopenie<br />
auftreten, insbesondere bei homozygoter TPMT-Defizienz (ca. 0,3% der Bevölkerung).<br />
Da die Mehrzahl der Leukopenien unter Azathioprin/6-Mercaptopurin jedoch<br />
unabhängig vom TPMT-Genotyp auftreten, wird eine routinemäßige TPMT-Bestimmung<br />
nicht empfohlen, sondern eine engmaschige Blutbildkontrolle (während der<br />
ersten 2 Monate 2-wöchentlich, danach alle 1–2 Monate).<br />
Bei Unverträglichkeit von Azathioprin/6-Mercaptopurin ist Methotrexat das Medikament<br />
der zweiten Wahl. Initial wird eine Dosis von 25 mg/Woche i.m. empfohlen; am<br />
Tag danach sollte die Gabe von Folsäure erfolgen. Mit Methotrexat kann bei ca. 40%<br />
der Patienten eine Remission induziert werden. Wird durch Methotrexat eine Remission<br />
erzielt, kann die Gabe in reduzierter Dosis (15 mg/Woche) fortgeführt werden.<br />
Die subkutane und orale Applikation ist der intramuskulären möglicherweise gleichwertig,<br />
bei oraler Applikation ist die Resorptionsrate jedoch individuell verschieden.<br />
Zur Effizienz und zu den Nebenwirkungen der langjährigen Methotrexat-Therapie<br />
gibt es bei Patienten mit CED deutlich weniger Daten als zur Azathioprin-Therapie.<br />
Bei nicht ausreichender Wirksamkeit der konventionellen Immunsuppressiva sollte<br />
die Frage einer chirurgischen Indikation geprüft werden. Besteht keine Operationsindikation,<br />
sind anti-TNF-α-Antikörper indiziert. Bei hoher Krankheitsaktivität und<br />
Notwendigkeit der raschen Remissionsinduktion können anti-TNF-α-Antikörper auch<br />
vor bzw. gleichzeitig mit den klassischen Immunsuppressiva eingesetzt werden. Zur<br />
Verfügung stehen Infliximab (5 mg/kg KG i. v.-Infusion in Woche 0, 2, 6, danach 8-wöchentlich)<br />
und Adalimumab (80/40 mg s. c. in Woche 0/2, danach 40 mg 2-wöchentlich).<br />
Initial sprechen ca. 70% der Patienten auf die anti-TNF-Therapie an und ca. 40%<br />
erreichen eine Remission. Der Wirkungseintritt erfolgt rasch, durch wiederholte Gaben<br />
werden dauerhafte Ansprechraten von ca. 40% und dauerhafte Remissionsraten<br />
von ca. 25% erreicht. Neuere Studiendaten (SONIC-Studie) zeigen, dass die Therapie<br />
mit Infliximab plus Azathioprin wirksamer ist als die alleinige Therapie mit Infliximab<br />
oder Azathioprin. Die steroidfreien Remissionsraten betrugen nach einem halben Jahr<br />
in der kombiniert behandelten Gruppe 57%, in der Infliximab-Gruppe 45% und in der<br />
Azathioprin-Gruppe 30%.<br />
P Beim steroidabhängigen und<br />
steroidrefraktären Verlauf sind<br />
Immunsuppressiva indiziert.<br />
P Immunsuppressivum der<br />
ersten Wahl ist Azathioprin.<br />
P Methotrexat ist Immunsuppressivum<br />
der zweiten Wahl.<br />
P Anti-TNF-Antikörper bei Versagen<br />
der klassischen Immunsuppressiva<br />
oder bei hoher Krankheitsaktivität.<br />
Vor dem Hintergrund der Therapiesicherheit stellt sich die Frage der Deeskalation<br />
der immunsuppressiven Therapie im Verlauf. Studiendaten zeigen, dass nach<br />
halbjähriger klinischer Remission unter Infliximab plus Azathioprin, entweder Azathioprin<br />
ohne nachteiligen Effekt gestoppt und eine Monotherapie mit Infliximab<br />
weitergeführt werden kann oder im Fall einer klinischen und endoskopischen Remission<br />
Infliximab gestoppt und eine Monotherapie mit Azathioprin weitergeführt<br />
werden kann.<br />
Für Tacrolimus und Mycophenolat-Mofetil existieren einige Berichte zum erfolgreichen<br />
Einsatz bei M. Crohn, ihre Verwendung kann jedoch nur als Einzeltherapiemaßnahme<br />
in besonderen Fällen empfohlen werden.<br />
11
Abbildung 5 zeigt den Therapiealgorithmus beim chronisch aktiven, steroidabhängigen<br />
und steroidrefraktären Verlauf.<br />
Morbus Crohn: chronisch aktiv, steroidabhängig, steroidrefraktär<br />
Abb. 5<br />
Chronisch aktiv, steroidabhängig, steroidrefraktär<br />
OP?<br />
Azathioprin/6-MP<br />
OP?<br />
Versagen/<br />
Unverträglichkeit<br />
⎧<br />
⎩<br />
OP?<br />
MTX<br />
⎫<br />
⎭<br />
Infliximab<br />
Adalimumab<br />
OP?<br />
6.3 Remissionserhaltung<br />
Die Remission des M. Crohn wird durch fehlende klinische Zeichen und Symptome<br />
der aktiven Erkrankung definiert.<br />
6.3.1 Medikamentös induzierte Remission<br />
Angesichts des Verhältnisses von Nutzen, Risiken und Kosten gibt es derzeit keine<br />
ausreichende Basis, eine remissionserhaltende Therapie bei allen Patienten durchzuführen.<br />
Für die Entscheidung zu einer remissionserhaltenden Therapie sind somit der<br />
individuelle Krankheitsverlauf, das spezifische Risikoprofil und die Patientenpräferenz<br />
ausschlaggebend.<br />
Nach erstem Schub und leichter bis mäßiger Erkrankungsaktivität kann eine<br />
Remissionserhaltung mit Mesalazin erfolgen, obwohl deren Wirksamkeit nicht sicher<br />
durch Metaanalysen bestätigt ist; für manche Patienten scheint jedoch ein Nutzen zu<br />
bestehen.<br />
Mesalazin zur Remissionserhaltung des Morbus Crohn<br />
(Metaanalyse Plazebo-kontrollierter Studien, Camma et al. 1997)<br />
Tab. 7<br />
Vorteil für Mesalazin<br />
(Differenz der Rezidivraten)<br />
Alle Studien 6,3%<br />
Nach medikamentös induzierter Remission 4,7%<br />
Nach chirurgisch induzierter Remission 13,1%*<br />
Eudragit-verkapseltes Mesalazin 8,4%*<br />
Methylzellulose-verkapseltes Mesalazin 4,6%<br />
* statistisch signifikant<br />
12
Bei Patienten mit vorausgegangenem ausgedehntem oder schwerem akutem<br />
Schub sowie bei wiederholten Schüben ist eine remissionserhaltende Therapie indiziert.<br />
Medikament der ersten Wahl zur Remissionserhaltung ist Azathioprin (Tagesdosis<br />
2–2,5 mg/kg KG) bzw. 6-Mercaptopurin (Tagesdosis 1–1,5 mg/kg KG). Medikament<br />
der zweiten Wahl bei Azathioprin-Unverträglichkeit oder Azathioprin-Versagen<br />
ist Methotrexat in einer Dosierung von 15 mg/Woche. Während für Azathioprin/<br />
6-Mercaptopurin langjährige Erfahrungen vorliegen und eine remissionserhaltende<br />
Behandlung von mindestens 4 Jahren empfohlen wird, gibt es für Methotrexat keine<br />
definitiven Empfehlungen zur Therapiedauer. In der Praxis wird man bei Wirksamkeit<br />
und guter Verträglichkeit jedoch eine längerfristige Behandlung (über 1 Jahr hinaus)<br />
durchführen.<br />
P Azathioprin ist das Medikament der<br />
ersten Wahl zur Remissionserhaltung.<br />
Bei Versagen der konventionellen Immunsuppressiva können nach Ausschluss einer<br />
operativen Indikation die anti-TNF-α-Antikörper Infliximab (wiederholte Infusionen<br />
in einer Dosierung von 5 mg/kg KG in 8-wöchigen Intervallen) oder Adalimumab<br />
(wiederholte s. c.-Gabe von 40 mg in 2-wöchigen Intervallen) zur Remissionserhaltung<br />
eingesetzt werden. Meist werden die anti-TNF-α-Antikörper bei den Patienten<br />
zur Remissionserhaltung eingesetzt, die zuvor mit diesen Substanzen eine Remisssion<br />
erreicht haben. In Studien wurden mittlerweile Remissionserhaltungen mit anti-TNFα-Antikörpern<br />
über 3 Jahre dokumentiert. Da Infliximab ein chimärer monoklonaler<br />
Antikörper ist, Adalimumab jedoch ein rein humaner monoklonaler Antikörper,<br />
können Patienten, die eine Unverträglichkeit oder einen Wirkverlust von Infliximab<br />
aufweisen, in manchen Fällen von Adalimumab profitieren.<br />
Glukokortikoide werden nicht zur Remissionserhaltung empfohlen.<br />
Probiotika sind für die Remissionserhaltung des M. Crohn wirkungslos.<br />
Eine einfache und wirkungsvolle Maßnahme zur Remissionserhaltung des M. Crohn<br />
ist die Beendigung des Rauchens. Dadurch kann die langfristige Rezidivrate des<br />
M. Crohn halbiert werden.<br />
Raucherstopp<br />
und<br />
und Verlauf des<br />
des<br />
Morbus<br />
Morbus<br />
Crohn<br />
Crohn<br />
Rezidivrisiko (%)<br />
100<br />
Stopper Nichtraucher Raucher<br />
80<br />
Abb. 6<br />
P Nichtrauchen reduziert das<br />
Rezidivrisiko.<br />
60<br />
40<br />
20<br />
0<br />
0 6 12 18 24 36 48<br />
Monate<br />
474 474 Raucher mit mit Morbus M. Crohn. Nach Beratung 59 (12%) Nichtraucher.<br />
Vergleichsgruppe: Nichtraucher mit Morbus mit M. Crohn<br />
6.3.2 Chirurgisch induzierte Remission<br />
Nach chirurgisch induzierter Remission wird keine generelle Durchführung einer remissionserhaltenden<br />
Therapie empfohlen. Die Indikation und die Wahl des anzuwendenden<br />
Medikaments erfolgt unter Berücksichtigung des individuellen Krankheitsverlaufs<br />
und des spezifischen Risikoprofils.<br />
13
Für die postoperative Remissionserhaltung erwies sich Mesalazin in einer täglichen<br />
Dosis von 3–4 g über einen Zeitraum von bis zu 3 Jahren als wirksam. Die Art der<br />
Mesalazin-Galenik scheint hierbei eine Rolle zu spielen. Mit Eudragit-verkapseltem<br />
Mesalazin konnte in einer Studie für die Gesamtpopulation der Patienten ein Vorteil<br />
erzielt werden, wobei besonders Patienten profitierten, bei denen das Kolon befallen<br />
war. In einer anderen Studie konnte mit Methylzellulose-verkapseltem Mesalazin nur<br />
bei einer Subgruppe von Patienten mit ausschließlichem Dünndarmbefall ein therapeutischer<br />
Vorteil erzielt werden.<br />
P Mesalazin ist für die postoperative<br />
Remissionserhaltung wirksam.<br />
Bei Patienten mit komplexem Verlauf wird zur postoperativen Remissionserhaltung<br />
Azathioprin/6-Mercaptopurin empfohlen. In der Praxis werden Dosierung und<br />
Therapiedauer wie nach medikamentös induzierter Remission erfolgen.<br />
6.4 Chirurgische Therapie<br />
Durch Resektion der betroffenen <strong>Darm</strong>abschnitte kann der M. Crohn nicht geheilt<br />
werden; eine Operation ist daher in der Regel erst bei Komplikationen des M. Crohn<br />
indiziert. Allerdings ist auch bei Patienten mit isoliertem symptomatischem Ileozökalbefall<br />
die Operation als Alternative zur konservativen Therapie zu erwägen. Gelegentlich<br />
führt auch eine schwere Exazerbation mit Sepsis oder die Therapierefraktärität zur<br />
Operation.<br />
P Operationen sind meist bei<br />
Komplikationen oder Therapierefraktärität<br />
indiziert.<br />
Typische Operationsindikationen sind symptomatische Stenosen, die auf eine<br />
konserva tive Therapie nicht ansprechen, sowie Kolonstenosen, deren Dignität nicht<br />
klar ist.<br />
Crohn-Fisteln erfordern eine differenzierte Indikationsstellung (siehe 6.7)<br />
6.5 Ernährungstherapie<br />
Als Folge des M. Crohn können in Abhängigkeit von Lokalisation und Krankheitsaktivität<br />
sowohl eine globale Malnutrition als auch spezifische Mangelzustände auftreten.<br />
Für die Defizite ist nicht immer die Malabsorption kausal, sondern häufig auch<br />
eine inadäquate Zufuhr, erhöhte Verluste oder ein gesteigerter Bedarf an Nährstoffen.<br />
Oft wird die durch Diarrhö, lokale Schmerzen und Übelkeit bedingte Einschränkung<br />
der Nahrungsaufnahme unterschätzt.<br />
P Ziel der Ernährungstherapie ist<br />
die Vermeidung von Malnutrition<br />
und Mangelzuständen.<br />
Bei Vorliegen einer Malnutrition ist eine Supplementierung mit einer nährstoffdefinierten<br />
Kost zu empfehlen. Hinweise, dass Elementardiäten oder Spezialprodukte<br />
einen Vorteil gegenüber hochmolekularen Standarddiäten böten, gibt es nicht.<br />
Eine enterale Ernährungstherapie ist zur alleinigen Schubtherapie nicht zu empfehlen.<br />
Sie kann jedoch additiv bei Ernährungsdefiziten eingesetzt werden sowie zur additiven<br />
Behandlung von Patienten, die im akuten Schub Ernährungsprobleme haben.<br />
Eine total parenterale Ernährung ist nur in speziellen Situationen indiziert. Dazu<br />
zählen eine hochgradige Stenose mit Subileus, ein schwerer akuter Schub mit toxischem<br />
Krankheitsbild, ferner schwere Malabsorption, z. B. beim Kurzdarmsyndrom.<br />
Eine Crohn-spezifische Ernährung gibt es nicht. Eine Diät oder Ernährungstherapie zur<br />
Remissionserhaltung ist daher nicht verfügbar.<br />
6.6 Psychotherapie<br />
Bei der Betreuung von Patienten mit M. Crohn sind psychosoziale Faktoren und die<br />
Lebensqualität der Betroffenen zu berücksichtigen. Bewältigungsstrategien haben<br />
einen Einfluss auf den Krankheitsverlauf, deshalb sollte bei maladaptivem Coping eine<br />
entsprechende psychosoziale und psychotherapeutische Unterstützung angeboten<br />
werden.<br />
P Psychotherapie ist für ausgewählte<br />
Patienten einzusetzen.<br />
14
Psychotherapie kann einen Nutzen für die Krankheitsbewältigung, die Lebensqualität<br />
und das psychische Befinden der Patienten bringen und ist bei folgenden Indikationen<br />
zu empfehlen: ungünstige Krankheitsverarbeitung, partnerschaftliche oder<br />
familiäre Konflikte, soziale Belastungssituationen (z. B. am Arbeitsplatz oder in der<br />
Schule), sozialer Rückzug, psychische Komorbidität, z. B. depressive Störung, Angst<br />
oder Persönlichkeitsstörung. Die Art der psychotherapeutischen Behandlung sollte je<br />
nach der vorhandenen Störung bzw. der individuellen Situation nach Einholung einer<br />
Fachmeinung gewählt werden.<br />
6.7 Fisteltherapie<br />
Fisteln können interenterisch, blind endend retroperitoneal, enterovesikal, enterovaginal<br />
oder enterokutan auftreten und mit entzündlichen Konglomerattumoren und<br />
Abszessen assoziiert sein. Häufig finden sich perianale Fisteln. Fisteln können durch<br />
eine antibiotische Therapie und Immunsuppressiva günstig beeinflusst werden. Für<br />
die antibiotische Behandlung kommen in erster Linie Metronidazol und/oder Ciprofloxacin<br />
infrage. Als klassische Immunsuppressiva kommen in erster Linie Azathioprin/<br />
6-Mercaptopurin, in zweiter Linie Methotrexat infrage. Wirksam sind ferner die anti-<br />
TNF-α-Antikörper Infliximab (5 mg/kg KG in Woche 0, 2, 6, danach evtl. 8-wöchentlich<br />
als Erhaltungstherapie) und Adalimumab (80/40 mg s. c. Woche 0, 2, danach 40 mg<br />
2-wöchentlich). Durch konservative Maßnahmen lässt sich häufig nur die Fistelsekretion<br />
reduzieren und ein passagerer Fistelverschluss erreichen, eine definitive Heilung<br />
ist oftmals nur durch operative Maßnahmen möglich.<br />
Bei interenterischen Fisteln besteht eine Operationsindikation nur bei Symptomatik<br />
(z. B. funktionelles Kurzdarmsyndrom). Blind endende retroperitoneale Fisteln<br />
stellen wegen der Abszessgefahr eine absolute Operationsindikation dar. Enterovesikale<br />
Fisteln stellen wegen der rezidivierenden Harnwegsinfekte mit der Gefahr der<br />
Urosepsis ebenfalls eine absolute Operationsindikation dar. Enterovaginale Fisteln<br />
stellen eine relative Operationsindikation dar. Die Indikation sollte in Abhängigkeit<br />
von der Symptomatik gestellt werden. Enterokutane Fisteln stellen ebenfalls eine<br />
relative Operationsindikation dar. Dasselbe gilt für perianale Fisteln; diese sollten<br />
nur operativ therapiert werden, wenn sie symptomatisch sind.<br />
P Fisteln und Abszesse sind häufige<br />
Komplikationen.<br />
P Die Fisteltherapie erfolgt<br />
differenziert und interdisziplinär<br />
(medikamentös bzw. operativ).<br />
Abszesse und Fistelverhalte stellen eine Indikation zur <strong>Dr</strong>ainage dar. Intraabdominelle<br />
Abszesse werden in der Regel interventionell drainiert, falls dies nicht möglich<br />
ist, operativ. Die <strong>Dr</strong>ainage ist immer nur eine präliminäre Maßnahme für weitere Diagnostik<br />
und ggf. eine weitere chirurgische Therapie. Perianale Abszesse und Fistelverhalte<br />
werden ebenfalls drainiert, ggf. wird eine Fadendrainage über längere Zeit<br />
angelegt. Bei der Behandlung von Patienten mit perianalem M. Crohn ist die gemeinsame<br />
interdisziplinäre Betreuung durch <strong>Gastro</strong>enterologe und Chirurg besonders<br />
wichtig.<br />
6.8 Therapie extraintestinaler Manifestationen und Komplikationen<br />
Arthralgien und Arthritiden, die in Assoziation mit einem Schub des M. Crohn auftreten<br />
(Typ-I-Arthritis), werden im Rahmen der Behandlung des M. Crohn therapiert.<br />
Bei der Typ-II-Arthritis werden Sulfasalazin oder Methotrexat und in refraktären<br />
Fällen anti-TNF-α-Antikörper eingesetzt. Bei chronischen peripheren Arthralgien<br />
wird eine adäquate analgetische Therapie, z. B. mit Paracetamol und Novaminsulfon,<br />
empfohlen. In Einzelfällen werden zentral wirksame Analgetika notwendig. Konventionelle<br />
unselektive NSAR sind mit einem erhöhten Risiko einer Verschlechterung des<br />
M. Crohn assoziiert. COX-2-Inhibitoren haben ein günstigeres Nebenwirkungsprofil.<br />
Celecoxib oder Etoricoxib können daher im Einzelfall zur symptomatischen Besserung<br />
eingesetzt werden. Bei Patienten mit axialer Arthritis sind anti-TNF-α-Antikörper<br />
wirksam. Die Patienten profitieren zudem von einer intensiven Physiotherapie. Für die<br />
Behandlung des Morbus Bechterew wird auf die Leitlinien der rheumatologischen<br />
Fachgesellschaft verwiesen.<br />
P Extraintestinale Manifestationen<br />
und Komplikationen erfordern<br />
spezifische Therapiekonzepte.<br />
15
Die medikamentöse Therapie des Erythema nodosum und des Pyoderma gangraenosum<br />
entspricht im Prinzip der Therapie der Grundkrankheit. Initial wird eine hoch<br />
dosierte Steroidtherapie empfohlen. Als Immunsuppressivum kommt Azathioprin infrage.<br />
Infliximab (5 mg/kg KG als einmalige Infusion) ist hochwirksam bei der Therapie<br />
des Pyoderma gangraenosum und sollte daher in allen Fällen eines schweren Pyoderma<br />
gangraenosum in Assoziation mit einem M. Crohn als primäre Therapie erwogen<br />
werden.<br />
Die Augenmanifestationen des M. Crohn sollten fachärztlich ophthalmologisch betreut<br />
werden. Bei der akuten Uveitis anterior werden topische Steroide empfohlen,<br />
zusätzlich wird eine Pupillenerweiterung zur Therapie des Spasmus sowie zur Prophylaxe<br />
von Synechien durchgeführt.<br />
Die primär sklerosierende Cholangitis (PSC) als hauptsächliche hepatobiliäre Manifestation<br />
sollte mittels einer Dauertherapie mit Ursodeoxycholsäure (15 mg/kg KG)<br />
behandelt werden. Bei nicht ausreichender Besserung der Cholestaseparameter kann<br />
die Ursodeoxycholsäure-Dosis auf 20 mg/kg KG gesteigert werden. Zusätzlich ist eine<br />
endoskopische Beurteilung und Therapie erreichbarer hochgradiger Gallengangsstenosen<br />
indiziert. Die Gefahr der Entwicklung eines cholangiozellulären Karzinoms ist<br />
zu beachten. In fortgeschrittenen Stadien ist die Lebertransplantation die Therapie<br />
der Wahl.<br />
Die Osteopenie und Osteoporose als wesentliche extraintestinale Komplikation<br />
des M. Crohn wird primär mittels Kalzium und Vitamin D behandelt. Bei manifester<br />
Osteoporose und stattgehabten Frakturen ist die zusätzliche Gabe eines Bisphosphonats<br />
indiziert.<br />
6.9 Therapie in Schwangerschaft und Stillzeit<br />
Eine Schub- oder eine remissionserhaltende Therapie sollte bei bestehender Indikation<br />
auch bei Kinderwunsch und während der Schwangerschaft durchgeführt werden.<br />
Glukokortikoide können in der Schwangerschaft zur Schubbehandlung eingesetzt<br />
werden. Für Mesalazin und Azathioprin/6-Mercaptopurin wurde in großen<br />
Beobachtungsstudien kein erhöhtes fetales und maternales Risiko nachgewiesen. Sie<br />
können daher für die remissionserhaltende Therapie in der Schwangerschaft angewendet<br />
werden. Für die anti-TNF-α-Antikörper wurden bisher keine negativen<br />
Schwangerschaftsfolgen berichtet, die Daten sind jedoch noch limitiert. Die DGVS<br />
empfiehlt daher, anti-TNF-α-Antikörper in der Schwangerschaft möglichst zu vermeiden<br />
und – falls doch notwendig – möglichst rechtzeitig vor dem errechneten Entbindungstermin<br />
zu stoppen (Infliximab 3 Monate vor dem Termin; Adalimumab wahrscheinlich<br />
entsprechend kürzer). Die amerikanische Food and <strong>Dr</strong>ug Administration<br />
(FDA) stuft anti-TNF-α-Antikörper in der Schwangerschaft allerdings als relativ sicher<br />
ein (Kategorie B; is not expected to be harmful). Methotrexat ist in der Schwangerschaft<br />
kontraindiziert und muss mindestens 3 Monate vor geplanter Schwangerschaft<br />
beendet werden.<br />
P Die Leitlinien erlauben die Gabe von<br />
Mesalazin, Glukokortikoiden, Azathioprin<br />
und – mit Einschränkungen –<br />
anti-TNF-Antikörpern in der Schwangerschaft.<br />
Methotrexat ist kontraindiziert.<br />
In der Stillzeit können Mesalazin und Glukokortikoide fortgeführt werden. Im Fall der<br />
Glukokortikoide wird zu einer 4-stündigen Stillpause nach der Einnahme geraten, da<br />
Prednison und Prednisolon in geringer Konzentration in die Muttermilch übergehen.<br />
Bei notwendiger Therapie mit Immunsuppressiva, z. B. Azathioprin oder anti-TNF-α-<br />
Antikörpern, sollte abgestillt werden.<br />
16
Zu empfehlende Literatur<br />
Literatur<br />
1 Hoffmann JC, Kroesen AJ, Klump B (Hrsg.).<br />
Chronische entzündliche <strong>Darm</strong>erkrankungen. Handbuch für Klinik und Praxis.<br />
Georg Thieme Verlag, Stuttgart, New York 2009.<br />
2 European Crohn’s and Colitis Organisation (ECCO).<br />
European evidence based consensus on the diagnosis and management of<br />
Crohn’s disease.<br />
Gut 2006; 55 (Suppl. I): i1–i58.<br />
3 Hoffmann JC, Preiß JC, Autschbach F, Buhr HJ, Häuser W, Herrlinger K, Höhne W,<br />
Koletzko S, Krieglstein CF, Kruis W, Matthes H, Moser G, Reinshagen M, Rogler G,<br />
Schreiber S, Schreyer AG, Sido B, Siegmund B, Stallmach A, Bokemeyer B, Stange EF,<br />
Zeitz, M.<br />
S3-Leitlinie „Diagnostik und Therapie des Morbus Crohn“. Ergebnisse einer Evidenzbasierten<br />
Konsensuskonferenz der Deutschen Gesellschaft für Verdauungs- und<br />
Stoffwechselkrankheiten zusammen mit dem Kompetenznetz Chronisch entzündliche<br />
<strong>Darm</strong>erkrankungen.<br />
Z <strong>Gastro</strong>enterol 2008; 46: 1094–1146.<br />
4 Baumgart DC.<br />
Diagnostik und Therapie von Morbus Crohn und Colitis ulcerosa.<br />
Dtsch Ärztebl Int 2009; 106: 123–133.<br />
5 Siegmund B, Zeitz M.<br />
Update M. Crohn.<br />
<strong>Gastro</strong>enterologie up2date 2009; 5: 195–206.<br />
6 Siegmund B, Zeitz M.<br />
Chronisch entzündliche <strong>Darm</strong>erkrankungen und Schwangerschaft.<br />
Z <strong>Gastro</strong>enterol 2009; 47: 1069–1074.<br />
17
Fragen zum Morbus Crohn<br />
Frage 1:<br />
Welchen Einfluss haben Umweltfaktoren auf den M. Crohn?<br />
w Eine Appendektomie schützt vor M. Crohn<br />
w Hygiene in der Kindheit schützt vor M. Crohn<br />
w Die Masernimpfung schützt vor M. Crohn<br />
w Nichtrauchen schützt vor M. Crohn<br />
w Orale Kontrazeptiva schützen vor M. Crohn<br />
<strong>Falk</strong><br />
<strong>Gastro</strong>-<strong>Kolleg</strong><br />
<strong>Darm</strong><br />
Frage 2:<br />
Welcher Befallstyp des M. Crohn ist am häufigsten?<br />
w Ausgedehnter Dünndarmbefall<br />
w Colitis Crohn<br />
w Ileozökaler Befall<br />
w Ösophagus/Magen<br />
w Perianaler Befall<br />
Frage 3:<br />
Welches Organsystem ist am häufigsten von extraintestinalen<br />
Manifestationen des M. Crohn betroffen?<br />
w Augen<br />
w Gefäße<br />
w Gelenke<br />
w Haut<br />
w Leber<br />
Bitte beachten Sie:<br />
Bei der Beantwortung der Fragen<br />
ist immer nur 1 Antwort möglich.<br />
Die Beantwortung der Fragen und<br />
Erlangung des Fortbildungszertifikats<br />
ist nur online möglich.<br />
Bitte gehen Sie dazu auf unsere Homepage<br />
www.falkfoundation.de.<br />
Unter dem Menüpunkt <strong>Falk</strong> <strong>Gastro</strong>-<strong>Kolleg</strong><br />
können Sie sich anmelden und die Fragen<br />
beantworten.<br />
Bitte diesen Fragebogen nicht<br />
per Post oder Fax schicken!<br />
Frage 4:<br />
Welche Methode wird neben der Sonografie primär zur<br />
Dünndarmdiagnostik empfohlen?<br />
w Computertomografie<br />
w Doppelballonenteroskopie<br />
w Dünndarmdoppelkontrast nach Sellink<br />
w Kapselendoskopie<br />
w Magnetresonanztomografie<br />
Frage 5:<br />
Welches Medikament ist erste Wahl beim leichten bis mäßig<br />
schweren Schub eines ileozökalen M. Crohn?<br />
w Azathioprin<br />
w Budesonid<br />
w Infliximab<br />
w Mesalazin<br />
w Prednisolon<br />
Wichtig:<br />
Fragebeantwortung unter<br />
www.falkfoundation.de<br />
<strong>Falk</strong> <strong>Gastro</strong>-<strong>Kolleg</strong><br />
18
Frage 6:<br />
Welche Aussage zu Azathioprin ist korrekt?<br />
w Vor Beginn einer Therapie mit Azathioprin sollte immer die TPMT-Aktivität<br />
bestimmt werden, da dadurch Blutbildkontrollen entfallen können<br />
w Die Mehrzahl der Leukopenien tritt unabhängig vom TPMT-Genotyp auf<br />
w Bei gastrointestinaler Unverträglichkeit von Azathioprin wird auch<br />
6-Mercaptopurin nicht vertragen<br />
w Azathioprin kann nach 2 Jahren abgesetzt werden, da es danach keinen<br />
Vorteil mehr bringt<br />
w Bei Versagen von Azathioprin ist 6-Mercaptopurin das Mittel der Wahl<br />
<strong>Falk</strong><br />
<strong>Gastro</strong>-<strong>Kolleg</strong><br />
<strong>Darm</strong><br />
Frage 7:<br />
Fall: 35-jähriger Mann mit M. Crohn mit ileozökalem Befall und<br />
Befall im Sigma; im laufenden Jahr bereits dreimal hoch dosiert<br />
Prednisolon wegen eines Schubs, bei Steroidreduktion unter<br />
20 mg/Tag jeweils wieder Verschlechterung. Welches Medikament<br />
würden Sie primär einsetzen?<br />
w Adalimumab<br />
w Azathioprin<br />
w Budesonid<br />
w Mesalazin<br />
w Methotrexat<br />
Frage 8:<br />
Welche Aussage zu anti-TNF-α-Antikörpern ist korrekt?<br />
w Adalimumab und Infliximab werden in 4-wöchigen Abständen subkutan<br />
verabreicht<br />
w Mit anti-TNF-α-Antikörpern werden Remissionsraten von 80% erreicht<br />
w Der Wirkungseintritt der anti-TNF-α-Antikörper ist rasch<br />
w Fisteln stellen eine Kontraindikation für anti-TNF-α-Antikörper dar<br />
w Für eine Remissionserhaltungstherapie sind anti-TNF-α-Antikörper nicht geeignet<br />
Frage 9:<br />
Welche Fisteln stellen eine absolute Operationsindikation dar?<br />
w Interenterische<br />
w Enterokutane<br />
w Enterovaginale<br />
w Enterovesikale<br />
w Perianale<br />
Frage 10:<br />
Welches Medikament ist in der Schwangerschaft kontraindiziert?<br />
w Adalimumab<br />
w Azathioprin<br />
w Infliximab<br />
w Methotrexat<br />
w Prednisolon<br />
19