1.2 Alkene - Ricki.ch
1.2 Alkene - Ricki.ch
1.2 Alkene - Ricki.ch
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
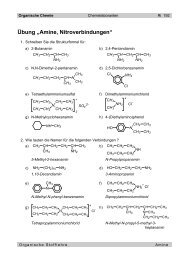
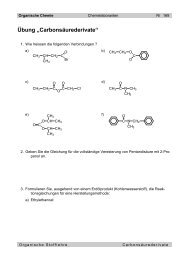
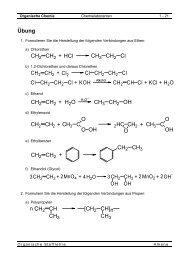
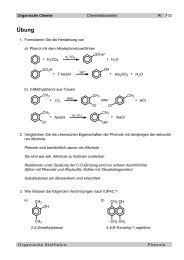
Organis<strong>ch</strong>e Chemie Chemielaboranten 1 - 12<br />
<strong>1.2</strong> <strong>Alkene</strong><br />
<strong>Alkene</strong>- und Cycloalkene sind aliphatis<strong>ch</strong>e respektive cycloaliphatis<strong>ch</strong>e,<br />
ungesÄttigte Kohlenwasserstoffe mit einer oder<br />
mehreren Doppelbindungen.<br />
Die Endung -en bezei<strong>ch</strong>net das Vorhandensein einer Doppelbindung, die Silben di-, tri- usw<br />
geben die Anzahl der Doppelbindungen im MolekÅl an.<br />
Na<strong>ch</strong> dem --Modell der Doppelbindung besteht diese aus zwei, ni<strong>ch</strong>t glei<strong>ch</strong>wertigen Bindungen:<br />
Die beiden C-Atome sind mit si<strong>ch</strong> und ihren Liganden mit je drei gewÇhnli<strong>ch</strong>en<br />
Atombindungen, sog. -Bindungen verknÅpft. Bei jedem C-Atom verbleibt aber no<strong>ch</strong> ein 4.<br />
Valenzelektron. Diese bilden eine zweiteilige Bindungselektronenwolke, eine sog. -<br />
Bindung, Åber und unter der -Bindung. Wegen ihrer zweiteiligen Gestalt ist die -Bindung<br />
s<strong>ch</strong>wÄ<strong>ch</strong>er als die -Bindung.<br />
Die beiden anderen Bindungen der beiden C-Atome liegen in einer Ebene. Dies bedeutet,<br />
dass die freie Drehbarkeit um eine Doppelbindung aufgehoben ist. Als Folge davon ist hier<br />
geometris<strong>ch</strong>e Isomerie mÇgli<strong>ch</strong>.<br />
Man findet dabei, dass trans-Isomere in der Regel stabiler sind als entspre<strong>ch</strong>ende cis-<br />
Isomere.<br />
Bei cis-Isomeren ist die rÄumli<strong>ch</strong>e We<strong>ch</strong>selwirkung, die sog.<br />
steris<strong>ch</strong>e Hinderung, vorallem zwis<strong>ch</strong>en grossen Substituenten,<br />
viel grÇsser als bei trans-Isomeren.<br />
Nomenklatur<br />
<strong>Alkene</strong> tragen die Endung -en.<br />
CH 2 CH 2 Ethen (Ethylen)<br />
O r g a n i s c h e S t o f f l e h r e<br />
A l k e n e
Organis<strong>ch</strong>e Chemie Chemielaboranten 1 - 13<br />
CH 2 CH CH 3 Propen (Propylen)<br />
Cyclohexen<br />
CH 2 CH CH 2 CH CH CH 2 CH 3 1,4-Heptadien<br />
UngesÄttigte Reste erhalten die Endung -yl.<br />
CH 2 CH Ethenyl- (Vinyl-)<br />
CH 2 CH CH 2 2-Propenyl- (Allyl-)<br />
Bei verzweigten <strong>Alkene</strong>n ist die lÄngste, unverzweigte Kette, wel<strong>ch</strong>e am meisten Doppelbindungen<br />
trÄgt, fÅr den Stammnamen verantwortli<strong>ch</strong>. Die Kette wird so numeriert, dass die<br />
Doppelbindungen eine mÇgli<strong>ch</strong>st niedrige Ziffer erhÄlt.<br />
CH 3 CH 2 CH CH 2 CH CH CH 3<br />
CH 3<br />
5-Methyl-2-hepten<br />
CH CH 2<br />
CH 3 CH CH 2 CH CH 3<br />
3,5-Dimethyl-1-octen<br />
CH 2 CH 2 CH 3<br />
CH CH 2<br />
CH 2 CH CH CH 2 CH 2 CH 3<br />
CH CH 2<br />
3-Propyl-1,4-pentadien<br />
2-Ethenyl-1,3-cyclopentadien<br />
FÅr den Fall von tri- und tetrasubstituierten <strong>Alkene</strong>n ist eine besondere Nomenklatur notwendig,<br />
um die vers<strong>ch</strong>iedenen geometris<strong>ch</strong>en Isomeren zu unters<strong>ch</strong>eiden.<br />
Man benÅtzt dazu die "Sequenzregel", na<strong>ch</strong> wel<strong>ch</strong>er alle mÇgli<strong>ch</strong>en Substituenten in eine<br />
Reihe na<strong>ch</strong> abnehmender PrioritÄt geordnet sind. Dasjenige Isomer, bei wel<strong>ch</strong>em die beiden<br />
Gruppen hÇherer PrioritÄt auf derselben Seite der Doppelbindung liegen, wird als (Z)-<br />
Isomer, das andere als (E)-Isomer bezei<strong>ch</strong>net. (Na<strong>ch</strong> der Sequenzregel ist die Reihenfolge<br />
na<strong>ch</strong> abnehmender Ordnungszahl des Atoms, als z.B. Br- vor CH 3 - vor H)<br />
CH 3<br />
H<br />
C C<br />
CH 3<br />
Br<br />
CH 3<br />
H<br />
C C<br />
Br<br />
CH 3<br />
(E)-2-Brom-2-buten<br />
(Z)-2-Brom-2-buten<br />
O r g a n i s c h e S t o f f l e h r e<br />
A l k e n e
Organis<strong>ch</strong>e Chemie Chemielaboranten 1 - 14<br />
Eigens<strong>ch</strong>aften<br />
In ihren physikalis<strong>ch</strong>en Eigens<strong>ch</strong>aften Ähneln die <strong>Alkene</strong> sehr stark den Alkanen.<br />
S<strong>ch</strong>melz- und Siedepunkte liegen etwas tiefer als die der entspre<strong>ch</strong>enden Alkane.<br />
Die Doppelbindung wirkt wie eine StÇrstelle, an der die<br />
Van der Waals-KrÄfte ni<strong>ch</strong>t wirksam sind.<br />
Ethen und Propen sind Inhalationsnarkotika. Die hÇheren <strong>Alkene</strong> sind zudem<br />
s<strong>ch</strong>leimhautrei-zend.<br />
Herstellung<br />
Cracken<br />
Die te<strong>ch</strong>nis<strong>ch</strong> wi<strong>ch</strong>tigsten <strong>Alkene</strong> werden dur<strong>ch</strong> vers<strong>ch</strong>iedene Crackverfahren hergestellt.<br />
Beim thermis<strong>ch</strong>en Cracken wird mit Wasserdampf vermis<strong>ch</strong>tes Rohbenzin in langen Rohren<br />
kurzzeitig auf Temperaturen bis 1100ÉC gebra<strong>ch</strong>t. Dabei entstehen dur<strong>ch</strong> Spaltung von C-C-<br />
Bindungen Radikale, die z.T. dur<strong>ch</strong> Wasserstoffabspaltung in <strong>Alkene</strong> Åbergehen.<br />
Beispiel: <br />
C 8 H 18 C 5 H • 11 + C 3 H 7<br />
•<br />
C 5 H • 11 C 5 H 10 + H • (Alken)<br />
C 3 H 7<br />
• + H • C 3 H 8<br />
Der Crackvorgang kann ni<strong>ch</strong>t so gesteuert werden, dass si<strong>ch</strong> ein einziges Produkt bildet.<br />
Dur<strong>ch</strong> die Wahl der Ausgangsstoffe und dur<strong>ch</strong> die Crackbedingungen kann jedo<strong>ch</strong> die Mengenverteilung<br />
beeinflusst werden.<br />
Produkte des thermis<strong>ch</strong>en Crackens von Benzin:<br />
(Alkan)<br />
Wasserstoff ca. 1 %<br />
Methan 10-15 %<br />
Ethan ca. 5 %<br />
Ethen 18-28 %<br />
Propen 15-20 %<br />
C 4 -KW (gesÄttigt und ungesÄttigt) 10-15 %<br />
C 5 -KW (gesÄttigt und ungesÄttigt) ca. 7 %<br />
Benzen ca. 5 %<br />
Toluen ca. 5 %<br />
C 8 -Aromaten ca. 5 %<br />
Ñbriges (Russ, hÇhere KW) 5-10 %<br />
O r g a n i s c h e S t o f f l e h r e<br />
A l k e n e
Organis<strong>ch</strong>e Chemie Chemielaboranten 1 - 15<br />
Elimination<br />
PrÄparativ ges<strong>ch</strong>ieht die EinfÅhrung der Doppelbindung dur<strong>ch</strong> Abspaltung von Atomen aus<br />
gesÄttigten Verbindungen, also dur<strong>ch</strong> Elimination.<br />
X Y<br />
R CH CH R<br />
R CH CH R + XY<br />
Als Ausgangsstoffe kommen in erster Linie Halogenalkane oder Alkohole in Frage. Dabei<br />
entsteht bevorzugt das am stÄrksten substituierte Alken (also in der Regel ni<strong>ch</strong>t das 1-<br />
Alken).<br />
Abspaltung von Wasser aus Alkoholen<br />
Beispiel Dehydratisierung von 2-Butanol<br />
OH<br />
CH 3 CH 2 CH CH 3<br />
H 3 PO 4 /<br />
CH 3<br />
CH CH CH 3 + H 2 O<br />
Abspaltung von Halogenwasserstoff aus Halogenalkanen<br />
Beispiel Elimination von Chlorwasserstoff aus 2-Chlorbutan<br />
OH<br />
CH 3 CH 2 CH CH 3<br />
Alkohol<br />
+ KOH CH 3 CH CH CH 3 + KCl + H 2 O<br />
Abspaltung von Halogen aus vicinalen Dihalogenalkanen<br />
Beispiel<br />
Br<br />
Br<br />
Elinination von Brom aus 1,2-Dibromcyclohexan<br />
+ Zn<br />
<br />
+ ZnBr 2<br />
Abspaltung von Wasserstoff aus Alkanen<br />
Beispiel Dehydrierungvon Ethan<br />
Cu/<br />
CH 3 CH 3 CH 2 CH 2 + H 2<br />
O r g a n i s c h e S t o f f l e h r e<br />
A l k e n e
Organis<strong>ch</strong>e Chemie Chemielaboranten 1 - 16<br />
Reaktionen<br />
Addition<br />
Es ist zu erwarten, dass bei den fÅr die <strong>Alkene</strong> <strong>ch</strong>arakteristis<strong>ch</strong>en Reaktionen die s<strong>ch</strong>wÄ<strong>ch</strong>ere<br />
-Bindung der Doppelbindung getrennt wird und dafÅr zwei neue -Bindungen gebildet<br />
werden. <strong>Alkene</strong> sind befÄhigt, andere MolekÅle an die Doppelbindung anzulagern (Addition),<br />
wobei aus einer ungesÄttigten, eine gesÄttigte Verbindung entsteht.<br />
Die ReaktionsfÄhigkeit fÅr Additionen nimmt jedo<strong>ch</strong> ab, je mehr Alkylsubstituenten die Doppelbindung<br />
besitzt:<br />
CH 2 =CH 2 > RCH=CH 2 > RCH=CHR > R 2 C=CH 2 > R 2 C=CHR > R 2 C=CR 2<br />
Addition von Wasserstoff<br />
Beispiel<br />
Hydrierung von Propen<br />
Ni<br />
CH 3 CH CH 2 + H 2<br />
CH 3 CH 2 CH 3<br />
Addition von Halogenen<br />
Die Addition von Fluor fÅhrt zum Abbau des C-GerÅstes und die Reaktion mit Iod ist aus<br />
steris<strong>ch</strong>en GrÅnden ers<strong>ch</strong>wert. Von Bedeutung sind deshalb nur die Chlorierung und die<br />
Bromierung (qualitativer Na<strong>ch</strong>weis dur<strong>ch</strong> EntfÄrbung von Bromwasser).<br />
Beispiel<br />
Bromierung von Ethen<br />
CH 2 CH 2 + Br 2 Br CH 2 CH 2 Br<br />
Addition von Halogenwasserstoff<br />
Bei der Addition von Halogenwasserstoff an <strong>Alkene</strong>, die an der Doppelbindung unsymmetris<strong>ch</strong><br />
substituiert sind, kÇnnen im Prinzip zwei vers<strong>ch</strong>iedene Produkte entstehen:<br />
R<br />
CH CH 2<br />
+<br />
H X<br />
R CHX CH 3<br />
R CH 2 CH 2 X<br />
Markownikow-Produkt<br />
Anti-Markownikow-Produkt<br />
Na<strong>ch</strong> der Regel von Markownikow wird das Halogenidion an dasjenige C-Atom addiert,<br />
wel<strong>ch</strong>es mehr Alkylgruppen trÄgt (Markownikow-Produkt).<br />
(TrÄgt die Verbindung an den Alkylresten stark polare funktionelle Gruppen oder lÄuft die<br />
Reaktion in Gegenwart von O 2 , entsteht das anti-Markownikow-Produkt.)<br />
O r g a n i s c h e S t o f f l e h r e<br />
A l k e n e
Organis<strong>ch</strong>e Chemie Chemielaboranten 1 - 17<br />
Beispiel<br />
Addition von Chlorwasserstoff an Methylpropen<br />
CH 3 CH 3<br />
+ HCl CH 3 C CH 3<br />
CH 2 C CH 3<br />
Cl<br />
Addition von Wasser<br />
Die Addition von Wasser benÇtigt die Gegenwart von SÄuren und verlÄuft na<strong>ch</strong> der<br />
Markownikow-Regel.<br />
Beispiel Hydratisierung von Propen<br />
OH<br />
CH 2 CH CH 3 + H 2 O H 3O + CH 3 CH CH 3<br />
Addition von S<strong>ch</strong>wefelsÄure<br />
Beispiel<br />
Herstellung von EthansulfonsÄure<br />
CH 2 CH 2 + H 2 SO 4 CH 3 CH 2 OSO 3 H<br />
Addition von Cyanwasserstoff<br />
Die Addition von Cyanwasserstoff verlÄuft in Gegenwart von Basen und ergibt eine KettenverlÄngerung<br />
um 1 C-Atom.<br />
Beispiel<br />
Herstellung von Methylpropannitril<br />
CH 3<br />
CH 3 CH CH 2 + HCN OH- CH 3 CH CN<br />
Polymerisation<br />
Eine der te<strong>ch</strong>nis<strong>ch</strong> wi<strong>ch</strong>tigsten Umsetzungen der niederen <strong>Alkene</strong> ist die VerknÅpfung zu<br />
einem MakromolekÅl, die dur<strong>ch</strong> eine geeignete Startersubstanz in Gang gesetzt wird. Sie<br />
liefert gewÇhnli<strong>ch</strong> FadenmolekÅle, deren Polymerisationsgrad je na<strong>ch</strong> den angewandten<br />
Reaktionsbedingungen sehr vers<strong>ch</strong>ieden ist.<br />
Beispiel<br />
Polyethylen<br />
n+2 CH 2 CH 2 CH 3 CH 2 [CH 2 CH 2 ] n CH CH 2<br />
O r g a n i s c h e S t o f f l e h r e<br />
A l k e n e
Organis<strong>ch</strong>e Chemie Chemielaboranten 1 - 18<br />
Oxidation<br />
Oxidation mit s<strong>ch</strong>wa<strong>ch</strong>en Oxidationsmitteln<br />
Die Oxidation mit s<strong>ch</strong>wa<strong>ch</strong>en Oxidationsmitteln fÅhrt zu Glycolen.<br />
Beispiel Oxidation von Propen mit KMnO 4 in alkalis<strong>ch</strong>er LÇsung<br />
OH OH<br />
KMnO<br />
CH 3 CH CH 4 /OH -<br />
2 CH 3 CH CH 2<br />
Oxidation mit PeroxysÄuren<br />
Die Oxidation von <strong>Alkene</strong>n mit PeroxysÄuren in hydroxylfreien LÇsungsmitteln (ohne OH-<br />
Gruppe) liefert isolierbare Epoxide.<br />
Beispiel<br />
Oxidation von Ethen mit PeroxyethansÄure<br />
CH 2 CH 2 + CH 3 C O O OH<br />
oxidative Spaltung mit Ozon<br />
2HC CH 2<br />
O<br />
+ CH 3 C O OH<br />
Eine zur KonstitutionsaufklÄrung von <strong>Alkene</strong>n wi<strong>ch</strong>tige Reaktion. Die Doppelbindung wird<br />
aufgespalten und es entstehen von der Lage der Doppelbindung abhÄngige Carbonylverbindungen<br />
(Aldehyde, Ketone), die lei<strong>ch</strong>t zu isolieren und zu identifizieren sind.<br />
Beispiel<br />
Oxidative Spaltung von 2-Methyl-2-buten<br />
CH 3<br />
O<br />
C CH CH 3<br />
CH 3 H<br />
3<br />
C O + C CH 3<br />
CH 3 CH 3 O<br />
Verwendung<br />
<strong>Alkene</strong> sind aufgrund ihrer guten ReaktionsfÄhigkeit Ausgangssubstanzen fÅr zahlrei<strong>ch</strong>e<br />
Synthesen). Ethen ist einer der wi<strong>ch</strong>tigsten Rohstoffe der <strong>ch</strong>emis<strong>ch</strong>en Industrie.<br />
Beispiele<br />
Kunststoffe (Polymerisate)<br />
Alkohole ( Aldehyde, CarbonsÄuren)<br />
Halogenalkane<br />
Epoxide (Epoxidharze, Polyester)<br />
SulfonsÄuren ( Was<strong>ch</strong>aktive Stoffe)<br />
O r g a n i s c h e S t o f f l e h r e<br />
A l k e n e
Organis<strong>ch</strong>e Chemie Chemielaboranten 1 - 19<br />
Polyene<br />
Polyene enthalten mehrere Doppelbindungen.<br />
FÅr das <strong>ch</strong>emis<strong>ch</strong>e Verhalten der Polyene ist die gegenseitige Lage der Doppelbindungen<br />
massgebend. Man unters<strong>ch</strong>eidet:<br />
kumulierte Doppelbindungen<br />
Die Doppelbindungen folgen si<strong>ch</strong> unmittelbar.<br />
1,2-Propadien ist der einfa<strong>ch</strong>ste Vertreter dieses Bindungstyps. Es ist kein planares (ebenes)<br />
MolekÅl: Die beiden Methylgruppen liegen in zwei zueinander senkre<strong>ch</strong>t stehenden<br />
Ebenen, wobei das mittlere C-Atom in deren S<strong>ch</strong>nittpunkt liegt.<br />
H<br />
H<br />
C C C<br />
H<br />
H<br />
Wegen den stark vom Tetraedermodell abwei<strong>ch</strong>enden Bindungswinkeln ist das MolekÅl<br />
stark gespannt und lagert si<strong>ch</strong> lei<strong>ch</strong>t zum Propin um.<br />
CH 2 C CH 2 CH 3 C CH<br />
konjugierte Doppelbindungen<br />
Die Doppelbindungen sind dur<strong>ch</strong> genau eine Einfa<strong>ch</strong>bindung<br />
getrennt.<br />
Konjugierte Doppelbindungen stehen miteinander in We<strong>ch</strong>selwirkung. Dies zeigt si<strong>ch</strong> darin,<br />
dass die Einfa<strong>ch</strong>bindung zwis<strong>ch</strong>en den Doppelbindungen kÅrzer ist als eine gewÇhnli<strong>ch</strong>e<br />
und dass die freie Drehbarkeit aufgehoben ist (Bildung von Konformeren).<br />
Eine ErklÄrung dafÅr findet si<strong>ch</strong> in der Delokalisation der -Bindungen. Die -Elektronen<br />
der Doppelnbindungen treten miteinander in We<strong>ch</strong>selwirkung und bilden Elektronenwolken,<br />
die Åber das ganze konjugierte System verteilt sind (Mesomerie).<br />
O r g a n i s c h e S t o f f l e h r e<br />
A l k e n e
Organis<strong>ch</strong>e Chemie Chemielaboranten 1 - 20<br />
Konjugierte Systeme sind stabiler als unkonjugierte mit der glei<strong>ch</strong>en Anzahl Doppelbindungen.<br />
Bei Additionsreaktionen an konjugierte Diene erhÄlt man neben den Produkten der<br />
gewÇhnli<strong>ch</strong>en 1,2-Addition au<strong>ch</strong> 1,4-Additionsprodukte, die oft mengenmÄssig Åberwiegen.<br />
1,4-Addition<br />
Beispiel<br />
Addition von Brom an 1,3-Butadien<br />
CH 2 CH CH CH 2 + Br 2 Br CH 2 CH CH CH 2 Br<br />
1,4-Polymerisation<br />
Beispiel<br />
Polymerisation von Isopren (Methylbutadien) zu Naturkauts<strong>ch</strong>uk<br />
n CH 2 CH C CH 2<br />
CH 3<br />
[CH 2 CH C CH 2 ]n<br />
CH 3<br />
isolierte Doppelbindungen<br />
Die Doppelbindungen sind dur<strong>ch</strong> mehr als eine Einfa<strong>ch</strong>bindung<br />
getrennt.<br />
Isolierte Doppelbindungen beeinflussen einander ni<strong>ch</strong>t. Sol<strong>ch</strong>e Polyene verhalten si<strong>ch</strong> <strong>ch</strong>emis<strong>ch</strong><br />
wie <strong>Alkene</strong>.<br />
O r g a n i s c h e S t o f f l e h r e<br />
A l k e n e