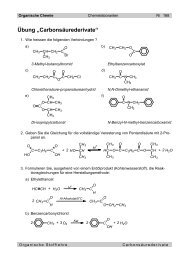
1.3. Alkine - Ricki.ch
1.3. Alkine - Ricki.ch
1.3. Alkine - Ricki.ch
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
Organis<strong>ch</strong>e Chemie<br />
Chemielaboranten<br />
Ri 51<br />
<strong>1.3.</strong> <strong>Alkine</strong><br />
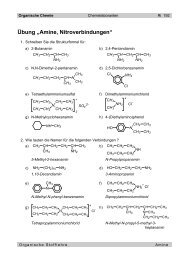
<strong>Alkine</strong> sind aliphatis<strong>ch</strong>e, ungesÄttigte Kohlenwasserstoffe<br />
die eine oder mehrere Dreifa<strong>ch</strong>bindungen aufweisen.<br />
Allgemeine Summenformel der Monoalkine:<br />
CnH2n-2<br />
<strong>Alkine</strong> sind gestreckte MolekÄle. Im --Modell besteht eine Dreifa<strong>ch</strong>bindung aus einer -<br />
Bindung und aus zwei -Bindungen, die in senkre<strong>ch</strong>t zueinander stehenden Ebenen angeordnet<br />
sind. Die -Bindungen Äberlappen si<strong>ch</strong> gegenseitig, sodass eine zylindris<strong>ch</strong>e Elektronenverteilung<br />
um die C-C-A<strong>ch</strong>se entsteht.<br />
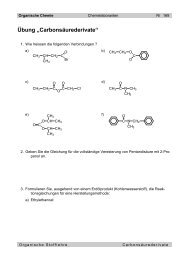
Nomenklatur<br />
Es gelten die glei<strong>ch</strong>en Regeln wie fÄr die Alkene, mit dem Unters<strong>ch</strong>ied, dass die Endung -in<br />
an den Stamm gehÅngt wird.<br />
CH CH<br />
CH 3<br />
CH 2<br />
CH 2<br />
CH 2<br />
CH 2<br />
C CH<br />
Ethin (Acetylen)<br />
1-Heptin<br />
CH 3 C C CH CH 3<br />
CH 3<br />
4-Methyl-2-pentin<br />
Bei glei<strong>ch</strong>zeitig vorkommenden Doppel- und Dreifa<strong>ch</strong>bindungen bildet die lÅngste unverzweigte<br />
Kette mit der hÇ<strong>ch</strong>sten Anzahl Mehrfa<strong>ch</strong>bindungen den Stamm. Dem Namen des<br />
entspre<strong>ch</strong>enden Alkens wird die Endung -in angefÄgt. Den Mehrfa<strong>ch</strong>bindungen werden die<br />
niedrigst mÇgli<strong>ch</strong>en Ziffern zugeordnet.<br />
CH C CH 2 CH CH CH 2 CH 3 4-Hepten-1-in<br />
CH 3 CH 2 CH 2 CH 2 CH 2<br />
C C C CH 2 CH CH 2<br />
4-Pentyl-4-propyl-<br />
CH 3<br />
CH 2 CH 2 CH 3<br />
1-hepten-5-in<br />
Wenn vers<strong>ch</strong>iedene glei<strong>ch</strong>wertige NumerierungsmÇgli<strong>ch</strong>keiten zur VerfÄgung stehen, erhalten<br />
die Doppelbindungen niedrigere Ziffern als die Dreifa<strong>ch</strong>bindungen.<br />
CH C CH CH CH CH 2<br />
1,3-Hexadien-5-in<br />
O r g a n i s c h e S t o f f l e h r e<br />
A l k i n e
Organis<strong>ch</strong>e Chemie<br />
Chemielaboranten<br />
Ri 52<br />
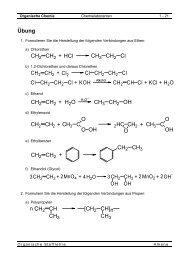
Eigens<strong>ch</strong>aften<br />
<strong>Alkine</strong> haben sehr Åhnli<strong>ch</strong>e Eigens<strong>ch</strong>aften wie Alkane und Alkene. Sie sind lipophil und<br />
unpo-lar. Die S<strong>ch</strong>melz- und Siedepunkte liegen etwas hÇher. Bei Raumtemperatur sind nur<br />
Ethin und Propin gasig. Ab etwa C 15 sind die Homologen fest.<br />
<strong>Alkine</strong> zeigen bei hÇheren Konzentrationen narkotisierende Wirkung.<br />
Herstellung<br />
<strong>Alkine</strong> kommen in der Natur ni<strong>ch</strong>t vor. <strong>Alkine</strong> entstehen in erster Linie als Nebenprodukte<br />
der ErdÇlveredlung (Cracken).<br />
PrÅparativ kÇnnen die <strong>Alkine</strong> wie die Alkene dur<strong>ch</strong> Eliminationen erhalten werden.<br />
Elimination von Halogenwasserstoff aus vic-Dihalogen-KW<br />
Beispiel<br />
Cl Cl<br />
CH 3 CH CH 2<br />
Elimination von Chlorwasserstoff aus 1,2-Di<strong>ch</strong>lorpropan<br />
+ 2 KOH Alkohol CH 3 C CH + 2 KCl + 2 H 2 O<br />
Elimination von Halogen aus Tetrahalogenalkanen<br />
Beispiel Herstellung von 2-Butin<br />
Cl Cl<br />
CH 3 C C CH 3<br />
+ 2 Zn CH 3 C C CH 3<br />
+ 2 ZnCl 2<br />
Cl Cl<br />
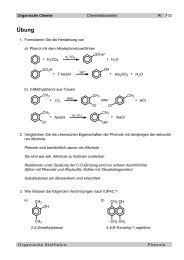
Reaktionen<br />
Additionsreaktionen<br />
Dreifa<strong>ch</strong>bindungen addieren ni<strong>ch</strong>t lei<strong>ch</strong>ter als Doppelbindungen.<br />
Dur<strong>ch</strong> die kleinere BindungslÄnge werden die Bindungselektronen<br />
von den C-AtomrÅmpfen stÄrker gebunden.<br />
O r g a n i s c h e S t o f f l e h r e<br />
A l k i n e
Organis<strong>ch</strong>e Chemie<br />
Chemielaboranten<br />
Ri 53<br />
An CC-Bindungen kÇnnen jeweils zwei Mol Reagens addiert werden. Dur<strong>ch</strong> geeignete<br />
Wahl der Bedingungen ist es aber au<strong>ch</strong> mÇgli<strong>ch</strong>, die Addition nur bis zur Stufe der Doppelbindung<br />
zu fÄhren.<br />
Beispiel Hydrierung von Ethin zu Ethan<br />
CH CH + 2 H 2<br />
Pt<br />
CH 3 CH 3<br />
Beispiel<br />
Addition von 1 Mol Brom an Propin<br />
CH 3 C CH + Br 2<br />
CH 3<br />
C C Cl<br />
Cl H<br />
E/Z-Isomerie<br />
Beispiel<br />
Addition von 1 Mol Bromwasserstoff an Propin<br />
Br<br />
CH 3 C CH + HBr CH 3 C CH 2<br />
Markownikow<br />
Beispiel Addition von Wasser an Propin<br />
OH<br />
CH 3 C CH + H 2 O H 3O + CH 3 C CH 2<br />
Das instabile 2-Propenol lagert sofort zum 2-Propanon um (tautomere Umlagerung).<br />
OH<br />
CH 3 C CH 2<br />
Enolform<br />
O<br />
CH 3 C CH 3<br />
Ketoform<br />
Salzbildung<br />
<strong>Alkine</strong> haben die Eigens<strong>ch</strong>aft, das an das C-Atom einer Dreifa<strong>ch</strong>bindung gebundene H-Atom<br />
als Proton abspalten zu kÇnnen (die SÅurestÅrke liegt zwis<strong>ch</strong>en Wasser und Ammoniak).<br />
Sie reagieren mit starken Basen und bilden ionis<strong>ch</strong>e Verbindungen: Acetylide.<br />
R C CH + OH - R C C - + H 2 O<br />
Die s<strong>ch</strong>werlÇsli<strong>ch</strong>en S<strong>ch</strong>wermetallacetylide sind in trockenem Zustand sehr unbestÅndig und<br />
explosiv.<br />
O r g a n i s c h e S t o f f l e h r e<br />
A l k i n e
Organis<strong>ch</strong>e Chemie<br />
Chemielaboranten<br />
Ri 54<br />
Verwendung<br />
Verwendung finden <strong>Alkine</strong> vorallem als Ausgangssubstanzen fÄr zahlrei<strong>ch</strong>e Synthesen. Ihre<br />
grosste<strong>ch</strong>nis<strong>ch</strong>e Bedeutung ist allerdings stark zurÄckgegangen, da wi<strong>ch</strong>tige Grundstoffe<br />
heute aus billigeren Alkenen hergestellt werden.<br />
wi<strong>ch</strong>tige Vertreter<br />
Ethin<br />
Ethin ist das weitaus wi<strong>ch</strong>tigste Alkin. Es ist ein farbloses, angenehm rie<strong>ch</strong>endes Gas, mit<br />
narkotisierender Wirkung. Ho<strong>ch</strong>reines Ethin wurde frÄher als Narkotikum eingesetzt, wegen<br />
der Explosionsgefahr aber wieder aufgegeben.<br />
Beim Erhitzen oder unter DruckerhÇhung zerfÅllt Ethin exotherm in seine Elemente.<br />
/p<br />
HC CH 2 C + H 2 kJ<br />
Ethin wird deshalb in Druckflas<strong>ch</strong>en aufbewahrt, die mit Aceton getrÅnktes Kieselgur enthalten,<br />
in wel<strong>ch</strong>em das Ethin gelÇst ist.<br />
Die Verbrennung von Ethin liefert sehr viel Energie. Die hohe VerbrennungswÅrme wird zum<br />
S<strong>ch</strong>weissen ausgenÄtzt. Mis<strong>ch</strong>ungen mit Luft sind mit weit auseinander liegenden Explosionsgrenzen<br />
(3 bis 70 %) Åusserst explosiv.<br />
2 C 2 H 2 + 5 O 2 4 CO 2 + 2 H 2 O H = -2612 kJ<br />
FrÄher wurde Ethin auss<strong>ch</strong>liessli<strong>ch</strong> aus Calciumcarbid und Wasser hergestellt.<br />
Calciumcarbid entsteht im Li<strong>ch</strong>tbogen aus Koks und gebranntem Kalk. So hergestelltes<br />
Ethin enthÅlt Phos-phorwasserstoff und ist deshalb toxis<strong>ch</strong> und hat einen Äblen Geru<strong>ch</strong>.<br />
CaO + 3 C CaC 2 + CO<br />
CaC 2 + 2 H 2 O C 2 H 2 + Ca(OH) 2<br />
Die Gewinnung erfolgt heute vorwiegend aus Methan im Li<strong>ch</strong>tbogen. Die Reaktionsprodukte<br />
mÄssen sofort mit Wasser abges<strong>ch</strong>reckt werden, da sonst das Ethin zu Russ und Wasserstoff<br />
zerfÅllt.<br />
1400ÄC<br />
CH 4 C 2 H 2 + 3 H 2<br />
O r g a n i s c h e S t o f f l e h r e<br />
A l k i n e
Organis<strong>ch</strong>e Chemie<br />
Chemielaboranten<br />
Ri 55<br />
Verwendung findet Ethin vorallem als S<strong>ch</strong>weissgas. Bis vor wenigen Jahren war es no<strong>ch</strong><br />
Haupausgangsstoff fÄr viele <strong>ch</strong>emis<strong>ch</strong>e Grundstoffe wie EssigsÅure, Aceton, Acetaldehyd,<br />
Acrylnitril, Tri<strong>ch</strong>lorethen ....<br />
Dur<strong>ch</strong> Reaktion von Halogenalkanen mit Natriumacetylid kÇnnen hÇhere <strong>Alkine</strong> hergestellt<br />
werden.<br />
HC C - Na + + Br CH 2 CH 3<br />
HC C CH 2 CH 3 + NaBr<br />
O r g a n i s c h e S t o f f l e h r e<br />
A l k i n e