Acetylsalicylsäure (Aspirin®) Organische Chemie - Adam Vollmer
Acetylsalicylsäure (Aspirin®) Organische Chemie - Adam Vollmer
Acetylsalicylsäure (Aspirin®) Organische Chemie - Adam Vollmer
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
2.7.1<br />
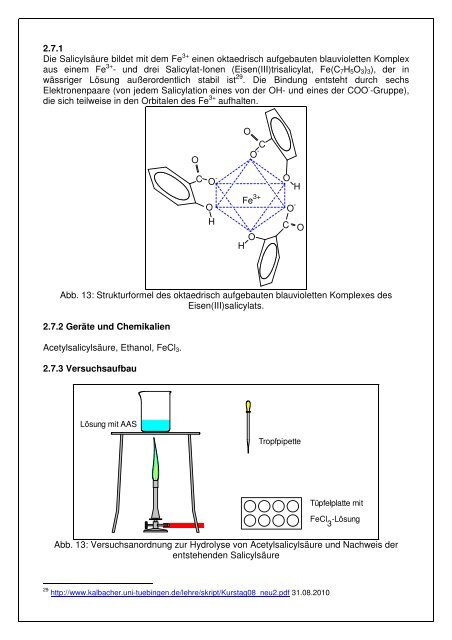
Die Salicylsäure bildet mit dem Fe 3+ einen oktaedrisch aufgebauten blauvioletten Komplex<br />
aus einem Fe 3+ - und drei Salicylat-Ionen (Eisen(III)trisalicylat, Fe(C 7 H 5 O 3 ) 3 ), der in<br />
wässriger Lösung außerordentlich stabil ist 29 . Die Bindung entsteht durch sechs<br />
Elektronenpaare (von jedem Salicylation eines von der OH- und eines der COO - -Gruppe),<br />
die sich teilweise in den Orbitalen des Fe 3+ aufhalten.<br />
O<br />
O<br />
O -<br />
C<br />
C<br />
O -<br />
O<br />
H<br />
O<br />
H<br />
H<br />
Fe 3+<br />
O<br />
C<br />
O -<br />
O<br />
Abb. 13: Strukturformel des oktaedrisch aufgebauten blauvioletten Komplexes des<br />
Eisen(III)salicylats.<br />
2.7.2 Geräte und Chemikalien<br />
Acetylsalicylsäure, Ethanol, FeCl 3 .<br />
2.7.3 Versuchsaufbau<br />
Lösung mit AAS<br />
Tropfpipette<br />
Tüpfelplatte mit<br />
FeCl 3<br />
-Lösung<br />
Abb. 13: Versuchsanordnung zur Hydrolyse von Acetylsalicylsäure und Nachweis der<br />
entstehenden Salicylsäure<br />
29 http://www.kalbacher.uni-tuebingen.de/lehre/skript/Kurstag08_neu2.pdf 31.08.2010