LOS SILICATOS Y SU ESTRUCTURA.
LOS SILICATOS Y SU ESTRUCTURA.
LOS SILICATOS Y SU ESTRUCTURA.
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
<strong>LOS</strong> <strong>SILICATOS</strong> Y <strong>SU</strong> <strong>ESTRUCTURA</strong>.<br />
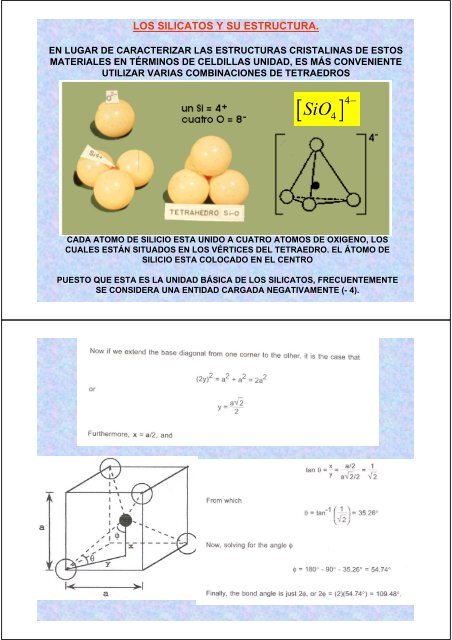
EN LUGAR DE CARACTERIZAR LAS <strong>ESTRUCTURA</strong>S CRISTALINAS DE ESTOS<br />
MATERIALES EN TÉRMINOS DE CELDILLAS UNIDAD, ES MÁS CONVENIENTE<br />
UTILIZAR VARIAS COMBINACIONES DE TETRAEDROS<br />
[ ] 4<br />
SiO4 −<br />
CADA ATOMO DE SILICIO ESTA UNIDO A CUATRO ÁTOMOS DE OXIGENO, <strong>LOS</strong><br />
CUALES ESTÁN SITUADOS EN <strong>LOS</strong> VÉRTICES DEL TETRAEDRO. EL ÁTOMO DE<br />
SILICIO ESTA COLOCADO EN EL CENTRO<br />
PUESTO QUE ESTA ES LA UNIDAD BÁSICA DE <strong>LOS</strong> <strong>SILICATOS</strong>, FRECUENTEMENTE<br />
SE CONSIDERA UNA ENTIDAD CARGADA NEGATIVAMENTE (- 4).
GRUPOS DE <strong>SILICATOS</strong><br />
SEGÚN EL TIPO DE <strong>ESTRUCTURA</strong>, <strong>LOS</strong> <strong>SILICATOS</strong> PUEDEN<br />
DIVIDIRSE EN SEIS GRUPOS DEPENDIENDO DEL NÚMERO DE<br />
OXÍGENOS DEL TETRAEDRO DE SILICIO QUE ESTÁN UNIDOS<br />
DIRECTAMENTE A OTROS TETRAEDROS DE SILICIO VECINOS (ES<br />
DECIR, SEGÚN EL NÚMERO DE VÉRTICES COMPARTIDOS POR<br />
TETRAEDROS, QUE PUEDEN SER 0, 1, 2, 3, y 4):
Esta subclase de silicatos es poco numerosa, comprende pocas especies<br />
minerales que se caracterizan en que tienen un radical estructural de orden<br />
superior al de los nesosilicatos formados por la agrupación de dos tetraedros que<br />
se unen compartiendo un vértice dando lugar a radicales (Si 2 O 7 ) 6- , este radical<br />
doble puede coexistir en la estructura de los sorosilicatos con tetraedros aislados<br />
SiO 4 y los dos tipos de radicales están neutralizados y unidos ente si por<br />
cationes. Los minerales más importantes de esta subclase son minerales cálcicos<br />
que son la vesubiana y el grupo de la epidota.
Cada SiO 4 comparte dos<br />
oxígenos con los silicios de<br />
los tetraedros vecinos.<br />
La mitad de los átomos de silicio<br />
comparten tres oxígenos con los<br />
vecinos y la otra mitad sólo dos<br />
[Si 4 O 11 ] 6-
(Si 2O 5) -
GRUPOS DE <strong>SILICATOS</strong><br />
A.- NESO<strong>SILICATOS</strong>, TETRAEDROS INDEPENDIENTES<br />
B.- SORO<strong>SILICATOS</strong>, TETRAEDROS EN PAREJAS<br />
C.- CIC<strong>LOS</strong>ILICATOS, TETRAEDROS EN ANIL<strong>LOS</strong><br />
GRUPOS DE <strong>SILICATOS</strong><br />
D.- INO<strong>SILICATOS</strong>, TETRAEDROS FORMANDO CADENAS SENCILLAS O DOBLES
GRUPOS DE <strong>SILICATOS</strong><br />
E.- FI<strong>LOS</strong>ILICATOS, TETRAEDROS FORMANDO CAPAS LAMINARES
FI<strong>LOS</strong>ILICATOS. ARCILLAS.<br />
LAS ARCILLAS SON “ROCAS” O MATERIALES TERROSOS FORMADAS<br />
PRINCIPALMENTE POR ALUMINO<strong>SILICATOS</strong> HIDRATADOS CON MATERIA<br />
COLOIDAL Y TROZOS DE FRAGMENTOS DE ROCAS, QUE GENERALMENTE<br />
SE HACEN PLÁSTICAS CUANDO ESTÁN HÚMEDAS Y PÉTREAS POR<br />
LA ACCIÓN DEL FUEGO.<br />
LA FABRICACIÓN TIENE <strong>SU</strong> FUNDAMENTO EN LA PLASTICIDAD O<br />
CAPACIDAD DE MOLDEO POR DEFORMACIÓN PLÁSTICA QUE TIENEN LAS<br />
ARCILLAS SEGÚN <strong>SU</strong> CONTENIDO DE AGUA. UNA VEZ CONFORMADAS LAS<br />
PIEZAS, POR DESECACIÓN Y COCCIÓN SE PRODUCEN LAS<br />
TRANSFORMACIONES IRREVERSIBLES QUE LE DAN CARÁCTER PÉTREO.<br />
ESTAS PROPIEDADES DAN A LAS ARCILLAS <strong>SU</strong> UTILIDAD, PUESTO QUE SE<br />
LES PUEDE MOLDEAR EN CASI TODAS LAS FORMAS, LAS CUALES<br />
CONSERVAN DESPUÉS DE SER SOMETIDAS A LA ACCIÓN DEL FUEGO.
FI<strong>LOS</strong>ILICATOS. ARCILLAS<br />
<strong>LOS</strong> ALUMINO<strong>SILICATOS</strong> HIDRATADOS POSEEN UNA <strong>ESTRUCTURA</strong> LAMINAR O DE<br />
CAPAS Y <strong>SU</strong>ELEN ESTAR ACOMPAÑADOS DE OTROS MINERALES DENOMINADOS<br />
“ACCESORIOS” ENTRE <strong>LOS</strong> QUE PODEMOS CITAR CUARZO, CALCITA, ÓXIDOS Y<br />
<strong>SU</strong>LFUROS DE HIERRO, YESO, RUTILO (TiO 2 ), ILMENITA (FeTiO 3 ), DOLOMITA,<br />
ÁLCALIS (QUE SE DERIVAN PRINCIPALMENTE DE LAS MICAS Y FELDESPATOS,<br />
AUNQUE PARTE SE DEBE AL INTERCAMBIO CATIÓNICO DE LAS PROPIAS<br />
ARCILLAS), MATERIA ORGÁNICA, ETC.<br />
Sustancias presentes en la naturaleza junto con la arcilla:<br />
-SO 4Ca·2H 20 (piedra de yeso)<br />
-CaCO 3 (carbonato cálcico)<br />
-Fe(OH) 3 (hidróxido férrico)<br />
-Fe 2O 3 (óxido férrico)<br />
-SiO 2 (cuarzo)<br />
-TiO 2 (rutilo)<br />
-FeTiO 3 (ilmenita)<br />
1.- PLANOS CONSTITUIDOS POR ÁTOMOS, TALES COMO O Y OH<br />
2.-CAPAS, TETRAÉDRICAS U OCTAÉDRICAS, FORMADAS POR UNA<br />
COMBINACIÓN O APILAMIENTO DE PLANOS<br />
3.- EL APILAMIENTO DE CAPAS DA LUGAR A LA FORMACION DE LAMINAS<br />
TO: BILAMINAR , TOT: TRILAMINAR , TOTO: CLORITAS<br />
4.- CRISTAL, QUE ES EL RE<strong>SU</strong>LTADO DE UN APILAMIENTO DE LAMINAS EN<br />
LA DIRECCIÓN CRISTALOGRÁFICA c MAS EL ESPACIO INTERLAMINAR<br />
<strong>ESTRUCTURA</strong><br />
GENERAL DE <strong>LOS</strong><br />
FI<strong>LOS</strong>ILICATOS
<strong>ESTRUCTURA</strong><br />
GENERAL DE <strong>LOS</strong><br />
FI<strong>LOS</strong>ILICATOS<br />
Composición química de los minerales de<br />
la arcilla<br />
(O 2- ) y (OH) - son los aniones que forman parte de la estructura.<br />
En los huecos que forman sus apilamientos de planos, se<br />
sitúan sit an los cationes, de dimensiones mucho menores.<br />
La coordinación coordinaci n de cada catión cati n está est determinada por su<br />
radio iónico. i nico.<br />
- (Si) 4+ Ocupa huecos de coordinación coordinaci n tetraédrica. tetra drica.<br />
- (Al) 3+ Puede ocupar huecos octaédricos octa dricos ó sustituir al Si en<br />
coordinación coordinaci n tetraédrica. tetra drica.<br />
- (Mg<br />
Mg) 2+<br />
2+ , (Fe) 2+ , (Fe) 3+ ... Ocupan huecos de coordinación coordinaci n octaédrica octa drica<br />
- (K) + , (Na ( Na) + , (Ca ( Ca) 2+ . Ocupan posiciones en el espacio interlaminar.<br />
interlaminar
Están constituidos por una capa indefinida de tetraedros que comparten tres de<br />
sus vértices de forma que quedan en un mismo plano. Se presenta en forma de<br />
una red hexagonal regular en la que la relación Silicio/Oxigeno es de 2/5.<br />
En el plano definido por el cuarto vértice de cada tetraedro se ubica un<br />
grupo OH en el centro del hexagono definido por los oxígenos<br />
tetraédricos.<br />
El tamaño del triángulo entre los dos oxígenos y un (OH) es aproximadamente el<br />
mismo (pero no idéntico a la cara triangular de un octaedro XO 6 (en donde X es<br />
comúnmente Mg o Al). Esto significa que es posible enlazar a una red regular de<br />
oxígenos apicales y grupos OH de composición (Si 2 O 5 OH) 3- una lámina de<br />
octaedros regulares, donde cada octaedro está inclinado sobre uno de sus lados<br />
triangulares<br />
Están constituidos por una capa indefinida de tetraedros que comparten tres de sus<br />
vértices de forma que quedan en un mismo plano. Se presenta en forma de una red<br />
hexagonal regular en la que la relación Silicio/Oxigeno es de 2/5.<br />
En el plano definido por el cuarto vértice de cada tetraedro se ubica un grupo OH en el<br />
centro del hexagono definido por los oxígenos tetraédricos. Este grupo OH y dos oxígenos<br />
del hexagono, forman un triángulo sobre el que se apoya un octaedro cuyos otros tres<br />
vértices se sitúan en un plano inferior, y están constituidos por grupos OH que pertenecen<br />
a una capa hexagonal centrada, o bien por un grupo OH y dos oxígenos, correspondientes<br />
a una capa tetraédrica análoga a la primera y situada especularmente con ella. Los huecos<br />
octaédricos pueden estar ocupados por Al o por Mg<br />
(O 2- ) y (OH) - son los aniones que forman parte de la estructura. En los huecos<br />
que forman sus apilamientos de planos,se sitúan sit an los cationes, de dimensiones<br />
mucho menores.
Este grupo OH y dos oxígenos del hexagono, forman un triángulo sobre el que<br />
se apoya un octaedro cuyos otros tres vértices se sitúan en un plano inferior,<br />
y están constituidos por grupos OH que pertenecen a una capa hexagonal<br />
centrada, o bien por un grupo OH y dos oxígenos, correspondientes a una capa<br />
tetraédrica análoga a la primera y situada especularmente con ella. Los huecos<br />
octaédricos pueden estar ocupados por Al o por Mg<br />
"capa compacta<br />
Cada cavidad está limitada<br />
por seis esferas y por ello a<br />
esta capa la vamos a<br />
denominar, "capa hexagonal"<br />
o "no compacta".<br />
El apilamiento de dos capas compactas, define agrupaciones de 6 esferas cuyos<br />
vértices forman un octaedro. Es la coordinación octaédrica o de 6 aniones<br />
El apilamiento de una capa hexagonal y de una capa compacta, define<br />
una serie de agrupaciones de 4 esferas cuyos vértices forman un<br />
tetraedro. Es la coordinación tetraédrica o de 4 aniones.
En todos los filosilicatos, el silicio y el aluminio pueden ocupar los<br />
puestos de coordinación tetraédrica (entre una capa hexagonal y una<br />
capa compacta), y el aluminio, magnesio y hierro son los que<br />
normalmente ocupan los puestos de coordinación octaédrica. ( entre<br />
dos capas compactas)<br />
Las capas hexagonales están formadas por átomos de oxígeno; las<br />
capas compactas por O y (OH) o por (OH) exclusivamente. La estabilidad<br />
de la hoja queda asegurada por las cargas positivas de los iones<br />
alojados en las cavidades citadas<br />
Así, los filosilicatos están formados por apilamientos de capas<br />
hexagonales y de capas compactas, presentando los principales grupos<br />
de minerales un número constante de estas capas cuyo conjunto se<br />
denomina "hoja". El espesor de dicha hoja es una de las características<br />
del mineral<br />
FI<strong>LOS</strong>ILICATOS. ARCILLAS
CAPA TETRAEDRICA<br />
FI<strong>LOS</strong>ILICATOS. ARCILLAS<br />
La hoja tetraédrica tiene simetría hexagonal, observándose los anillos<br />
de seis oxígenos y todos los oxígenos apicales no compartidos (con<br />
una valencia libre), se encuentran en un mismo plano orientados en la<br />
misma dirección.<br />
El Si 4+ del centro de los tetraedros, puede ser reemplazado - al menos<br />
en parte - isomórficamente por Al 3+ ya que presentan un radio iónico<br />
parecido y la estructura no se altera en forma significativa. Cuando<br />
ocurre este tipo de sustitución (sustitución isomórfica), la lámina<br />
tetraédrica se descompensa eléctricamente pues existen cargas<br />
negativas de los oxígenos que quedan sin compensar o dicho de otra<br />
manera, existe déficit de cargas positivas.<br />
TRES DE <strong>LOS</strong> CUATRO OXIGENOS DE CADA TETRAEDRO SiO 4 ESTAN<br />
COMPARTIDOS CON TETRAEDROS VECINOS, RE<strong>SU</strong>LTANDO ASI UNA<br />
RELACION Si:O = 2:5<br />
Capa tetraédrica: tetra drica: Si 2O5 Cada oxígeno ox geno es compartido compartido por dos hexágonos hex gonos<br />
Cada silicio es compartido por tres tres hexágonos hex gonos<br />
Los oxígenos ox genos apicales, sobre los silicios
PLANO HEXAGONAL: Si, O<br />
(Si 2 O 5 ) 2-<br />
Malla de un filosilicato (el menor volumen que presenta todas las<br />
características del cristal eléctricamente neutro<br />
3 O<br />
2 Si<br />
2 O
CAPA OCTAEDRICA<br />
FI<strong>LOS</strong>ILICATOS. ARCILLAS<br />
EN LA LAMINA OCTAÉDRICA CONSTITUIDA POR OCTAEDROS QUE<br />
INCLUYEN UN CATIÓN (Al3+, Mg2+, Fe2+, Fe3+) SITUADO EN EL CENTRO DE<br />
SEIS OXIDRI<strong>LOS</strong>, <strong>LOS</strong> OCTAEDROS SE UNEN ENTRE SÍ COMPARTIENDO<br />
ARISTAS, ES DECIR, COMPARTIENDO OXIDRI<strong>LOS</strong> CON OCTAEDROS<br />
VECINOS<br />
Capa Átomos<br />
Valencia<br />
+ -<br />
hexagonal 6 O 12<br />
4 Si 16<br />
compacta 4O-2OH 8 + 2<br />
4 Al 12<br />
compacta 6 OH 6<br />
Capa Átomos<br />
Valencia<br />
+ -<br />
hexagonal 6 O 12<br />
4 Si 16<br />
compacta 4O-2OH 8 + 2<br />
6 Mg 12<br />
compacta 6 OH 6<br />
LAMINA DIOCTAEDRICA<br />
LAMINA TRIOCTAEDRICA
La división de los filosilicatos se basa en tres criterios:<br />
1.- Iones que ocupan la coordinación octaédrica.<br />
dioctaédricos: con iones trivalentes, generalmente aluminio<br />
trioctaédricos: con iones divalentes, por ejemplo magnesio<br />
2.- La existencia, o no, de sustituciones en las coordinaciones<br />
tetraédricas o/y octaédricas y, en el caso de existencia de las<br />
mismas, la forma de compensación de este déficit de carga.<br />
3.- El espesor de las hojas y las fuerzas de ligazón entre las<br />
mismas.<br />
Con respecto a espesor, se distinguen tres tipos distintos:<br />
Tipo de 7Å (Te-Oc):<br />
Hoja formada por tres capas, una hexagonal de O y dos compactas, una de<br />
O y (OH) y otra de (OH). Recordemos los dos ejemplos citados.<br />
Caolinita Serpentina<br />
6 O 6 O<br />
4 Si 4 Si<br />
4O - 2OH 4O - 2OH<br />
4 Al 6 Mg<br />
6 OH 6 OH<br />
Si 4 O 10 Al 4 (OH) 8<br />
Si 4 O 10 Mg 6 (OH) 8
Si<br />
Tipo de 1OÅ (Te-Oc-Te):<br />
Hoja formada por cuatro capas, 2 compactas de O y (OH) encerradas, a<br />
modo de bocadillo, entre dos capas hexagonales de O.<br />
TALCO<br />
9,5<br />
Pirofillita Muscovita<br />
K<br />
6 O 6 O<br />
4 Si 3Si - 1Al<br />
4O - 2OH 4O - 2OH<br />
4 Al 4 Al<br />
4 Si 3Si - 1Al<br />
6 O 6 O<br />
Si 4 O 10 Al 2 (OH) 2<br />
K<br />
Si 3 AlO 10 Al 2 (OH) 2 K<br />
•Tipo de 14Å (Te-De-Te-Oc-Oc):<br />
10<br />
MICA<br />
•Hoja doble, una presenta la estructura anterior y otra (llamada hoja<br />
brucítica) está formada por dos capas compactas de (OH).<br />
Clorita<br />
6 O<br />
3Si - 1Al<br />
4O - 2OH<br />
4 Al<br />
4O - 2OH<br />
3Si - 1Al<br />
6 O<br />
6 OH<br />
4Mg - 4Al<br />
6 OH<br />
Mg<br />
K