1. Digestion de l'ADN par les enzymes de - Département de biologie
1. Digestion de l'ADN par les enzymes de - Département de biologie
1. Digestion de l'ADN par les enzymes de - Département de biologie
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
Dé<strong>par</strong>tement <strong>de</strong> <strong>biologie</strong> Page 4 sur 6<br />
Ne jetez surtout pas <strong>les</strong> tubes dans <strong>les</strong>quels vous avez fait <strong>les</strong> digestions !!! Laissez-<br />
<strong>les</strong> dans la boîte à glace. Vous allez en avoir encore besoin !!<br />
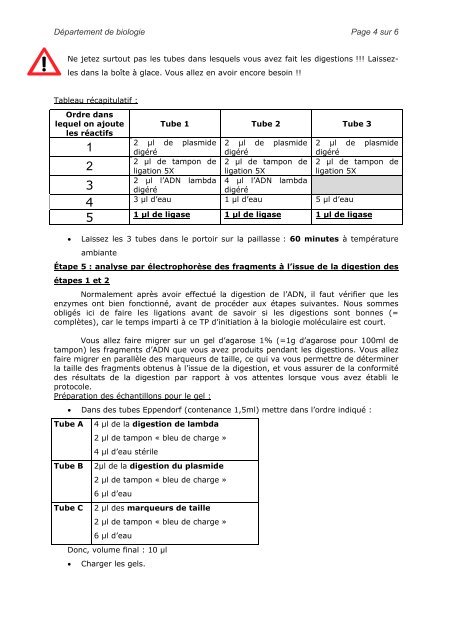
Tableau récapitulatif :<br />
Ordre dans<br />
lequel on ajoute<br />
<strong>les</strong> réactifs<br />
1<br />
2<br />
3<br />
• Laissez <strong>les</strong> 3 tubes dans le portoir sur la paillasse : 60 minutes à température<br />
ambiante<br />
Étape 5 : analyse <strong>par</strong> électrophorèse <strong>de</strong>s fragments à l’issue <strong>de</strong> la digestion <strong>de</strong>s<br />
étapes 1 et 2<br />
Normalement après avoir effectué la digestion <strong>de</strong> l’ADN, il faut vérifier que <strong>les</strong><br />
<strong>enzymes</strong> ont bien fonctionné, avant <strong>de</strong> procé<strong>de</strong>r aux étapes suivantes. Nous sommes<br />
obligés ici <strong>de</strong> faire <strong>les</strong> ligations avant <strong>de</strong> savoir si <strong>les</strong> digestions sont bonnes (=<br />
complètes), car le temps im<strong>par</strong>ti à ce TP d’initiation à la <strong>biologie</strong> moléculaire est court.<br />
Vous allez faire migrer sur un gel d’agarose 1% (=1g d’agarose pour 100ml <strong>de</strong><br />
tampon) <strong>les</strong> fragments d’ADN que vous avez produits pendant <strong>les</strong> digestions. Vous allez<br />
faire migrer en <strong>par</strong>allèle <strong>de</strong>s marqueurs <strong>de</strong> taille, ce qui va vous permettre <strong>de</strong> déterminer<br />
la taille <strong>de</strong>s fragments obtenus à l’issue <strong>de</strong> la digestion, et vous assurer <strong>de</strong> la conformité<br />
<strong>de</strong>s résultats <strong>de</strong> la digestion <strong>par</strong> rapport à vos attentes lorsque vous avez établi le<br />
protocole.<br />
Pré<strong>par</strong>ation <strong>de</strong>s échantillons pour le gel :<br />
• Dans <strong>de</strong>s tubes Eppendorf (contenance 1,5ml) mettre dans l’ordre indiqué :<br />
Tube A 4 µl <strong>de</strong> la digestion <strong>de</strong> lambda<br />
2 µl <strong>de</strong> tampon « bleu <strong>de</strong> charge »<br />
4 µl d’eau stérile<br />
Tube B 2µl <strong>de</strong> la digestion du plasmi<strong>de</strong><br />
2 µl <strong>de</strong> tampon « bleu <strong>de</strong> charge »<br />
6 µl d’eau<br />
Tube C 2 µl <strong>de</strong>s marqueurs <strong>de</strong> taille<br />
2 µl <strong>de</strong> tampon « bleu <strong>de</strong> charge »<br />
6 µl d’eau<br />
Donc, volume final : 10 µl<br />
• Charger <strong>les</strong> gels.<br />
Tube 1 Tube 2 Tube 3<br />
2 µl <strong>de</strong> plasmi<strong>de</strong><br />
digéré<br />
2 µl <strong>de</strong> tampon <strong>de</strong><br />
ligation 5X<br />
2 µl l’ADN lambda<br />
digéré<br />
2 µl <strong>de</strong> plasmi<strong>de</strong><br />
digéré<br />
2 µl <strong>de</strong> tampon <strong>de</strong><br />
ligation 5X<br />
4 µl l’ADN lambda<br />
digéré<br />
2 µl <strong>de</strong> plasmi<strong>de</strong><br />
digéré<br />
2 µl <strong>de</strong> tampon <strong>de</strong><br />
ligation 5X<br />
4 3 µl d’eau 1 µl d’eau 5 µl d’eau<br />
5 1 µl <strong>de</strong> ligase 1 µl <strong>de</strong> ligase 1 µl <strong>de</strong> ligase