3 - IARC
3 - IARC
3 - IARC
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
dérégulation de la réparation de l'ADN, la<br />
capacité de croissance dans des conditions<br />
hostiles en raison d’une diminution de<br />
l'apoptose (Apoptose, p. 115), la capacité<br />
invasion locale des tissus et de formation<br />
de métastases à distance, la capacité d’activer<br />
la formation de nouveaux vaisseaux<br />
sanguins (angiogenèse). Ensemble, ces<br />
cinq phénomènes biologiques peuvent être<br />
caricaturés comme des pièces du ‘puzzle<br />
du cancer’ [5] (fig. 3.15). Aucun n'est suffisant<br />
à lui seul, mais le cancer survient<br />
lorsqu'ils interagissent dans une chaîne<br />
d'événements coordonnés, qui modifie<br />
profondément le schéma cellulaire normal<br />
de croissance et de développement.<br />
Oncogènes humains courants<br />
Plusieurs proto-oncogènes courants codent<br />
pour des composants des cascades<br />
moléculaires qui régulent la réponse cellulaire<br />
aux signaux mitogènes [6], à savoir les<br />
facteurs de croissance (par exemple, TGFA),<br />
les récepteurs des facteurs de croissance<br />
(par exemple, les récepteurs du facteur de<br />
croissance épidermique, EGF et son homologue<br />
proche, ERBB2), les molécules de<br />
transduction du signal couplées à des<br />
récepteurs (notamment, plusieurs petites<br />
protéines liant la guanosine triphosphate<br />
(GTP) situées sur la face interne de la membrane<br />
cellulaire, comme les différents<br />
membres de la famille RAS), les kinases<br />
(SRC, ABL, RAF1), les sous-unités régulatrices<br />
des kinases du cycle cellulaire (CCND1<br />
et CCNA), les phosphatases (CDC25B), les<br />
molécules anti-apoptotiques (BCL2) et les<br />
facteurs de transcription (MYC, MYB, FOS,<br />
JUN). La nomenclature peu pratique de ces<br />
gènes (encadré : Dénomination des gènes<br />
et des protéines, p. 102) s'inspire grandement<br />
de la manière dont ils ont été découverts<br />
et identifiés. Le gène SRC, par exemple,<br />
fut le premier oncogène identifié, en<br />
1976, comme étant une version modifiée<br />
d'un gène cellulaire incorporé dans le<br />
génome d'un rétrovirus aviaire à fort pouvoir<br />
transformant, le virus du sarcome de<br />
Rous. Le gène MYC fut aussi initialement<br />
identifié dans le génome d'un rétrovirus<br />
aviaire responsable de la leucémie<br />
promyélocytaire. Les gènes RAS furent<br />
d'abord identifiés comme des gènes<br />
activés capables d'induire la formation de<br />
A<br />
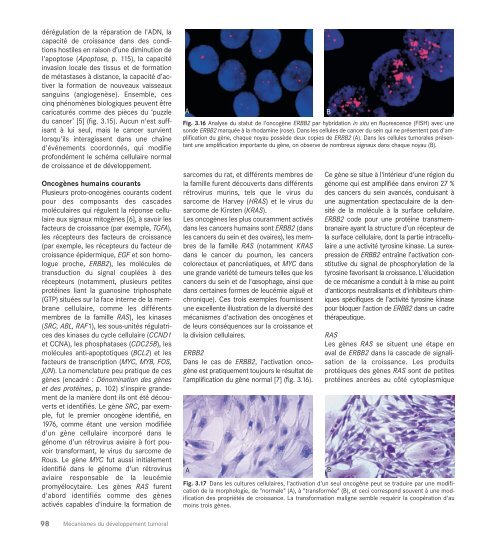
Fig. 3.16 Analyse du statut de l'oncogène ERBB2 par hybridation in situ en fluorescence (FISH) avec une<br />
sonde ERBB2 marquée à la rhodamine (rose). Dans les cellules de cancer du sein qui ne présentent pas d'amplification<br />
du gène, chaque noyau possède deux copies de ERBB2 (A). Dans les cellules tumorales présentant<br />
une amplification importante du gène, on observe de nombreux signaux dans chaque noyau (B).<br />
sarcomes du rat, et différents membres de<br />
la famille furent découverts dans différents<br />
rétrovirus murins, tels que le virus du<br />
sarcome de Harvey (HRAS) et le virus du<br />
sarcome de Kirsten (KRAS).<br />
Les oncogènes les plus couramment activés<br />
dans les cancers humains sont ERBB2 (dans<br />
les cancers du sein et des ovaires), les membres<br />
de la famille RAS (notamment KRAS<br />
dans le cancer du poumon, les cancers<br />
colorectaux et pancréatiques, et MYC dans<br />
une grande variété de tumeurs telles que les<br />
cancers du sein et de l'œsophage, ainsi que<br />
dans certaines formes de leucémie aiguë et<br />
chronique). Ces trois exemples fournissent<br />
une excellente illustration de la diversité des<br />
mécanismes d'activation des oncogènes et<br />
de leurs conséquences sur la croissance et<br />
la division cellulaires.<br />
ERBB2<br />
Dans le cas de ERBB2, l'activation oncogène<br />
est pratiquement toujours le résultat de<br />
l’amplification du gène normal [7] (fig. 3.16).<br />
A<br />
Ce gène se situe à l'intérieur d'une région du<br />
génome qui est amplifiée dans environ 27 %<br />
des cancers du sein avancés, conduisant à<br />
une augmentation spectaculaire de la densité<br />
de la molécule à la surface cellulaire.<br />
ERBB2 code pour une protéine transmembranaire<br />
ayant la structure d’un récepteur de<br />
la surface cellulaire, dont la partie intracellulaire<br />
a une activité tyrosine kinase. La surexpression<br />
de ERBB2 entraîne l’activation constitutive<br />
du signal de phosphorylation de la<br />
tyrosine favorisant la croissance. L'élucidation<br />
de ce mécanisme a conduit à la mise au point<br />
d'anticorps neutralisants et d'inhibiteurs chimiques<br />
spécifiques de l’activité tyrosine kinase<br />
pour bloquer l'action de ERBB2 dans un cadre<br />
thérapeutique.<br />
RAS<br />
Les gènes RAS se situent une étape en<br />
aval de ERBB2 dans la cascade de signalisation<br />
de la croissance. Les produits<br />
protéiques des gènes RAS sont de petites<br />
protéines ancrées au côté cytoplasmique<br />
Fig. 3.17 Dans les cultures cellulaires, l'activation d'un seul oncogène peut se traduire par une modification<br />
de la morphologie, de "normale" (A), à "transformée" (B), et ceci correspond souvent à une modification<br />
des propriétés de croissance. La transformation maligne semble requérir la coopération d'au<br />
moins trois gènes.<br />
B<br />
B<br />
98 Mécanismes du développement tumoral