3 - IARC
3 - IARC
3 - IARC
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
INVASION ET METASTASE<br />
RESUME<br />
> La capacité des cellules tumorales à<br />
envahir et à coloniser des sites distants<br />
est une caractéristique majeure<br />
différenciant les tumeurs bénignes<br />
des cancers malins.<br />
> La plupart des tumeurs humaines conduisent<br />
au décès en raison de l'invasion<br />
métastatique plutôt que des effets locaux<br />
indésirables du néoplasme primitif.<br />
>La dissémination métastatique débute<br />
généralement par un envahissement<br />
des ganglions lymphatiques régionaux,<br />
suivi d'une diffusion hématogène dans<br />
tout le corps. Les métastases peuvent<br />
apparaître cliniquement plusieurs<br />
années après la résection de la tumeur<br />
primaire.<br />
>Les procédés actuels ne permettent pas<br />
de détecter les micrométastases en routine,<br />
et la recherche de thérapies efficaces<br />
et sélectives contre la croissance<br />
métastatique reste un défi majeur.<br />
Le terme métastase (du grec signifiant<br />
‘changement de place’) fait référence à la<br />
croissance de tumeurs secondaires en<br />
des sites distants d’un néoplasme primitif.<br />
Ce terme différencie donc les lésions<br />
bénignes des lésions malignes, et caractérise<br />
la dernière étape du processus<br />
multi-étape de la progression tumorale.<br />
La croissance métastatique est la<br />
principale cause d'échec des traitements<br />
et de décès des patients cancéreux. Bien<br />
que les tumeurs secondaires puissent<br />
provenir de l’essaimage de cellules dans<br />
des cavités corporelles, le terme métastase<br />
est généralement réservé à la<br />
dissémination des cellules tumorales via<br />
le sang ou le système lymphatique. La<br />
propagation dans le fluide cérébrospinal<br />
et le passage transcoelomique est aussi<br />
possible. La plupart des patients<br />
cancéreux (60 à 70 %) présentent des<br />
métastases manifestes ou occultes lors<br />
du diagnostic, et le pronostic pour la<br />
majorité de ces patients est sombre<br />
(Encadré : Classification TNM des<br />
Tumeurs Malignes, p. 126).<br />
Il est absolument nécessaire d’identifier<br />
des indicateurs fiables du potentiel<br />
métastatique, étant donné que la détection<br />
clinique de la dissémination métastatique<br />
est souvent synonyme d’un mauvais<br />
pronostic. Les méthodes actuelles de<br />
détection de nouvelles tumeurs, comprenant<br />
la tomodensitométrie (CT scan)<br />
ou l'imagerie par résonance magnétique<br />
(IRM), les ultrasons ou la mesure des marqueurs<br />
circulants comme l’antigène<br />
carcinoembryonnaire (CEA), l’antigène<br />
spécifique de la prostate (PSA) ou<br />
l'antigène du cancer 125 (CA 125) ne sont<br />
pas suffisamment sensibles pour détecter<br />
des micrométastases. Une meilleure compréhension<br />
des mécanismes moléculaires<br />
des métastases est nécessaire. Il est<br />
évident que la croissance métastatique<br />
reflète à la fois une perte et un gain de<br />
fonction et, en effet, la recherche de<br />
gènes ‘suppresseurs des métastases’<br />
s’est avérée plus fructueuse que l’identification<br />
de gènes dont on est sûr qu’ils<br />
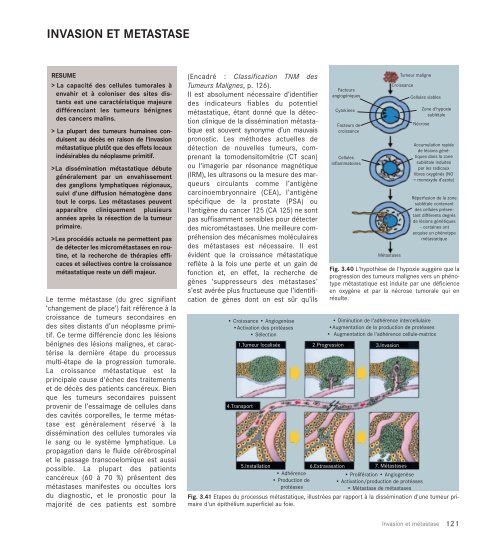
• Croissance • Angiogenèse<br />
•Activation des protéases<br />
• Sélection<br />
1.Tumeur localisée 2.Progression 3.Invasion<br />
4.Transport<br />
5.Installation<br />
• Adhérence<br />
• Production de<br />
protéases<br />
6.Extravasation<br />
Facteurs<br />
angiogéniques<br />
Cytokines<br />
Facteurs de<br />
croissance<br />
Cellules<br />
inflammatoires<br />
Métastases<br />
Tumeur maligne<br />
Croissance<br />
Fig. 3.40 L'hypothèse de l'hypoxie suggère que la<br />
progression des tumeurs malignes vers un phénotype<br />
métastatique est induite par une déficience<br />
en oxygène et par la nécrose tumorale qui en<br />
résulte.<br />
• Diminution de l'adhérence intercellulaire<br />
•Augmentation de la production de protéases<br />
• Augmentation de l'adhérence cellule-matrice<br />
7. Métastases<br />
• Prolifération • Angiogenèse<br />
• Activation/production de protéases<br />
• Métastase de métastases<br />
Cellules viables<br />
Zone d'hypoxie<br />
sublétale<br />
Nécrose<br />
Accumulation rapide<br />
de lésions génétiques<br />
dans la zone<br />
sublétale induites<br />
par les radicaux<br />
libres oxygénés (NO<br />
= monoxyde d’azote)<br />
Réperfusion de la zone<br />
sublétale contenant<br />
des cellules présentant<br />
différents degrés<br />
de lésions génétiques<br />
– certaines ont<br />
acquise un phénotype<br />
métastatique<br />
Fig. 3.41 Etapes du processus métastatique, illustrées par rapport à la dissémination d'une tumeur primaire<br />
d'un épithélium superficiel au foie.<br />
Invasion et métastase 121