Energia libera - Università degli Studi di Salerno
Energia libera - Università degli Studi di Salerno
Energia libera - Università degli Studi di Salerno
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
UNIVERSITÀ DEGLI STUDI DI SALERNO<br />
Termo<strong>di</strong>namica<br />
Chimica<br />
<strong>Energia</strong> g <strong>libera</strong><br />
FACOLTÀ DI FARMACIA<br />
C. A. Mattia<br />
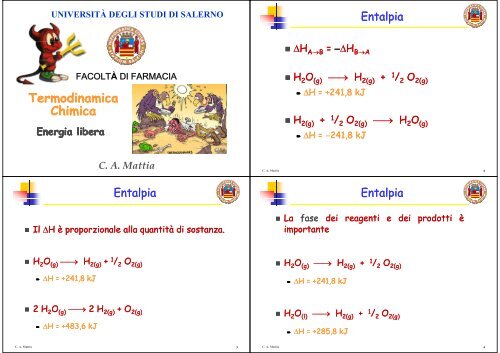
Entalpia p<br />
Il H H è proporzionale alla quantità <strong>di</strong> sostanza.<br />
H2O (g) H2(g) 2(g) + 1 / 2 O2(g) 2(g)<br />
H H = +241,8 kJ<br />
2 H H2O 2O (g) 2 H 2(g) + O 2(g)<br />
H H = +483,6 kJ<br />
C. A. Mattia 3<br />
H AB = H BA<br />
H H2O 2O ( (g) (g) ) <br />
H H2( 2(g) )<br />
H H = +241,8 kJ<br />
H 2(g) +<br />
Entalpia p<br />
2( 2(g) ) +<br />
+ 1 + / 2 O O2( 2( 2(g) 2(g) )<br />
1 + / O H O<br />
1 / 2 O 2(g) H2O (g)<br />
H H H = 241,8 241 241,8 8 kJ<br />
C. A. Mattia 2<br />
Entalpia p<br />
La fase dei reagenti e dei prodotti è<br />
importante<br />
H2O (g) H2(g) (g) + 1 / 2 O2(g) (g)<br />
H =+241 241,8 kJ<br />
H O H + 1 (l) H2(g) (g) + / O 1 / 2 O2(g) (g)<br />
H 2O (l)<br />
H H = +285 285 285,88 kJ<br />
C. A. Mattia 4
A pressione costante<br />
H H e E E<br />
H H H = U U U + ppV ppV<br />
Se il cambiamento <strong>di</strong> volume è molto piccolo:<br />
ppV V V 0 H H H U U<br />
C. A. Mattia 5<br />
Stati standard e H standard<br />
Ad esempio esempio, lo stato standard dell’etanolo dell etanolo a<br />
298 Kè etanolo liquido puro a 298 Ke1bar bar.<br />
Lo stato standard del ferro a500 500 Kè ferro<br />
puro solido ad 1bar bar.<br />
Si deve considerare la fase più stabile stabile.<br />
Una variazione <strong>di</strong> entalpia standard, èil il H <strong>di</strong><br />
un processo d dove sia l lo stato iniziale l che h quello<br />
ll<br />
finale fna sono stati stat standard standard. stan ar .<br />
C. A. Mattia 7<br />
Stati standard<br />
È comodo considerare le variazioni <strong>di</strong> entalpia<br />
<strong>di</strong> un processo, riferite ad un insieme <strong>di</strong><br />
con<strong>di</strong>zioni <strong>di</strong> i i standard standard. d d<br />
Si è deciso <strong>di</strong> considerare una pressione<br />
standard <strong>di</strong> 1bar bar. Me Mentre nt re per la temperatura<br />
non si èfissato fissato uno standard, se non in<strong>di</strong>cata,<br />
convenzionalmente si usa 25 °C C (298 298 298,15 15 K) K).<br />
Lo stato standard <strong>di</strong> una sostanza ad una data<br />
temperatura<br />
temperatura, èla la sua forma pura alla pressione<br />
<strong>di</strong> 1 bar bar.<br />
C. A. Mattia<br />
Tipo <strong>di</strong><br />
Processo<br />
tipo tipoH<br />
H <br />
H H standard<br />
H H2O (l) H H2O (g)<br />
Reagenti e<br />
prodotti p in stati<br />
standard: 1 bar<br />
H ° (373 K) 44 kJ m l 1<br />
vap vapH (373 K) = +44 kJ mol mol-1 C. A. Mattia 8<br />
6
Cambiamenti <strong>di</strong> fase<br />
bl blH ° subl sublH =<br />
= f H ° = + H °<br />
fus fusH + vap vapH<br />
C. A. Mattia 9<br />
Altri H H standard<br />
Combustione cHH°<br />
Ionizzazione ion<br />
ionH° ionH<br />
Idratazione hyd<br />
hydH° hyd<br />
Miscelazione mix<br />
E altri …<br />
mixH°<br />
Il H° delle transizioni <strong>di</strong> fase è comodo<br />
riportarlo i l alla ll temperatura a cui i avviene i la l<br />
transizione.<br />
C. A. Mattia 11<br />
Cambiamenti <strong>di</strong> fase<br />
Gas<br />
Sublimazione Brinamento<br />
Condensazione<br />
vapH<br />
o Li Liquefazione f i<br />
Vaporizzazione<br />
sub subH° sub vap vapH° vap<br />
- sub subH° sub subH<br />
Fusione<br />
fus fusH° H°<br />
Liquido<br />
- vap vapH° vap vapH<br />
Soli<strong>di</strong>ficazione<br />
S Solido lid<br />
- fus fusH°<br />
S Sublimazione bli i<br />
Bi Brinamento t<br />
C. A. Mattia 10<br />
Entalpia p <strong>di</strong> combustione<br />
L’entalpia Lentalpia standard <strong>di</strong> combustione cH° cH è<br />
l’entalpia standard per la completa ossidazione<br />
<strong>di</strong> un composto organico organico, con O O2(g) (g), con<br />
formazione <strong>di</strong> CO<br />
CO2(g) (g) e H2O (l) (l).<br />
C C3HH 8(g) + 5 O 2(g) 3 3 CO 2(g) + 4 H H2O O (l)<br />
C6H 6(l) + 15/2 O O2(g) C6H12 12O 6(s) + 6 O O2(g) 2(g) CO CO2(g) 2(g) CO CO2(g) 2(g) + 3 H H2O (l)<br />
2(g) + 6 H H2O (l)<br />
C. A. Mattia 12
Entalpia p <strong>di</strong> reazione<br />
La variazione <strong>di</strong> entalpia per una reazione<br />
chimica è definita come<br />
H H = H Hprodotti prodotti prodotti prodotti - H reagenti<br />
reagenti.<br />
Una equazione termochimica include il valore <strong>di</strong><br />
H ele le fasi in cui sono presenti ireagenti reagenti ei<br />
prodotti<br />
CH 4(g) + 2 O O2(g) 2(g) CO CO2(g) 2(g) + 2 H H2O (g)<br />
H= H= -802 802 kJ<br />
C. A. Mattia 13<br />
Etalpia p standard <strong>di</strong> reazione<br />
Un <strong>di</strong>verso modo <strong>di</strong> descrivere la<br />
variazione <strong>di</strong> entalpia in una reazione<br />
chimica, h è riportare l’ l’entalpia l standard d d d <strong>di</strong><br />
reazione rHH°<br />
CH 4(g) + 2 O O2(g) 2(g) CO CO2(g) 2(g) + 2 H H2O (g) (g)<br />
rH°= = -802 802 kJ mol mol-1 Notare che è un’entalpia molare.<br />
C. A. Mattia 15<br />
N 2(g)<br />
Equazioni q termochimiche<br />
2(g) + 3 H 2(g) 2 NH NH3(g) 3(g)<br />
H = -92,8 92,8 kJ kJ/mol /mol<br />
Notare che per reagenti e<br />
prodotti d tti vengono specificate ifi t le l fasi f i Il segno < 0 in<strong>di</strong>ca una<br />
reazione esotermica<br />
Avendo solamente 1,8 moli <strong>di</strong> H 2 come si calcola<br />
l’ l’entalpia l entalpia <strong>di</strong> reazione?<br />
Si Si moltiplica moltiplica l’equazione l equazione per per 1,8/3 1 8/3 incluso incluso il il H H<br />
H H = - 92 92,38 38 kJ kJ•1,8/3 1 8/3 = - 55 55,43 43 kJ<br />
C. A. Mattia 14<br />
Diagrammi g <strong>di</strong> entalpia p<br />
Un <strong>di</strong>agramma g <strong>di</strong> entalpia p mostra H per p lo stato iniziale<br />
e finale del processo.<br />
H<br />
H 1<br />
H 2<br />
CH CH4(g) 4( 4(g) ) + +2O + 2 O O2(g) 2( 2(g) )<br />
CO 2(g) + 2 H H2O (g)<br />
A A pressione ssi costante st t q = H H H = -802 802 kJ kJ.<br />
C. A. Mattia<br />
H H = -802 802 kJ<br />
16
Entalpie p <strong>di</strong> reazione<br />
La variazione <strong>di</strong> entalpia <strong>di</strong>pende dalla fase dei reagenti e<br />
dei prodotti<br />
CH CH4(g) 4(g) + 2 O O2(g) 2(g) CO CO2(g) 2(g) + 2 H H2O O(l) (l) H= H= H -890 890 kJ<br />
C. A. Mattia<br />
H<br />
CH CH4(g) 4(g) 4(g) + 2 O 2(g)<br />
4(g)<br />
-802 802 kJ<br />
CO 2(g) + 2H 2HO 2 H H2O (g)<br />
CO CO2(g) 2( 2(g) ) + +2H + 2 H H2O 2O (l)<br />
H H = -890 890 kJ<br />
Entalpie p <strong>di</strong> reazione<br />
H è è una una proprietà proprietà estensiva estensiva, quin<strong>di</strong> il H H H <strong>di</strong>pende<br />
dalla quantità <strong>di</strong> reagenti e <strong>di</strong> prodotti.<br />
Qual è il H H per p la combustione <strong>di</strong> 11,0 g <strong>di</strong> CH 4<br />
in eccesso <strong>di</strong> ossigeno?<br />
C. A. Mattia<br />
CH 4(g) + 2 O 2(g) CO CO CO 2(g) + 2 H H2O 2O (g)<br />
mol CH4<br />
11,0 g CH4 <br />
16,<br />
04 g CH<br />
802 kJ<br />
<br />
mol CH<br />
16 4<br />
4<br />
H H H = -802 802 kJ<br />
= -550 kJ<br />
17<br />
19<br />
Entalpie p <strong>di</strong> reazione<br />
Invertendo la reazione, , il H H si inverte <strong>di</strong> segno. g<br />
C. A. Mattia<br />
CO CO2(g) 2(g) + 2 H H2O (g)<br />
H H<br />
H 2<br />
H H1 (g) CH CH4(g) 4(g) + 2 O O2(g) 2(g)<br />
CH CH4(g) (g) + 2 O O2(g) (g)<br />
CO CO2(g) 2(g) (g) + 2H 2 H H2O(g) 2O(g) O(g)<br />
H H = +802 kJ<br />
H H = +802 kJ<br />
Entalpie p <strong>di</strong> reazione<br />
Quanto butano b bisogna b bruciare b<br />
per produrre d 100 kJ kJ <strong>di</strong> <strong>di</strong> calore? l ?<br />
2 C C4H 10(g) (g) + 13 O O2(g) (g)<br />
2(g) (g) 8 8 CO 2(g) (g) + 10 H H2O (g)<br />
H H = -5317 5317 kJ<br />
2 mol C4H10<br />
58,12 g C<br />
100 kJ <br />
4H10<br />
100 kJ <br />
= 2,19 g C C4H 4H10 10<br />
kJ mol C<br />
C. A. Mattia<br />
5317 10<br />
4H<br />
18<br />
20
Legge gg <strong>di</strong> Hess<br />
C Consideriamo id i una reazione i i in d due sta<strong>di</strong>. t <strong>di</strong><br />
Qual è il H?<br />
C (s) + ½ O 2(g) CO (g) (g) H 1 =<br />
= -110 110 kJ<br />
CO (g) + ½ O O2(g) 2(g) CO CO 2(g) H 2 = -283 283 kJ<br />
___________________ ___________<br />
C (s) + O 2(g) CO CO2(g) 2(g) H H H = -393 393 kJ<br />
C (s)<br />
Legge <strong>di</strong> Hess Hess: Hess Hess: per una reazione sud<strong>di</strong>visa in più<br />
sta<strong>di</strong>, il H totale èla la somma delle variazioni <strong>di</strong><br />
entalpia t l i dei d ddei i singoli i li sta<strong>di</strong> sta<strong>di</strong>. t <strong>di</strong><br />
C. A. Mattia<br />
Legge gg <strong>di</strong> Hess<br />
La Legge <strong>di</strong> Hess è semplicemente<br />
una applicazione del primo principio<br />
della termo<strong>di</strong>namica a processi p a<br />
pressione costante costante.<br />
Ha principalmente una importanza<br />
storica, essendo stata formulata<br />
prima i d del l primo i principio i i i d della ll<br />
termo<strong>di</strong>namica termo<strong>di</strong>namica, da cui <strong>di</strong>scende <strong>di</strong>scende.<br />
C. A. Mattia<br />
21<br />
23<br />
Legge gg <strong>di</strong> Hess<br />
La legge gg <strong>di</strong> Hess si basa sul fatto che l’entalpia l’ entalpia p è una<br />
funzione <strong>di</strong> stato stato.<br />
C. A. Mattia<br />
H H C (s) +O + O 2(g)<br />
-110 110 kJ<br />
CO (g) + ½ O 2(g)<br />
CO 2(g)<br />
-283 283 83 kJ J<br />
H H = -393 393 kJ<br />
La legge gg <strong>di</strong> Hess in azione<br />
Date due reazioni chimiche (#1 and #2) e il loro H<br />
#1 #1: : Fe Fe2O3 + 3CO (g) 2 Fe (s) + 3CO 2(g)<br />
H=-26,7 26,7 kJ kJ/mol /mol<br />
#2 #2: #2 #2: : CO ( (g) ) + 1/2 O O2(g) 2( 2(g) ) CO CO2(g) 2( 2(g) )<br />
H=-283,0 283,0 kJ kJ/mol /mol<br />
calcolare l l il il H H d della ll seguente reazione reazione: i<br />
2 Fe (s) (s) + 3/2 O 2(g) Fe Fe2OO 3(s) 3(s) H H = ?<br />
C. A. Mattia 24<br />
22
Passo 1<br />
C Cominciamo i i controllando t ll d l la posizione i i <strong>di</strong> reagenti ti e<br />
prodotti nella reazione desiderata e in quelle date.<br />
Obiettivo: 2 Fe (s) (s) (s) (s) + 3/2 O O2(g) 2( 2(g) ) Fe Fe2O 2O 3(s) H= H = ?<br />
#1 #1: Fe Fe2O3 + 3CO (g) (g) 2 Fe (s) + 3CO 3CO2(g) 2(g) H=-26,7 26,7 kJ/mol<br />
Osserviamo che il ferro appare pp a destra nella<br />
reazione obiettivo ea sinistra nella #1.<br />
S SSoluzione Soluzione: l i i invertiamo ti l la reazione i #1 #1, e<br />
cambiamo segno alla sua entalpia. entalpia<br />
C. A. Mattia 25<br />
Passo 3<br />
Ora sommiamo assieme le due equazioni e<br />
cancelliamo ciò che appare sia adestra destra che a<br />
sinistra (se anche la fase èidentica) identica).<br />
2 F Fe (s) + 3CO 2(g) F Fe Fe2OO 3(s) + 3CO (g)<br />
3CO (g) + 3/2 O 2(g) 3 CO 2(g)<br />
2Fe (s) +3CO +3CO2(g) 2(g) +3CO (g) + 3/2O 2(g) <br />
3CO H = = + 26,7 6 k kJ kJ/mol /mol / l<br />
(g) H<br />
H H = = - 849,0 kJ kJ/mol /mol<br />
Fe Fe2O 3(s) + 3CO (g) (g)+ + 3CO 2(g)<br />
2 Fe (s) + 3/2 O 2(g) Fe Fe2O 3(s)<br />
H H H = = = -822,3 822 822,3 3 kJ/mol<br />
C. A. Mattia 27<br />
Passo 2<br />
Ci devono essere 3/2 O2 a sinistra, e<br />
dobbiamo cancellare 3 CO e 3 CO CO2 quando<br />
sommiamo le equazioni. equazioni Moltiplichiamo per 3<br />
la seconda reazione, eil il suo H.<br />
[ (g)<br />
#2 #2: : 3 [CO CO (g) + 1/2 O 2(g)<br />
2(g) CO 2(g) ]<br />
H= H = 3* 3*(-283 3 (-283,0 283 283,0 0 kJ) = -849 -849,0 849 849,0 0 kJ/mol<br />
C. A. Mattia 26<br />
Esercizio<br />
Calcolare il H° per p la reazione<br />
S (s)<br />
Dati<br />
2 SO 2(g) + O 2(g)<br />
2 S (s) + 3 O O2(g) (s) + O O2(g) SO<br />
2(g) <br />
2(g) 2 SO 3(g)<br />
2(g) 2 SO 3(g)<br />
S (s) + 3/2 O O2(g) 2(g) SO<br />
SO3(g) 3(g)<br />
SO2(g) 2(g)<br />
H° = 196 196 kJ/mol<br />
(a) ( (a) )<br />
H° = 790 790 kJ/mol<br />
(b)<br />
(b)•1/2<br />
SO 3(g) SO 2(g) + 1/2 O 2(g) (a)• (a)•-1/2 1/2<br />
S (s) ( ) + O O2(g) (g)<br />
2(g) (g) SO 2(g) (g)<br />
ΔH = ½ ΔΔHb<br />
Hb + (-½) ( ) ΔHa<br />
ΔH° = ½( ½(-790) 790) + (-½)( ( )(-196) 196) = -297 297 kJ kJ/mol /mol<br />
C. A. Mattia 28
Cibo<br />
n unità <strong>di</strong><br />
energia<br />
g<br />
Per non non ingrassare<br />
ingrassare<br />
o si mangia <strong>di</strong> meno<br />
o si i consuma <strong>di</strong> <strong>di</strong> più iù<br />
facendo più<br />
esercizio.<br />
Cibo e grasso g<br />
Grasso<br />
nn-a a unità<br />
<strong>di</strong> energia<br />
Esercizio<br />
a unità <strong>di</strong><br />
energia<br />
i<br />
C. A. Mattia 29<br />
Contenuto calorico<br />
La quantità relativa <strong>di</strong> proteine, grassi e<br />
carboidrati nei cibi costituisce il contenuto<br />
calorico calorico.<br />
C. A. Mattia 31<br />
Contenuto energetico g dei cibi<br />
L’energia ’ chimica h negli l animali l d deriva d dalla ll<br />
metabolizzazione <strong>di</strong> carboidrati, , grassi g e proteine proteine. p<br />
Valore energetico (kJ/g) (Cal/g)<br />
Carboidrati 17 4<br />
Grassi 38 9<br />
Proteine 17 4<br />
Spesso <strong>di</strong> usano le Calorie (Cal o kcal)<br />
1 Cal l = 1 kcal k l = 4,184 kJ k<br />
C. A. Mattia 30<br />
Carboidrati<br />
La maggior parte dell’energia dell energia <strong>di</strong> cui abbiamo<br />
bisogno deriva dalla combustione <strong>di</strong> zuccheri e<br />
grassi grassi. i<br />
Per il glucosio glucosio, la combustione è:<br />
C6H12 12O 6 (s) + 6 O O2(g) (g) 6 CO 2 (g) + 6 H H2O rH H = -2816 2816 kJ<br />
L’energia L LL’energia energ a è <strong>di</strong>sponibile d spon b le imme<strong>di</strong>atamente.<br />
mmed atamente.<br />
O (l) (l).<br />
Valore energetico me<strong>di</strong>o = 17 kJ/g = 4 kcal/g.<br />
C. A. Mattia 32
Coca Coca-Cola Cola ® …<br />
C. A. Mattia 33<br />
Proteine<br />
Contenuto energetico me<strong>di</strong>o = 17 kJ/g kJ/g,<br />
Quando vengono metabolizzate dal corpo<br />
umano, l’azoto contenuto viene trasformato ed<br />
espulso sotto forma <strong>di</strong> urea urea.<br />
Poiché i prodotti metabolici sono <strong>di</strong>versi da<br />
quelli lli ottenuti tt ti s semplicemente mpli m t b bruciando i d l le<br />
proteine p in presenza p <strong>di</strong> ossigeno, g , non è<br />
possibile utilizzare un normale calorimetro per<br />
misurare l’energia sviluppata sviluppata.<br />
C. A. Mattia 35<br />
Grassi<br />
Anche la combustione dei grassi produce CO 2 e<br />
H2O. O.<br />
Ad d esempio, l la tristearina<br />
C57 57H110 110O 6 (s) + 163/2 O O2(g) (g) 57 CO 2 (g) + 55 H H2O H 37 8 10 104 rH = -37,8 37,8 x 10 kJ 4 kJ<br />
O (l) (l).<br />
I grassi g sono il serbatoio energetico g del corpo p<br />
Insolubili in acqua<br />
C Contenuto t t energetico ti me<strong>di</strong>o m <strong>di</strong> = 38 38 kJ/g kJ/ circa i<br />
il doppio dei carboidrati.<br />
C. A. Mattia 34<br />
Calorimetri per p uomini<br />
C. A. Mattia 36
Reazione <strong>di</strong> formazione<br />
Reazione <strong>di</strong> formazione<br />
formazione: formazione<br />
formazione: è la reazione <strong>di</strong><br />
formazione <strong>di</strong> una mole <strong>di</strong> una sostanza dai suoi<br />
elementi nei loro stati standard (forma efase fase<br />
più p stabile a 1bar bar e alla temperatura p in<strong>di</strong>cata<br />
(se non in<strong>di</strong>cata si considera 25 25°)).<br />
Ad esempio, la reazione <strong>di</strong> formazione <strong>di</strong><br />
C CCaCO CO<br />
CaCO3(s) (s).<br />
Ca (s) + C (grafite) + 3 / 2 O 2(g)<br />
CaCO 3(s)<br />
C. A. Mattia 37<br />
Entalpia p standard <strong>di</strong> formazione<br />
Qual l è il l fH° H° d dell’ossigeno ll’ gassoso?<br />
O O fH fH H H = 0<br />
O 2(g)<br />
2(g) O 2(g)<br />
Qual è il fH ° del <strong>di</strong>amante?<br />
C (grafite) (grafite) C (<strong>di</strong>amante)<br />
fH fH = 1,9 kJ/mol<br />
Qual è il fH ° d dell’atomo ll’ d <strong>di</strong> cloro l gassoso?<br />
C. A. Mattia<br />
½ Cl 2(g) Cl (g) fH fH H H = 122 kJ/ kJ/mol l<br />
39<br />
Entalpia standard <strong>di</strong> formazione<br />
L’ L entalpia standard <strong>di</strong> formazione<br />
formazione, fHº fH Hº H , <strong>di</strong> una<br />
sostanza èil il H della sua reazione <strong>di</strong> formazione<br />
formazione.<br />
Ca (s) +C (grafite) 2 2(g) (g) CaCO 3(s) (s)<br />
(grafite) + 3 / 2 O 2(g)<br />
Ca (s) (s) +½O 2(g) (g) CaO (s)<br />
C (grafite)<br />
(grafite) + O O2(g) 2(g) CO CO 2(g)<br />
fH°(CaCO (CaCO3,s) ,s) =-1207 1207 kJ/mol<br />
fH°(CaO,s) (CaO,s) =-636 636 kJ/mol<br />
fH°(CO (CO2,g) ,g) = -394 394 kJ/mol<br />
C. A. Mattia 38<br />
Entalpia p standard <strong>di</strong> formazione<br />
fH(<strong>di</strong>amante) fH (<strong>di</strong>amante) = 1,9 1,9 kJ kJ. kJ kJ. . Come si trova?<br />
La conversione <strong>di</strong>retta dalla grafite al <strong>di</strong>amante<br />
non è semplice l ( (altrimenti l l lo f faremmo tutti )<br />
e quin<strong>di</strong> q non lo possiamo p misurare <strong>di</strong>rettamente.<br />
<strong>di</strong>rettamente<br />
Possiamo tuttavia bruciare della grafite e del<br />
<strong>di</strong> <strong>di</strong>amante t , misurare i i calori l i <strong>di</strong> combustione, b ti e<br />
usare le legge <strong>di</strong> Hess Hess.<br />
C (grafite) (g f ) + O 2(g) (g) CO CO 2(g) (g) f<br />
C (<strong>di</strong>amante) ( ) + O 2(g) (g) CO CO 2(g) (g) f<br />
fH° = -393,5 393,5 kJ/mol<br />
fH° = -395,4 395,4 kJ/mol<br />
C. A. Mattia 40
Entalpia p standard <strong>di</strong> formazione<br />
Entalpie molari a 298 K e 1 bar<br />
C. A. Mattia 41<br />
Termo<strong>di</strong>namica e cinetica<br />
La grafite è termo<strong>di</strong>namicamente più stabile<br />
del <strong>di</strong>amante <strong>di</strong>amante.<br />
Tuttavia, la termo<strong>di</strong>namica non <strong>di</strong>ce nulla sul<br />
tempo necessario afar far avvenire i processi processi.<br />
Questo riguarda invece la cinetica chimica chimica.<br />
La cinetica chimica in<strong>di</strong>ca che la velocità della<br />
reazione <strong>di</strong> trasformazione del <strong>di</strong>amante in<br />
grafite è estremamente lenta. lenta<br />
C. A. Mattia 43<br />
fH fH H° (C (C, (C, grafite) grafite) = = 0<br />
Diamanti<br />
fH fH H° (C (C, (C, <strong>di</strong>amante) <strong>di</strong>amante) = 1 1,90 90 kJ/mol<br />
La grafite è più stabile del <strong>di</strong>amante.<br />
Perché P PPerché hé gli li anelli lli non si i trasformano f i in<br />
carbone?<br />
Si trasformano, ma lo fanno molto<br />
lentamente!<br />
C. A. Mattia 42<br />
Entalpia p standard <strong>di</strong> reazione<br />
Possiamo considerare una reazione come una<br />
decomposizione dei reagenti negli elementi, e<br />
nella formazione dei prodotti a partire dagli<br />
elementi elementi.<br />
Quin<strong>di</strong> il rH è esprimibile come:<br />
rH° = n n fH°(prodotti prodotti) ) - m m fH°(reagenti reagenti)<br />
Reagenti e prodotti devono essere alla stessa<br />
temperatura<br />
temperatura.<br />
C. A. Mattia 44
H° a partire dai fH°<br />
r p f<br />
I fH H in kJ/m kJ/mol l sono s n tabulati. tabulati<br />
Al (s) (s)<br />
BaCO<br />
CO (g)<br />
CO 2(g)<br />
CS<br />
S Sostanza t fHH Sostanza fHH <br />
BaCO3(s) 3(s)<br />
CS 2(g)<br />
0<br />
-1219 1219<br />
-110 110<br />
-394 394<br />
+117<br />
Cl 2(g)<br />
H H2O O(ll)<br />
H2O (g)<br />
NaHCO<br />
Na Na2CO NaHCO NaHCO3(s) 3(s) 3(s) 3(s)<br />
CO 3(s)<br />
0<br />
-286 286<br />
-242 242<br />
-947,7 947,7<br />
-1131 1131<br />
Ricordare che i fH H per gli elementi nei loro stati<br />
standard è 0.<br />
C. A. Mattia 45<br />
Variazione rH° con la temperatura<br />
p<br />
r<br />
Le entalpie standard <strong>di</strong> molte importanti<br />
reazioni sono state misurate a varie<br />
temperature e riportate in tabelle tabelle.<br />
In mancanza <strong>di</strong> informazioni informazioni, si possono<br />
calcolare in modo approssimato rH°(T) (T).<br />
L’espressione della variazione <strong>di</strong> entalpia<br />
H ( T<br />
T<br />
2) H ( T1)<br />
<br />
2<br />
T<br />
1<br />
C pdT<br />
C. A. Mattia 47<br />
Entalpia p standard <strong>di</strong> reazione<br />
Calcoliamo il rHº Hº della reazione<br />
CaCO 3( 3(s) ) CaO () ()+ (s) + CO CO2(g) 2( 2(g) )<br />
H Ca () ()+ + C () ()+ + 3 H Ca (s) + C (s) + / 2<br />
1207 kJ<br />
CaCO 3(s)<br />
2 O O2(g) 2( 2(g) )<br />
177 kJ<br />
-636 636 + -394 394 kJ<br />
CaO(s) + CO CO2(g) 2(g) (g)<br />
Hº H = fH°(CaO fH (CaO,s) s) + fH°(CO fH (CO22,g) g) - fH°(CaCO fH (CaCO33,s) s)<br />
C. A. Mattia<br />
Legge gg <strong>di</strong> Kirchhoff<br />
<br />
r<br />
H (<br />
T2<br />
) <br />
<br />
C<br />
r<br />
<br />
p<br />
r<br />
T<br />
H (<br />
T1)<br />
<br />
rC<br />
<br />
<br />
prodotti<br />
C<br />
<br />
p,<br />
m<br />
T<br />
2<br />
1<br />
<br />
<br />
reagenti<br />
<br />
p<br />
C<br />
Se T T T T è è piccolo, piccolo possiamo<br />
considerare le capacità<br />
termiche costanti.<br />
C. A. Mattia 48<br />
dT<br />
<br />
p,<br />
m<br />
46
Yerka<br />
Calore<br />
Termo<strong>di</strong>namica<br />
Trasformazione <strong>di</strong><br />
<strong>di</strong><br />
in<br />
Van Gogh<br />
Lavoro<br />
C. A. Mattia 49<br />
Che cosa è la spontaneità?<br />
p<br />
La spontaneità è la capacità <strong>di</strong> un<br />
processo p <strong>di</strong> avvenire senza<br />
interventi esterni esterni.<br />
Accade naturalmente.<br />
Termo<strong>di</strong>namica<br />
Termo<strong>di</strong>namica: un processo p è<br />
spontaneo se avviene senza che<br />
venga eseguito it d del l l lavoro sul sull<br />
sistema sistema.<br />
C. A. Mattia 51<br />
Processi spontanei<br />
p<br />
Perché le cose accadono?<br />
Tempo<br />
C. A. Mattia 50<br />
Esempi p <strong>di</strong> processi p spontanei p<br />
Una pallina scende spontaneamente una<br />
<strong>di</strong>scesa, ma non sale spontaneamente una<br />
salita salita.<br />
Il ferro arrugginisce spontaneamente, spontaneamente ma la<br />
ruggine non forma spontaneamente ossigeno<br />
e ferro ferro. ferro ferro.<br />
Un gas si espande fino a riempire il<br />
contenitore<br />
contenitore. Le molecole <strong>di</strong> un gas non si<br />
concentrano mai nell’angolo <strong>di</strong> un recipiente. recipiente<br />
L’acqua soli<strong>di</strong>fica spontaneamente a<br />
temperature inferiori a 0 °CC.<br />
C. A. Mattia 52
Esempi p più p complessi p<br />
Gli esseri viventi invecchiano<br />
invecchiano.<br />
L’universo Luniverso pare avere una freccia del<br />
tempo tempo.<br />
Se un processo è spontaneo in una<br />
<strong>di</strong> <strong>di</strong>rezione, i allora ll nelle ll stesse t con<strong>di</strong>zioni<br />
<strong>di</strong> i i<br />
il processo opposto non è spontaneo spontaneo. spontaneo spontaneo.<br />
I processi p spontanei p sono sempre<br />
p<br />
irreversibili<br />
irreversibili.<br />
C. A. Mattia 53<br />
Reazioni spontanee p<br />
CH CH4 + O O2 CO CO2 + H H2O O + energia<br />
oppure<br />
CO 2 + H H2O 2O + energia g CH 4 + O 2<br />
Il primo p principio p p non è in grado g <strong>di</strong><br />
prevedere il verso <strong>di</strong> una reazione.<br />
C. A. Mattia 55<br />
Equilibrio q termico. Perché?<br />
L’esperienza L esperienza ci <strong>di</strong>ce che<br />
due oggetti a<br />
temperature d <strong>di</strong>verse<br />
posti a contatto<br />
raggiungono l’equilibrio<br />
termico e raggiungono la<br />
stessa temperatura<br />
temperatura.<br />
Perché?<br />
La conservazione<br />
dell’energia non c’entra!<br />
C. A. Mattia 54<br />
Spontaneità velocità<br />
La spontaneità <strong>di</strong> un processo non ha nulla a che<br />
fare con la velocità con cui avviene. avviene<br />
La spontaneità riguarda l’accadere omeno meno del<br />
processo processo, non la sua velocità (lenta o veloce) veloce).<br />
Non si deve confondere un processo spontaneo<br />
con una velocità estremamente piccola, con un<br />
processo non spontaneo spontaneo. t<br />
La conversione del <strong>di</strong>amante in grafite è<br />
spontanea, ma estremamente lenta lenta.<br />
C. A. Mattia 56
Spesso le reazioni<br />
esotermiche sono<br />
spontanee.<br />
Fe Fe2O 2 3(s) + 2 Al (s) (s) <br />
2 Fe (s) (s) + Al Al2O3(s) 3(s)<br />
Spontaneità p H H < 0<br />
H H = - 848 kJ/mol.<br />
C. A. Mattia 57<br />
Processi spontanei p e temperatura p<br />
La <strong>di</strong>rezione <strong>di</strong> un processo può <strong>di</strong>pendere dalla<br />
temperatura.<br />
Il ghiaccio hi i fonde f ffonde d spontaneamente t t a T > 0 C. CC.<br />
L’ L’acqua acqua q soli<strong>di</strong>fica spontaneamente p<br />
a T < 0 C. C.<br />
C. A. Mattia 59<br />
Spontaneità p H H < 0<br />
Molti processi spontanei sono endotermici.<br />
NH NH4Cl Cl (s) +<br />
+ energia NH NH4Cl Esistono anche processi<br />
spontanei con H H = 0.<br />
L’energia L LL’energia energia dell dell’universo universo è<br />
è<br />
costante: un processo<br />
spontaneo esotermico i<br />
(sistema) ( ) è anche spontaneo p<br />
endotermico (ambiente).<br />
C. A. Mattia<br />
Cl (aq) (aq)<br />
Spontaneità p e funzioni <strong>di</strong> stato<br />
“Though Though the course may change sometimes,<br />
rivers always reach the sea sea” ”<br />
(Page/Plant Page/Plant ‘Ten Ten Years Gone’ Gone , Led Zeppelin Zeppelin) Zeppelin Zeppelin). ).<br />
La spontaneità <strong>di</strong> un processo non <strong>di</strong>pende dal cammino<br />
percorso, p , ma m solo dallo stato iniziale e finale. f<br />
C. A. Mattia 60<br />
58
Mistero<br />
Sherlok Holmes:<br />
Mmmhh Mmmhh, dagli dagli in<strong>di</strong>zi in<strong>di</strong>zi raccolti raccolti mi mi par<br />
par<br />
<strong>di</strong> poter p concludere che è coinvolta<br />
una funzione <strong>di</strong> stato.<br />
Ma quale? q<br />
C. A. Mattia 61<br />
Mi Microscopico i<br />
Macroscopico<br />
La freccia del tempo<br />
p<br />
Conservazione Conservazione dell’energia<br />
dell’energia gg<br />
Conservazione Conservazione del del momento momento<br />
Conservazione Conservazione dell’energia<br />
dell’energia<br />
Conservazione Conservazione del del momento momento<br />
C. A. Mattia 63<br />
La freccia del tempo<br />
p<br />
Un uovo che cade si rompe. rompe<br />
Il processo inverso<br />
inverso (t (tuorlo l<br />
ealbume albume che saltano nella mano<br />
e ricompongono l’uovo) non<br />
accade mai. mai<br />
I processi spontanei hanno una <strong>di</strong>rezione<br />
La freccia del tempo<br />
C. A. Mattia 62<br />
La temperatura non<br />
varia varia.<br />
Spontanea, ma U U = 0.<br />
Perché il gas si<br />
espande?<br />
d ?<br />
Espansione p <strong>libera</strong> gas g ideale<br />
L’espansione è isoterma.<br />
Il gas non compie lavoro<br />
e non non v viene ene<br />
scambiato<br />
calore. l<br />
C. A. Mattia 64
Perché le cose accadono?<br />
La scienza moderna non può accontentarsi<br />
delle risposte tipiche <strong>di</strong> altri contesti contesti: contesti contesti:<br />
Aristotele Aristotele: le cose tendono al loro stato<br />
naturale naturale. Isassi sassi cadono perché vogliono andare<br />
verso il basso basso.<br />
Religione: Religione g le cose accadono perché p così vuole<br />
Dio (azioni ↔ libero arbitrio) arbitrio).<br />
Abbiamo bisogno <strong>di</strong> un criterio <strong>di</strong>mostrabile<br />
e utilizzabile in pratica pratica.<br />
C. A. Mattia 65<br />
Spontaneità p ed energia g<br />
Tuttavia Tuttavia, ad un esame attento attento, ci<br />
accorgiamo che alla fine <strong>di</strong> un processo<br />
spontaneo d <strong>di</strong> un sistema isolato, l l’ l’energia<br />
è <strong>di</strong>stribuita in maniera <strong>di</strong>versa <strong>di</strong>versa.<br />
Alla fine <strong>di</strong> una espansione espansione, le molecole<br />
del gas, sono <strong>di</strong>stribuite in tutto il<br />
contenitore<br />
contenitore.<br />
L’energia ha molti più mo<strong>di</strong> per essere<br />
<strong>di</strong>stribuita <strong>di</strong>stribuita.<br />
C. A. Mattia 67<br />
Spontaneità p ed energia g<br />
L’energia g totale non può p essere responsabile<br />
p<br />
della <strong>di</strong>rezione <strong>di</strong> un processo processo.<br />
Neppure la quantità <strong>di</strong> energia del sistema può<br />
essere r responsabile<br />
responsabile.<br />
r p n a .<br />
Un Gas si espande, espande, ma U =0.<br />
Se l’energia del sistema <strong>di</strong>minuisce, quella<br />
d dell’ambiente ll’ bi t aumenta, t eviceversa viceversa. i M Ma l la <strong>di</strong> <strong>di</strong>visione i i<br />
tra sistema e ambiente è arbitraria. arbitraria<br />
Quin<strong>di</strong> un criterio che ponesse l’accento solo sul<br />
sistema<br />
corretto corretto.<br />
o solo sull’ambiente<br />
sull sull’ambiente ambiente non può essere<br />
C. A. Mattia 66<br />
Dispersione p <strong>di</strong> energia g<br />
Saltando la palla p trasferisce energia g<br />
termica alle molecole del suolo.<br />
A poco a poco, tutta l’energia l’<br />
potenziale della palla si<br />
trasforma in calore.<br />
Non osserviamo<br />
il processo<br />
inverso<br />
C. A. Mattia 68
Dispersione p <strong>di</strong> energia g<br />
L’energia L LL’energia energia or<strong>di</strong>nata<br />
delle molecole della palla<br />
viene convertita in<br />
calore ovvero in energia g<br />
termica delle molecole.<br />
L’energia L LL’energia energia termica è<br />
è<br />
<strong>di</strong>sor<strong>di</strong>nata<br />
<strong>di</strong>sor<strong>di</strong>nata, le<br />
molecole l l si i muovono in i<br />
modo casuale.<br />
C. A. Mattia 69<br />
Dispersione p <strong>di</strong> energia g e <strong>di</strong>sor<strong>di</strong>ne<br />
Dopo secoli, si è capito che i cambiamenti<br />
spontanei sono accompagnati non da<br />
<strong>di</strong> <strong>di</strong>minuzione i i <strong>di</strong> energia i ( (anche h se spesso l’ l’energia i<br />
del sistema <strong>di</strong>minuisce) ma da una ri<strong>di</strong>stribuzione<br />
dell’energia in una forma più <strong>di</strong>sor<strong>di</strong>nata<br />
<strong>di</strong>sor<strong>di</strong>nata.<br />
Tempo<br />
C. A. Mattia 71<br />
Dispersione p <strong>di</strong> energia g<br />
Dopo aver <strong>di</strong>ssipato<br />
tutta l’energia<br />
potenziale potenziale, le molecole<br />
del suolo e della palla si<br />
muovono in maniera più ù<br />
<strong>di</strong>sor<strong>di</strong>nata<br />
<strong>di</strong>sor<strong>di</strong>nata.<br />
Il processo inverso non<br />
avviene avviene: : scaldando il<br />
paviment pavimento la la palla<br />
appoggiata non inizia a<br />
saltellare.<br />
C. A. Mattia 70<br />
Seconda legge gg della termo<strong>di</strong>namica<br />
Kelvin Kelvin-Plank<br />
Kelvin Plank<br />
Nessun processo p può, p come solo risultato, prendere p<br />
calore da un serbatoio econvertirlo<br />
convertirlo completamente<br />
in lavoro lavoro.<br />
Clausius aus us<br />
È impossibile un trasferimento spontaneo <strong>di</strong> calore<br />
da un corpo freddo ad uno caldo. caldo<br />
Sono affermazioni <strong>di</strong> impossibilità.<br />
p<br />
C. A. Mattia 72
Seconda legge gg della termo<strong>di</strong>namica<br />
È una legge probabilistica<br />
probabilistica.<br />
probabilistica<br />
probabilistica.<br />
È molto improbabile che tutte le molecole d’aria<br />
vadano nello stesso istante nell’angolo nell nell’angolo angolo della stanza stanza, e<br />
io muoia soffocato. soffocato<br />
Richiede un’analisi del concetto <strong>di</strong> probabilità<br />
<strong>di</strong> una <strong>di</strong>stribuzione <strong>di</strong> materia e energia, e una<br />
grandezza per misurarla quantitativamente:<br />
quantitativamente<br />
C. A. Mattia 73<br />
Entropia p macroscopica p<br />
Consideriamo ora l’effetto l effetto <strong>di</strong> un trasferimento<br />
reversibile infinitesimo <strong>di</strong> calore ad un corpo corpo.<br />
Dal punto <strong>di</strong> vista dell’or<strong>di</strong>ne molecolare edella della<br />
ri<strong>di</strong>stribuzione energetica interna interna, fornire una<br />
quantità dq rev al sistema ha un effetto<br />
maggiore se la temperatura è bassa. bassa<br />
S Se il sistema it è già ià ad add alte lt t temperature, t avrà<br />
à<br />
già g una grande g ri<strong>di</strong>stribuzione interna<br />
dell’energia, e fornire dq rev al sistema ha meno<br />
effetto effetto.<br />
C. A. Mattia 75<br />
Entropia p macroscopica p<br />
Come possiamo p esprimere p l’entropia p in termini<br />
miacroscopici<br />
miacroscopici?<br />
Le molecole <strong>di</strong> un sistema ad alta temperatura sono<br />
molto <strong>di</strong>sor<strong>di</strong>nate, sia nella loro posizione sia in<br />
termini <strong>degli</strong> stati energetici occupati (t (traslazionali<br />
ttraslazionali, sl i li<br />
vibrazionali, rotazionali)<br />
rotazionali).<br />
L Le molecole l l <strong>di</strong> un corpo a b bassa t temperatura t (ad ( (ad d<br />
esempio un solido) sono molto più or<strong>di</strong>nate, sia nella<br />
posizione i i sia i negli li stati t ti energetici ti i permessi permessi. i<br />
Un sistema a bassa temperatura p ha meno stati<br />
energetici eposizioni posizioni permesse <strong>di</strong> un sistema ad alta<br />
temperatura<br />
temperatura. p<br />
C. A. Mattia 74<br />
Entropia p macroscopica p<br />
L’effetto L effetto sulla <strong>di</strong>stribuzione molecolare, a<br />
parità <strong>di</strong> dq <strong>di</strong>pende dalla temperatura.<br />
temperatura<br />
dqrev rev, <strong>di</strong>pende<br />
P Possiamo allora ll considerare d l la quantità à d dq / /T.<br />
dqrev rev/T<br />
Il calore non è un <strong>di</strong>fferenziale esatto esatto,<br />
tuttavia èpossibile possibile <strong>di</strong>mostrare che dq dqrev rev/T /T èun un<br />
<strong>di</strong>ff <strong>di</strong>fferenziale i l esatto. esatto tt<br />
Quin<strong>di</strong> esiste una funzione <strong>di</strong> stato stato, che<br />
chiamiamo entropia, tale che<br />
dS = dq dqq rev rev/T rev rev/T<br />
C. A. Mattia 76
Seconda legge gg della termo<strong>di</strong>namica<br />
L’entropia L’entropia p <strong>di</strong> un sistema isolato<br />
durante un processo spontaneo<br />
aumenta.<br />
S S <br />
0 tot<br />
C. A. Mattia 77<br />
S S t tot tt><br />
><br />
S tot =<br />
Variazioni <strong>di</strong> entropia p<br />
S S tot 0<br />
> 0 Processo irreversibile<br />
= 0 Processo reversibile<br />
In forma <strong>di</strong>fferenziale<br />
d dS dSamb amb+ + d dS sis 0<br />
C. A. Mattia 79<br />
C. A. Mattia<br />
Entropia: riassunto<br />
L’entropia (S) è una funzione <strong>di</strong> stato.<br />
S tot = S sis + S amb amb.<br />
S Se S S tot è positivo iti il il processo è è spontaneo. t<br />
Se S S tot t ttot ttè<br />
è negativo, negativo il il processo processo è è spontaneo<br />
spontaneo<br />
nella <strong>di</strong>rezione opposta.<br />
In un processo spontaneo<br />
l’entropia l ll’entropia entropia dell dell’universo universo aumenta sempre sempre.<br />
S<br />
<br />
f<br />
<br />
i<br />
dq<br />
T<br />
rev<br />
Or<strong>di</strong>ne e <strong>di</strong>sor<strong>di</strong>ne<br />
Le parole or<strong>di</strong>ne e <strong>di</strong>sor<strong>di</strong>ne non hanno significato<br />
in termo<strong>di</strong>namica classica, dato che non si<br />
i interessa t <strong>di</strong> modelli d lli d della ll materia. materia t i<br />
Nella termo<strong>di</strong>namica statistica statistica, un aumento <strong>di</strong><br />
entropia corrisponde ad un aumento <strong>degli</strong> stati<br />
accessibili al sistema sistema, aumentandone il <strong>di</strong>sor<strong>di</strong>ne <strong>di</strong>sor<strong>di</strong>ne.<br />
In termo<strong>di</strong>namica statistica si considera che il<br />
sistema sia libero <strong>di</strong> passare attraverso tutti gli<br />
stati possibili possibili.<br />
L’entropia p èuna una misura dei mo<strong>di</strong> in cui esiste il<br />
sistema sistema.<br />
C. A. Mattia 80<br />
78
Or<strong>di</strong>ne e <strong>di</strong>sor<strong>di</strong>ne<br />
Visitando il mio stu<strong>di</strong>o troverete molte carte<br />
sparse “a caso” caso per la stanza. stanza<br />
In generale <strong>di</strong>rete che la <strong>di</strong>sposizione delle<br />
carte è <strong>di</strong>sor<strong>di</strong>nata<br />
<strong>di</strong>sor<strong>di</strong>nata.<br />
Ritornando più p volte nel mio stu<strong>di</strong>o, , troverete<br />
le carte <strong>di</strong>sposte nello stesso modo, epertanto pertanto<br />
osserverete ss t un n’ unica ni <strong>di</strong>sp <strong>di</strong>sposizione<br />
<strong>di</strong>sposizione. si i n<br />
Dal punto <strong>di</strong> vista “entropico entropico” entropico non vi è<br />
<strong>di</strong>sor<strong>di</strong>ne, ma un tipo <strong>di</strong> “or<strong>di</strong>ne or<strong>di</strong>ne” <strong>di</strong>verso da<br />
quello ll atteso. atteso<br />
C. A. Mattia 81<br />
Molteplicità<br />
p<br />
W = 6<br />
C. A. Mattia 83<br />
Entropia p microscopica p<br />
S S0 = KlnW R = KN KNA Disposizione perfetta (or<strong>di</strong>nata)<br />
<strong>di</strong> molecole molecole <strong>di</strong> monossido <strong>di</strong><br />
carbonio in un cristallo.<br />
W = 1 S0 = 0<br />
Disposizione imperfetta<br />
(<strong>di</strong> (<strong>di</strong>sor<strong>di</strong>nata). <strong>di</strong> t )<br />
W > 1 S0 > 0<br />
0<br />
C. A. Mattia 82<br />
Entropia p microscopica p<br />
S S 0 = KlnW R = KN KNA Nel ghiaccio vi sono 6<br />
<strong>di</strong>sposizioni<br />
equivalenti <strong>di</strong> 4 atomi<br />
<strong>di</strong> H intorno ad un O.<br />
Altre <strong>di</strong>eci <strong>di</strong>sposizioni<br />
creano molecole con<br />
un numero <strong>di</strong> legami<br />
<strong>di</strong>verso da 2.<br />
2N atomi <strong>di</strong> H<br />
W = 2 2N (6/16) N = (3/2) N<br />
C. A. Mattia 84
Terza legge gg della termo<strong>di</strong>namica<br />
Per T =0, tutto il moto termico si è smorzato,<br />
e in inn cristallo cr cristallo stallo perfetto gli gl atomi atom o gli gl ioni on<br />
formano un reticolo regolare ed uniforme uniforme.<br />
Vi è un solo l modo d per ottenere questo<br />
arrangiamento.<br />
arrangiamento g<br />
S0 =kln ln(W) (W) =kln ln(1) =0.<br />
C. A. Mattia 85<br />
S = 0<br />
Terza Terza Terza Terza legge legge legge legge della della della della termo<strong>di</strong>namica<br />
termo<strong>di</strong>namica<br />
termo<strong>di</strong>namica<br />
termo<strong>di</strong>namica<br />
Ryman<br />
Se T = 0 con or<strong>di</strong>ne massimo, S = 0<br />
Mondrian<br />
S > 0<br />
S S > 0<br />
0<br />
Severini<br />
Pollock<br />
S S = SSmax<br />
SSmax<br />
max<br />
C. A. Mattia 87<br />
III legge gg della termo<strong>di</strong>namica<br />
l’ l’entropia <strong>di</strong> d un cristallo ll perfetto f a 0 K è è 0.<br />
A <strong>di</strong>fferenza delle entalpie entalpie, , le entropie hanno<br />
una scala assoluta, grazie alla terza legge legge.<br />
C. A. Mattia 86<br />
Non troppo seriamente...<br />
Prima legge legge: legge : non puoi vincere!<br />
Non puoi ricavare da un sistema più energia <strong>di</strong> quella<br />
che ci metti dentro dentro.<br />
Seconda legge legge: : non puoi neanche pareggiare!<br />
N Non puoi i tirare ti f fuori i neanche h t tutta tt l’ l’energia i che h ci i<br />
metti dentro.<br />
Terza legge legge: legge legge: : e neppure uscire dal gioco!<br />
L’entropia dell’universo aumenta sempre sempre.<br />
C. A. Mattia 88
Serbatoio<br />
Freddo<br />
Isolante<br />
Macchine Termiche<br />
Fluido<br />
Serbatoio<br />
Caldo<br />
Una macchina termica opera tra<br />
due tempe temperature rature <strong>di</strong>verse e<br />
trasforma tr trasforma sf rm p parte rt d del l calore c l r in<br />
lavoro.<br />
Il fluido interno compie un<br />
ciclo ciclo.<br />
C. A. Mattia 89<br />
p<br />
4<br />
1<br />
Ciclo <strong>di</strong> Carnot<br />
q T C<br />
q C<br />
q qF T F = costante<br />
C = costante<br />
2<br />
3<br />
1-2 2 : Isoterma<br />
2-3 3 : A<strong>di</strong>abatica<br />
3-4 4 : Isoterma<br />
4-1 1 : A<strong>di</strong>abatica<br />
costante Lavoro estratto<br />
V<br />
C. A. Mattia 91<br />
Motore<br />
C. A. Mattia 90<br />
p<br />
4<br />
w = C CV(T (T (TF-TT C) )<br />
q = 0<br />
1<br />
w = -RT RTCln(V C ln(V ( 2/V 2/V1) 1)<br />
q = +RT +RTCln(V ln(V2/V /V1) w = -RT RT RTFln(V ln(V ln(V4/V 4/V /V /V3) 3)<br />
q = +RT +RTFln(V ln(V4/V /V3) V<br />
Ciclo <strong>di</strong> Carnot<br />
2<br />
w = -RT RTCln(V C ln(V ( 2/V 2/V1)-RT 1) RTFln(V F ln(V ( 4/V 4/V3) 3)<br />
gli sta<strong>di</strong> a<strong>di</strong>abatici si elidono<br />
q C = RT RTCln(V Cln(V ln(V ln(V2/V /V /V1) )<br />
V c<br />
1TC = VV4T<br />
c<br />
F<br />
V T c V T c<br />
V c<br />
2TC = VV3T<br />
c<br />
F<br />
V1V3(T (TCTF) c = VV2V<br />
4(T (TCTF) c<br />
(TF-TC) V1/V /V2 = V V4/V /V3 w = =-R(T R(T R(TC-T C TF)ln(V F)ln(V )ln(V )ln(V2/V 2/V /V /V1) 1)<br />
3 ren<strong>di</strong>mento ε = |w|/|q |w|/|qC| ε = (T (TC-TT F)/T )/T )/TC ε = 1-T 1 F/T /TC ε = 1-q 1 F/q<br />
w = C CV(T q = 0<br />
/q C<br />
C. A. Mattia 92
p<br />
4<br />
1<br />
Ciclo <strong>di</strong> Carnot<br />
Efficienza:<br />
qC T TC= = costante<br />
2 <br />
lavoro compiuto / calore<br />
assorbito = 11-T<br />
F/T /TC. Nessun ciclo può essere<br />
più efficiente <strong>di</strong> un ciclo<br />
qF 3<br />
<br />
<strong>di</strong> Carnot senza violare la<br />
seconda legge.<br />
Si può p tendere a<br />
F=<br />
costante <br />
efficienza 1 se T C 0. 0.<br />
Percorrendo un ciclo<br />
in senso antiorario<br />
V<br />
otteniamo un<br />
fi frigorifero. if<br />
T F=<br />
C. A. Mattia 93<br />
Motore a ciclo <strong>di</strong> Otto<br />
P Passo 1: 1 Entra E t la l miscela i l aria i benzina b i dal d l carburatore b t<br />
C. A. Mattia 95<br />
Quattro Tempi<br />
12: 12: 2: a<strong>di</strong>abatica lenta<br />
23: 3: isocora veloce<br />
34: 4: a<strong>di</strong>abatica lenta<br />
441: 1 1: isocora veloce l<br />
Il Ciclo <strong>di</strong> Otto<br />
C. A. Mattia 94<br />
Motore a ciclo <strong>di</strong> Otto<br />
P Passo 2: 2 C Compressione i della d ll miscela i l<br />
C. A. Mattia 96
Motore a ciclo <strong>di</strong> Otto<br />
P Passo 3: 3 A Accensione i ed d espansione i d della ll miscela i l<br />
C. A. Mattia 97<br />
Processi spontanei<br />
p<br />
Un Un processo processo è è spontaneo spontaneo se se l’entropia<br />
l entropia<br />
dell’universo aumenta.<br />
S tot = S sis + S amb 0<br />
È scomodo d d dover esplicitamente li it t t tener conto t <strong>di</strong><br />
quello q che succede nell’universo. Preferiremmo<br />
concentrarci solo sul sistema.<br />
Se lavoriamo a pressione costante o a volume<br />
costante costante, è facile tener conto dei contributi<br />
entropici dell’ambiente.<br />
C. A. Mattia 99<br />
Motore a ciclo <strong>di</strong> Otto<br />
P Passo 4: 4 Scarico S i dei d i G Gas<br />
C. A. Mattia 98<br />
Processi spontanei<br />
p<br />
Partiamo dalla <strong>di</strong>suguaglianza <strong>di</strong> Clausius<br />
dq Processo<br />
dS 0<br />
T spontaneo<br />
Consideriamo la pressione p costante costante: : dq q = dH<br />
dH<br />
dS <br />
0<br />
T<br />
dH TdS <br />
0<br />
E Esprime Esprime il l criterio <strong>di</strong> d spontaneità à solo l in base b<br />
a funzioni <strong>di</strong> stato del sistema.<br />
C. A. Mattia 100
dH – T dS 0 0.<br />
<strong>Energia</strong> g <strong>di</strong> Gibbs<br />
Se S = costante costante, , H viene minimizzato.<br />
Se H = costante costante, , S viene massimizzato.<br />
Introduciamo la funzione<br />
G = energia g <strong>di</strong> Gibbs<br />
A temperatura costante<br />
G = H – T S<br />
Gibbs (energia energia <strong>libera</strong> <strong>libera</strong>). ).<br />
dG = dH – T dS – S dT = dH – T dS<br />
C. A. Mattia 101<br />
<strong>Energia</strong> g <strong>di</strong> Gibbs e universo<br />
S Se p e T sono costanti t ti<br />
G G G < 0 S S universo > 0<br />
Se p e T non sono costanti, G è ugualmente<br />
definita, ma ΔG G non rappresenta più la<br />
variazione i i <strong>di</strong> <strong>di</strong> entropia t i d dell’universo. ll’ i<br />
C. A. Mattia 103<br />
<strong>Energia</strong> g <strong>di</strong> Gibbs<br />
Se il sistema cambia a T e p costanti,<br />
dG p,T p, = dH – T dS 0<br />
All’equilibrio dG p,T = 0<br />
Per una variazione finita, a T e p costanti<br />
G = H H H – T S S<br />
G p,T =<br />
Se il processo p è spontaneo p<br />
G G < 0<br />
All’equilibrio<br />
G G = 0<br />
C. A. Mattia 102<br />
<strong>Energia</strong> g <strong>di</strong> Helmholtz<br />
A volume costante: dq = dU<br />
dU<br />
dS <br />
0<br />
T<br />
dU TdS <br />
0<br />
Introduciamo la funzione <strong>di</strong> Helmoltz<br />
A temperatura costante<br />
A = U – T S<br />
dA dA = dU – T dS – S dT = dU – T dS<br />
C. A. Mattia 104
Importanza p <strong>di</strong> G<br />
G G<br />
Fornisce il<br />
Fornisce la<br />
massimo l lavoro<br />
<strong>di</strong>rezione<br />
utilizzabile <strong>di</strong> un<br />
d del l processo<br />
processo<br />
C. A. Mattia 105<br />
G G G = H H H - TS. TS. S.<br />
Contributi al G<br />
Distinguiamo i due contributi alla variazione <strong>di</strong><br />
energia d <strong>di</strong> Gbb Gibbs Gibbs:<br />
Entropico ( (S) ( (S) S)<br />
Entalpico ( (H) H)<br />
H H S S G G .<br />
- + - Processo spontaneo per ogni T<br />
- - ? Processo spontaneo a basse T<br />
+ + ? Processo spontaneo ad alte T<br />
+ - + Processo mai spontaneo per qualsiasi T<br />
Processo P mai i spontaneo t per qualsiasi l i i T<br />
T<br />
C. A. Mattia 107<br />
<strong>Energia</strong> g <strong>di</strong> Gibbs e spontaneità p<br />
G G = H H – TS<br />
La variazione finita <strong>di</strong> G è G G G = H H H - (TS) (TS). (TS) (TS).<br />
A Temperatura e pressione costante<br />
G G = H H -TS G G < 0 - processo spontaneo.<br />
G G G > 0 - processo non spontaneo t ( (spontaneo<br />
( spontaneo t<br />
nella <strong>di</strong>rezione opposta). pp<br />
G G = 0 - sistema in equilibrio.<br />
C. A. Mattia 106<br />
S°<br />
H° < 0 H° > 0<br />
S° > 0<br />
S° > 0<br />
Spontanea a<br />
ogni temperatura<br />
H° < 0<br />
S° < 0<br />
Spontanea p a<br />
bassa temperatura<br />
Spontanea ad<br />
alta temperatura<br />
H° > 0<br />
S° S < 0<br />
Mai spontanea<br />
Esotermica Endotermica<br />
H°<br />
C. A. Mattia 108
fH° fH° (C, (C, grafite) grafite) = = 0<br />
0<br />
fH fH H° (C (C, (C, <strong>di</strong>amante) <strong>di</strong>amante) = = 1 1.9 9 kJ/mol<br />
W Watson:<br />
Mistero<br />
Dottor Holmes, come posso sapere se la grafite è<br />
più stabile del <strong>di</strong>amante?<br />
Sherlock Holmes:<br />
Calcolando il G, G, caro Watson !<br />
C. A. Mattia 109<br />
<strong>Energia</strong> g <strong>libera</strong> <strong>di</strong> formazione<br />
Il rGG i ò i i f i d ll<br />
o si può esprimere esprimere in funzione delle<br />
energie energie g <strong>di</strong> Gibbs <strong>di</strong> formazione<br />
formazione.<br />
G n<br />
G G<br />
prodotti d i m<br />
G <br />
f <br />
reagentii<br />
rG<br />
f<br />
fG fG G G è l’ l’energia i <strong>di</strong> Gibb Gibbs standard standard t d d per l la<br />
formazione f m <strong>di</strong><br />
<strong>di</strong> un<br />
un composto composto mp a partire p dagli<br />
dagli g<br />
elementi nei nei loro<br />
loro stati<br />
stati standard. standard<br />
C. A. Mattia 111<br />
Elementare Watson<br />
Calcoliamo il G G m(298 m(298 298 K) per la<br />
trasformazione da grafite in <strong>di</strong>amante<br />
<strong>di</strong>amante.<br />
Cgrafite grafite C<strong>di</strong>amante <strong>di</strong>amante<br />
C g ggrafite f<br />
Ho rH (k / l)<br />
o (kJ/mol)<br />
rG H T<br />
o = rH o - T rSo (k (kJ/mol) / l) S o<br />
m ( / l )<br />
grafite 0 5,740<br />
C<strong>di</strong>amante <strong>di</strong>amante<br />
1,895 2,377<br />
(J/mol (J/mol K) K)<br />
rGo = ((1895-0) ((1895 0) – 298,15 (2,377 – 5,740))J mol mol-1 1 = 2,898 kJ mol mol-1 Quin<strong>di</strong> la trasformazione <strong>di</strong>amante grafite grafite è<br />
spontanea.<br />
C. A. Mattia 110<br />
Vita e reazioni Spontanee<br />
p<br />
Negli Negli esseri viventi avvengono milioni milioni <strong>di</strong><br />
reazioni non spontanee spontanee. Come è possibile?<br />
ATP<br />
C. A. Mattia 112
ATP = Adenosintrifosfato<br />
L’ L’ATP L ATP è la banca <strong>di</strong> energia del corpo umano umano. umano umano.<br />
La reazione <strong>di</strong> idrolisi ATP ADP èspontanea spontanea. p<br />
Quando Q il corpo p ha bisogno g <strong>di</strong> energia g p<br />
energia (per<br />
flettere un muscolo, sintetizzare una proteina, etc etc…)<br />
accoppia una idrolisi dell’ATP dell dell’ATP ATP con la reazione<br />
desiderata (e un enzima opportuno)<br />
opportuno).<br />
Il metabolismo del glucosio ritrasforma ADP<br />
(Adenosin<strong>di</strong>fosfato)<br />
immagazzinato<br />
immagazzinato.<br />
in ATP ATP, che viene<br />
C. A. Mattia 113<br />
ATP e energia g <strong>di</strong> Gibbs<br />
–CH CH CH2CH CH CH2COOH COOH + NH NH3 –CH CH CH2CH CH CH2CONH CONH CONH2 + H H2OO La reazione tra acido glutammico (un aminoacido) e<br />
l’ammoniaca non èspontanea spontanea (G > 0).<br />
Nella cellula questa reazione avviene grazie<br />
all’accoppiamento con l’idrolisi dell’ dell’ATP ATP che fornisce<br />
l’energia lenergia lenergia<strong>libera</strong><br />
l’energia <strong>libera</strong> <strong>di</strong> Gibbs necessaria necessaria.<br />
C. A. Mattia 115<br />
ATP e reazioni biochimiche<br />
Accoppiamento <strong>di</strong> reazioni non<br />
spontanee p con l’idrolisi dell’ATP<br />
C. A. Mattia 114<br />
ATP e energia g <strong>di</strong> Gibbs<br />
Reazione non<br />
spontanea.<br />
F Fosforilazione f il i d dell’acido ll’ id<br />
glutammico. Reazione<br />
spontanea.<br />
L’energia del gruppo<br />
fosfato viene usata per<br />
far avvenire la reazione.<br />
La reazione globale ha un<br />
G G negativo, e quin<strong>di</strong> è<br />
spontanea.<br />
C. A. Mattia 116