Energia libera - Università degli Studi di Salerno
Energia libera - Università degli Studi di Salerno
Energia libera - Università degli Studi di Salerno
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
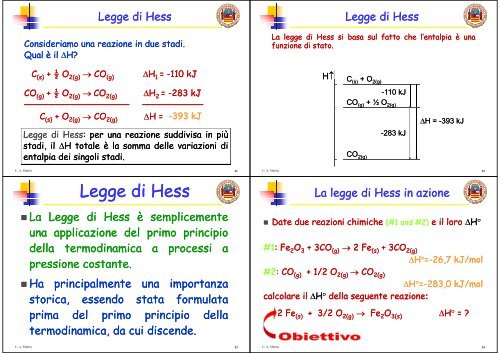
Legge gg <strong>di</strong> Hess<br />
C Consideriamo id i una reazione i i in d due sta<strong>di</strong>. t <strong>di</strong><br />
Qual è il H?<br />
C (s) + ½ O 2(g) CO (g) (g) H 1 =<br />
= -110 110 kJ<br />
CO (g) + ½ O O2(g) 2(g) CO CO 2(g) H 2 = -283 283 kJ<br />
___________________ ___________<br />
C (s) + O 2(g) CO CO2(g) 2(g) H H H = -393 393 kJ<br />
C (s)<br />
Legge <strong>di</strong> Hess Hess: Hess Hess: per una reazione sud<strong>di</strong>visa in più<br />
sta<strong>di</strong>, il H totale èla la somma delle variazioni <strong>di</strong><br />
entalpia t l i dei d ddei i singoli i li sta<strong>di</strong> sta<strong>di</strong>. t <strong>di</strong><br />
C. A. Mattia<br />
Legge gg <strong>di</strong> Hess<br />
La Legge <strong>di</strong> Hess è semplicemente<br />
una applicazione del primo principio<br />
della termo<strong>di</strong>namica a processi p a<br />
pressione costante costante.<br />
Ha principalmente una importanza<br />
storica, essendo stata formulata<br />
prima i d del l primo i principio i i i d della ll<br />
termo<strong>di</strong>namica termo<strong>di</strong>namica, da cui <strong>di</strong>scende <strong>di</strong>scende.<br />
C. A. Mattia<br />
21<br />
23<br />
Legge gg <strong>di</strong> Hess<br />
La legge gg <strong>di</strong> Hess si basa sul fatto che l’entalpia l’ entalpia p è una<br />
funzione <strong>di</strong> stato stato.<br />
C. A. Mattia<br />
H H C (s) +O + O 2(g)<br />
-110 110 kJ<br />
CO (g) + ½ O 2(g)<br />
CO 2(g)<br />
-283 283 83 kJ J<br />
H H = -393 393 kJ<br />
La legge gg <strong>di</strong> Hess in azione<br />
Date due reazioni chimiche (#1 and #2) e il loro H<br />
#1 #1: : Fe Fe2O3 + 3CO (g) 2 Fe (s) + 3CO 2(g)<br />
H=-26,7 26,7 kJ kJ/mol /mol<br />
#2 #2: #2 #2: : CO ( (g) ) + 1/2 O O2(g) 2( 2(g) ) CO CO2(g) 2( 2(g) )<br />
H=-283,0 283,0 kJ kJ/mol /mol<br />
calcolare l l il il H H d della ll seguente reazione reazione: i<br />
2 Fe (s) (s) + 3/2 O 2(g) Fe Fe2OO 3(s) 3(s) H H = ?<br />
C. A. Mattia 24<br />
22