Energia libera - Università degli Studi di Salerno
Energia libera - Università degli Studi di Salerno
Energia libera - Università degli Studi di Salerno
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
UNIVERSITÀ DEGLI STUDI DI SALERNO<br />
Termo<strong>di</strong>namica<br />
Chimica<br />
<strong>Energia</strong> g <strong>libera</strong><br />
FACOLTÀ DI FARMACIA<br />
C. A. Mattia<br />
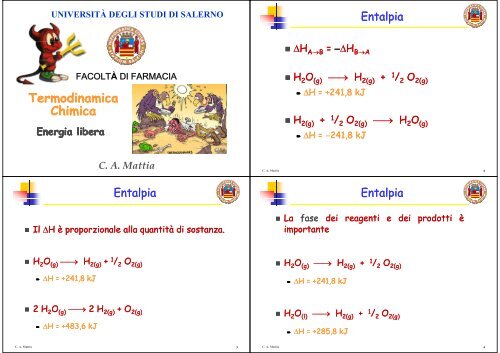
Entalpia p<br />
Il H H è proporzionale alla quantità <strong>di</strong> sostanza.<br />
H2O (g) H2(g) 2(g) + 1 / 2 O2(g) 2(g)<br />
H H = +241,8 kJ<br />
2 H H2O 2O (g) 2 H 2(g) + O 2(g)<br />
H H = +483,6 kJ<br />
C. A. Mattia 3<br />
H AB = H BA<br />
H H2O 2O ( (g) (g) ) <br />
H H2( 2(g) )<br />
H H = +241,8 kJ<br />
H 2(g) +<br />
Entalpia p<br />
2( 2(g) ) +<br />
+ 1 + / 2 O O2( 2( 2(g) 2(g) )<br />
1 + / O H O<br />
1 / 2 O 2(g) H2O (g)<br />
H H H = 241,8 241 241,8 8 kJ<br />
C. A. Mattia 2<br />
Entalpia p<br />
La fase dei reagenti e dei prodotti è<br />
importante<br />
H2O (g) H2(g) (g) + 1 / 2 O2(g) (g)<br />
H =+241 241,8 kJ<br />
H O H + 1 (l) H2(g) (g) + / O 1 / 2 O2(g) (g)<br />
H 2O (l)<br />
H H = +285 285 285,88 kJ<br />
C. A. Mattia 4
A pressione costante<br />
H H e E E<br />
H H H = U U U + ppV ppV<br />
Se il cambiamento <strong>di</strong> volume è molto piccolo:<br />
ppV V V 0 H H H U U<br />
C. A. Mattia 5<br />
Stati standard e H standard<br />
Ad esempio esempio, lo stato standard dell’etanolo dell etanolo a<br />
298 Kè etanolo liquido puro a 298 Ke1bar bar.<br />
Lo stato standard del ferro a500 500 Kè ferro<br />
puro solido ad 1bar bar.<br />
Si deve considerare la fase più stabile stabile.<br />
Una variazione <strong>di</strong> entalpia standard, èil il H <strong>di</strong><br />
un processo d dove sia l lo stato iniziale l che h quello<br />
ll<br />
finale fna sono stati stat standard standard. stan ar .<br />
C. A. Mattia 7<br />
Stati standard<br />
È comodo considerare le variazioni <strong>di</strong> entalpia<br />
<strong>di</strong> un processo, riferite ad un insieme <strong>di</strong><br />
con<strong>di</strong>zioni <strong>di</strong> i i standard standard. d d<br />
Si è deciso <strong>di</strong> considerare una pressione<br />
standard <strong>di</strong> 1bar bar. Me Mentre nt re per la temperatura<br />
non si èfissato fissato uno standard, se non in<strong>di</strong>cata,<br />
convenzionalmente si usa 25 °C C (298 298 298,15 15 K) K).<br />
Lo stato standard <strong>di</strong> una sostanza ad una data<br />
temperatura<br />
temperatura, èla la sua forma pura alla pressione<br />
<strong>di</strong> 1 bar bar.<br />
C. A. Mattia<br />
Tipo <strong>di</strong><br />
Processo<br />
tipo tipoH<br />
H <br />
H H standard<br />
H H2O (l) H H2O (g)<br />
Reagenti e<br />
prodotti p in stati<br />
standard: 1 bar<br />
H ° (373 K) 44 kJ m l 1<br />
vap vapH (373 K) = +44 kJ mol mol-1 C. A. Mattia 8<br />
6
Cambiamenti <strong>di</strong> fase<br />
bl blH ° subl sublH =<br />
= f H ° = + H °<br />
fus fusH + vap vapH<br />
C. A. Mattia 9<br />
Altri H H standard<br />
Combustione cHH°<br />
Ionizzazione ion<br />
ionH° ionH<br />
Idratazione hyd<br />
hydH° hyd<br />
Miscelazione mix<br />
E altri …<br />
mixH°<br />
Il H° delle transizioni <strong>di</strong> fase è comodo<br />
riportarlo i l alla ll temperatura a cui i avviene i la l<br />
transizione.<br />
C. A. Mattia 11<br />
Cambiamenti <strong>di</strong> fase<br />
Gas<br />
Sublimazione Brinamento<br />
Condensazione<br />
vapH<br />
o Li Liquefazione f i<br />
Vaporizzazione<br />
sub subH° sub vap vapH° vap<br />
- sub subH° sub subH<br />
Fusione<br />
fus fusH° H°<br />
Liquido<br />
- vap vapH° vap vapH<br />
Soli<strong>di</strong>ficazione<br />
S Solido lid<br />
- fus fusH°<br />
S Sublimazione bli i<br />
Bi Brinamento t<br />
C. A. Mattia 10<br />
Entalpia p <strong>di</strong> combustione<br />
L’entalpia Lentalpia standard <strong>di</strong> combustione cH° cH è<br />
l’entalpia standard per la completa ossidazione<br />
<strong>di</strong> un composto organico organico, con O O2(g) (g), con<br />
formazione <strong>di</strong> CO<br />
CO2(g) (g) e H2O (l) (l).<br />
C C3HH 8(g) + 5 O 2(g) 3 3 CO 2(g) + 4 H H2O O (l)<br />
C6H 6(l) + 15/2 O O2(g) C6H12 12O 6(s) + 6 O O2(g) 2(g) CO CO2(g) 2(g) CO CO2(g) 2(g) + 3 H H2O (l)<br />
2(g) + 6 H H2O (l)<br />
C. A. Mattia 12
Entalpia p <strong>di</strong> reazione<br />
La variazione <strong>di</strong> entalpia per una reazione<br />
chimica è definita come<br />
H H = H Hprodotti prodotti prodotti prodotti - H reagenti<br />
reagenti.<br />
Una equazione termochimica include il valore <strong>di</strong><br />
H ele le fasi in cui sono presenti ireagenti reagenti ei<br />
prodotti<br />
CH 4(g) + 2 O O2(g) 2(g) CO CO2(g) 2(g) + 2 H H2O (g)<br />
H= H= -802 802 kJ<br />
C. A. Mattia 13<br />
Etalpia p standard <strong>di</strong> reazione<br />
Un <strong>di</strong>verso modo <strong>di</strong> descrivere la<br />
variazione <strong>di</strong> entalpia in una reazione<br />
chimica, h è riportare l’ l’entalpia l standard d d d <strong>di</strong><br />
reazione rHH°<br />
CH 4(g) + 2 O O2(g) 2(g) CO CO2(g) 2(g) + 2 H H2O (g) (g)<br />
rH°= = -802 802 kJ mol mol-1 Notare che è un’entalpia molare.<br />
C. A. Mattia 15<br />
N 2(g)<br />
Equazioni q termochimiche<br />
2(g) + 3 H 2(g) 2 NH NH3(g) 3(g)<br />
H = -92,8 92,8 kJ kJ/mol /mol<br />
Notare che per reagenti e<br />
prodotti d tti vengono specificate ifi t le l fasi f i Il segno < 0 in<strong>di</strong>ca una<br />
reazione esotermica<br />
Avendo solamente 1,8 moli <strong>di</strong> H 2 come si calcola<br />
l’ l’entalpia l entalpia <strong>di</strong> reazione?<br />
Si Si moltiplica moltiplica l’equazione l equazione per per 1,8/3 1 8/3 incluso incluso il il H H<br />
H H = - 92 92,38 38 kJ kJ•1,8/3 1 8/3 = - 55 55,43 43 kJ<br />
C. A. Mattia 14<br />
Diagrammi g <strong>di</strong> entalpia p<br />
Un <strong>di</strong>agramma g <strong>di</strong> entalpia p mostra H per p lo stato iniziale<br />
e finale del processo.<br />
H<br />
H 1<br />
H 2<br />
CH CH4(g) 4( 4(g) ) + +2O + 2 O O2(g) 2( 2(g) )<br />
CO 2(g) + 2 H H2O (g)<br />
A A pressione ssi costante st t q = H H H = -802 802 kJ kJ.<br />
C. A. Mattia<br />
H H = -802 802 kJ<br />
16
Entalpie p <strong>di</strong> reazione<br />
La variazione <strong>di</strong> entalpia <strong>di</strong>pende dalla fase dei reagenti e<br />
dei prodotti<br />
CH CH4(g) 4(g) + 2 O O2(g) 2(g) CO CO2(g) 2(g) + 2 H H2O O(l) (l) H= H= H -890 890 kJ<br />
C. A. Mattia<br />
H<br />
CH CH4(g) 4(g) 4(g) + 2 O 2(g)<br />
4(g)<br />
-802 802 kJ<br />
CO 2(g) + 2H 2HO 2 H H2O (g)<br />
CO CO2(g) 2( 2(g) ) + +2H + 2 H H2O 2O (l)<br />
H H = -890 890 kJ<br />
Entalpie p <strong>di</strong> reazione<br />
H è è una una proprietà proprietà estensiva estensiva, quin<strong>di</strong> il H H H <strong>di</strong>pende<br />
dalla quantità <strong>di</strong> reagenti e <strong>di</strong> prodotti.<br />
Qual è il H H per p la combustione <strong>di</strong> 11,0 g <strong>di</strong> CH 4<br />
in eccesso <strong>di</strong> ossigeno?<br />
C. A. Mattia<br />
CH 4(g) + 2 O 2(g) CO CO CO 2(g) + 2 H H2O 2O (g)<br />
mol CH4<br />
11,0 g CH4 <br />
16,<br />
04 g CH<br />
802 kJ<br />
<br />
mol CH<br />
16 4<br />
4<br />
H H H = -802 802 kJ<br />
= -550 kJ<br />
17<br />
19<br />
Entalpie p <strong>di</strong> reazione<br />
Invertendo la reazione, , il H H si inverte <strong>di</strong> segno. g<br />
C. A. Mattia<br />
CO CO2(g) 2(g) + 2 H H2O (g)<br />
H H<br />
H 2<br />
H H1 (g) CH CH4(g) 4(g) + 2 O O2(g) 2(g)<br />
CH CH4(g) (g) + 2 O O2(g) (g)<br />
CO CO2(g) 2(g) (g) + 2H 2 H H2O(g) 2O(g) O(g)<br />
H H = +802 kJ<br />
H H = +802 kJ<br />
Entalpie p <strong>di</strong> reazione<br />
Quanto butano b bisogna b bruciare b<br />
per produrre d 100 kJ kJ <strong>di</strong> <strong>di</strong> calore? l ?<br />
2 C C4H 10(g) (g) + 13 O O2(g) (g)<br />
2(g) (g) 8 8 CO 2(g) (g) + 10 H H2O (g)<br />
H H = -5317 5317 kJ<br />
2 mol C4H10<br />
58,12 g C<br />
100 kJ <br />
4H10<br />
100 kJ <br />
= 2,19 g C C4H 4H10 10<br />
kJ mol C<br />
C. A. Mattia<br />
5317 10<br />
4H<br />
18<br />
20
Legge gg <strong>di</strong> Hess<br />
C Consideriamo id i una reazione i i in d due sta<strong>di</strong>. t <strong>di</strong><br />
Qual è il H?<br />
C (s) + ½ O 2(g) CO (g) (g) H 1 =<br />
= -110 110 kJ<br />
CO (g) + ½ O O2(g) 2(g) CO CO 2(g) H 2 = -283 283 kJ<br />
___________________ ___________<br />
C (s) + O 2(g) CO CO2(g) 2(g) H H H = -393 393 kJ<br />
C (s)<br />
Legge <strong>di</strong> Hess Hess: Hess Hess: per una reazione sud<strong>di</strong>visa in più<br />
sta<strong>di</strong>, il H totale èla la somma delle variazioni <strong>di</strong><br />
entalpia t l i dei d ddei i singoli i li sta<strong>di</strong> sta<strong>di</strong>. t <strong>di</strong><br />
C. A. Mattia<br />
Legge gg <strong>di</strong> Hess<br />
La Legge <strong>di</strong> Hess è semplicemente<br />
una applicazione del primo principio<br />
della termo<strong>di</strong>namica a processi p a<br />
pressione costante costante.<br />
Ha principalmente una importanza<br />
storica, essendo stata formulata<br />
prima i d del l primo i principio i i i d della ll<br />
termo<strong>di</strong>namica termo<strong>di</strong>namica, da cui <strong>di</strong>scende <strong>di</strong>scende.<br />
C. A. Mattia<br />
21<br />
23<br />
Legge gg <strong>di</strong> Hess<br />
La legge gg <strong>di</strong> Hess si basa sul fatto che l’entalpia l’ entalpia p è una<br />
funzione <strong>di</strong> stato stato.<br />
C. A. Mattia<br />
H H C (s) +O + O 2(g)<br />
-110 110 kJ<br />
CO (g) + ½ O 2(g)<br />
CO 2(g)<br />
-283 283 83 kJ J<br />
H H = -393 393 kJ<br />
La legge gg <strong>di</strong> Hess in azione<br />
Date due reazioni chimiche (#1 and #2) e il loro H<br />
#1 #1: : Fe Fe2O3 + 3CO (g) 2 Fe (s) + 3CO 2(g)<br />
H=-26,7 26,7 kJ kJ/mol /mol<br />
#2 #2: #2 #2: : CO ( (g) ) + 1/2 O O2(g) 2( 2(g) ) CO CO2(g) 2( 2(g) )<br />
H=-283,0 283,0 kJ kJ/mol /mol<br />
calcolare l l il il H H d della ll seguente reazione reazione: i<br />
2 Fe (s) (s) + 3/2 O 2(g) Fe Fe2OO 3(s) 3(s) H H = ?<br />
C. A. Mattia 24<br />
22
Passo 1<br />
C Cominciamo i i controllando t ll d l la posizione i i <strong>di</strong> reagenti ti e<br />
prodotti nella reazione desiderata e in quelle date.<br />
Obiettivo: 2 Fe (s) (s) (s) (s) + 3/2 O O2(g) 2( 2(g) ) Fe Fe2O 2O 3(s) H= H = ?<br />
#1 #1: Fe Fe2O3 + 3CO (g) (g) 2 Fe (s) + 3CO 3CO2(g) 2(g) H=-26,7 26,7 kJ/mol<br />
Osserviamo che il ferro appare pp a destra nella<br />
reazione obiettivo ea sinistra nella #1.<br />
S SSoluzione Soluzione: l i i invertiamo ti l la reazione i #1 #1, e<br />
cambiamo segno alla sua entalpia. entalpia<br />
C. A. Mattia 25<br />
Passo 3<br />
Ora sommiamo assieme le due equazioni e<br />
cancelliamo ciò che appare sia adestra destra che a<br />
sinistra (se anche la fase èidentica) identica).<br />
2 F Fe (s) + 3CO 2(g) F Fe Fe2OO 3(s) + 3CO (g)<br />
3CO (g) + 3/2 O 2(g) 3 CO 2(g)<br />
2Fe (s) +3CO +3CO2(g) 2(g) +3CO (g) + 3/2O 2(g) <br />
3CO H = = + 26,7 6 k kJ kJ/mol /mol / l<br />
(g) H<br />
H H = = - 849,0 kJ kJ/mol /mol<br />
Fe Fe2O 3(s) + 3CO (g) (g)+ + 3CO 2(g)<br />
2 Fe (s) + 3/2 O 2(g) Fe Fe2O 3(s)<br />
H H H = = = -822,3 822 822,3 3 kJ/mol<br />
C. A. Mattia 27<br />
Passo 2<br />
Ci devono essere 3/2 O2 a sinistra, e<br />
dobbiamo cancellare 3 CO e 3 CO CO2 quando<br />
sommiamo le equazioni. equazioni Moltiplichiamo per 3<br />
la seconda reazione, eil il suo H.<br />
[ (g)<br />
#2 #2: : 3 [CO CO (g) + 1/2 O 2(g)<br />
2(g) CO 2(g) ]<br />
H= H = 3* 3*(-283 3 (-283,0 283 283,0 0 kJ) = -849 -849,0 849 849,0 0 kJ/mol<br />
C. A. Mattia 26<br />
Esercizio<br />
Calcolare il H° per p la reazione<br />
S (s)<br />
Dati<br />
2 SO 2(g) + O 2(g)<br />
2 S (s) + 3 O O2(g) (s) + O O2(g) SO<br />
2(g) <br />
2(g) 2 SO 3(g)<br />
2(g) 2 SO 3(g)<br />
S (s) + 3/2 O O2(g) 2(g) SO<br />
SO3(g) 3(g)<br />
SO2(g) 2(g)<br />
H° = 196 196 kJ/mol<br />
(a) ( (a) )<br />
H° = 790 790 kJ/mol<br />
(b)<br />
(b)•1/2<br />
SO 3(g) SO 2(g) + 1/2 O 2(g) (a)• (a)•-1/2 1/2<br />
S (s) ( ) + O O2(g) (g)<br />
2(g) (g) SO 2(g) (g)<br />
ΔH = ½ ΔΔHb<br />
Hb + (-½) ( ) ΔHa<br />
ΔH° = ½( ½(-790) 790) + (-½)( ( )(-196) 196) = -297 297 kJ kJ/mol /mol<br />
C. A. Mattia 28
Cibo<br />
n unità <strong>di</strong><br />
energia<br />
g<br />
Per non non ingrassare<br />
ingrassare<br />
o si mangia <strong>di</strong> meno<br />
o si i consuma <strong>di</strong> <strong>di</strong> più iù<br />
facendo più<br />
esercizio.<br />
Cibo e grasso g<br />
Grasso<br />
nn-a a unità<br />
<strong>di</strong> energia<br />
Esercizio<br />
a unità <strong>di</strong><br />
energia<br />
i<br />
C. A. Mattia 29<br />
Contenuto calorico<br />
La quantità relativa <strong>di</strong> proteine, grassi e<br />
carboidrati nei cibi costituisce il contenuto<br />
calorico calorico.<br />
C. A. Mattia 31<br />
Contenuto energetico g dei cibi<br />
L’energia ’ chimica h negli l animali l d deriva d dalla ll<br />
metabolizzazione <strong>di</strong> carboidrati, , grassi g e proteine proteine. p<br />
Valore energetico (kJ/g) (Cal/g)<br />
Carboidrati 17 4<br />
Grassi 38 9<br />
Proteine 17 4<br />
Spesso <strong>di</strong> usano le Calorie (Cal o kcal)<br />
1 Cal l = 1 kcal k l = 4,184 kJ k<br />
C. A. Mattia 30<br />
Carboidrati<br />
La maggior parte dell’energia dell energia <strong>di</strong> cui abbiamo<br />
bisogno deriva dalla combustione <strong>di</strong> zuccheri e<br />
grassi grassi. i<br />
Per il glucosio glucosio, la combustione è:<br />
C6H12 12O 6 (s) + 6 O O2(g) (g) 6 CO 2 (g) + 6 H H2O rH H = -2816 2816 kJ<br />
L’energia L LL’energia energ a è <strong>di</strong>sponibile d spon b le imme<strong>di</strong>atamente.<br />
mmed atamente.<br />
O (l) (l).<br />
Valore energetico me<strong>di</strong>o = 17 kJ/g = 4 kcal/g.<br />
C. A. Mattia 32
Coca Coca-Cola Cola ® …<br />
C. A. Mattia 33<br />
Proteine<br />
Contenuto energetico me<strong>di</strong>o = 17 kJ/g kJ/g,<br />
Quando vengono metabolizzate dal corpo<br />
umano, l’azoto contenuto viene trasformato ed<br />
espulso sotto forma <strong>di</strong> urea urea.<br />
Poiché i prodotti metabolici sono <strong>di</strong>versi da<br />
quelli lli ottenuti tt ti s semplicemente mpli m t b bruciando i d l le<br />
proteine p in presenza p <strong>di</strong> ossigeno, g , non è<br />
possibile utilizzare un normale calorimetro per<br />
misurare l’energia sviluppata sviluppata.<br />
C. A. Mattia 35<br />
Grassi<br />
Anche la combustione dei grassi produce CO 2 e<br />
H2O. O.<br />
Ad d esempio, l la tristearina<br />
C57 57H110 110O 6 (s) + 163/2 O O2(g) (g) 57 CO 2 (g) + 55 H H2O H 37 8 10 104 rH = -37,8 37,8 x 10 kJ 4 kJ<br />
O (l) (l).<br />
I grassi g sono il serbatoio energetico g del corpo p<br />
Insolubili in acqua<br />
C Contenuto t t energetico ti me<strong>di</strong>o m <strong>di</strong> = 38 38 kJ/g kJ/ circa i<br />
il doppio dei carboidrati.<br />
C. A. Mattia 34<br />
Calorimetri per p uomini<br />
C. A. Mattia 36
Reazione <strong>di</strong> formazione<br />
Reazione <strong>di</strong> formazione<br />
formazione: formazione<br />
formazione: è la reazione <strong>di</strong><br />
formazione <strong>di</strong> una mole <strong>di</strong> una sostanza dai suoi<br />
elementi nei loro stati standard (forma efase fase<br />
più p stabile a 1bar bar e alla temperatura p in<strong>di</strong>cata<br />
(se non in<strong>di</strong>cata si considera 25 25°)).<br />
Ad esempio, la reazione <strong>di</strong> formazione <strong>di</strong><br />
C CCaCO CO<br />
CaCO3(s) (s).<br />
Ca (s) + C (grafite) + 3 / 2 O 2(g)<br />
CaCO 3(s)<br />
C. A. Mattia 37<br />
Entalpia p standard <strong>di</strong> formazione<br />
Qual l è il l fH° H° d dell’ossigeno ll’ gassoso?<br />
O O fH fH H H = 0<br />
O 2(g)<br />
2(g) O 2(g)<br />
Qual è il fH ° del <strong>di</strong>amante?<br />
C (grafite) (grafite) C (<strong>di</strong>amante)<br />
fH fH = 1,9 kJ/mol<br />
Qual è il fH ° d dell’atomo ll’ d <strong>di</strong> cloro l gassoso?<br />
C. A. Mattia<br />
½ Cl 2(g) Cl (g) fH fH H H = 122 kJ/ kJ/mol l<br />
39<br />
Entalpia standard <strong>di</strong> formazione<br />
L’ L entalpia standard <strong>di</strong> formazione<br />
formazione, fHº fH Hº H , <strong>di</strong> una<br />
sostanza èil il H della sua reazione <strong>di</strong> formazione<br />
formazione.<br />
Ca (s) +C (grafite) 2 2(g) (g) CaCO 3(s) (s)<br />
(grafite) + 3 / 2 O 2(g)<br />
Ca (s) (s) +½O 2(g) (g) CaO (s)<br />
C (grafite)<br />
(grafite) + O O2(g) 2(g) CO CO 2(g)<br />
fH°(CaCO (CaCO3,s) ,s) =-1207 1207 kJ/mol<br />
fH°(CaO,s) (CaO,s) =-636 636 kJ/mol<br />
fH°(CO (CO2,g) ,g) = -394 394 kJ/mol<br />
C. A. Mattia 38<br />
Entalpia p standard <strong>di</strong> formazione<br />
fH(<strong>di</strong>amante) fH (<strong>di</strong>amante) = 1,9 1,9 kJ kJ. kJ kJ. . Come si trova?<br />
La conversione <strong>di</strong>retta dalla grafite al <strong>di</strong>amante<br />
non è semplice l ( (altrimenti l l lo f faremmo tutti )<br />
e quin<strong>di</strong> q non lo possiamo p misurare <strong>di</strong>rettamente.<br />
<strong>di</strong>rettamente<br />
Possiamo tuttavia bruciare della grafite e del<br />
<strong>di</strong> <strong>di</strong>amante t , misurare i i calori l i <strong>di</strong> combustione, b ti e<br />
usare le legge <strong>di</strong> Hess Hess.<br />
C (grafite) (g f ) + O 2(g) (g) CO CO 2(g) (g) f<br />
C (<strong>di</strong>amante) ( ) + O 2(g) (g) CO CO 2(g) (g) f<br />
fH° = -393,5 393,5 kJ/mol<br />
fH° = -395,4 395,4 kJ/mol<br />
C. A. Mattia 40
Entalpia p standard <strong>di</strong> formazione<br />
Entalpie molari a 298 K e 1 bar<br />
C. A. Mattia 41<br />
Termo<strong>di</strong>namica e cinetica<br />
La grafite è termo<strong>di</strong>namicamente più stabile<br />
del <strong>di</strong>amante <strong>di</strong>amante.<br />
Tuttavia, la termo<strong>di</strong>namica non <strong>di</strong>ce nulla sul<br />
tempo necessario afar far avvenire i processi processi.<br />
Questo riguarda invece la cinetica chimica chimica.<br />
La cinetica chimica in<strong>di</strong>ca che la velocità della<br />
reazione <strong>di</strong> trasformazione del <strong>di</strong>amante in<br />
grafite è estremamente lenta. lenta<br />
C. A. Mattia 43<br />
fH fH H° (C (C, (C, grafite) grafite) = = 0<br />
Diamanti<br />
fH fH H° (C (C, (C, <strong>di</strong>amante) <strong>di</strong>amante) = 1 1,90 90 kJ/mol<br />
La grafite è più stabile del <strong>di</strong>amante.<br />
Perché P PPerché hé gli li anelli lli non si i trasformano f i in<br />
carbone?<br />
Si trasformano, ma lo fanno molto<br />
lentamente!<br />
C. A. Mattia 42<br />
Entalpia p standard <strong>di</strong> reazione<br />
Possiamo considerare una reazione come una<br />
decomposizione dei reagenti negli elementi, e<br />
nella formazione dei prodotti a partire dagli<br />
elementi elementi.<br />
Quin<strong>di</strong> il rH è esprimibile come:<br />
rH° = n n fH°(prodotti prodotti) ) - m m fH°(reagenti reagenti)<br />
Reagenti e prodotti devono essere alla stessa<br />
temperatura<br />
temperatura.<br />
C. A. Mattia 44
H° a partire dai fH°<br />
r p f<br />
I fH H in kJ/m kJ/mol l sono s n tabulati. tabulati<br />
Al (s) (s)<br />
BaCO<br />
CO (g)<br />
CO 2(g)<br />
CS<br />
S Sostanza t fHH Sostanza fHH <br />
BaCO3(s) 3(s)<br />
CS 2(g)<br />
0<br />
-1219 1219<br />
-110 110<br />
-394 394<br />
+117<br />
Cl 2(g)<br />
H H2O O(ll)<br />
H2O (g)<br />
NaHCO<br />
Na Na2CO NaHCO NaHCO3(s) 3(s) 3(s) 3(s)<br />
CO 3(s)<br />
0<br />
-286 286<br />
-242 242<br />
-947,7 947,7<br />
-1131 1131<br />
Ricordare che i fH H per gli elementi nei loro stati<br />
standard è 0.<br />
C. A. Mattia 45<br />
Variazione rH° con la temperatura<br />
p<br />
r<br />
Le entalpie standard <strong>di</strong> molte importanti<br />
reazioni sono state misurate a varie<br />
temperature e riportate in tabelle tabelle.<br />
In mancanza <strong>di</strong> informazioni informazioni, si possono<br />
calcolare in modo approssimato rH°(T) (T).<br />
L’espressione della variazione <strong>di</strong> entalpia<br />
H ( T<br />
T<br />
2) H ( T1)<br />
<br />
2<br />
T<br />
1<br />
C pdT<br />
C. A. Mattia 47<br />
Entalpia p standard <strong>di</strong> reazione<br />
Calcoliamo il rHº Hº della reazione<br />
CaCO 3( 3(s) ) CaO () ()+ (s) + CO CO2(g) 2( 2(g) )<br />
H Ca () ()+ + C () ()+ + 3 H Ca (s) + C (s) + / 2<br />
1207 kJ<br />
CaCO 3(s)<br />
2 O O2(g) 2( 2(g) )<br />
177 kJ<br />
-636 636 + -394 394 kJ<br />
CaO(s) + CO CO2(g) 2(g) (g)<br />
Hº H = fH°(CaO fH (CaO,s) s) + fH°(CO fH (CO22,g) g) - fH°(CaCO fH (CaCO33,s) s)<br />
C. A. Mattia<br />
Legge gg <strong>di</strong> Kirchhoff<br />
<br />
r<br />
H (<br />
T2<br />
) <br />
<br />
C<br />
r<br />
<br />
p<br />
r<br />
T<br />
H (<br />
T1)<br />
<br />
rC<br />
<br />
<br />
prodotti<br />
C<br />
<br />
p,<br />
m<br />
T<br />
2<br />
1<br />
<br />
<br />
reagenti<br />
<br />
p<br />
C<br />
Se T T T T è è piccolo, piccolo possiamo<br />
considerare le capacità<br />
termiche costanti.<br />
C. A. Mattia 48<br />
dT<br />
<br />
p,<br />
m<br />
46
Yerka<br />
Calore<br />
Termo<strong>di</strong>namica<br />
Trasformazione <strong>di</strong><br />
<strong>di</strong><br />
in<br />
Van Gogh<br />
Lavoro<br />
C. A. Mattia 49<br />
Che cosa è la spontaneità?<br />
p<br />
La spontaneità è la capacità <strong>di</strong> un<br />
processo p <strong>di</strong> avvenire senza<br />
interventi esterni esterni.<br />
Accade naturalmente.<br />
Termo<strong>di</strong>namica<br />
Termo<strong>di</strong>namica: un processo p è<br />
spontaneo se avviene senza che<br />
venga eseguito it d del l l lavoro sul sull<br />
sistema sistema.<br />
C. A. Mattia 51<br />
Processi spontanei<br />
p<br />
Perché le cose accadono?<br />
Tempo<br />
C. A. Mattia 50<br />
Esempi p <strong>di</strong> processi p spontanei p<br />
Una pallina scende spontaneamente una<br />
<strong>di</strong>scesa, ma non sale spontaneamente una<br />
salita salita.<br />
Il ferro arrugginisce spontaneamente, spontaneamente ma la<br />
ruggine non forma spontaneamente ossigeno<br />
e ferro ferro. ferro ferro.<br />
Un gas si espande fino a riempire il<br />
contenitore<br />
contenitore. Le molecole <strong>di</strong> un gas non si<br />
concentrano mai nell’angolo <strong>di</strong> un recipiente. recipiente<br />
L’acqua soli<strong>di</strong>fica spontaneamente a<br />
temperature inferiori a 0 °CC.<br />
C. A. Mattia 52
Esempi p più p complessi p<br />
Gli esseri viventi invecchiano<br />
invecchiano.<br />
L’universo Luniverso pare avere una freccia del<br />
tempo tempo.<br />
Se un processo è spontaneo in una<br />
<strong>di</strong> <strong>di</strong>rezione, i allora ll nelle ll stesse t con<strong>di</strong>zioni<br />
<strong>di</strong> i i<br />
il processo opposto non è spontaneo spontaneo. spontaneo spontaneo.<br />
I processi p spontanei p sono sempre<br />
p<br />
irreversibili<br />
irreversibili.<br />
C. A. Mattia 53<br />
Reazioni spontanee p<br />
CH CH4 + O O2 CO CO2 + H H2O O + energia<br />
oppure<br />
CO 2 + H H2O 2O + energia g CH 4 + O 2<br />
Il primo p principio p p non è in grado g <strong>di</strong><br />
prevedere il verso <strong>di</strong> una reazione.<br />
C. A. Mattia 55<br />
Equilibrio q termico. Perché?<br />
L’esperienza L esperienza ci <strong>di</strong>ce che<br />
due oggetti a<br />
temperature d <strong>di</strong>verse<br />
posti a contatto<br />
raggiungono l’equilibrio<br />
termico e raggiungono la<br />
stessa temperatura<br />
temperatura.<br />
Perché?<br />
La conservazione<br />
dell’energia non c’entra!<br />
C. A. Mattia 54<br />
Spontaneità velocità<br />
La spontaneità <strong>di</strong> un processo non ha nulla a che<br />
fare con la velocità con cui avviene. avviene<br />
La spontaneità riguarda l’accadere omeno meno del<br />
processo processo, non la sua velocità (lenta o veloce) veloce).<br />
Non si deve confondere un processo spontaneo<br />
con una velocità estremamente piccola, con un<br />
processo non spontaneo spontaneo. t<br />
La conversione del <strong>di</strong>amante in grafite è<br />
spontanea, ma estremamente lenta lenta.<br />
C. A. Mattia 56
Spesso le reazioni<br />
esotermiche sono<br />
spontanee.<br />
Fe Fe2O 2 3(s) + 2 Al (s) (s) <br />
2 Fe (s) (s) + Al Al2O3(s) 3(s)<br />
Spontaneità p H H < 0<br />
H H = - 848 kJ/mol.<br />
C. A. Mattia 57<br />
Processi spontanei p e temperatura p<br />
La <strong>di</strong>rezione <strong>di</strong> un processo può <strong>di</strong>pendere dalla<br />
temperatura.<br />
Il ghiaccio hi i fonde f ffonde d spontaneamente t t a T > 0 C. CC.<br />
L’ L’acqua acqua q soli<strong>di</strong>fica spontaneamente p<br />
a T < 0 C. C.<br />
C. A. Mattia 59<br />
Spontaneità p H H < 0<br />
Molti processi spontanei sono endotermici.<br />
NH NH4Cl Cl (s) +<br />
+ energia NH NH4Cl Esistono anche processi<br />
spontanei con H H = 0.<br />
L’energia L LL’energia energia dell dell’universo universo è<br />
è<br />
costante: un processo<br />
spontaneo esotermico i<br />
(sistema) ( ) è anche spontaneo p<br />
endotermico (ambiente).<br />
C. A. Mattia<br />
Cl (aq) (aq)<br />
Spontaneità p e funzioni <strong>di</strong> stato<br />
“Though Though the course may change sometimes,<br />
rivers always reach the sea sea” ”<br />
(Page/Plant Page/Plant ‘Ten Ten Years Gone’ Gone , Led Zeppelin Zeppelin) Zeppelin Zeppelin). ).<br />
La spontaneità <strong>di</strong> un processo non <strong>di</strong>pende dal cammino<br />
percorso, p , ma m solo dallo stato iniziale e finale. f<br />
C. A. Mattia 60<br />
58
Mistero<br />
Sherlok Holmes:<br />
Mmmhh Mmmhh, dagli dagli in<strong>di</strong>zi in<strong>di</strong>zi raccolti raccolti mi mi par<br />
par<br />
<strong>di</strong> poter p concludere che è coinvolta<br />
una funzione <strong>di</strong> stato.<br />
Ma quale? q<br />
C. A. Mattia 61<br />
Mi Microscopico i<br />
Macroscopico<br />
La freccia del tempo<br />
p<br />
Conservazione Conservazione dell’energia<br />
dell’energia gg<br />
Conservazione Conservazione del del momento momento<br />
Conservazione Conservazione dell’energia<br />
dell’energia<br />
Conservazione Conservazione del del momento momento<br />
C. A. Mattia 63<br />
La freccia del tempo<br />
p<br />
Un uovo che cade si rompe. rompe<br />
Il processo inverso<br />
inverso (t (tuorlo l<br />
ealbume albume che saltano nella mano<br />
e ricompongono l’uovo) non<br />
accade mai. mai<br />
I processi spontanei hanno una <strong>di</strong>rezione<br />
La freccia del tempo<br />
C. A. Mattia 62<br />
La temperatura non<br />
varia varia.<br />
Spontanea, ma U U = 0.<br />
Perché il gas si<br />
espande?<br />
d ?<br />
Espansione p <strong>libera</strong> gas g ideale<br />
L’espansione è isoterma.<br />
Il gas non compie lavoro<br />
e non non v viene ene<br />
scambiato<br />
calore. l<br />
C. A. Mattia 64
Perché le cose accadono?<br />
La scienza moderna non può accontentarsi<br />
delle risposte tipiche <strong>di</strong> altri contesti contesti: contesti contesti:<br />
Aristotele Aristotele: le cose tendono al loro stato<br />
naturale naturale. Isassi sassi cadono perché vogliono andare<br />
verso il basso basso.<br />
Religione: Religione g le cose accadono perché p così vuole<br />
Dio (azioni ↔ libero arbitrio) arbitrio).<br />
Abbiamo bisogno <strong>di</strong> un criterio <strong>di</strong>mostrabile<br />
e utilizzabile in pratica pratica.<br />
C. A. Mattia 65<br />
Spontaneità p ed energia g<br />
Tuttavia Tuttavia, ad un esame attento attento, ci<br />
accorgiamo che alla fine <strong>di</strong> un processo<br />
spontaneo d <strong>di</strong> un sistema isolato, l l’ l’energia<br />
è <strong>di</strong>stribuita in maniera <strong>di</strong>versa <strong>di</strong>versa.<br />
Alla fine <strong>di</strong> una espansione espansione, le molecole<br />
del gas, sono <strong>di</strong>stribuite in tutto il<br />
contenitore<br />
contenitore.<br />
L’energia ha molti più mo<strong>di</strong> per essere<br />
<strong>di</strong>stribuita <strong>di</strong>stribuita.<br />
C. A. Mattia 67<br />
Spontaneità p ed energia g<br />
L’energia g totale non può p essere responsabile<br />
p<br />
della <strong>di</strong>rezione <strong>di</strong> un processo processo.<br />
Neppure la quantità <strong>di</strong> energia del sistema può<br />
essere r responsabile<br />
responsabile.<br />
r p n a .<br />
Un Gas si espande, espande, ma U =0.<br />
Se l’energia del sistema <strong>di</strong>minuisce, quella<br />
d dell’ambiente ll’ bi t aumenta, t eviceversa viceversa. i M Ma l la <strong>di</strong> <strong>di</strong>visione i i<br />
tra sistema e ambiente è arbitraria. arbitraria<br />
Quin<strong>di</strong> un criterio che ponesse l’accento solo sul<br />
sistema<br />
corretto corretto.<br />
o solo sull’ambiente<br />
sull sull’ambiente ambiente non può essere<br />
C. A. Mattia 66<br />
Dispersione p <strong>di</strong> energia g<br />
Saltando la palla p trasferisce energia g<br />
termica alle molecole del suolo.<br />
A poco a poco, tutta l’energia l’<br />
potenziale della palla si<br />
trasforma in calore.<br />
Non osserviamo<br />
il processo<br />
inverso<br />
C. A. Mattia 68
Dispersione p <strong>di</strong> energia g<br />
L’energia L LL’energia energia or<strong>di</strong>nata<br />
delle molecole della palla<br />
viene convertita in<br />
calore ovvero in energia g<br />
termica delle molecole.<br />
L’energia L LL’energia energia termica è<br />
è<br />
<strong>di</strong>sor<strong>di</strong>nata<br />
<strong>di</strong>sor<strong>di</strong>nata, le<br />
molecole l l si i muovono in i<br />
modo casuale.<br />
C. A. Mattia 69<br />
Dispersione p <strong>di</strong> energia g e <strong>di</strong>sor<strong>di</strong>ne<br />
Dopo secoli, si è capito che i cambiamenti<br />
spontanei sono accompagnati non da<br />
<strong>di</strong> <strong>di</strong>minuzione i i <strong>di</strong> energia i ( (anche h se spesso l’ l’energia i<br />
del sistema <strong>di</strong>minuisce) ma da una ri<strong>di</strong>stribuzione<br />
dell’energia in una forma più <strong>di</strong>sor<strong>di</strong>nata<br />
<strong>di</strong>sor<strong>di</strong>nata.<br />
Tempo<br />
C. A. Mattia 71<br />
Dispersione p <strong>di</strong> energia g<br />
Dopo aver <strong>di</strong>ssipato<br />
tutta l’energia<br />
potenziale potenziale, le molecole<br />
del suolo e della palla si<br />
muovono in maniera più ù<br />
<strong>di</strong>sor<strong>di</strong>nata<br />
<strong>di</strong>sor<strong>di</strong>nata.<br />
Il processo inverso non<br />
avviene avviene: : scaldando il<br />
paviment pavimento la la palla<br />
appoggiata non inizia a<br />
saltellare.<br />
C. A. Mattia 70<br />
Seconda legge gg della termo<strong>di</strong>namica<br />
Kelvin Kelvin-Plank<br />
Kelvin Plank<br />
Nessun processo p può, p come solo risultato, prendere p<br />
calore da un serbatoio econvertirlo<br />
convertirlo completamente<br />
in lavoro lavoro.<br />
Clausius aus us<br />
È impossibile un trasferimento spontaneo <strong>di</strong> calore<br />
da un corpo freddo ad uno caldo. caldo<br />
Sono affermazioni <strong>di</strong> impossibilità.<br />
p<br />
C. A. Mattia 72
Seconda legge gg della termo<strong>di</strong>namica<br />
È una legge probabilistica<br />
probabilistica.<br />
probabilistica<br />
probabilistica.<br />
È molto improbabile che tutte le molecole d’aria<br />
vadano nello stesso istante nell’angolo nell nell’angolo angolo della stanza stanza, e<br />
io muoia soffocato. soffocato<br />
Richiede un’analisi del concetto <strong>di</strong> probabilità<br />
<strong>di</strong> una <strong>di</strong>stribuzione <strong>di</strong> materia e energia, e una<br />
grandezza per misurarla quantitativamente:<br />
quantitativamente<br />
C. A. Mattia 73<br />
Entropia p macroscopica p<br />
Consideriamo ora l’effetto l effetto <strong>di</strong> un trasferimento<br />
reversibile infinitesimo <strong>di</strong> calore ad un corpo corpo.<br />
Dal punto <strong>di</strong> vista dell’or<strong>di</strong>ne molecolare edella della<br />
ri<strong>di</strong>stribuzione energetica interna interna, fornire una<br />
quantità dq rev al sistema ha un effetto<br />
maggiore se la temperatura è bassa. bassa<br />
S Se il sistema it è già ià ad add alte lt t temperature, t avrà<br />
à<br />
già g una grande g ri<strong>di</strong>stribuzione interna<br />
dell’energia, e fornire dq rev al sistema ha meno<br />
effetto effetto.<br />
C. A. Mattia 75<br />
Entropia p macroscopica p<br />
Come possiamo p esprimere p l’entropia p in termini<br />
miacroscopici<br />
miacroscopici?<br />
Le molecole <strong>di</strong> un sistema ad alta temperatura sono<br />
molto <strong>di</strong>sor<strong>di</strong>nate, sia nella loro posizione sia in<br />
termini <strong>degli</strong> stati energetici occupati (t (traslazionali<br />
ttraslazionali, sl i li<br />
vibrazionali, rotazionali)<br />
rotazionali).<br />
L Le molecole l l <strong>di</strong> un corpo a b bassa t temperatura t (ad ( (ad d<br />
esempio un solido) sono molto più or<strong>di</strong>nate, sia nella<br />
posizione i i sia i negli li stati t ti energetici ti i permessi permessi. i<br />
Un sistema a bassa temperatura p ha meno stati<br />
energetici eposizioni posizioni permesse <strong>di</strong> un sistema ad alta<br />
temperatura<br />
temperatura. p<br />
C. A. Mattia 74<br />
Entropia p macroscopica p<br />
L’effetto L effetto sulla <strong>di</strong>stribuzione molecolare, a<br />
parità <strong>di</strong> dq <strong>di</strong>pende dalla temperatura.<br />
temperatura<br />
dqrev rev, <strong>di</strong>pende<br />
P Possiamo allora ll considerare d l la quantità à d dq / /T.<br />
dqrev rev/T<br />
Il calore non è un <strong>di</strong>fferenziale esatto esatto,<br />
tuttavia èpossibile possibile <strong>di</strong>mostrare che dq dqrev rev/T /T èun un<br />
<strong>di</strong>ff <strong>di</strong>fferenziale i l esatto. esatto tt<br />
Quin<strong>di</strong> esiste una funzione <strong>di</strong> stato stato, che<br />
chiamiamo entropia, tale che<br />
dS = dq dqq rev rev/T rev rev/T<br />
C. A. Mattia 76
Seconda legge gg della termo<strong>di</strong>namica<br />
L’entropia L’entropia p <strong>di</strong> un sistema isolato<br />
durante un processo spontaneo<br />
aumenta.<br />
S S <br />
0 tot<br />
C. A. Mattia 77<br />
S S t tot tt><br />
><br />
S tot =<br />
Variazioni <strong>di</strong> entropia p<br />
S S tot 0<br />
> 0 Processo irreversibile<br />
= 0 Processo reversibile<br />
In forma <strong>di</strong>fferenziale<br />
d dS dSamb amb+ + d dS sis 0<br />
C. A. Mattia 79<br />
C. A. Mattia<br />
Entropia: riassunto<br />
L’entropia (S) è una funzione <strong>di</strong> stato.<br />
S tot = S sis + S amb amb.<br />
S Se S S tot è positivo iti il il processo è è spontaneo. t<br />
Se S S tot t ttot ttè<br />
è negativo, negativo il il processo processo è è spontaneo<br />
spontaneo<br />
nella <strong>di</strong>rezione opposta.<br />
In un processo spontaneo<br />
l’entropia l ll’entropia entropia dell dell’universo universo aumenta sempre sempre.<br />
S<br />
<br />
f<br />
<br />
i<br />
dq<br />
T<br />
rev<br />
Or<strong>di</strong>ne e <strong>di</strong>sor<strong>di</strong>ne<br />
Le parole or<strong>di</strong>ne e <strong>di</strong>sor<strong>di</strong>ne non hanno significato<br />
in termo<strong>di</strong>namica classica, dato che non si<br />
i interessa t <strong>di</strong> modelli d lli d della ll materia. materia t i<br />
Nella termo<strong>di</strong>namica statistica statistica, un aumento <strong>di</strong><br />
entropia corrisponde ad un aumento <strong>degli</strong> stati<br />
accessibili al sistema sistema, aumentandone il <strong>di</strong>sor<strong>di</strong>ne <strong>di</strong>sor<strong>di</strong>ne.<br />
In termo<strong>di</strong>namica statistica si considera che il<br />
sistema sia libero <strong>di</strong> passare attraverso tutti gli<br />
stati possibili possibili.<br />
L’entropia p èuna una misura dei mo<strong>di</strong> in cui esiste il<br />
sistema sistema.<br />
C. A. Mattia 80<br />
78
Or<strong>di</strong>ne e <strong>di</strong>sor<strong>di</strong>ne<br />
Visitando il mio stu<strong>di</strong>o troverete molte carte<br />
sparse “a caso” caso per la stanza. stanza<br />
In generale <strong>di</strong>rete che la <strong>di</strong>sposizione delle<br />
carte è <strong>di</strong>sor<strong>di</strong>nata<br />
<strong>di</strong>sor<strong>di</strong>nata.<br />
Ritornando più p volte nel mio stu<strong>di</strong>o, , troverete<br />
le carte <strong>di</strong>sposte nello stesso modo, epertanto pertanto<br />
osserverete ss t un n’ unica ni <strong>di</strong>sp <strong>di</strong>sposizione<br />
<strong>di</strong>sposizione. si i n<br />
Dal punto <strong>di</strong> vista “entropico entropico” entropico non vi è<br />
<strong>di</strong>sor<strong>di</strong>ne, ma un tipo <strong>di</strong> “or<strong>di</strong>ne or<strong>di</strong>ne” <strong>di</strong>verso da<br />
quello ll atteso. atteso<br />
C. A. Mattia 81<br />
Molteplicità<br />
p<br />
W = 6<br />
C. A. Mattia 83<br />
Entropia p microscopica p<br />
S S0 = KlnW R = KN KNA Disposizione perfetta (or<strong>di</strong>nata)<br />
<strong>di</strong> molecole molecole <strong>di</strong> monossido <strong>di</strong><br />
carbonio in un cristallo.<br />
W = 1 S0 = 0<br />
Disposizione imperfetta<br />
(<strong>di</strong> (<strong>di</strong>sor<strong>di</strong>nata). <strong>di</strong> t )<br />
W > 1 S0 > 0<br />
0<br />
C. A. Mattia 82<br />
Entropia p microscopica p<br />
S S 0 = KlnW R = KN KNA Nel ghiaccio vi sono 6<br />
<strong>di</strong>sposizioni<br />
equivalenti <strong>di</strong> 4 atomi<br />
<strong>di</strong> H intorno ad un O.<br />
Altre <strong>di</strong>eci <strong>di</strong>sposizioni<br />
creano molecole con<br />
un numero <strong>di</strong> legami<br />
<strong>di</strong>verso da 2.<br />
2N atomi <strong>di</strong> H<br />
W = 2 2N (6/16) N = (3/2) N<br />
C. A. Mattia 84
Terza legge gg della termo<strong>di</strong>namica<br />
Per T =0, tutto il moto termico si è smorzato,<br />
e in inn cristallo cr cristallo stallo perfetto gli gl atomi atom o gli gl ioni on<br />
formano un reticolo regolare ed uniforme uniforme.<br />
Vi è un solo l modo d per ottenere questo<br />
arrangiamento.<br />
arrangiamento g<br />
S0 =kln ln(W) (W) =kln ln(1) =0.<br />
C. A. Mattia 85<br />
S = 0<br />
Terza Terza Terza Terza legge legge legge legge della della della della termo<strong>di</strong>namica<br />
termo<strong>di</strong>namica<br />
termo<strong>di</strong>namica<br />
termo<strong>di</strong>namica<br />
Ryman<br />
Se T = 0 con or<strong>di</strong>ne massimo, S = 0<br />
Mondrian<br />
S > 0<br />
S S > 0<br />
0<br />
Severini<br />
Pollock<br />
S S = SSmax<br />
SSmax<br />
max<br />
C. A. Mattia 87<br />
III legge gg della termo<strong>di</strong>namica<br />
l’ l’entropia <strong>di</strong> d un cristallo ll perfetto f a 0 K è è 0.<br />
A <strong>di</strong>fferenza delle entalpie entalpie, , le entropie hanno<br />
una scala assoluta, grazie alla terza legge legge.<br />
C. A. Mattia 86<br />
Non troppo seriamente...<br />
Prima legge legge: legge : non puoi vincere!<br />
Non puoi ricavare da un sistema più energia <strong>di</strong> quella<br />
che ci metti dentro dentro.<br />
Seconda legge legge: : non puoi neanche pareggiare!<br />
N Non puoi i tirare ti f fuori i neanche h t tutta tt l’ l’energia i che h ci i<br />
metti dentro.<br />
Terza legge legge: legge legge: : e neppure uscire dal gioco!<br />
L’entropia dell’universo aumenta sempre sempre.<br />
C. A. Mattia 88
Serbatoio<br />
Freddo<br />
Isolante<br />
Macchine Termiche<br />
Fluido<br />
Serbatoio<br />
Caldo<br />
Una macchina termica opera tra<br />
due tempe temperature rature <strong>di</strong>verse e<br />
trasforma tr trasforma sf rm p parte rt d del l calore c l r in<br />
lavoro.<br />
Il fluido interno compie un<br />
ciclo ciclo.<br />
C. A. Mattia 89<br />
p<br />
4<br />
1<br />
Ciclo <strong>di</strong> Carnot<br />
q T C<br />
q C<br />
q qF T F = costante<br />
C = costante<br />
2<br />
3<br />
1-2 2 : Isoterma<br />
2-3 3 : A<strong>di</strong>abatica<br />
3-4 4 : Isoterma<br />
4-1 1 : A<strong>di</strong>abatica<br />
costante Lavoro estratto<br />
V<br />
C. A. Mattia 91<br />
Motore<br />
C. A. Mattia 90<br />
p<br />
4<br />
w = C CV(T (T (TF-TT C) )<br />
q = 0<br />
1<br />
w = -RT RTCln(V C ln(V ( 2/V 2/V1) 1)<br />
q = +RT +RTCln(V ln(V2/V /V1) w = -RT RT RTFln(V ln(V ln(V4/V 4/V /V /V3) 3)<br />
q = +RT +RTFln(V ln(V4/V /V3) V<br />
Ciclo <strong>di</strong> Carnot<br />
2<br />
w = -RT RTCln(V C ln(V ( 2/V 2/V1)-RT 1) RTFln(V F ln(V ( 4/V 4/V3) 3)<br />
gli sta<strong>di</strong> a<strong>di</strong>abatici si elidono<br />
q C = RT RTCln(V Cln(V ln(V ln(V2/V /V /V1) )<br />
V c<br />
1TC = VV4T<br />
c<br />
F<br />
V T c V T c<br />
V c<br />
2TC = VV3T<br />
c<br />
F<br />
V1V3(T (TCTF) c = VV2V<br />
4(T (TCTF) c<br />
(TF-TC) V1/V /V2 = V V4/V /V3 w = =-R(T R(T R(TC-T C TF)ln(V F)ln(V )ln(V )ln(V2/V 2/V /V /V1) 1)<br />
3 ren<strong>di</strong>mento ε = |w|/|q |w|/|qC| ε = (T (TC-TT F)/T )/T )/TC ε = 1-T 1 F/T /TC ε = 1-q 1 F/q<br />
w = C CV(T q = 0<br />
/q C<br />
C. A. Mattia 92
p<br />
4<br />
1<br />
Ciclo <strong>di</strong> Carnot<br />
Efficienza:<br />
qC T TC= = costante<br />
2 <br />
lavoro compiuto / calore<br />
assorbito = 11-T<br />
F/T /TC. Nessun ciclo può essere<br />
più efficiente <strong>di</strong> un ciclo<br />
qF 3<br />
<br />
<strong>di</strong> Carnot senza violare la<br />
seconda legge.<br />
Si può p tendere a<br />
F=<br />
costante <br />
efficienza 1 se T C 0. 0.<br />
Percorrendo un ciclo<br />
in senso antiorario<br />
V<br />
otteniamo un<br />
fi frigorifero. if<br />
T F=<br />
C. A. Mattia 93<br />
Motore a ciclo <strong>di</strong> Otto<br />
P Passo 1: 1 Entra E t la l miscela i l aria i benzina b i dal d l carburatore b t<br />
C. A. Mattia 95<br />
Quattro Tempi<br />
12: 12: 2: a<strong>di</strong>abatica lenta<br />
23: 3: isocora veloce<br />
34: 4: a<strong>di</strong>abatica lenta<br />
441: 1 1: isocora veloce l<br />
Il Ciclo <strong>di</strong> Otto<br />
C. A. Mattia 94<br />
Motore a ciclo <strong>di</strong> Otto<br />
P Passo 2: 2 C Compressione i della d ll miscela i l<br />
C. A. Mattia 96
Motore a ciclo <strong>di</strong> Otto<br />
P Passo 3: 3 A Accensione i ed d espansione i d della ll miscela i l<br />
C. A. Mattia 97<br />
Processi spontanei<br />
p<br />
Un Un processo processo è è spontaneo spontaneo se se l’entropia<br />
l entropia<br />
dell’universo aumenta.<br />
S tot = S sis + S amb 0<br />
È scomodo d d dover esplicitamente li it t t tener conto t <strong>di</strong><br />
quello q che succede nell’universo. Preferiremmo<br />
concentrarci solo sul sistema.<br />
Se lavoriamo a pressione costante o a volume<br />
costante costante, è facile tener conto dei contributi<br />
entropici dell’ambiente.<br />
C. A. Mattia 99<br />
Motore a ciclo <strong>di</strong> Otto<br />
P Passo 4: 4 Scarico S i dei d i G Gas<br />
C. A. Mattia 98<br />
Processi spontanei<br />
p<br />
Partiamo dalla <strong>di</strong>suguaglianza <strong>di</strong> Clausius<br />
dq Processo<br />
dS 0<br />
T spontaneo<br />
Consideriamo la pressione p costante costante: : dq q = dH<br />
dH<br />
dS <br />
0<br />
T<br />
dH TdS <br />
0<br />
E Esprime Esprime il l criterio <strong>di</strong> d spontaneità à solo l in base b<br />
a funzioni <strong>di</strong> stato del sistema.<br />
C. A. Mattia 100
dH – T dS 0 0.<br />
<strong>Energia</strong> g <strong>di</strong> Gibbs<br />
Se S = costante costante, , H viene minimizzato.<br />
Se H = costante costante, , S viene massimizzato.<br />
Introduciamo la funzione<br />
G = energia g <strong>di</strong> Gibbs<br />
A temperatura costante<br />
G = H – T S<br />
Gibbs (energia energia <strong>libera</strong> <strong>libera</strong>). ).<br />
dG = dH – T dS – S dT = dH – T dS<br />
C. A. Mattia 101<br />
<strong>Energia</strong> g <strong>di</strong> Gibbs e universo<br />
S Se p e T sono costanti t ti<br />
G G G < 0 S S universo > 0<br />
Se p e T non sono costanti, G è ugualmente<br />
definita, ma ΔG G non rappresenta più la<br />
variazione i i <strong>di</strong> <strong>di</strong> entropia t i d dell’universo. ll’ i<br />
C. A. Mattia 103<br />
<strong>Energia</strong> g <strong>di</strong> Gibbs<br />
Se il sistema cambia a T e p costanti,<br />
dG p,T p, = dH – T dS 0<br />
All’equilibrio dG p,T = 0<br />
Per una variazione finita, a T e p costanti<br />
G = H H H – T S S<br />
G p,T =<br />
Se il processo p è spontaneo p<br />
G G < 0<br />
All’equilibrio<br />
G G = 0<br />
C. A. Mattia 102<br />
<strong>Energia</strong> g <strong>di</strong> Helmholtz<br />
A volume costante: dq = dU<br />
dU<br />
dS <br />
0<br />
T<br />
dU TdS <br />
0<br />
Introduciamo la funzione <strong>di</strong> Helmoltz<br />
A temperatura costante<br />
A = U – T S<br />
dA dA = dU – T dS – S dT = dU – T dS<br />
C. A. Mattia 104
Importanza p <strong>di</strong> G<br />
G G<br />
Fornisce il<br />
Fornisce la<br />
massimo l lavoro<br />
<strong>di</strong>rezione<br />
utilizzabile <strong>di</strong> un<br />
d del l processo<br />
processo<br />
C. A. Mattia 105<br />
G G G = H H H - TS. TS. S.<br />
Contributi al G<br />
Distinguiamo i due contributi alla variazione <strong>di</strong><br />
energia d <strong>di</strong> Gbb Gibbs Gibbs:<br />
Entropico ( (S) ( (S) S)<br />
Entalpico ( (H) H)<br />
H H S S G G .<br />
- + - Processo spontaneo per ogni T<br />
- - ? Processo spontaneo a basse T<br />
+ + ? Processo spontaneo ad alte T<br />
+ - + Processo mai spontaneo per qualsiasi T<br />
Processo P mai i spontaneo t per qualsiasi l i i T<br />
T<br />
C. A. Mattia 107<br />
<strong>Energia</strong> g <strong>di</strong> Gibbs e spontaneità p<br />
G G = H H – TS<br />
La variazione finita <strong>di</strong> G è G G G = H H H - (TS) (TS). (TS) (TS).<br />
A Temperatura e pressione costante<br />
G G = H H -TS G G < 0 - processo spontaneo.<br />
G G G > 0 - processo non spontaneo t ( (spontaneo<br />
( spontaneo t<br />
nella <strong>di</strong>rezione opposta). pp<br />
G G = 0 - sistema in equilibrio.<br />
C. A. Mattia 106<br />
S°<br />
H° < 0 H° > 0<br />
S° > 0<br />
S° > 0<br />
Spontanea a<br />
ogni temperatura<br />
H° < 0<br />
S° < 0<br />
Spontanea p a<br />
bassa temperatura<br />
Spontanea ad<br />
alta temperatura<br />
H° > 0<br />
S° S < 0<br />
Mai spontanea<br />
Esotermica Endotermica<br />
H°<br />
C. A. Mattia 108
fH° fH° (C, (C, grafite) grafite) = = 0<br />
0<br />
fH fH H° (C (C, (C, <strong>di</strong>amante) <strong>di</strong>amante) = = 1 1.9 9 kJ/mol<br />
W Watson:<br />
Mistero<br />
Dottor Holmes, come posso sapere se la grafite è<br />
più stabile del <strong>di</strong>amante?<br />
Sherlock Holmes:<br />
Calcolando il G, G, caro Watson !<br />
C. A. Mattia 109<br />
<strong>Energia</strong> g <strong>libera</strong> <strong>di</strong> formazione<br />
Il rGG i ò i i f i d ll<br />
o si può esprimere esprimere in funzione delle<br />
energie energie g <strong>di</strong> Gibbs <strong>di</strong> formazione<br />
formazione.<br />
G n<br />
G G<br />
prodotti d i m<br />
G <br />
f <br />
reagentii<br />
rG<br />
f<br />
fG fG G G è l’ l’energia i <strong>di</strong> Gibb Gibbs standard standard t d d per l la<br />
formazione f m <strong>di</strong><br />
<strong>di</strong> un<br />
un composto composto mp a partire p dagli<br />
dagli g<br />
elementi nei nei loro<br />
loro stati<br />
stati standard. standard<br />
C. A. Mattia 111<br />
Elementare Watson<br />
Calcoliamo il G G m(298 m(298 298 K) per la<br />
trasformazione da grafite in <strong>di</strong>amante<br />
<strong>di</strong>amante.<br />
Cgrafite grafite C<strong>di</strong>amante <strong>di</strong>amante<br />
C g ggrafite f<br />
Ho rH (k / l)<br />
o (kJ/mol)<br />
rG H T<br />
o = rH o - T rSo (k (kJ/mol) / l) S o<br />
m ( / l )<br />
grafite 0 5,740<br />
C<strong>di</strong>amante <strong>di</strong>amante<br />
1,895 2,377<br />
(J/mol (J/mol K) K)<br />
rGo = ((1895-0) ((1895 0) – 298,15 (2,377 – 5,740))J mol mol-1 1 = 2,898 kJ mol mol-1 Quin<strong>di</strong> la trasformazione <strong>di</strong>amante grafite grafite è<br />
spontanea.<br />
C. A. Mattia 110<br />
Vita e reazioni Spontanee<br />
p<br />
Negli Negli esseri viventi avvengono milioni milioni <strong>di</strong><br />
reazioni non spontanee spontanee. Come è possibile?<br />
ATP<br />
C. A. Mattia 112
ATP = Adenosintrifosfato<br />
L’ L’ATP L ATP è la banca <strong>di</strong> energia del corpo umano umano. umano umano.<br />
La reazione <strong>di</strong> idrolisi ATP ADP èspontanea spontanea. p<br />
Quando Q il corpo p ha bisogno g <strong>di</strong> energia g p<br />
energia (per<br />
flettere un muscolo, sintetizzare una proteina, etc etc…)<br />
accoppia una idrolisi dell’ATP dell dell’ATP ATP con la reazione<br />
desiderata (e un enzima opportuno)<br />
opportuno).<br />
Il metabolismo del glucosio ritrasforma ADP<br />
(Adenosin<strong>di</strong>fosfato)<br />
immagazzinato<br />
immagazzinato.<br />
in ATP ATP, che viene<br />
C. A. Mattia 113<br />
ATP e energia g <strong>di</strong> Gibbs<br />
–CH CH CH2CH CH CH2COOH COOH + NH NH3 –CH CH CH2CH CH CH2CONH CONH CONH2 + H H2OO La reazione tra acido glutammico (un aminoacido) e<br />
l’ammoniaca non èspontanea spontanea (G > 0).<br />
Nella cellula questa reazione avviene grazie<br />
all’accoppiamento con l’idrolisi dell’ dell’ATP ATP che fornisce<br />
l’energia lenergia lenergia<strong>libera</strong><br />
l’energia <strong>libera</strong> <strong>di</strong> Gibbs necessaria necessaria.<br />
C. A. Mattia 115<br />
ATP e reazioni biochimiche<br />
Accoppiamento <strong>di</strong> reazioni non<br />
spontanee p con l’idrolisi dell’ATP<br />
C. A. Mattia 114<br />
ATP e energia g <strong>di</strong> Gibbs<br />
Reazione non<br />
spontanea.<br />
F Fosforilazione f il i d dell’acido ll’ id<br />
glutammico. Reazione<br />
spontanea.<br />
L’energia del gruppo<br />
fosfato viene usata per<br />
far avvenire la reazione.<br />
La reazione globale ha un<br />
G G negativo, e quin<strong>di</strong> è<br />
spontanea.<br />
C. A. Mattia 116