Energia libera - Università degli Studi di Salerno
Energia libera - Università degli Studi di Salerno
Energia libera - Università degli Studi di Salerno
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
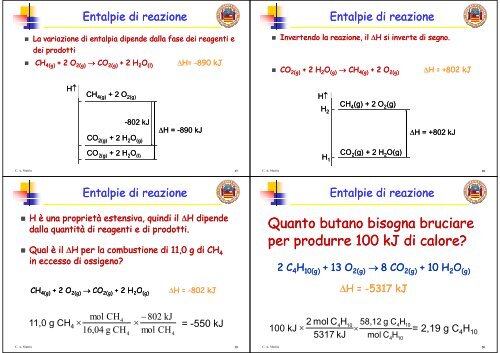
Entalpie p <strong>di</strong> reazione<br />
La variazione <strong>di</strong> entalpia <strong>di</strong>pende dalla fase dei reagenti e<br />
dei prodotti<br />
CH CH4(g) 4(g) + 2 O O2(g) 2(g) CO CO2(g) 2(g) + 2 H H2O O(l) (l) H= H= H -890 890 kJ<br />
C. A. Mattia<br />
H<br />
CH CH4(g) 4(g) 4(g) + 2 O 2(g)<br />
4(g)<br />
-802 802 kJ<br />
CO 2(g) + 2H 2HO 2 H H2O (g)<br />
CO CO2(g) 2( 2(g) ) + +2H + 2 H H2O 2O (l)<br />
H H = -890 890 kJ<br />
Entalpie p <strong>di</strong> reazione<br />
H è è una una proprietà proprietà estensiva estensiva, quin<strong>di</strong> il H H H <strong>di</strong>pende<br />
dalla quantità <strong>di</strong> reagenti e <strong>di</strong> prodotti.<br />
Qual è il H H per p la combustione <strong>di</strong> 11,0 g <strong>di</strong> CH 4<br />
in eccesso <strong>di</strong> ossigeno?<br />
C. A. Mattia<br />
CH 4(g) + 2 O 2(g) CO CO CO 2(g) + 2 H H2O 2O (g)<br />
mol CH4<br />
11,0 g CH4 <br />
16,<br />
04 g CH<br />
802 kJ<br />
<br />
mol CH<br />
16 4<br />
4<br />
H H H = -802 802 kJ<br />
= -550 kJ<br />
17<br />
19<br />
Entalpie p <strong>di</strong> reazione<br />
Invertendo la reazione, , il H H si inverte <strong>di</strong> segno. g<br />
C. A. Mattia<br />
CO CO2(g) 2(g) + 2 H H2O (g)<br />
H H<br />
H 2<br />
H H1 (g) CH CH4(g) 4(g) + 2 O O2(g) 2(g)<br />
CH CH4(g) (g) + 2 O O2(g) (g)<br />
CO CO2(g) 2(g) (g) + 2H 2 H H2O(g) 2O(g) O(g)<br />
H H = +802 kJ<br />
H H = +802 kJ<br />
Entalpie p <strong>di</strong> reazione<br />
Quanto butano b bisogna b bruciare b<br />
per produrre d 100 kJ kJ <strong>di</strong> <strong>di</strong> calore? l ?<br />
2 C C4H 10(g) (g) + 13 O O2(g) (g)<br />
2(g) (g) 8 8 CO 2(g) (g) + 10 H H2O (g)<br />
H H = -5317 5317 kJ<br />
2 mol C4H10<br />
58,12 g C<br />
100 kJ <br />
4H10<br />
100 kJ <br />
= 2,19 g C C4H 4H10 10<br />
kJ mol C<br />
C. A. Mattia<br />
5317 10<br />
4H<br />
18<br />
20