6° Lezione - Struttura delle proteine - Scuola1024
6° Lezione - Struttura delle proteine - Scuola1024
6° Lezione - Struttura delle proteine - Scuola1024
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
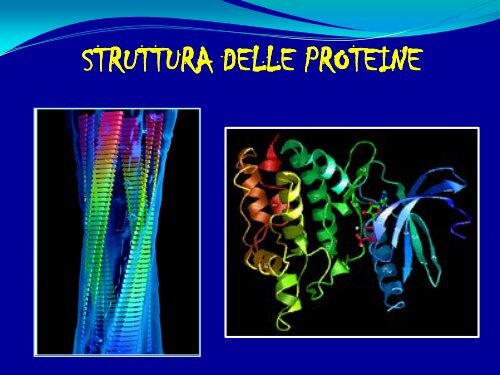
STRUTTURA DELLE PROTEINE
Peptide Peptide:<br />
corta catena (meno di 20 ammino acidi)<br />
mancanza di una struttura spaziale organizzata<br />
Polipeptide (proteina proteina):<br />
lunga catena di ammino acidi<br />
struttura spaziale organizzata
Le <strong>proteine</strong> svolgono numerose e svariate funzioni:<br />
SOSTEGNO<br />
SOSTEGNO: : Proteine strutturali, (collagene, cheratina, elastina,<br />
fibroina).<br />
MOVIMENTO<br />
MOVIMENTO: : Proteine contrattili (actina e miosina).<br />
TRASPORTO<br />
TRASPORTO: : Emoglobina, mioglobina, apolipo<strong>proteine</strong><br />
apolipo<strong>proteine</strong>, , albumina,<br />
<strong>proteine</strong> di membrana.<br />
CATALISI CATALISI: : Tutti gli enzimi<br />
ORMONALI<br />
ORMONALI: : Insulina e glucagone sono solo alcuni esempi di ormoni<br />
di natura proteica.<br />
"DIFESA DIFESA": ": Immunoglobuline (anticorpi).<br />
"ATTACCO<br />
ATTACCO": ": Tossine batteriche, veleni dei serpenti.<br />
RISERVA RISERVA: Normalmente le <strong>proteine</strong> non hanno un ruolo di riserva di<br />
amminoacidi, ma l' l'ovoalbumina<br />
ovoalbumina e la caseina sono esempi di <strong>proteine</strong><br />
con questa funzione funzione.
Forma e Funzione<br />
Le <strong>proteine</strong> di sostegno e alcune di quelle<br />
contrattili hanno una forma fibrosa fibrosa. . Sono<br />
costituite da catene polipeptidiche allungate,<br />
disposte in fasci lungo uno stesso asse a costituire<br />
le fibre fibre.. Sono insolubili in acqua.<br />
• Gli enzimi, gli anticorpi e le <strong>proteine</strong> di<br />
trasporto hanno invece una forma globulare globulare. . Le<br />
catene sono strettamente avvolte in forma<br />
compatta, sferica o globulare, come un gomitolo.<br />
Sono solubili in acqua.
D. L. Nelson, M. M. Cox, I PRINCIPI DI BIOCHIMICA DI LEHNINGER 4/E, Zanichelli Editore S.p.A. Copyright © 2006
<strong>Struttura</strong> primaria<br />
La struttura primaria di una proteina è l'ordine con cui gli<br />
amminoacidi si susseguono nella catena polipeptidica<br />
polipeptidica. . In breve,<br />
la struttura primaria si identifica con la sequenza<br />
amminoacidica<br />
amminoacidica.<br />
• L'ordine con cui gli amminoacidi si susseguono nella catena<br />
non è casuale, ma è rigorosamente immutabile per ogni<br />
particolare proteina di un organismo.<br />
• Così ad esempio l'albumina (una proteina sierica presente in<br />
numerosi organismi animali), in ogni individuo appartenente alla stessa<br />
specie, presenta sempre la stessa composizione in amminoacidi<br />
amminoacidi, , i quali<br />
sono legati l'uno all'altro sempre con lo stesso ordine ordine.
Il meccanismo della biosintesi proteica (che avviene sui ribosomi) assicura<br />
che la proteina sia costruita secondo le precise istruzioni contenute in una<br />
porzione di DNA, il gene.<br />
Nei geni, le informazioni sono codificate in triplette di basi basi, , ognuna <strong>delle</strong><br />
quali corrisponde ad un particolare amminoacido.<br />
Il cosiddetto "dogma centrale" ci ricorda che il flusso<br />
dell'informazione procede dal DNA all'RNA messaggero ed<br />
infine alla proteina, in cui l'informazione si concretizza in una<br />
entità funzionale.<br />
Le <strong>proteine</strong> sono infatti quelle molecole che realizzano gli<br />
obiettivi codificati nel "progetto dell'organismo", cioè nei geni del<br />
DNA cromosomico.
La struttura secondaria<br />
Le catene polipetidiche si ripiegano formando strutture regolari.<br />
Esistono diversi motivi proteici:<br />
elica Foglietto β Anse Ripiegamenti
I diversi motivi proteici impartiscono caratteristiche<br />
differenti<br />
L’ -elica elica<br />
La conformazione destrorsa<br />
elicoidale ha 3,6 residui per<br />
giro.<br />
In media 12 aa.<br />
Le linee tratteggiate indicano i<br />
legami idrogeno che si formano<br />
tra gruppi C=O e gruppi N-H<br />
che si trovano a quattro<br />
residui l’uno dall’altro lungo la<br />
catena polipeptidica.<br />
L’idrofilicità/idrofobicità della<br />
catena dipende dai gruppi R<br />
(verde) che sono rivolti verso<br />
l’esterno della molecola.<br />
[© Irving Geis.]<br />
Tratto da D. Voet, G. Voet e C.W. Pratt “Fondamenti di biochimica”<br />
Berg et al., BIOCHIMICA 6/E,<br />
Zanichelli editore S.p.A.<br />
Copyright © 2007
Modello spaziale di un’ -elica elica.<br />
Gli atomi dello scheletro sono<br />
colorati: carbonio carbonio, azoto azoto, ossigeno e<br />
idrogeno (bianco). Le catene laterali<br />
si proiettano verso l’esterno fuori<br />
dall’elica.<br />
Questa -elica è un segmento della<br />
mioglobina di capodoglio.<br />
La prolina, avendo il gruppo R<br />
impegnato nell’anello imminico, non ha<br />
un NH che possa formare un legame a<br />
H e a causa dell'anomalo ingombro<br />
sterico del proprio gruppo laterale,<br />
costringe il piano peptidico ad<br />
assumere angoli diedrici non idonei alla<br />
formazione dell'α-elica.<br />
Tratto da D. Voet, G. Voet e C.W. Pratt “Fondamenti di biochimica”
La permanente è un’operazione di ingegneria<br />
biochimica!<br />
L’ -cheratina assume la conformazione con il<br />
vapore acqueo ("messa in piega").<br />
La riduzione dei ponti disolfuro e il trattamento<br />
a caldo fa sì che la struttura ad -elica si<br />
“srotoli” e si allunghi. La soluzione riducente<br />
viene quindi lavata via e si aggiunge un agente<br />
ossidante che riforma ponti disolfuro nuovi tra<br />
le cys <strong>delle</strong> diverse catene. L’asciugatura<br />
rigenera le -eliche e il capello assume la forma<br />
del bigodino, arricciandosi.<br />
La cheratina presente in maggiore quantità<br />
nel capello è quella , fibrosa, a basso<br />
contenuto di gruppi SH, con PM circa 45 kD kD,<br />
insolubile in acqua acqua. Le catene polipeptidiche<br />
sono rese stabili da legami ponte idrogeno<br />
(conferiscono solidità) e ponti disolfuro disolfuro.
(a) Foglietto antiparallelo<br />
(5 (5--15 15 residui residui; ; 22--12<br />
12 catene catene polipeptidiche<br />
polipeptidiche): ):<br />
l’orientamento<br />
l’orientamento , , ( (Nterminale Nterminale vs vs<br />
Cterminale Cterminale) ) è è in in senso senso contrario contrario<br />
Foglietti<br />
Le linee tratteggiate indicano i legami<br />
idrogeno tra le catene polipeptidiche. Per<br />
maggiore chiarezza le catene laterali non<br />
sono state riportate.<br />
Normalmente i foglietti β non sono planari,<br />
ma tendono ad assumere una forma<br />
incurvata e lievemente "avvitata".<br />
[© Irving Geis]<br />
(b) Foglietto parallelo<br />
((55--15 15 residui residui; ; 22--12<br />
12 catene catene polipeptidiche<br />
polipeptidiche))<br />
Meno Meno stabile stabile ( (legami legami H H distorti distorti))<br />
D. L. Nelson, M. M. Cox, I PRINCIPI DI BIOCHIMICA DI LEHNINGER 4/E, Zanichelli Editore S.p.A. Copyright © 2006
Foglietto misto<br />
Foglietto avvolto<br />
Berg et al., BIOCHIMICA 6/E, Zanichelli editore S.p.A. Copyright © 2007
Ripiegamenti e anse<br />
Nelle <strong>proteine</strong> sono presenti anche tratti di<br />
catena apparentemente disorganizzati, di<br />
lunghezza molto variabile e più o meno convoluti convoluti.<br />
Questi tratti, definiti loop loop, fanno da collegamento<br />
fra α eliche o foglietti β ed hanno un importante<br />
ruolo nell’organizzazione 3D del peptide peptide.<br />
Sono relativamente flessibili e, soprattutto, consentono cambi di<br />
direzione, anche repentini, alle sequenze in conformazione α e β.<br />
Molto comuni sono i brevi loop di 3-5 residui che collegano due<br />
filamenti β consecutivi, orientati in modo antiparallelo (β-turns turns).<br />
Inoltre, i loop partecipano spesso alla formazione di siti di legame<br />
(loop loop "a forcina" degli anticorpi) o del sito attivo degli enzimi enzimi.<br />
Nelle regioni loop è quasi costante la presenza degli aminoacidi glicina glicina<br />
o prolina.<br />
prolina
(a) (b)<br />
Connessioni tra catene adiacenti in foglietti<br />
(a) Le catene antiparallele possono essere collegate da una piccola ansa (3-4 aa aa,<br />
residui Pro o Gly Gly).<br />
(b) Le catene parallele richiededono invece un’estesa connessione trasversale trasversale.<br />
[Tratta Tratta da Richardson, J.S., Adv Adv. Protein Chem Chem. 34 34, p. 196 (1981 1981).]<br />
Presente<br />
con<br />
maggiore<br />
frequenza<br />
Tratto da D. Voet, G. Voet e C.W. Pratt “Fondamenti di biochimica”
*<br />
*<br />
Distribuzione degli aa nelle diverse strutture II<br />
D. L. Nelson, M. M. Cox, I PRINCIPI DI BIOCHIMICA DI LEHNINGER 4/E, Zanichelli Editore S.p.A. Copyright © 2006
La struttura tridimensionale/terziaria<br />
Rappresenta la struttura tridimensionale vera e propria della<br />
proteina. In pratica, la struttura terziaria definisce le coordinate<br />
spaziali di tutti gli atomi del polipeptide.<br />
E’ caratteristica <strong>delle</strong> <strong>proteine</strong> globulari, assente in quelle fibrose<br />
E’ determinata da una sequenza aa unica ed è la struttura più stabile<br />
dal punto di vista termodinamico (conformazione nativa)<br />
E’ stabilizzata da forze non covalenti<br />
Determina ed influenza la funzione della<br />
proteina
E’ dovuta a legami ionici, ponti H,<br />
interazioni idrofobiche, covalenti<br />
P. Champe, R. Harvey, D. R. Ferrier, LE BASI DELLA BIOCHIMICA, Zanichelli Editore S.p.A. Copyright © 2006
Rappresentazioni di strutture terziarie: la mioglobina di<br />
a) A nastro<br />
b) A rete (risalto alla<br />
superficie)<br />
c) Evidenzia tasche e<br />
infossature<br />
d) Evidenzia le catene<br />
laterali dei residui<br />
idrofobici<br />
e) Modello spaziale con<br />
catene laterali<br />
capodoglio<br />
D. L. Nelson, M. M. Cox, I PRINCIPI DI BIOCHIMICA DI LEHNINGER 4/E, Zanichelli Editore S.p.A. Copyright © 2006
La struttura quaternaria
La struttura quaternaria<br />
Molte <strong>proteine</strong> nella loro forma attiva sono costituite dall'associazione<br />
di due o più unità di struttura terziaria (monomeri monomeri o subunità subunità), ), uguali<br />
(<strong>proteine</strong> <strong>proteine</strong> omo omo-oligomeriche<br />
oligomeriche) o diverse (<strong>proteine</strong> <strong>proteine</strong> etero etero-oligomeriche<br />
oligomeriche).<br />
Si parla in tal caso di struttura quaternaria<br />
quaternaria, per riferirsi<br />
all'organizzazione multimerica della proteina proteina.<br />
Le subunità sono tenute insieme da interazioni generalmente non<br />
covalenti, spesso di natura idrofobica idrofobica.<br />
Raramente, più catene peptidiche sono unite da legami covalenti covalenti.<br />
Es Es. le IgG IgG, in cui le catene leggere e pesanti sono tenute insieme da ponti<br />
disolfuro disolfuro.<br />
Altrettanto insolito è il coinvolgimento diretto di legami a ponte di<br />
idrogeno nell'associazione di più subunità subunità. Nella struttura quaternaria<br />
infatti, le subunità tendono ad affiancarsi in modo da contrapporre l'una<br />
all'altra le loro porzioni idrofobiche, rivolgendo verso l'esterno le regioni<br />
polari, idrofile idrofile.
La struttura quaternaria: l’esempio <strong>delle</strong> IgS<br />
D. L. Nelson, M. M. Cox, I PRINCIPI DI BIOCHIMICA DI LEHNINGER 4/E, Zanichelli Editore S.p.A S.p.A. Copyright © 2006
La struttura quaternaria: l’esempio <strong>delle</strong> IgS<br />
Il macrofago espone le <strong>proteine</strong> MHC<br />
(complesso maggiore di<br />
istocompatibilità) che lega frammenti<br />
peptidici derivanti dalla digestione di<br />
<strong>proteine</strong>.<br />
Quando i peptidi derivano dalla<br />
digestione <strong>delle</strong> <strong>proteine</strong> virali,<br />
diventano gli antigeni che il sistema<br />
immunitario riconosce come estranei.<br />
D. L. Nelson, M. M. Cox, I PRINCIPI DI BIOCHIMICA DI LEHNINGER 4/E, Zanichelli Editore S.p.A S.p.A. Copyright © 2006
Folding <strong>delle</strong> <strong>proteine</strong><br />
Per poter svolgere la propria funzione biologica, una<br />
proteina deve essere strutturata nella cosiddetta<br />
conformazione nativa<br />
La conformazione nativa è quella struttura 3D stabile e<br />
funzionale funzionale, , caratterizzata da un minimo di energia<br />
potenziale e da quella particolare conformazione, unica,<br />
che consente alla proteina di svolgere adeguatamente la<br />
funzione a cui è deputata.<br />
Il processo che dalla biosintesi del peptide, porta alla<br />
proteina strutturata nella forma nativa, biologicamente<br />
attiva, prende il nome di "folding folding". ".
Il meccanismo del folding è probabilmente un processo<br />
progressivo progressivo. Le strutture secondarie (α-eliche eliche e strutture<br />
β) si formano piuttosto rapidamente, dato che devono<br />
sottostare a "costrizioni" più rigide e a breve distanza distanza.<br />
Le regioni flessibili iniziano a ripiegarsi per effetto <strong>delle</strong><br />
interazioni a lungo raggio e <strong>delle</strong> interazioni con il solvente solvente.<br />
I residui polari tenderanno a rimanere esposti alla<br />
superficie, mentre quelli apolari verranno "sepolti"<br />
all'interno della proteina proteina.
Nonostante sia un processo termodinamicamente spontaneo, il<br />
folding "in vivo" è molto spesso facilitato da particolari<br />
<strong>proteine</strong> che vengono chiamate "chaperon chaperon molecolari molecolari".<br />
Agirebbero in modo da impedire alla proteina in fase di<br />
maturazione di intraprendere un percorso di strutturazione<br />
errato, che la condurrebbe ad un processo di aggregazione<br />
irreversibile<br />
irreversibile<br />
Questo aspetto del folding folding ha un'enorme importanza medica,<br />
poiché sembra che patologie quali l'Alzheimer, la fibrosi cistica<br />
e il morbo della mucca pazza (sindrome di Creutzfeldt<br />
Creutzfeldt-Jakob Jakob<br />
nell'uomo) abbiano una eziologia comune in un difettoso folding folding<br />
di alcune <strong>proteine</strong>, con conseguente aggregazione,<br />
precipitazione e successiva morte cellulare cellulare.
Unfolding<br />
Il folding è un processo reversibile.<br />
Esponendo una proteina<br />
nativa a condizioni<br />
particolari di<br />
temperatura, pH, forza<br />
ionica oppure all'azione<br />
di agenti denaturanti<br />
(quali urea o guanidina) o<br />
di detergenti, è possibile<br />
provocarne la<br />
destrutturazione più o<br />
meno completa<br />
("unfolding").
Ribonucleasi<br />
La denaturazione della proteina<br />
porta alla perdita della forma nativa e<br />
biologicamente attiva della proteina<br />
per alterazione <strong>delle</strong> strutture II e III<br />
(ma non della struttura primaria!!!)<br />
In vitro, un buon numero di <strong>proteine</strong><br />
denaturate tende a riacquistare<br />
spontaneamente la forma nativa<br />
(refolding o rinaturazione) per semplice<br />
rimozione <strong>delle</strong> cause che ne hanno<br />
provocato l'unfolding, ovvero in<br />
seguito al ripristino <strong>delle</strong> condizioni<br />
iniziali ottimali.<br />
D. L. Nelson, M. M. Cox, I PRINCIPI DI BIOCHIMICA DI LEHNINGER 4/E, Zanichelli Editore S.p.A. Copyright © 2006
I gruppi prostetici<br />
Parte non aminoacidica di una proteina coniugata<br />
Ha un ruolo<br />
determinante<br />
della funzione<br />
biologica della<br />
proteina
I polipeptidi di grandi dimensioni possono formare i<br />
domìni<br />
Alcune <strong>proteine</strong> presentano unità strutturalmente<br />
indipendenti che possiedono le caratteristiche di<br />
piccole <strong>proteine</strong> globulari<br />
La gliceraldeide 3P<br />
deidrogenasi possiede due<br />
domini: il primo lega il<br />
NAD + (rosso), il secondo secondo<br />
(verde) lega il substrato,<br />
la gliceraldeide 3P.
Riassumendo…..<br />
P. Champe, R. Harvey, D. R.<br />
Ferrier, LE BASI DELLA<br />
BIOCHIMICA, Zanichelli<br />
Editore S.p.A. Copyright ©<br />
2006













![2-9 ormoni steroidei [modalità compatibilità] - Scuola1024](https://img.yumpu.com/14959322/1/190x135/2-9-ormoni-steroidei-modalita-compatibilita-scuola1024.jpg?quality=85)
