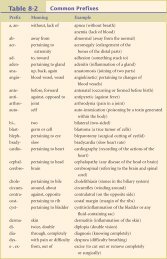
Estruturas orgânicas
Estruturas orgânicas
Estruturas orgânicas
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
APÊNDICE <strong>Estruturas</strong> <strong>orgânicas</strong><br />
Representamos as moléculas <strong>orgânicas</strong> da natureza como as estruturas da Figura 2.2. Este apêndice apresenta uma breve<br />
revisão dos princípios da estrutura molecular dos compostos orgânicos, para auxiliar o leitor a interpretar os diagramas estruturais<br />
encontrados neste livro.<br />
Hidrocarbonetos; alcanos<br />
Os hidrocarbonetos são compostos orgânicos que contêm somente carbono e hidrogênio. O carbono possui quatro elétrons<br />
de valência (os elétrons de valência estão na parte externa da camada de eletrônica e estão disponíveis para o compartilhamento<br />
com outros átomos), que podem ser compartilhados com até quatro outros átomos. Esses elétrons compartilhados<br />
constituem as ligações químicas. Eles são a ‘cola’ que mantém a molécula unida. O hidrocarboneto mais simples é o CH , meta-<br />
4<br />
no, o principal componente do gás natural.<br />
O carbono também pode compartilhar elétrons com outros átomos de carbono. Se substituirmos um dos átomos de H no<br />
metano por um átomo de C e adicionarmos mais três átomos de H, o resultado é o etano, C H , cuja estrutura pode ser represen-<br />
2 6<br />
tada traçando-se linhas entre os átomos que compartilham elétrons:<br />
H<br />
H C<br />
H<br />
A substituição de um átomo de H no etano com outro átomo de C e mais três átomos de H produz o propano, C 3 H 8 :<br />
H<br />
H C<br />
H<br />
H<br />
C<br />
H<br />
Os próximos membros dessa série de moléculas são butano, C 4 H 10 , pentano, C 5 H 12 , hexano, C 6 H 14 e assim por diante. Cada<br />
vez que um átomo de C é adicionado, o mesmo acontece com dois átomos de H; a fórmula geral para essa série, denominada<br />
alcanos, é C n H 2n+2 .<br />
Cadeias ramifi cadas; isômeros<br />
Entretanto, quando chegamos ao butano, há duas formas de arranjarmos as ligações:<br />
H<br />
H C<br />
H<br />
H<br />
C<br />
H<br />
H<br />
C<br />
H<br />
H<br />
C<br />
H<br />
H<br />
C<br />
H<br />
H<br />
C<br />
H<br />
H<br />
H<br />
H<br />
H ou H C<br />
O quarto átomo de C pode ser adicionado ao fi nal da cadeia de três átomos de C ou no meio. As duas moléculas possuem<br />
a mesma fórmula química, mas, como o arranjo da ligação difere, elas apresentam diferentes propriedades físicas (por<br />
exemplo, diferentes pontos de fusão e ebulição) e químicas (diferente reatividade). São chamadas de isômeros. O primeiro<br />
isômero é denominado de n-butano (n- para ‘normal’; todos os alcanos de cadeia linear carregam esse prefi xo) e o segundo,<br />
de isobutano.<br />
H<br />
H<br />
H<br />
C<br />
C<br />
H<br />
H<br />
C<br />
H<br />
H<br />
H
À medida que o número de átomos de C aumenta, o número de isômeros possíveis cresce rapidamente. Para fazer a<br />
distinção entre esses isômeros, foi desenvolvido um esquema sistemático de nomenclatura. O nome se baseia na cadeia mais<br />
longa de átomos de C na molécula, e a posição da substituição de uma cadeia mais curta é numerada com origem no fi nal da<br />
cadeia mais longa. Por exemplo, o nome sistemático para o isobutano é 2-metilpropano, porque a cadeia mais longa possui<br />
três átomos de C, e o segundo átomo de C dessa cadeia carrega um grupo metila. O sufi xo –il indica um fragmento em que uma<br />
ligação a um átomo de H é substituída por uma ligação com o restante da molécula, ou seja:<br />
2<br />
Química ambiental<br />
H C H H C<br />
3 3<br />
metano metila<br />
É conveniente juntar os átomos de H com os átomos de C, aos quais eles estão ligados, tornando implícitas as ligações C—H.<br />
Outro exemplo de um hidrocarboneto de cadeia ramifi cada é o 2,2,4-trimetilpentano:<br />
CH CH 3<br />
3<br />
1 2 3 4 5<br />
CH CH CH 2<br />
3<br />
H 3 C C<br />
CH 3<br />
Essa molécula, também chamada de ‘iso-octano’, é um isômero de n-octano. As propriedades de combustão do iso-octano<br />
defi nem a ‘escala de octanagem’ da qualidade da gasolina.<br />
Os n-alcanos são moléculas de cadeia linear, e os seus isômeros são moléculas de cadeia ramificada. Os organismos produzem<br />
hidrocarbonetos de cadeia linear como os principais componentes de gorduras e lipídios. As gorduras são moléculas<br />
de armazenamento de energia, e os lipídios são os blocos de construção das membranas biológicas. Conseqüentemente, o<br />
petróleo contém uma proporção considerável de hidrocarbonetos de cadeia linear. Mas ele também contém muitos hidrocarbonetos<br />
de cadeia ramifi cada, porque as condições de altas pressão e temperatura dos depósitos geológicos induzem<br />
ao rearranjo das ligações C—C. Esse processo é deliberadamente contínuo nos reatores químicos das refi narias de petróleo,<br />
visto que os hidrocarbonetos com cadeias ramifi cadas possuem classifi cação de octanagem mais elevada do que os de cadeias<br />
lineares.<br />
Anéis<br />
No processo de ligar os átomos de C entre si, é possível formar anéis, além de cadeias. Podemos ter:<br />
CH 2<br />
H C CH 2 2<br />
ciclopropano<br />
H 2 C CH 2<br />
H 2 C CH 2<br />
ciclobutano<br />
CH 2<br />
H 2 C CH 2<br />
H 2 C CH 2<br />
ciclopentano<br />
e assim por diante.<br />
Os anéis também podem ser unidos para formar as moléculas policíclicas. Um exemplo disso é o marcador molecular<br />
biológico, bacterio-hopanotetrol (veja a Figura 2.2), que possui quatro anéis de seis membros e um anel de cinco membros,<br />
além de uma cadeia de sete carbonos. Essa molécula complexa é produzida pelas bactérias, mas os animais também produzem<br />
moléculas policíclicas, tal como o colesterol (C H O):<br />
27 46<br />
HO<br />
18<br />
H 3 C<br />
21<br />
20 22<br />
2<br />
11 12<br />
17 23<br />
19 13<br />
H C<br />
16<br />
3 9 14<br />
24<br />
1<br />
10 8 15 25<br />
H H<br />
26<br />
3<br />
4<br />
5<br />
6<br />
7<br />
27<br />
Os números indicam as posições dos 27 carbonos; nem todas as ligações C—H são mostradas: os carbonos 3, 6, 8, 9, 14, 17,<br />
20 e 25 são, cada qual, ligados a um único hidrogênio; os carbonos 1, 2, 4, 7, 11, 12, 15, 16, 22, 23 e 24 são ligados a dois hidrogênios;<br />
os carbonos 18, 19, 21, 26 e 27 são ligados a três hidrogênios; os carbonos 5, 10 e 13 não possuem ligação C—H.
Resolução de problema A.1 Isômeros de pentano<br />
Quantos isômeros de pentano existem? Desenhe e nomeie-os.<br />
Um isômero é obviamente o n-pentano de cadeia linear:<br />
CH3 CH2 CH2 CH2 CH3 Outro isômero é obtido inserindo-se um grupo metila no meio de uma cadeia de quatro átomos de C:<br />
H 3 C CH<br />
CH 3<br />
Esse é o 2-metilbutano (note que não importa qual dos dois átomos de C no meio está ligado aos grupos metila, porque se obtém a<br />
mesma molécula girando-se a estrutura). Finalmente, os dois grupos metila podem estar ligados ao C do meio de uma cadeia de três C:<br />
CH 3<br />
C<br />
CH 2<br />
CH 3<br />
CH 3<br />
Esse é o 2,2-dimetilpropano. Outro nome, igualmente descritivo, seria tetrametilmetano, o qual identifi ca que essa molécula pode se<br />
derivar do CH 4 substituindo-se todos os quatro átomos de H por grupos metila.<br />
Não há outra maneira de combinar as moléculas com a fórmula C 5 H 12 . O pentano possui três isômeros.<br />
Hidrocarbonetos insaturados<br />
O carbono pode compartilhar dois ou três de seus quatro elétrons de valência por vez, formando ligações duplas ou triplas<br />
(simbolizadas por linhas duplas ou triplas, ═ e ≡). O hidrocarboneto mais simples com uma ligação dupla é o eteno (comumente<br />
chamado de etileno), CH ═CH , e o mais simples com uma ligação tripla é o etino (chamado de acetileno), CH≡CH. Os átomos<br />
2 2<br />
de H nesses alcenos e alcinos mais simples podem ser substituídos por átomos de C para formar moléculas mais complexas. Por<br />
exemplo, substituir um átomo de H em etileno e acetileno por um grupo metila produz o propeno (geralmente chamado de<br />
propileno), CH ═CHCH , e propino, CH≡CCH , respectivamente. Se há duas ou mais ligações duplas ou triplas, temos um poli-eno<br />
2 3 3<br />
ou poli-ino.<br />
As moléculas com ligações C═C ou C≡C são considerados insaturados, porque os átomos de C não possuem o complemento<br />
integral dos quatro possíveis parceiros de ligação. Estamos todos familiarizados com os óleos de cozinha insaturados e<br />
poliinsaturados, porque podem contribuir menos do que os óleos saturados para as doenças cardíacas. Os óleos insaturados<br />
contêm moléculas de gordura com uma ligação dupla em suas cadeias de hidrocarboneto, e os óleos poliinsaturados possuem<br />
duas ou mais ligações duplas em uma cadeia.<br />
Forma molecular<br />
As moléculas insaturadas diferem das moléculas saturadas na forma, porque os ângulos da ligação diferem. Os pares de<br />
elétrons na camada de valência tentam se manter o mais distante possível um do outro. Desse modo, se um átomo de C possui<br />
quatro parceiros de ligação, as ligações se estendem para os quatro cantos de um tetraedro (ângulos de ligação de 109,5º). Mas,<br />
se há uma ligação dupla, os dois pares de elétron na ligação são forçados a ocupar a mesma região no espaço e juntos permanecem<br />
o mais distante possível dos outros dois pares de elétrons nas ligações simples. As três ligações, uma dupla e duas simples,<br />
apontam para os cantos de um triângulo eqüilátero (ângulos de ligação de aproximadamente 120º). O resultado é que a unidade<br />
com dois carbonos, com suas ligações simples associadas, é planar. Portanto, o etileno pode ser representado como:<br />
CH 3<br />
H H<br />
C C<br />
H H<br />
CH 3<br />
Apêndice – <strong>Estruturas</strong> <strong>orgânicas</strong><br />
3
Analogamente, os elétrons em uma ligação tripla fi cam o mais distante possível do par nas ligações simples restantes,<br />
produzindo um ângulo de ligação de 180º. Uma ligação tripla é colinear com as ligações simples associadas; o acetileno pode<br />
ser representado como:<br />
4<br />
Química ambiental<br />
H—C≡C—H<br />
Outro importante aspecto geométrico é a facilidade de rotação em torno de uma ligação. A rotação é fácil em torno das<br />
ligações simples; as partes da molécula conectadas por uma ligação única podem adotar várias orientações intercambiáveis.<br />
Contudo, a rotação em torno de uma ligação dupla é difícil; isso só ocorre sob temperaturas muito elevadas. Conseqüentemente,<br />
há duas orientações separadas para as partes da molécula conectadas por uma ligação dupla, tais como:<br />
CH 3<br />
H C 3<br />
C C<br />
H H<br />
cis-2-buteno<br />
ou<br />
H C H<br />
3<br />
C C<br />
H<br />
trans-2-buteno<br />
Essas duas orientações são chamadas de cis e trans (grupos metila do mesmo lado ou em lados opostos da ligação dupla).<br />
Como a ligação dupla não gira, trata-se de isômeros geométricos, que possuem propriedades físicas e químicas diferentes porque<br />
suas formas são diferentes.<br />
Representações da estrutura do carbono<br />
Para reduzir a desordem nos diagramas estruturais orgânicos, pode-se simplesmente representar a estrutura do carbono<br />
como uma série de linhas interconectadas. Por exemplo, o n-octano e o iso-octano podem se representados como:<br />
n-octano<br />
e<br />
iso-octano<br />
Os átomos de H e C estão implícitos nessas representações. Subentende-se que as linhas conectam os átomos de C, que<br />
possuem tantas ligações C—H quantas forem necessárias para completar seu complemento de quatro ligações. A dobra entre<br />
as linhas representa o fato de que os átomos saturados de C possuem ângulos de ligação tetraédricos.<br />
Quando a estrutura de carbono contém ligações duplas ou triplas, isso é indicado por linhas duplas ou triplas traçadas no<br />
ponto apropriado.<br />
cis-2-buteno 2-butino<br />
Note que as linhas são colineares para o 2-butino, por causa dos ângulos de ligação de 180º. Às vezes, a representação da<br />
estrutura é utilizada com parte dos átomos de H mantidos para fi ns de clareza, assim como na estrutura de colesterol.<br />
Resolução de Problema A.2 <strong>Estruturas</strong> de nome<br />
Denomine os seguintes compostos com base nas representações das estruturas:<br />
cis-3-hexeno 2-metil-trans-3-penteno<br />
CH 3<br />
Note que essas duas moléculas têm o mesmo número de átomos C e H; elas são isômeros.<br />
Cicloexeno 1,3-cicloexadieno<br />
As ligações são sempre cis em uma estrutura anelar, por isso essa designação é dispensável.
Compostos aromáticos<br />
Quando o anel com seis membros possui três ligações duplas, um tipo diferente de molécula, o benzeno, é formado. As<br />
ligações duplas podem ser representadas de duas formas alternativas, porém equivalentes:<br />
benzeno<br />
Normalmente, as ligações duplas são mais curtas do que as ligações simples, mas no benzeno todas as seis ligações de<br />
carbono-carbono apresentam o mesmo comprimento. Os elétrons acabam adotando ambas as combinações de ligações ao<br />
mesmo tempo, um fenômeno denominado ressonância (e indicado pela seta de duas pontas acima desenhada). Em geral,<br />
representamos essa situação inscrevendo um círculo no anel.<br />
Em virtude da ressonância, a molécula de benzeno é mais estável e menos reativa do que se poderia esperar de uma molécula<br />
com três ligações duplas.<br />
Os átomos de hidrogênio no benzeno podem ser substituídos por átomos de carbono, fazendo surgir uma grande classe<br />
de moléculas chamada (por razões históricas) de moléculas aromáticas. Por exemplo, o metilbenzeno, também chamado de<br />
tolueno, é um solvente comum:<br />
H 3 C<br />
tolueno<br />
A molécula de lignina na Figura 2.4 é uma molécula aromática muito complexa.<br />
Quando dois ou mais átomos de H no benzeno são substituídos, a possibilidade de isômeros aumenta novamente. Por<br />
exemplo, há três isômeros de xileno, a molécula obtida pela substituição de dois grupos metila no benzeno:<br />
o- m-p-<br />
Eles são designados como orto-, meta- e para-, abreviados como o-, m- e p- (os nomes sistemáticos, contudo, são 1,2-, 1,3- e<br />
1,4-dimetilbenzeno).<br />
Quando uma molécula de benzeno se liga a uma molécula orgânica maior, ela é chamada de grupo fenila. Por exemplo, o<br />
inseticida DDT é o diclorodifeniltricloroetano.<br />
Assim como no caso dos anéis saturados nos alcanos policíclicos, é possível unir os anéis de benzeno para formar os hidrocarbonetos<br />
aromáticos policíclicos [PAH], por exemplo:<br />
naftaleno antraceno<br />
Esses PAHs constituem subprodutos de combustão incompleta. São motivos de preocupação como potentes carcinógenos.<br />
O PAH mais comum é a grafi te, cuja estrutura é uma lâmina contínua de anéis de benzeno (veja a Figura 2.4).<br />
Heteroátomos; grupos funcionais<br />
Os compostos orgânicos se baseiam no carbono e no hidrogênio, mas geralmente contêm átomos de outros elementos,<br />
coletivamente conhecidos como heteroátomos. Os elementos mais comumente encontrados são halogêneos, oxigênio, nitrogênio,<br />
enxofre e fósforo. Freqüentemente, esses heteroátomos são locais de reatividade química, e os grupos químicos que os<br />
Apêndice – <strong>Estruturas</strong> <strong>orgânicas</strong><br />
5
contêm são chamados de grupos funcionais (veja a Tabela A.1). As ligações duplas e triplas também constituem grupos funcionais;<br />
seus elétrons são ligados mais frouxamente do que os das ligações simples, tornando-os mais reativos.<br />
Os átomos de halogêneo formam somente uma ligação e podem, em princípio, ser substituídos por qualquer dos átomos<br />
de H em um hidrocarboneto. O símbolo geral para os organo-halogenados é RX, onde X representa F, Cl, Br ou I; e R representa o<br />
restante da molécula orgânica. Os organo-halogenados são geralmente menos reativos do que o hidrocarboneto original. Essa<br />
é uma das razões de os pesticidas à base de organoclorados, tal como o DDT, representarem uma preocupação ambiental. Em<br />
razão de sua baixa reatividade, duram muito e podem se acumular nos tecidos do organismo animal, até mesmo do humano.<br />
Os átomos de oxigênio formam duas ligações covalentes, como ocorre na H O. Se um átomo de O forma uma ligação com<br />
2<br />
um átomo de C, bem como com um átomo de H, obtemos um álcool, simbolizado por ROH. Os álcoois são nomeados acrescentando-se<br />
–ol ao fi nal do nome da molécula orgânica. O álcool ingerível é o álcool etílico, ou etanol, CH —CH —OH. A molécula<br />
3 2<br />
complexa na Figura 2.2 é designada como bacterio-hopanotetrol por causa dos quatro grupos de álcool que contém.<br />
6<br />
TABELA A.1 Grupos funcionais orgânicos selecionados.<br />
Nome da classe Grupo funcional Estrutura geral de classe*<br />
Alcano Nenhum R — H<br />
Alceno<br />
R R<br />
C C<br />
R R<br />
Alcino C C R R<br />
Haleto X (X = F, Cl, Br, I) R X<br />
Álcool<br />
Éter<br />
Aldeído<br />
Cetona<br />
Amina<br />
Imina<br />
Química ambiental<br />
C O H R OH<br />
C O C<br />
O<br />
C<br />
O<br />
C<br />
H<br />
C N<br />
C N<br />
R<br />
R<br />
R<br />
R<br />
O<br />
O<br />
R<br />
R H<br />
O<br />
R R<br />
Nitrilo C N R N<br />
Ácido carboxílico<br />
Éster<br />
Amida<br />
*Em algumas classes, R, R’ e R” podem ser H.<br />
O<br />
C<br />
O H<br />
R<br />
N<br />
N<br />
O<br />
R<br />
R<br />
R<br />
OH<br />
O O<br />
R R<br />
C O C<br />
O<br />
O<br />
C<br />
N<br />
R<br />
O<br />
N<br />
R<br />
R
Se o átomo de O é ligado a dois átomos de C, temos um éter, ROR’. Fazemos a distinção entre R e R’ porque os dois fragmentos<br />
orgânicos que estão conectados ao átomo de O não precisam ser iguais. Um exemplo é:<br />
O CH3 H3C C CH3 CH3 metil-terc-butil éter<br />
abreviado como MTBE (o -terc representa terciário e o terc-butil é uma forma de designar um grupo de quatro carbonos, em<br />
que todas as ligações que partem do átomo conector de C seguem para outros átomos de C). Atualmente, o MTBE é utilizado<br />
como aditivo da gasolina com o propósito de reduzir a poluição, mas ganhou notoriedade por causa da contaminação de lençóis<br />
freáticos por vazamentos de gasolina. Note que a estrutura de lignina (veja a Figura 2.4) possui muitos grupos de álcool<br />
e éter.<br />
O átomo de O também pode formar uma ligação dupla com um átomo de C, e o grupo resultante C═O é chamado de carbonila.<br />
Os compostos de carbonila se distinguem pelo que está ligado ao átomo de C. As cetonas possuem dois outros átomos<br />
de C, e os aldeídos possuem um átomo de C e um átomo de H. Os exemplos comuns são:<br />
O<br />
C<br />
H C CH 3 3<br />
acetona<br />
Outros grupos funcionais são os ácidos carboxílicos e os ésteres:<br />
e<br />
O<br />
C<br />
H C H<br />
3<br />
acetaldeído<br />
O O<br />
R C R C<br />
OH OR<br />
ácido orgânico éster<br />
A química do grupo carbonila é consideravelmente alterada quando se tem um grupo OH ou OR ligado ao átomo de C. Os<br />
poliésteres constituem uma importante classe de moléculas de polímero em que os hidrocarbonetos são ligados repetindo-se<br />
os grupos éster em longas cadeias. São amplamente utilizados em tecidos e recipientes de plástico.<br />
Finalmente, dois átomos de oxigênio podem compartilhar uma ligação simples, enquanto cada um deles possui outra<br />
ligação simples com H ou com C. São os peróxidos, com a fórmula geral R—O—O—R’. Se um dos grupos R for o H, temos um<br />
hidroxiperóxido; o membro mais simples da família, H—O—O—H, é o peróxido de hidrogênio. A ligação O—O é fraca, e os peróxidos<br />
são uma classe reativa de moléculas. Eles desempenham um papel importante na química da poluição.<br />
Como o enxofre está no mesmo grupo da tabela periódica que o oxigênio, as mesmas regras de valência se aplicam e<br />
grupos funcionais similares são encontrados tanto no enxofre orgânico quanto nos compostos orgânicos de oxigênio. Entretanto,<br />
por ser um átomo maior, ele é capaz de ter mais do que oito elétrons em sua camada de valência quando se combina<br />
com elementos altamente necessitados de elétrons (eletronegativos), tais como oxigênio e fl úor. Os átomos de oxigênio podem<br />
prontamente se somar aos compostos orgânicos de enxofre, produzindo sulfonas, R SO, sulfóxidos, R SO ou ácidos sulfônicos,<br />
2 2 2<br />
RSO H. Embora muito menos abundantes do que o oxigênio nos tecidos biológicos, o enxofre é um componente signifi cativo<br />
3<br />
do carvão e do petróleo, além de ser um importante fator de contribuição para a poluição atmosférica, quando esses combustíveis<br />
fósseis são queimados.<br />
Os compostos com três ligações a um átomo de N são as aminas. Além da amônia, NH , incluem as aminas primárias, RNH ,<br />
3 2<br />
aminas secundárias, R,R’NH e aminas terciárias, R,R’,R”N. Os compostos com N de dupla ligação são as iminas, R,R’C NR” (os Rs<br />
também podem ser H), e os compostos com N de tripla ligação são os nitrilos, RC≡N.<br />
Uma classe importante de compostos é o das amidas, na qual um átomo de N é conectado ao átomo de C de um grupo<br />
carbonila:<br />
R C<br />
O<br />
Os polímeros de poliamida (por exemplo, náilon) são importantes como fi bras e plásticos, e as moléculas de proteína, que<br />
possuem aminoácidos ligados de uma ponta a outra por conexões de amida são as próprias poliamidas da natureza.<br />
N<br />
R<br />
R<br />
Apêndice – <strong>Estruturas</strong> <strong>orgânicas</strong><br />
7
8<br />
Química ambiental<br />
H N 2<br />
C<br />
CH<br />
O<br />
OH<br />
R<br />
O fósforo está no mesmo grupo que o nitrogênio na tabela periódica e os análogos de fósforo das aminas são as fosfi nas.<br />
Entretanto, o fósforo forma ligações muito mais fortes com o oxigênio do que com o carbono ou o hidrogênio. Na natureza, os<br />
átomos de P estão sempre cercados por átomos de O. A forma mais comum é o íon fosfato, PO⊌ – , que pode se condensar em<br />
íons fosfato, tal como o tripolifosfato, ao formar ligações P—O—P. Muitas moléculas biológicas importantes são os ésteres de<br />
fosfato, ROPO⊀ – ; os ácidos nucléicos são polímeros mantidos unidos por ligações de fosfodiéster, RO— PO 2 —OR’.