apostila de exercÃcios
apostila de exercÃcios
apostila de exercÃcios
- No tags were found...
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
QBQ-0116BIOQUÍMICA: ESTRUTURA DE BIOMOLÉCULASe METABOLISMO2012
pH e SISTEMAS TAMPÃO01. Segel, Biochemical Calculations, Capítulo 1, Problema 1-19. O Ka do ácido fraco HA é1,6 x 10 -6 . Calcular:a) O grau <strong>de</strong> ionização do ácido para uma solução 10 -3 M.b) O pH02. Segel, Biochemical Calculations, Capítulo 1, Problema 1-26.a) Indicar os componentes <strong>de</strong> um tampão acetatob) Mostrar através <strong>de</strong> reações como o tampão acetato resiste a mudanças <strong>de</strong> pHquando se adiciona íons OH - ou H + .03. Quais os fatores que <strong>de</strong>terminam a eficiência ou capacida<strong>de</strong> tamponante <strong>de</strong> uma solução?04. Dispõe-se <strong>de</strong> solução <strong>de</strong> ácido acético e acetato <strong>de</strong> sódio ambas 0,1 M. Com estas duassoluções, preparar os seguintes tampões acetato 0,1 M (pKa do ácido acético = 4,7):a) pH = 3,7b) pH = 5,708. Lehninger, Biochemistry, segunda edição, Capítulo 2, Problema 8.a) Calcular a relação [HCO 3- ]/[H2 CO 3 ] no plasma sanguíneo em pH 7,4 (pKa =3,77),b) Calcular a relação [HPO 42- ]/[H2 PO 4- ] no plasma sanguíneo (pKa = 7,20),c) Qual dos dois pares ácido-base conjugados é o tampão mais eficiente em umaamostra <strong>de</strong> plasma sanguíneo em um frasco fechado, sem espaço disponível paragases (totalmente ocupado por líquido)?09. Segel, Biochemical Calculations, Capítulo 1, Problema 1-52. O plasma sanguíneocontém uma reserva ("pool") total <strong>de</strong> carbonato (essencialmente HCO 3- + CO 2 ) <strong>de</strong> 2,52 x10 -2 M.a) Qual é a razão [HCO 3- ]/[CO2 ] e a concentração <strong>de</strong> cada componente do tampãopresente a pH 7,4?b) Qual seria o pH se for adicionado 10 -2 M <strong>de</strong> H + sob condições tais que o aumentoda [CO 2 ] não possa ser liberado?c) Qual seria o pH se for adicionado 10 -2 M <strong>de</strong> H + e o excesso <strong>de</strong> CO 2 eliminado(mantendo-se assim a [CO 2 ] original)?Consi<strong>de</strong>rar o pKa para o equilíbrio abaixo:CO 2 + H 2 O → HCO 3- + H + , como sendo 6,1.←
→AMINOÁCIDOS01. Segel, Biochemical Calculations, Capítulo 1, Problema 1-45. Escreva as estruturas dasvárias formas <strong>de</strong> alanina, ácido aspártico e lisina que po<strong>de</strong>m ser obtidas. Mostre comocada forma ioniza em água.02. Segel, Biochemical Calculations, Capítulo 1, Problema 1-46 Desenhe a curva <strong>de</strong> titulação<strong>de</strong> cloridrato <strong>de</strong> alanina com KOH. Indique o pI. São dados:pKa 1 = 2,4 e pKa 2 = 9,603. Conhecidos os valores dos pKas, discuta as curvas <strong>de</strong> titulação do ácido aspártico elisina. Indique os respectivos pIs.04. Segel, Biochemical Calculations, Capítulo 2, Problema 2-2. Quais são as mobilida<strong>de</strong>seletroforéticas relativas <strong>de</strong> glicina, leucina, ácido aspártico, ácido glutâmico e lisina a pH4,7?Dados:Aminoácido P.M. pILisina 146,2 9,74Glicina 75,1 5,97Leucina 131,2 5,98Ácido Glutâmico 147,1 3,22Ácido Aspártico 133,1 2,98Consi<strong>de</strong>re: mobilida<strong>de</strong> eletroforética = k .pH - pIP.M.05. Lehninger, Principles of Biochemistry, Capítulo 5, Problema 3. Relação entre estrutura eproprieda<strong>de</strong>s químicas dos aminoácidos.Uma vez que os aminoácidos servem como unida<strong>de</strong>s fundamentais formadoras dasproteínas, o conhecimento <strong>de</strong> suas estruturas e proprieda<strong>de</strong>s químicas é crucial para acompreensão <strong>de</strong> como as proteínas executam suas funções biológicas.a) Escreva as estruturas das ca<strong>de</strong>ias laterais (grupos R) dos seguintes aminoácidos: (1) Ala,(2) Arg, (3) Asn, (4) Asp, (5) Cys, (6) Glu, (7) Gly, (8) His, (9) Lys, (10) Met, (11) Phe,(12) Pro, (13) Ser, (14) Trp, (15) Tyr e (16) Val.b) Associe compatibilizando cada estrutura com a <strong>de</strong>scrição <strong>de</strong> suas proprieda<strong>de</strong>s fornecidasabaixo (algumas <strong>de</strong>scrições po<strong>de</strong>m ser usadas mais <strong>de</strong> uma vez).(Associe o número do aminoácido com a letra correspon<strong>de</strong>nte à <strong>de</strong>scrição).a) Grupo R pequeno e polar contendo um grupo hidroxila. Este aminoácido é importante nosítio ativo <strong>de</strong> algumas enzimas.b) Provoca o menor impedimento estérico.c) O grupo R tem pKa próximo <strong>de</strong> 10,5, o que torna-o carregado positivamente no pHcelular.d) O grupo R contém enxofre e é neutro em todos os pHs.e) O grupo R é aromático, <strong>de</strong> natureza hidrofóbica e neutro em todos os pHs.f) Hidrocarboneto saturado, importante em interações hidrofóbicas.g) O único aminoácido que possui um grupo R ionizável com pKa próximo <strong>de</strong> 7. É um grupoimportante no sítio ativo <strong>de</strong> algumas enzimas.
h) O único aminoácido que possui um alfa-amino grupo substituído. Influencia o dobramentoda proteína forçando uma curvatura na ca<strong>de</strong>ia.i) O grupo R tem pKa próximo <strong>de</strong> 4 e assim está carregado negativamente em pH 7.j) Tem grupo R aromático, capaz <strong>de</strong> formar pontes <strong>de</strong> hidrogênio; tem pKa perto <strong>de</strong> 10.k) Forma ligações cruzadas <strong>de</strong> dissulfeto (pontes <strong>de</strong> dissulfeto) entre ca<strong>de</strong>ias polipeptídicas,o pKa do seu grupo funcional é cerca <strong>de</strong> 8.l) O grupo R tem pKa próximo <strong>de</strong> 12, fazendo-o positivamente carregado em todos os pHsfisiológicos. Sua carga positiva é importante em algumas proteínas para a ligação comgrupos fosfatos negativamente carregados.m) Quando seu grupo R polar não carregado é hidrolisado, este aminoácido converte-se emoutro que possui uma carga negativa em seu grupo R quando em pH ao redor <strong>de</strong> 7.06.Wood et al., Biochemistry: A Problems Approach, Capítulo 2, Problema 2-2. Analisandoas estruturas dos aminoácidos, indique qual <strong>de</strong>les se adapta às seguintes <strong>de</strong>scrições:a) ______________________ altera o dobramento da ca<strong>de</strong>ia polipeptídica porque não é umverda<strong>de</strong>iro aminoácido. Nas ca<strong>de</strong>ias polipeptídicas da mioglobina e hemoglobina nemtodo dobramento tem ________________, mas todo(a) _________ produz umdobramento. (Todos os três espaços vazios correspon<strong>de</strong>m ao mesmo resíduo <strong>de</strong>aminoácido, o qual é único na maneira pela qual ele forma ligações peptídicas).b) ________________ tem uma ca<strong>de</strong>ia lateral não polar e interage com outros anéisaromáticos. (Os anéis aromáticos têm a tendência a se empilhar (estaquear) com outrosanéis aromáticos).c) ______________ é pequeno(a), e não contém enxofre. Ele (ela) po<strong>de</strong> formar pontes <strong>de</strong>hidrogênio internas numa proteína enovelada.d) O par <strong>de</strong> elétrons solitário em um dos nitrogênios do anel no(a) ______________, o(a)torna, como metionina um ligante potencial, importante na união dos íons <strong>de</strong> ferro nahemoglobina.e) ______________________ <strong>de</strong>sempenha um papel crucial na estabilização da estrutura <strong>de</strong>muitas proteínas em virtu<strong>de</strong> da habilida<strong>de</strong> <strong>de</strong> dois <strong>de</strong> tais resíduos formar uma ligaçãocovalente entre suas ca<strong>de</strong>ias laterais, quando estes resíduos estão presentes na mesma ouem diferentes ca<strong>de</strong>ias polipeptídicas.f) Os carbonos em um aminoácido são <strong>de</strong>signados por letras do alfabeto grego começandocom o carbono alfa e exten<strong>de</strong>ndo pela ca<strong>de</strong>ia lateral: beta, gama, <strong>de</strong>lta, ... Se dois ou trêsgrupos (não átomos <strong>de</strong> hidrogênio) são ligados ao carbono beta, a molécula é ditaramificada no carbono beta. Dois resíduos adjacentes que têm ramificações no carbono βtornam a estrutura do polipeptí<strong>de</strong>o conhecido como alfa hélice instável. Por este critério__________, ________ e ________ <strong>de</strong>vem interromper a α-hélice quando adjacentes.g) Nas proteínas, sob condições fisiológicas normais (próximo ao pH = 7), as ca<strong>de</strong>ias laterais<strong>de</strong> ________ e __________ são quase totalmente positivamente carregadas, mas asca<strong>de</strong>ias laterais <strong>de</strong> __________ estão somente em parte positivamente carregadas.PEPTÍDEOS1. Baseado em Marzzoco e Torres, Bioquímica Básica, Página 220, Problema 3.Para o tripeptí<strong>de</strong>o H 3 N + -Ala-Lys-Ser-COO -a) Classifique os grupos R segundo suas polarida<strong>de</strong>s.b) Diga para que tipo <strong>de</strong> ligação esses grupos po<strong>de</strong>riam contribuir na estrutura terciária <strong>de</strong>uma proteína.c) Calcule o pI sabendo que:
Ala Lys Ser GlupK a1 2,34 2,18 2,21 2,19pK a2 9,69 8,95 9,15 9,67pK a3 (grupo R) 10,53 4,25d) Para que polo migraria o tripeptí<strong>de</strong>o numa eletroforese feita a pH = 7?e) Discuta a capacida<strong>de</strong> do peptí<strong>de</strong>o <strong>de</strong> atuar como tampão.f) Refaça os ítens anteriores para um tripeptí<strong>de</strong>o contendo ácido glutâmico no lugar <strong>de</strong>lisina.02. Stryer, Biochemistry, 3 a edição, Capítulo 3, Problema 1. Os seguintes reagentes sãocomumente usados na Química <strong>de</strong> Proteínas:CNBr (brometo <strong>de</strong> cianogênio) Cloreto <strong>de</strong> DabsilaUréiaHCl 6Nβ-MercaptoetanolNinhidrinaTripsinaFenil isotiocianatoÁcido PerfórmicoQuimiotripsinaQual(is) <strong>de</strong>le(s) é(são) o(s) mais a<strong>de</strong>quado(s) para executar cada uma das seguintes tarefas?a) Determinação da sequência <strong>de</strong> aminoácidos <strong>de</strong> um peptí<strong>de</strong>o pequeno.b) I<strong>de</strong>ntificação <strong>de</strong> um resíduo amino-terminal <strong>de</strong> um peptí<strong>de</strong>o (do qual dispõe-se somente<strong>de</strong> menos <strong>de</strong> 10 -7 g).c) Desnaturação reversível <strong>de</strong> uma proteína isenta <strong>de</strong> pontes <strong>de</strong> dissulfeto. Que outroreagente seria necessário se elas estivessem presentes?d) Hidrólise <strong>de</strong> ligações peptídicas no lado carboxílico <strong>de</strong> resíduos com R aromático.e) Clivagem <strong>de</strong> ligações peptídicas no lado carboxílico <strong>de</strong> metioninas.f) Hidrólise <strong>de</strong> ligações peptídicas no lado carboxílico <strong>de</strong> resíduos <strong>de</strong> lisina e arginina.03. Rawn, Biochemistry, Capítulo 3, Problema 4. Um peptí<strong>de</strong>o tem a composição: Ala, Arg,Asp 2 , Glu 2 , Gly 3 , Leu, Val 3 .Os seguintes peptí<strong>de</strong>os foram isolados após hidrólise ácida parcial e suas sequências<strong>de</strong>terminadas:(1) Asp-Glu-Val-Gly-Gly-Glu-Ala(2) Val-Asp-Val-Asp-Glu(3) Val-Asp-Val(4) Glu-Ala-Leu-Gly-Arg(5) Val-Gly-Gly-Glu-Ala-Leu-Gly-Arg(6) Leu-Gly-ArgCom estes dados, indique a sequência <strong>de</strong> aminoácidos no peptí<strong>de</strong>o original.04. Segel, Biochemical Calculations, Capítulo 2, Problema 2-3. A hidrólise parcial <strong>de</strong> umaproteína forneceu vários polipeptí<strong>de</strong>os. Um <strong>de</strong>les foi purificado. Deduza a sequência <strong>de</strong>aminoácidos neste polipeptí<strong>de</strong>o a partir das seguintes informações:a) A hidrólise ácida completa forneceu Ala + Arg + 2 Ser + Lys + Phe + Met + Trp + Pro.b) O tratamento com fluorodinitrobenzeno (FDNB, o reagente <strong>de</strong> Sanger) seguido dahidrólise ácida completa forneceu como únicos dinitrofenil <strong>de</strong>rivados (DNP <strong>de</strong>rivados), aalfa- dinitrofenilalanina (alfa-DNP-Ala) e a epsilon-dinitrofenilisina (epsilon-DNP-Lys).c) Carboxipeptidase A ou carboxipeptidase B não liberaram qualquer aminoácido Cterminal.d) O tratamento com brometo <strong>de</strong> cianogênio (CNBr) forneceu dois peptí<strong>de</strong>os. Um continhaSer + Trp + Pro. O outro continha todos os aminoácidos restantes (inclusive a segundaserina).e) O tratamento com quimiotripsina forneceu três peptí<strong>de</strong>os. Um continha somente Ser +Pro. Outro, somente Met + Trp. O terceiro Phe + Lys + Ser + Arg + Ala.
f) O tratamento com tripsina forneceu três peptí<strong>de</strong>os. Um continha somente Ala + Arg. Outrocontinha somente Lys + Ser. O terceiro continha Phe + Trp + Met + Ser + Pro.Informações: (1) FDNB reage com amino-grupos livres fornecendo DNP-aminoácidos apóshidrólise; (2) Carboxipeptidase A libera todos os aminoácidos C terminais, exceto Arg, Lys ePro e Carboxipeptidase B libera somente C terminal correspon<strong>de</strong>nte a Arg ou Lys; (3) CNBrcliva especificamente no lado carboxílico <strong>de</strong> resíduos <strong>de</strong> Met; e (4) Quimiotripsina e tripsinaclivam especificamente no lado carboxílico, respectivamente, <strong>de</strong> resíduos com R aromático(Phe, Tyr e Trp) e <strong>de</strong> resíduos com R <strong>de</strong> Lys e Arg.PROTEÍNAS01. Indique as proprieda<strong>de</strong>s das proteínas nas quais se baseiam as seguintes técnicasutilizadas na sua purificação:(a) Eletroforese, (b) Salting out, (c) Precipitação no pI, (d) Ultra centrifugação e (e) Diálise02. Lehninger, Biochemistry, 2 a. ed., Capítulo 7, Problema 6. Para que direção, isto é para oanodo (A), para o catodo (C) ou permenência na origem (O), migrarão num campoelétrico as seguintes proteínas, nos pHs indicados?a) Albumina do ovo (pI = 4,6) em pH 5,0b) β-Lactoglobulina (pI = 5,2) nos pHs 5,0 e 7,0c) Quimiotripsinogênio (pI = 9,5) nos pHs 5,0, 9,5 e 11,003. Lehninger, Biochemistry, 2 a. ed., Capítulo 7, Problema 7. Em que pH será a eletroforesemais eficiente na separação das seguintes misturas <strong>de</strong> proteínas?a) Albumina sérica e hemoglobina; pIs = 4,9 e 6,8, respectivamenteb) Mioglobina e quimiotripsinogênio; pIs = 7,0 e 9,5, respectivamentec) Albumina do ovo, albumina sérica e urease, pIs = 4,6, 4,9 e 5,0, respectivamente04. Marzzoco e Torres, Bioquímica Básica, Página 220, Problema 7. Abaixo estárepresentada a mobilida<strong>de</strong> eletroforética em pH 8,6 da hemoglobina normal e <strong>de</strong> umasérie <strong>de</strong> hemoglobinas anormais (que possuem um aminoácido substituído):(-) ______________________________________________________ (+)A B Normal C DIndique a que posição A, B, C ou D correspon<strong>de</strong> cada hemoglobina anormal:HbS - Val em lugar <strong>de</strong> Glu, HbJ - Asp em lugar <strong>de</strong> Gly, HbN - Glu em lugar <strong>de</strong> Lys eHbC - Lys em lugar <strong>de</strong> ácido Glu.05. Segel, Biochemical Calculations, 2 a. ed., Capítulo 2, Problema 2-7. O peso molecularmédio <strong>de</strong> um resíduo <strong>de</strong> aminoácido é 120. A <strong>de</strong>nsida<strong>de</strong> média <strong>de</strong> uma proteína é 1,33g/cm 3 . Calcule:a) A massa <strong>de</strong> uma única molécula <strong>de</strong> uma proteína que contém 270 aminoácidos, (b) Ovolume ocupado por uma única molécula <strong>de</strong>sta proteína, e (c) Po<strong>de</strong>rá uma molécula <strong>de</strong>staproteína adaptar-se no interior <strong>de</strong> uma membrana celular medindo 100 Å <strong>de</strong> espessura?Consi<strong>de</strong>re que esta molécula é esférica.06. Wood et al, Biochemistry: A Problems Approach, Capítulo 4, Problema 4-1. Indique seas seguintes afirmações são falsas ou verda<strong>de</strong>iras. Justifique as que forem falsas:a) Pontes <strong>de</strong> hidrogênio ocorrem entre átomos <strong>de</strong> Hidrogênio na superfície das moléculas <strong>de</strong>proteína em solução.
) A conformação termodinamicamente mais estável <strong>de</strong> uma proteína correspon<strong>de</strong> a estrutura<strong>de</strong> energia livre mais baixa.c) A formação <strong>de</strong> pontes <strong>de</strong> hidrogênio internas correspon<strong>de</strong> a principal interação quedireciona o dobramento da molécula <strong>de</strong> proteína.d) Solventes orgânicos <strong>de</strong>snaturam proteínas, principalmente por dificultar interaçõesiônicas.e) O dobramento <strong>de</strong> uma molécula <strong>de</strong> proteína hidrofóbica é acompanhado por um aumentona entropia do polipeptí<strong>de</strong>o.f) O termo estrutura quaternária refere-se a conformação da proteína em quarta dimensão,isto é, como uma função do tempo.g) Pontes dissulfeto ligam covalentemente resíduos <strong>de</strong> cisteína cujas proximida<strong>de</strong>s são<strong>de</strong>terminadas por interações prévias não covalentes.h) Numa alfa-hélice, os Hidrogênios amídicos <strong>de</strong> todas as ligações peptídicas estão formandopontes <strong>de</strong> Hidrogênio.i) A partir da estrutura primária completa <strong>de</strong> uma proteína, é possível predizer suaconformação tridimensional.07. Wood et al., Biochemistry: A Problems Approach, Capítulo 4, Problema 4-2a) As conformações das proteínas correspon<strong>de</strong>ntes ao mínimo <strong>de</strong> energia livre muitas vezessão favorecidas por ligações cruzadas covalentes entre resíduos <strong>de</strong> ____________.b) As interações hidrofóbicas levam a um(a) ____________ <strong>de</strong> energia livre quando asca<strong>de</strong>ias laterais dos resíduos <strong>de</strong> aminoácidos não polares são removidos da fase aquosa.c) O posicionamento <strong>de</strong> ca<strong>de</strong>ias laterais hidrofóbicas no interior <strong>de</strong> uma proteína________________ a entropia do ambiente aquoso.d) Solventes orgânicos estabilizam (diminuem a energia livre) <strong>de</strong> grupos _______________em meio aquoso.e) Na α-hélice, as pontes <strong>de</strong> hidrogênio entre os grupos C=O e N-H são bastante estáveisporque os três átomos envolvidos são __________________.08. Wood et al., Biochemistry: A Problems Approach, Capítulo 4, Problema 4-16. Suponhaque foram fornecidas a você pequenas quantida<strong>de</strong>s <strong>de</strong> três proteínas <strong>de</strong>sconhecidas: A, Be C. Seu instrutor <strong>de</strong> bioquímica lhe informou que uma <strong>de</strong>las forma predominantementeα-hélice, outra, folha pregueada β e a terceira, hélice tripla <strong>de</strong> colágeno. O laboratórioon<strong>de</strong> você está trabalhando está equipado com um analisador <strong>de</strong> aminoácido, masinfelizmente não dispõe <strong>de</strong> um equipamento para R-X cristalográfico. Você <strong>de</strong>terminou acomposição <strong>de</strong> aminoácidos (em porcentagem molar) para cada proteína, como mostradona tabela a seguir:A B C A B CAla 29,4 5,0 10,7 Leu 0,5 6,9 2,4Arg 0,5 7,2 5,0 Lys 0,3 2,3 3,4Asp 1,3 6,0 4,5 Met - 0,5 0,8Cys - 11,2 - Phe 0,5 2,5 1,2Glu 1,0 12,1 7,1 Pro 0,3 7,5 12,2Gly 44,6 8,1 33,0 Ser 12,2 10,2 4,3His 0,2 0,7 0,4 Trp 0,2 1,2 -Hypro - - 9,4 Tyr 5,2 4,2 0,4Ile 0,7 2,8 0,9 Val 2,2 5,1 2,3Baseado nos dados da tabela, você po<strong>de</strong> prever a estrutura secundária predominantepara cada uma?
09. Lehninger, Principles of Biochemistry, Capítulo 8, Problema 9. Comparação entre ashemoglobinas da mãe e do feto. Estudo do transporte <strong>de</strong> oxigênio em mulheres grávidasmostraram que as curvas <strong>de</strong> saturação pelo oxigênio do sangue materno e fetal sãomarcadamente diferentes quando medidas nas mesmas condições. Esta observaçãoprovém do fato <strong>de</strong> os eritrócitos fetais possuirem uma variante natural da hemoglobina A(hemoglobina F, alfa 2 gama 2 ), enquanto que os eritrócitos maternos contém ahemoglobina A (alfa 2 beta 2 ), normal em adultos.a) Qual das hemoglobinas apresenta maior afinida<strong>de</strong> pelo oxigênio nas condiçõesfisiológicas? Explique.b) Qual é o significado fisiológico das diferenças <strong>de</strong> afinida<strong>de</strong>? Explique.Removendo-se cuidadosamente todo DPG <strong>de</strong> amostras <strong>de</strong> hemoglobina A e F,verifica-se que as curvas <strong>de</strong> saturação pelo oxigênio (e consequentemente as afinida<strong>de</strong>s) são<strong>de</strong>slocadas, no gráfico, para o lado esquerdo. Nesta situação, hemoglobina A passa a termaior afinida<strong>de</strong> pelo oxigênio. Recolocando-se DPG, as curvas <strong>de</strong> saturação voltam aonormal, como mostrado no gráfico acima. Pergunta-se:c) Qual é o efeito <strong>de</strong> DPG na afinida<strong>de</strong> da hemoglobina pelo oxigênio?d) Como as informações acima (relativas ao item c) po<strong>de</strong>m explicar a razão das diferentesafinida<strong>de</strong>s apresentadas pela hemoglobina fetal e materna?10. Seguindo as instruções abaixo, faça com papel um mo<strong>de</strong>lo aproximado da alfa-hélice:a) Trace em papel milimetrado duas linhas paralelas separadas 1,8 cm uma da outra.b) Na linha <strong>de</strong> baixo, a partir <strong>de</strong> origem marque pontos distantes 3 cm um do outro.c) Na linha superior marque a origem 0,5 cm à frente da origem correspon<strong>de</strong>nte na linhainferior. A partir da origem, marque pontos na linha superior distantes 3 cm um do outro.d) Una os pontos correspon<strong>de</strong>ntes nas linhas superior e inferior, <strong>de</strong> tal modo a obter umasérie <strong>de</strong> paralelogramos.e) Em cada paralelogramo trace três segmentos auxiliares:(1) No lado menor da esquerda marque um ponto 0,3 cm abaixo do vértice esquerdosuperior. No lado menor à direita marque um ponto 0,3 cm acima do vértice inferior. Unaestes pontos.(2) e (3) Trace segmentos paralelos aos lados menores que distem entre si 1 cm.Desta forma o paralelogramo é dividido por estes segmentos em três terços iguais.f) Escreva a letra C (Carbono) no encontro dos segmentos (1) e (2) e o N (Nitrogênio) noencontro <strong>de</strong> (1) e (3).g) No centro dos lados menores escreva Cα.h) Una C α - C - N - C α - C - N - ....i) Faça C = O para cima ao longo do segmento (2) e N - H para baixo ao longo <strong>de</strong> (3).
j) Dobre a tira <strong>de</strong> papel nas posições correspon<strong>de</strong>ntes aos lados menores e fixe as pontes <strong>de</strong>hidrogênio N - H ... O = C com pequeno pedaço <strong>de</strong> fita a<strong>de</strong>siva, <strong>de</strong> tal forma a obter noconjunto uma hélice.11. Seguindo as instruções abaixo, faça com papel um mo<strong>de</strong>lo aproximado <strong>de</strong> um folhapregueada beta com ca<strong>de</strong>ias polipeptídicas antiparalelas:a) Numa folha <strong>de</strong> papel sulfite com seus lados maiores em posição horizontal trace as linhasauxiliares da maneira indicada abaixo.b) Trace levemente linhas verticais distantes entre si 6 cm. A primeira linha à esquerda po<strong>de</strong>distar 1 cm do lado menor.c) Trace levemente pares <strong>de</strong> paralelas horizontais distantes 1,2 cm entre si. No primeiro par,a linha superior <strong>de</strong>ve distar 1 cm do lado maior superior da folha <strong>de</strong> papel. A paralelainferior dista 1,2 cm da linha superior.d) Abaixo 4,2 cm da linha inferior do primeiro par <strong>de</strong> paralelas trace a linha superior dosegundo par. Trace em seguida a linha inferior do segundo par.e) Da mesma forma trace o terceiro e quarto pares <strong>de</strong> paralelas.f) Com as verticais e os pares <strong>de</strong> paralelas você obteve uma série <strong>de</strong> retângulos medindo 1,2cm (lado menor) por 6 cm (lado maior).g) Na primeira série <strong>de</strong> retângulos (a série superior) escreva Cα no vértice superior esquerdodo primeiro retângulo da esquerda. No vértice inferior direito escreva também Cα. Assim,<strong>de</strong> forma diagonalmente oposta, vá escrevendo Cα na primeira série <strong>de</strong> retângulos.h) Na segunda série <strong>de</strong> retângulos (uma abaixo da série superior) escreva Cα no vérticeinferior esquerdo do primeiro retângulo da esquerda. No vértice superior direito escrevatambém Cα. Assim, <strong>de</strong> forma diagonalmente oposta, vá escrevendo Cα na segunda série<strong>de</strong> retângulos.i) Proceda com em (g) para escrever Cα na terceira série <strong>de</strong> retângulos.j) Proceda como em (h) para escrever Cα na quarta série <strong>de</strong> retângulos.k) Entre duas verticais (separadas <strong>de</strong> 6 cm) trace levemente duas outras verticais separadas<strong>de</strong> 2 cm.l) Agora, na primeira série <strong>de</strong> retângulos escreva C <strong>de</strong> forma diagonalmente aposta a Cα.Diagonalmente oposto a C escreva N. Vá escrevendo C e N diagonalmente opostos.m) Também, na segunda série <strong>de</strong> retângulos escreva N <strong>de</strong> forma diagonalmente oposta a Cα.Diagonalmente oposto a N escreva C. Vá escrevendo N e C diagonalmente opostos.n) Na terceira série <strong>de</strong> retângulos escreva C e N como em (l).o) Na quarta série <strong>de</strong> retângulos escreva N e C como em (m).p) Nos C (não em Cα) faça C = O (as ligações <strong>de</strong>vem estar centradas em C e a 120 o ).q) Nos N faça N - H (as ligações <strong>de</strong>vem estar centradas em N e a 120 o ).r) Estabeleça as pontes <strong>de</strong> hidrogênio entre as ca<strong>de</strong>ias com os C = O e H - N próximos(C = O --- H - N).s) Dobre a folha <strong>de</strong> papel em zig-zag, vincando-a nas verticais que passam por Cα.
ENZIMAS01. Segel, Biochemical Calculations, Capítulo 4, Problema 4-18. Um extrato bruto livre <strong>de</strong>células contém 20 mg/ml <strong>de</strong> proteína. Uma alíquota <strong>de</strong> 10 µl (microlitros) <strong>de</strong>ste extratoem um volume total <strong>de</strong> reação standard <strong>de</strong> 0,5 ml catalisou a formação <strong>de</strong> 30 nmoles(nanomoles) do produto em 1 min sob condições ótimas <strong>de</strong> ensaio (força iônica e pHótimos, concentrações saturantes <strong>de</strong> todos substratos, coenzimas, ativadores, etc.)a) Expresse v em termos <strong>de</strong> nmoles x ml -1 x min -1 , nmoles x litro -1 x min -1 , µmolesx litro -1 x min -1 , M x min -1b) Qual seria o valor <strong>de</strong> v se os mesmos 10 µl do extrato fossem ensaiados em um volumetotal <strong>de</strong> 1,0 ml?c) Em termos <strong>de</strong> unida<strong>de</strong>s/ml, qual é a concentração da enzima na mistura <strong>de</strong> ensaio e noextrato?d) Qual é a ativida<strong>de</strong> específica da preparação?02. Rawn, Biochemistry, Capítulo 7, Problema 1. A acetilcolinesterase (uma esterase)catalisa a hidrólise da acetilcolina:acetilcolina + H O2 →colina + acido aceticoa) Escreva a reação catalisada usando fórmulas estruturais e indique na estrutura daacetilcolina a ligação que é clivada. A enzima é inativada por DFP (diisopropilfluorofosfato).b) Qual é o resíduo <strong>de</strong> aminoácido que provavelmente está no sítio ativo da esterase?c) Como po<strong>de</strong>ria ser i<strong>de</strong>ntificado o resíduo modificado?d) Qual é o provável papel <strong>de</strong>ste resíduo no mecanismo da catálise?03. Wood et al., Biochemistry: A Problems Approach, Capítulo 7, Problema 7-7 (Resolvernumericamente; não graficamente). Os dados da tabela abaixo foram obtidos para umareação enzimática (volume final 10 ml), usando-se o seguinte procedimento:A fim <strong>de</strong> se estudar a <strong>de</strong>pendência da velocida<strong>de</strong> <strong>de</strong> uma reação enzimática pelaconcentração <strong>de</strong> substrato, uma quantida<strong>de</strong> constante <strong>de</strong> enzima foi adicionada a umasérie <strong>de</strong> tubos contendo diferentes concentrações <strong>de</strong> substrato. As velocida<strong>de</strong>s iniciais dareação foram <strong>de</strong>terminadas medindo-se o número <strong>de</strong> moles (ou µmoles) <strong>de</strong> substratoconsumido (ou produto formado) por minuto. A tabela a seguir mostra as velocida<strong>de</strong>siniciais fornecidas pelas respectivas concentrações <strong>de</strong> substrato:Pergunta-se:[S] (moles/litro)v (µmoles/min)5,0 x 10 -2 0,255,0 x 10 -3 0,255,0 x 10 -4 0,255,0 x 10 -5 0,205,0 x 10- 6 0,0715,0 x 10- 7 0,0096(a) Qual é a V max para esta concentração <strong>de</strong> enzima?(b) Qual é o K M <strong>de</strong>sta enzima?(c) Verifique se esta reação segue uma cinética simples <strong>de</strong> Michaelis-Menten.(d) Quais serão as velocida<strong>de</strong>s iniciais para:[S] = 1,0 x 10 -6 M e [S] = 1,0 x 10 -1 M?
(e) Calcule a quantida<strong>de</strong> total <strong>de</strong> produto formado durante os primeiros cinco minutosquando a [S] = 2,0 x 10 -3 M. É possível fazer o mesmo cálculo para uma[S]=2,0x10 -6 M?(f) Suponha que a concentração <strong>de</strong> enzima em cada tubo foi aumentada por um fator <strong>de</strong> 4.Quais são os valores <strong>de</strong> K M e V max ? Neste caso, qual é o valor <strong>de</strong> v para[S] = 5,0x10 -6 M?04. Stryer, Biochemistry, 2 a. ed., Capítulo 6, Problema 2. A penicilinase, uma enzimapresente em algumas bactérias resistentes, hidrolisa penicilina tornando-a inativa. O P.M.<strong>de</strong>sta enzima em Staphylococcus aureus é 29.600. Mediu-se em função da concentração<strong>de</strong> penicilina, a quantida<strong>de</strong> <strong>de</strong>ste antibiótico que foi hidrolisada em 1 min em 10 ml <strong>de</strong>uma solução que continha 10 -9 g <strong>de</strong> penicilinase purificada. Consi<strong>de</strong>re que aconcentração <strong>de</strong> penicilina não se altera apreciavelmente durante o ensaio:Penicilina(moles/litro)Quantida<strong>de</strong> hidrolisada(moles)0,1 x 10 -5 0,11 x 10 -90,3 x 10 -5 0,25 x 10 -90,5 x 10 -5 0,34 x 10 -91,0 x 10 -5 0,45 x 10 -93,0 x 10 -5 0,58 x 10 -95,0 x 10 -5 0,61 x 10 -9(a) Projete 1/v versus 1/[S] para estes dados. Há indicação <strong>de</strong> que a penicilinase segue umacinética <strong>de</strong> Michaelis-Menten? Em caso afirmativo, qual é o valor <strong>de</strong> K M ?(b) Qual é o valor <strong>de</strong> V max ?(c) Qual é o valor do número <strong>de</strong> transformação (turnover) da penicilinase nestas condiçõesexperimentais? (Consi<strong>de</strong>re um centro ativo por molécula <strong>de</strong> enzima)05. Faça o gráfico da velocida<strong>de</strong> <strong>de</strong> uma reação enzimática em função do pH, admitindo-seque a enzima seja estável <strong>de</strong> pH 3 a 12, o substrato não contém grupos ionizáveis e acatálise <strong>de</strong>pen<strong>de</strong> da presença no centro ativo <strong>de</strong>: (a) uma carboxila (pKa = 5)<strong>de</strong>sprotonada, (b) um grupo amina (pKa = 9) protonado, e (c) uma carboxila (pKa = 5)<strong>de</strong>sprotonada e um grupo amina (pKa = 9) protonado.06. Stryer, Biochemistry, 2 a. ed., Capítulo 6, Problema 3. Foram efetuadas medidascinéticas para uma enzima na ausência e na presença <strong>de</strong> inibidor ([I] = 2 x 10 -3 M, fixa).As velocida<strong>de</strong>s iniciais correspon<strong>de</strong>ntes às várias concentrações <strong>de</strong> substrato estãoindicadas na tabela abaixo:Pergunta-se:[S] MVelocida<strong>de</strong> (µmol/min)sem inibidor com inibidor0,3 x 10 -5 10,4 4,10,5 x 10 -5 14,5 6,41,0 x 10 -5 22,5 11,33,0 x 10 -5 33,8 22,69,0 x 10 -5 40,5 33,8(a) Quais são os valores <strong>de</strong> V max e K M na ausência <strong>de</strong> inibidor? E na sua presença? (b)Qual é o tipo <strong>de</strong> inibição? (c) Qual é a constante <strong>de</strong> dissociação do complexo enzimainibidor?Compare com o valor <strong>de</strong> K M .
07. Stryer, Biochemistry, 2 a ed., Capítulo 6, Problema 4. Foram efetuadas medidas cinéticaspara a enzima discutida no exercício anterior na presença <strong>de</strong> um inibidor diferente([I] = 10 -4 M, fixa):Pergunta-se:[S] MVelocida<strong>de</strong> (u mol/min)sem inibidor com inibidor0,3 x 10 -5 10,4 2,10,5 x 10 -5 14,5 2,91,0 x 10 -5 22,5 4,53,0 x 10 -5 33,8 6,89,0 x 10 -5 40,5 8,1(a) Quais são os valores <strong>de</strong> V max e K M na presença <strong>de</strong>ste inibidor? (b) Qual é o tipo <strong>de</strong>inibição? (c) Qual é a constante <strong>de</strong> dissociação do complexo enzima-inibidor?CARBOIDRATOS01. Stryer, Biochemistry, 3 a ed., Capítulo 14, Problema 1. Indique se cada um dos seguintespares consiste <strong>de</strong> anômeros, epímeros ou par aldose-cetose:a) D-gliceral<strong>de</strong>ido e dihidroxiacetonab) D-glicose e D-manosec) D-glicose e D-frutosed) α-D-glicose e β-D-glicosee) D-ribose e D-ribulosef) D-galactose e D-glicose02. Gumport et al., Stu<strong>de</strong>nt’s Companion to Stryer’s Biochemistry, Capítulo 14, Self-Test,Problema 3. Examine as cinco seguintes estruturas <strong>de</strong> açúcares.
Indique através das letras representativas os açúcares que:a) contêm ou são pentosesb) contêm ou são cetosesc) contêm os mesmos monossacarí<strong>de</strong>os dê o nome <strong>de</strong>stesmonossacarí<strong>de</strong>osd) fornecem diferentes açúcares por hidrólise enzimática ou química da ligação glicosídicae) são redutoresf) contêm um carbono β anoméricog) sofrem mutarrotaçãoh) é sacarosei) correspon<strong>de</strong>m aos que são liberados na digestão do amido03. Lehminger, Principles of Biochemistry, Capítulo 11, Problema 1. Interconversão dasformas <strong>de</strong> D-galactose.Uma solução recém-preparada da forma α (1g/ml em um tubo polarimétrico <strong>de</strong> 1 dm)mostra uma rotação óptica <strong>de</strong> + 150,7 o . Quando <strong>de</strong>ixada em repouso por um longoperíodo <strong>de</strong> tempo a rotação <strong>de</strong>cresce gradualmente até atingir um valor <strong>de</strong> equilíbrioigual a + 80,2 o . Em contraste, uma solução recém-preparada (1g/ml) da forma β mostrarotação ótica <strong>de</strong> apenas +52,8 o . Quando esta solução é <strong>de</strong>ixada em repouso por váriashoras a rotação aumenta até o valor <strong>de</strong> equilíbrio igual a +80,2 o , valor idêntico àqueleobservado para a α-D-galactose.a) Escreva as fórmulas <strong>de</strong> projeção <strong>de</strong> Haworth das formas α e β da D-galactose. Qualcaracterística distingue as duas formas?b) Por que a rotação <strong>de</strong> uma solução recém-preparada da forma α <strong>de</strong>cresce gradualmentecom o tempo? Explique por que soluções das formas α e β (<strong>de</strong> concentrações iguais)atingem o mesmo valor <strong>de</strong> rotação óptica no equilíbrio? Explique.c) Calcule a composição percentual das duas formas <strong>de</strong> galactose no equilíbrio.04. Van Eikeren, Gui<strong>de</strong> to Lehninger’s Principles of Biochemistry, Capítulo 11, Structureand Properties of Monosacchari<strong>de</strong>s, Study Questions and Problems, Problema 7. Frutose,o principal açúcar do mel, é comumente usada como adoçante <strong>de</strong> alimento. Este açúcarna forma β-D-piranose é provavelmente a substância mais doce conhecida. A forma β-Dfuranoseé muito menos doce.Quais são as estruturas da β-D-frutopiranose e β-D-frutofuranose?A doçura do mel diminui ao <strong>de</strong>ixá-lo em repouso e ao mesmo tempo aumentando atemperatura. Explique.05. Van Eikeren, Gui<strong>de</strong> to Lehninger’s Principles of Biochemistry, Capítulo 11, CovalentlyBon<strong>de</strong>d Monosacchari<strong>de</strong>s: Disacchari<strong>de</strong>s and Polysacchari<strong>de</strong>s, Study Questions andProblems. Problema 1. Conhecendo-se as fórmulas <strong>de</strong> projeção <strong>de</strong> Haworth da maltose,lactose e sacarose, i<strong>de</strong>ntifique em cada uma <strong>de</strong>las a ligação glicosídica. Quais são osprodutos quando cada dissacarí<strong>de</strong>o é hidrolisado em presença <strong>de</strong> ácido? Escreva asestruturas dos monossacarí<strong>de</strong>os.
06. Van Eikeren, Gui<strong>de</strong> to Lehninger’s Principles of Biochemistry, Capítulo 11, CovalentlyBon<strong>de</strong>d Monosacchari<strong>de</strong>s: Disacchari<strong>de</strong>s and Polysacchari<strong>de</strong>s, Study Questions andProblems. Problema 2. Uma amostra <strong>de</strong> dissacarí<strong>de</strong>o correspon<strong>de</strong> ou lactose ou sacarose.A amostra fornece resultado negativo no teste para se verificar se o dissacarí<strong>de</strong>o éredutor. Entretanto, o mesmo teste dá resultado positivo se a amostra é antes tratada comácido diluído e aquecida. A amostra <strong>de</strong>sconhecida correspon<strong>de</strong> a lactose ou a sacarose?Explique.07. Lehninger, Principles of Biochemistry, Capítulo 11. Problema 7. Comparação entrecelulose e glicogênio. A Celulose, praticamente pura obtida das fibras que envolvem assementes do algodão, é resistente, fibrosa e completamente insolúvel em água.Diferentemente, o glucogênio extraído <strong>de</strong> fígado ou músculo dispersa-se facilmente emágua quente formando uma solução turva. Embora eles tenham proprieda<strong>de</strong>s físicasmarcadamente diferentes, as duas substâncias são compostas por moléculas <strong>de</strong> D-glicosepolimerizadas através <strong>de</strong> ligações 1 → 4 e têm pesos moleculares comparáveis.Quais características estruturais são responsáveis por estas proprieda<strong>de</strong>s tãodiferentes dos dois polissacarí<strong>de</strong>os?Quais as vantagens biológicas <strong>de</strong> suas respectivas proprieda<strong>de</strong>s físicas?08. Van Eikeren, Gui<strong>de</strong> to Lehninger’s Principles of Biochemistry, Capítulo 11,Glycoproteins: Hybrid Molecules of Carbohydrate and Protein, Problema 1. A figuraabaixo mostra uma unida<strong>de</strong> repetitiva da molécula <strong>de</strong> uma glicoproteína.Escreva a fórmula <strong>de</strong> projeção <strong>de</strong> Haworth <strong>de</strong>sta unida<strong>de</strong>, assumindo-se que osmonossacarí<strong>de</strong>os são ligados por ligação glucosídica β1 → 4.09. Van Eikeren, Gui<strong>de</strong> to Lehninger’s Principles of Biochemistry, Capítulo 11, Self-Test,Problema 13. A porção <strong>de</strong> natureza sacarídica <strong>de</strong> algumas glicoproteínas po<strong>de</strong> servircomo sítio <strong>de</strong> reconhecimento celular. Para <strong>de</strong>sempenhar esta função, os oligossacarí<strong>de</strong>osou glicoproteínas <strong>de</strong>vem ter a capacida<strong>de</strong> <strong>de</strong> formar um gran<strong>de</strong> número <strong>de</strong> diferentesestruturas. Qual dos dois po<strong>de</strong> produzir uma maior varieda<strong>de</strong> <strong>de</strong> estruturas:oligopeptí<strong>de</strong>os compostos <strong>de</strong> cinco resíduos <strong>de</strong> diferentes aminoácidos ouoligossacarí<strong>de</strong>os compostos <strong>de</strong> cinco resíduos <strong>de</strong> diferentes monossacarí<strong>de</strong>os? Explique.10. Stryer, Biochemistry, 3 a ed. Capítulo 14, Problema 7. Supõe-se que uma unida<strong>de</strong>trissacarídica <strong>de</strong> uma glicoproteína <strong>de</strong> uma superfície celular <strong>de</strong>sempenha um papelcrítico em promover a a<strong>de</strong>são célula-célula em um <strong>de</strong>terminado tecido. Planeje umexperimento simples para testar esta idéia.LIPÍDEOS e MEMBRANAS01. Lehninger, Princípios <strong>de</strong> Bioquímica, Capítulo 12, Problema 1. Ponto <strong>de</strong> fusão dosácidos graxos. Os pontos <strong>de</strong> fusão <strong>de</strong> uma série <strong>de</strong> ácidos graxos <strong>de</strong> 18 átomos <strong>de</strong>carbono são: ácido esteárico (69,9 o C), ácido oléico (13,4 o C), ácido linoléico (-5 o C) eácido linolénico (-11 o C). Que aspecto estrutural <strong>de</strong>stes ácidos graxos <strong>de</strong> 18 carbonos
po<strong>de</strong> ser correlacionado com o ponto <strong>de</strong> fusão? Forneça uma explicação molecular paraesta tendência do ponto <strong>de</strong> fusão.02. Lehninger, Princípios <strong>de</strong> Bioquímica, Capítulo 12, Problema 13. Flui<strong>de</strong>z e função damembrana. Uma hipótese central, na área da pesquisa <strong>de</strong> membranas, é que os lipí<strong>de</strong>os<strong>de</strong> membrana <strong>de</strong>vem ser fluídos (em oposição a "congelados") a fim <strong>de</strong> que a membranapossa <strong>de</strong>sempenhar suas funções. O apoio para esta hipótese é fornecido pela observação<strong>de</strong> que a composição <strong>de</strong> ácido graxo das membranas po<strong>de</strong> ser alterada pelas condiçõesnas quais a bactéria cresce. Por exemplo, se a bactéria está crescendo em temperaturamenor que a normal, as quantida<strong>de</strong>s observadas <strong>de</strong> ácidos graxos insaturados (relativasao conteúdo <strong>de</strong> ácido graxo saturado) estão acima do normal.Contrariamente, se a bactéria está crescendo em temperatura acima da normal, asquantida<strong>de</strong>s observadas <strong>de</strong> ácidos graxos insaturados nos lipí<strong>de</strong>os da membrana (relativasaos ácidos graxos saturados) estão abaixo do normal.(a) Sugira razões por que o conteúdo lipídico na membrana bacteriana <strong>de</strong>ve ser fluido paraque a membrana intacta opere apropriadamente.(b) Explique como a alteração observada nos níveis dos ácidos graxos insaturados relativaaos níveis dos ácidos graxos saturados, em diferentes temperaturas <strong>de</strong> crescimento, apóiaa hipótese da flui<strong>de</strong>z da membrana.03. Rawn, Biochemistry, Capítulo 9, Problema 1. Seja uma bicamada lipídica sintéticaformada apenas <strong>de</strong> fosfatidato, na qual as duas ca<strong>de</strong>ias hidrofóbicas correspon<strong>de</strong>m aoácido graxo saturado C18, ácido esteárico. Consi<strong>de</strong>re que a esta bicamada foramimpostas as seguintes mudanças:(a) substituição <strong>de</strong> meta<strong>de</strong> das ca<strong>de</strong>ias hidrofóbicas por outras ca<strong>de</strong>ias hidrofóbicas <strong>de</strong>rivadas<strong>de</strong> C18, nas quais ocorrem uma insaturação <strong>de</strong> configuração cis (entre C9 e C10).(b) Adição <strong>de</strong> íons Ca 2+ à solução que contém a bicamada.Em ambos os casos, faça uma previsão a respeito da temperatura <strong>de</strong> transição <strong>de</strong> fase.04. Stryer, Biochemistry, 2 a. ed., Capítulo 10, Problema 1 Quantas moléculas <strong>de</strong> fosfolipí<strong>de</strong>oexistem em 1 µm 2 da região da membrana em bicamada <strong>de</strong> fosfolipí<strong>de</strong>o? Consi<strong>de</strong>re que amolécula <strong>de</strong> fosfolipí<strong>de</strong>o ocupa 70 Å 2 <strong>de</strong> área.05. Rawn, Biochemistry, Capitulo 9, Problema 3. Qual é a força ("driving force") que dirigea formação <strong>de</strong> bicamadas fosfolipídicas?06. Lehninger, Principles of Biochemistry, Capítulo 4, Problema 9. O pH e a absorção <strong>de</strong>drogas. A droga aspirina, intensamente receitada, é um ácido fraco com um pKa <strong>de</strong> 3,5.a) Escreva por fórmulas estruturais a ionização reversível da aspirina.A aspirina é absorvida para o sangue através das células <strong>de</strong> revestimento do estômagoe do intestino <strong>de</strong>lgado. Para uma substância ser absorvida ela <strong>de</strong>ve atravessar facilmentea membrana celular. A passagem através da membrana celular é <strong>de</strong>terminada pelapolarida<strong>de</strong> da molécula: moléculas iônicas (carregadas) e moléculas altamente polarespassam lentamente, enquanto aquelas neutras e hidrofóbicas passam rapidamente. Comoo pH do suco gástrico é cerca <strong>de</strong> 1 e o pH no intestino <strong>de</strong>lgado, cerca <strong>de</strong> 6, pergunta-se:b) On<strong>de</strong> a aspirina é mais absorvida para a corrente sanguínea, no estômago ou no intestino<strong>de</strong>lgado? Justifique claramente a sua escolha.07. Rawn, Biochemistry, Capítulo 9, Problema 2. Forneça uma explicação termodinâmicapara o fato <strong>de</strong> que moléculas <strong>de</strong> fosfolipí<strong>de</strong>o difun<strong>de</strong>m rapidamente no plano dabicamada, mas muito lentamente mudam <strong>de</strong> uma face à oposta.
08. Stryer, Biochemistry, 3 a. ed., Capítulo 12, Problema 5. R.D. Kornberg e H.M.McConnell (1971) pesquisaram a difusão transversa (flip-flop) <strong>de</strong> fosfolipí<strong>de</strong>os em umamembrana em bicamada usando um análogo paramagnético da fosfatidilcolina chamadofosfatidilcolina marcada com marcador <strong>de</strong> spin. (Procure a fórmula estrutural <strong>de</strong>stemarcador <strong>de</strong> spin no Stryer).O grupo nitróxido (NO) em uma fosfatidilcolina marcada com marcador <strong>de</strong> spinfornece um espectro <strong>de</strong> ressonância paramagnética eletrônica característico. Este espectro<strong>de</strong>saparece quando nitróxidos são transformados em hidroxilaminas por agentesredutores, tal como o ascorbato.Vesículas <strong>de</strong> lipí<strong>de</strong>os contendo fosfatidilcolina (95%) e o análogo marcado (5%)foram preparadas por sonicação e purificadas por cromatografia <strong>de</strong> filtração em gel. Odiâmetro externo <strong>de</strong>stes lipossomos mediu cerca <strong>de</strong> 25Å. A amplitu<strong>de</strong> do espectro <strong>de</strong>ressonância paramagnética eletrônica <strong>de</strong>cresceu a 35% do seu valor inicial em poucosminutos após a adição <strong>de</strong> ascorbato. Não houve nenhuma mudança <strong>de</strong>tectável noespectro poucos minutos após a adição <strong>de</strong> uma segunda alíquota <strong>de</strong> ascorbato. Entretanto,a amplitu<strong>de</strong> do espectro residual <strong>de</strong>cai exponencialmente com uma meia-vida <strong>de</strong> 6,5 h.Como você interpreta estas mudanças na amplitu<strong>de</strong> do espectro paramagnético?09. Campbell, Biochemistry, Capítulo 16, Problema 15. Por que, ao invés <strong>de</strong> na forma livre,o colesterol é transportado na corrente sanguínea na forma empacotada? (Ler noCampbell, no Capítulo 11, o tópico "Receptores <strong>de</strong> Membrana" e, no Capítulo 16, otópico "O Papel do Colesterol em Doenças do Coração". Ler no Stryer, no Capítulo 23,os tópicos "Colesterol e outros Lipí<strong>de</strong>os são transportados a Alvos Específicos porLipoproteínas", "O Receptor da Lipoproteína <strong>de</strong> Baixa Densida<strong>de</strong> (LDL) <strong>de</strong>sempenha umpapel importante no controle do Metabolismo do Colesterol", "O Receptor da LDL é umaProteína Transmembrânica com cinco domínios funcionalmente diferentes" e "Aausência do Receptor <strong>de</strong> LDL leva a Hipercolesterolemia e a Aterosclerose").10. Campbell, Biochemistry, Capítulo 11, Problema 8. Que tipo <strong>de</strong> resíduos <strong>de</strong> aminoácidosé mais provável se encontrar no sítio <strong>de</strong> ligação do receptor da LDL? Dê uma razão parasua resposta.TERMODINÂMICA APLICADA ÀS REAÇÕES BIOQUÍMICAS01. Wood et al., Biochemistry: A Problems Approach, Capítulo 9, Problema 9-4. O ∆G o’para a hidrólise do ATP a ADP + Pi é -7,3 Kcal/mol.a) Calcule a constante <strong>de</strong> equilíbrio para esta reação. No equilíbrio há mais ADP que ATP ouo inverso?.b) Na célula, esta reação está no equilíbrio?02. Wood et al., Biochemistry: A Problems Approach, Capítulo 9, Problema 9-5. No interiorda célula é, em geral, o ∆G' para a hidrólise do ATP mais negativo ou menos negativoque o ∆G o’ ? Por quê?03. Stryer, Biochemistry, 3 a edição, Capítulo 13, Problema 5. A formação <strong>de</strong> Acetil CoA apartir <strong>de</strong> Acetato é um processo <strong>de</strong>pen<strong>de</strong>nte <strong>de</strong> ATP:Acetato + ATP + CoAAcetil CoA + AMP + PPia) Calcular o ∆G o ' da reação acima, sabendo-se que os ∆G o ' <strong>de</strong> hidrólise do Acetil CoA aAcetato é -7,5 Kcal/mol e do ATP a AMP e PPi é -7,3 Kcal/mol.
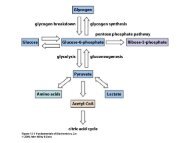
) Sabendo que nas células o PPi formado é rapidamente hidrolisado a 2Pi por umapirofosfatase inorgânica (∆G o '= -8 Kcal/mol), discuta o efeito da hidrólise do PPi naformação <strong>de</strong> Acetil CoA a partir <strong>de</strong> Acetato.04. Stryer, Biochemistry, 3 a edição, Capítulo 13, Problema 4. Dados os ∆G o ' <strong>de</strong> hidrólise <strong>de</strong>glicose-6-fosfato e glicose-1-fosfato, respectivamente -3,3 Kcal/mol e -5,0 Kcal/mol,calcule:a) O ∆G o ' da isomerização <strong>de</strong> glicose-6-fosfato a glicose-1-fosfato.b) No equilíbrio, qual é a razão entre as concentrações <strong>de</strong> glicose-6-fosfato e <strong>de</strong> glicose-1-fosfato?c) Em que condições celulares a isomerização referida no item (a) po<strong>de</strong>ria produzircontinuamente e em alta velocida<strong>de</strong> a glicose-1-fosfato?05. Stryer, Biochemsitry, 3 a edição, Capítulo 13, Problema 1. Discuta em que sentidoocorrem as reações abaixo, quando os reagentes estão presentes inicialmente emquantida<strong>de</strong>s equimolaresa) ATP + creatina creatinafosfato + ADPb) ATP + glicerol glicerol-3-fosfato + ADPc) ATP + piruvato fosfoenolpiruvato + ADPd) ATP + glicose glicose-6-fosfato + ADP∆G o ' <strong>de</strong> hidrólisecreatinafosfato-10,3 Kcal/molglicerol-3-fosfato- 2,2 Kcal/molfosfoenolpiruvato-14,8 Kcal/molglicose-6-fosfato- 3,3 Kcal/molATP a ADP- 7,3 Kcal/mol06. Van Eikeren, qui<strong>de</strong> to Lehninger's Principles of Biochemistry, Capítulo 14, Self-Test,Problema 1. Consi<strong>de</strong>re um ecossistema que consiste <strong>de</strong> um ovo e uma choca<strong>de</strong>ira. Aclara e a gema do ovo contêm proteínas, carboidratos e lipí<strong>de</strong>os. Se fertilizado, o ovotransforma-se <strong>de</strong> uma simples célula em um organismo complexo. Discuta este processoirreversível em termos <strong>de</strong> variações <strong>de</strong> entropia que se verificam no sistema, vizinhançase universo. Esteja certo <strong>de</strong> que, antes <strong>de</strong> mais nada, você tenha <strong>de</strong>finido claramente osistema e as vizinhanças.INTRODUÇÃO AO METABOLISMO01. Consi<strong>de</strong>rar o mapa metabólico simplificado apresentado em classe e respon<strong>de</strong>r:(a) Quais são os passos irreversíveis que aparecem no mapa?(b) Qual é o primeiro composto comum que aparece na <strong>de</strong>gradação <strong>de</strong> proteínas, lipí<strong>de</strong>os ecarboidratos?(c) Animais <strong>de</strong> laboratório foram submetidos a dietas compostas exclusivamente <strong>de</strong>carboidratos, ou lipí<strong>de</strong>os, ou proteínas. Analisar em que caso haveria sobrevivência,verificando se é possível sintetizar:ácido graxo a partir <strong>de</strong> glicoseproteína a partir <strong>de</strong> glicoseglicose a partir <strong>de</strong> ácido graxoproteína a partir <strong>de</strong> ácido graxoglicose a partir <strong>de</strong> proteínaácido graxo a partir <strong>de</strong> proteína
Em cada caso afirmativo, indicar a via utilizada02. Que compostos um indivíduo <strong>de</strong>ve obrigatoriamente receber na dieta? Utilizar apenas asinformações do mapa metabólico simplificado.03. Glicose é utilizada como fonte <strong>de</strong> energia para a célula, ou organismo com a finalida<strong>de</strong><strong>de</strong> produzir ATP. O excesso <strong>de</strong> glicose po<strong>de</strong> ser convertido em gordura. O esquemasimplificado abaixo mostra estas duas possibilida<strong>de</strong>s:Discuta:a) Neste esquema, quais são as possíveis reações catalisadas por enzimas alostéricas?b) Como funciona o esquema acima quando há disponibilida<strong>de</strong> <strong>de</strong> muita glicose?c) O substrato B po<strong>de</strong> dar origem a dois produtos diferentes. Faça os gráficos <strong>de</strong> velocida<strong>de</strong>em função da concentração <strong>de</strong> B para cada uma das enzimas.d) Quando houver pouca disponibilida<strong>de</strong> <strong>de</strong> B qual seu caminho preferencial? Por quê?04. Lehninger, Principles of Biochemistry, Capítulo 13, Problema 5. Comparação entre viacatabólica e via anabólica. A interconversão <strong>de</strong> glicose a frutose-1,6-difosfato, uma sériemuito importante <strong>de</strong> etapas no metabolismo <strong>de</strong> carboidratos, é mostrada abaixo. Aquebra da glicose constitui a via catabólica, enquanto a biossíntese <strong>de</strong> glicose a partir <strong>de</strong>frutose-1,6-difosfato correspon<strong>de</strong> a via anabólica. Ambas as vias usam as mesmashexoses monofosfato intermediárias. Embora estas vias tenham semelhanças, elasapresentam diferenças básicas. A finalida<strong>de</strong> <strong>de</strong>ste exercício é reconhecê-las.
a) Esquematize a reação balanceada para cada passo na via catabólica. Escreva a equaçãolíquida que resulta quando soma-se os passos individuais.b) Repita o item (a) para a via anabólica.c) Baseado nas equações líquidas, quais são as diferenças que po<strong>de</strong>m ser notadas entre asvias catabólica e anabólica? As duas vias são simplesmente o reverso uma da outra?d) O que assegura o sentido das reações individuais no catabolismo da glicose? Ou seja, oque impe<strong>de</strong> que no catabolismo da glicose passe a ocorrer por vias reversas?e) Nas vias catabólica e anabólica, a interconversão <strong>de</strong> glicose e glicose-6-fosfato po<strong>de</strong>ria sercatalisada pela mesma enzima? Explique. A interconversão <strong>de</strong> glicose-6-fosfato efrutose-6-fosfato nas vias catabólica e anabólica po<strong>de</strong>ria ser catalisada pela mesmaenzima? ExpliqueGLICÓLISE01. Stryer, Biochemistry 3 a edição, Capítulo 15, Problema 3. Escreva a equação balanceadapara a conversão da Glicose a Lactato.a) Calcule a variação <strong>de</strong> energia livre padrão <strong>de</strong>sta reação usando os dados apresentados natabela 15-2 do capítulo 15 do Stryer (3 a edição) e levando em conta que o ∆G o' para areação Piruvato + NADH + H + → Lactato + NAD + , é igual a -6 Kcal/molb) Qual é a variação <strong>de</strong> energia livre (∆G', não ∆G o’ ) para esta reação quando asconcentrações <strong>de</strong> reagentes e produtos são:Glicose 5 mM ADP 0,2 mMLactato 0,05 mM Pi 1 mMATP2 mM02. Stryer, Biochemistry, 3 a edição, Capítulo 15, Problema 2. Glicose marcada com 14 C emC-1 é incubada com as enzimas da glicólise e os cofatores necessários. Qual é adistribuição <strong>de</strong> 14 C no Piruvato que é formado? (Consi<strong>de</strong>rar que a interconversão entreGliceral<strong>de</strong>ído 3-fosfato e Dihidroxiacetona fosfato é muito rápida comparada com opasso subsequente).03. Discutir a regulação da via glicolítica em função da relação ATP/ADP.04. Em relação a via glicolítica:a) Verificar os compostos que apresentam ligações tipo: fosfoenol, anidrido fosfórico e ésterfosfórico e i<strong>de</strong>ntificar aqueles que são compostos ricos em energiab) Indicar as reações <strong>de</strong> oxidorreduçãoc) Dizer como é regulada a via glicolítica e citar as enzimas e seus moduladoresd) Mostrar os passos irreversíveis que fazem parte do mapae) Determinar quantas moléculas <strong>de</strong> Ácido Pirúvico se formam a partir <strong>de</strong> uma molécula <strong>de</strong>hexose05. Rawn, Biochemistry, Capítulo, 12, Problema 14. Uma pessoa incapaz <strong>de</strong> executarexercícios físicos intensos e prolongados teve suas enzimas analisadas. Todas as enzimasda via glicolítica estavam em concentração normal, com excessão da fosfogliceratomutase muscular.
a) Como será afetada a produção <strong>de</strong> energia metabólica em uma célula que apresenta baixosníveis <strong>de</strong>sta enzima?b) Como será afetada a produção <strong>de</strong> Lactato na ausência <strong>de</strong>sta enzima? [Referência: DiMauro, S.; Miranda, A.F.; Kahn, S.; Gitlin, K. - Human muscle phosphoglycerate mutase<strong>de</strong>ficiency Science 212: 1277-1279, 1981].β-OXIDAÇÃO DE ÁCIDOS GRAXOS01. Carnitina é amplamente distribuída nos tecidos, mas atinge concentração elevada nomúsculo. O que sugere este dado?02. Cite os compostos que <strong>de</strong>vem ser fornecidos para a manutenção da espiral <strong>de</strong> Lynen.03. Compare a oxidação <strong>de</strong> 3 Glicose → Acetil-CoA, com a oxidação <strong>de</strong> Ácido Láurico(12C) a Acetil-CoA, quanto a:a) Número <strong>de</strong> moléculas <strong>de</strong> Acetil-CoA formadasb) Liberação <strong>de</strong> CO 2c) Gasto em ATPd) Saldo <strong>de</strong> ATPe) Número <strong>de</strong> moléculas <strong>de</strong> NADH ou FADH 2 formadasf) Coenzimas e vitaminas envolvidasg) Localização celular04. Indique o caminho percorrido pelos carbonos do Glicerol na sua transformação a AcetilCoA.CICLO DE KREBS01. Quando uma preparação <strong>de</strong> mitocôndrias (convenientemente tratada) é incubada comAcetil-CoA, verifica-se que para cada mol <strong>de</strong> Acetil-CoA adicionado formam-se doismoles <strong>de</strong> CO 2 e que a velocida<strong>de</strong> <strong>de</strong> formação <strong>de</strong> CO 2 (µl <strong>de</strong> CO 2 /min) tem um valor Aqualquer.a) Quando se adiciona Acetil-CoA + Succinato, observa-se que a velocida<strong>de</strong> da produção <strong>de</strong>CO 2 aumenta e o aumento <strong>de</strong> CO 2 produzido exce<strong>de</strong> a quantida<strong>de</strong> <strong>de</strong> Succinatoadicionado, ou seja, o efeito do Succinato é catalítico.Discuta as observações acima.b) O que aconteceria se a incubação fosse feita na presença <strong>de</strong> Acetil-CoA + Succinato +Malonato?02. Como os intermediários do ciclo <strong>de</strong> Krebs po<strong>de</strong>riam ser repostos se houvesse intensasíntese <strong>de</strong> Ácido Aspártico e Glutâmico às custas dos intermediários do ciclo <strong>de</strong> Krebs?03. A carboxilase pirúvica é estimulada alostericamente por Acetil-CoA. Discuta aimportância <strong>de</strong>ste fato para o metabolismo energético.04. Mostre como o ciclo <strong>de</strong> Krebs e a glicólise po<strong>de</strong>m ser reguladas pela isocitrato<strong>de</strong>sidrogenase.
05. Por que um esquimó com dieta <strong>de</strong>ficiente em carboidratos estaria nutricionalmentemelhor comendo alimentos com lipí<strong>de</strong>os contendo ácidos graxos com número ímpar <strong>de</strong>átomos <strong>de</strong> Carbono ao invés <strong>de</strong> número par?CADEIA RESPIRATÓRIA01. A relação entre energia livre <strong>de</strong> uma reação e o potencial redox é:∆G o ' = -nF∆E o ' on<strong>de</strong> n é o número <strong>de</strong> elétrons transferidosF é a constante <strong>de</strong> Faraday(F = 23.060 cal V -1 )∆E o ' é o potencial padrão da dupla redox.Utilizar esta relação para calcular os pontos da ca<strong>de</strong>ia respiratória on<strong>de</strong> a energia"liberada" na reação <strong>de</strong> transferência <strong>de</strong> elétrons po<strong>de</strong>ria ser usada para a síntese <strong>de</strong> umcomposto rico em energia, aproximadamente +7300 cal/mol.02. A uma solução 1 M <strong>de</strong> NAD + , NADH, Piruvato e Lactato, adicionou-se lactato<strong>de</strong>sidrogenase:Lactato + NAD + ↔ Piruvato + NADH + H +E o ' (NAD + /NADH) = -0,32 VE o ' (Piruvato/Lactato) = 0,19 Va) Em que sentido a reação ocorrerá?b) À medida que a reação ocorre, como variam esses potenciais redox?c) Quando a reação atingirá o equilíbrio? Qual o valor do potencial redox (∆E) nessasituação?03. Citar as consequências dos seguintes fatores para o funcionamento da ca<strong>de</strong>ia respiratóriae da fosforilação oxidativa:a) Presença <strong>de</strong> KCN ou COb) Carência <strong>de</strong> Pic) Carência <strong>de</strong> ADPd) Presença <strong>de</strong> DNP (dinitrofenol)e) Carência <strong>de</strong> Pi e/ou ADP em presença <strong>de</strong> DNPf) Presença <strong>de</strong> oligomicinag) Presença <strong>de</strong> oligomicina + DNP04. Uma droga X inibe o consumo <strong>de</strong> O 2 e a síntese <strong>de</strong> ATP em uma suspensão <strong>de</strong>mitocôndrias. Que tipo <strong>de</strong> droga <strong>de</strong>veria ser adicionada para se <strong>de</strong>terminar o modo <strong>de</strong>ação da droga X?05. Calcular o número <strong>de</strong> moléculas <strong>de</strong> ATPs formadas na oxidação total <strong>de</strong>:I. glicose (uma molécula)II. ácido palmítico (16C) (uma molécula)a) Qual seria o <strong>de</strong>stino da energia não armazenada sob a forma <strong>de</strong> ATP?b) Qual seria o resultado na presença <strong>de</strong> dinitrofenol?06. Discutir o funcionamento do ciclo <strong>de</strong> Krebs, beta-oxidação e via glicolítica em umasuspensão <strong>de</strong> células hepáticas na presença dos seguintes compostos:
antimicina, oligomicina, dinitrofenol, antimicina + dinitrofenol e oligomicina +dinitrofenol.Justificar.07. A membrana externa da mitocôndria é permeável à maioria dos solutos <strong>de</strong> baixo pesomolecular. A membrana interna, entretanto, possui seletivida<strong>de</strong>, sendo impermeável porexemplo a coenzimas, nucleotí<strong>de</strong>os, etc. De posse <strong>de</strong>ssas informações respon<strong>de</strong>r asseguintes indagações:a) Como os acil-CoA produzidos após ativação dos ácidos graxos po<strong>de</strong>m ser <strong>de</strong>gradados naβ-oxidação?b) Como o NADH produzido na via glicolítica po<strong>de</strong> ser reoxidado na ca<strong>de</strong>ia respiratória?c) Como o ATP produzido na ca<strong>de</strong>ia respiratória po<strong>de</strong> ser utilizado nas biossínteses queocorrem no citoplasma?08. Um microorganismo aeróbico facultativo é cultivado em meio líquido glicosado comaeração e sem aeração. Em qual das duas culturas o consumo <strong>de</strong> glicose pelas células émaior? Justificar a resposta em termos <strong>de</strong> regulação metabólica.09. Aceita-se que a oxidação <strong>de</strong> NADH ao nível <strong>de</strong> ca<strong>de</strong>ia respiratória produz, em média, 3ATP. É conhecido que existem "sítios" <strong>de</strong> produção <strong>de</strong> ATP (quais?). Discutir a relaçãoestequiométrica e a existência <strong>de</strong> "sítios" à luz da teoria do acoplamento quimiosmótico.VIA DAS PENTOSES01. Po<strong>de</strong>-se consi<strong>de</strong>rar, para efeito <strong>de</strong> melhor compreensão, que a via das pentoses constituise<strong>de</strong> um ramo oxidativo (transformação irreversível <strong>de</strong> glicose-6-fosfato a pentoses) e <strong>de</strong>um ramo não oxidativo (transformação reversível <strong>de</strong> pentoses a frutose-6-fosfato egliceral<strong>de</strong>ído-3-fosfato). Partindo-se <strong>de</strong> glicose-6-fosfato e consi<strong>de</strong>rando-se estes doisramos, pe<strong>de</strong>-se indicar como po<strong>de</strong>m ser obtidos os seguintes intermediários quando uma<strong>de</strong>terminada célula <strong>de</strong>les necessite em gran<strong>de</strong>s quantida<strong>de</strong>s:a) ribose-5-fosfatob) ribose-5-fosfato e NADPHc) NADPH02. Experimentos com glicose-6-fosfato marcada com isótopo radioativo ( 14 C) no C 1 ou noC 6 indicam quanto do substrato inicial é metabolizado pela via das pentoses e quanto émetabolizado pela ação combinada da glicólise e ciclo <strong>de</strong> Krebs. Uma alíquota dohomogenato do tecido em estudo é incubada com glicose-6-fosfato com 14 C no C 1 eoutra, com o mesmo substrato com 14 C no C 6 . Que resultado <strong>de</strong>ve ser esperado, emtermos <strong>de</strong> produção <strong>de</strong> 14 CO 2 em função do tempo, se o homogenato metabolizaglicose-6-fosfato:a) Somente pela ação combinada da glicólise e ciclo <strong>de</strong> Krebs,b) Somente pela via das pentoses, ec) Pelas duas vias simultaneamente03. Discutir as condições em que <strong>de</strong>verá haver predomínio <strong>de</strong> uma das vias (glicólise ou viadas pentoses) no metabolismo da glicose. Citar os tecidos on<strong>de</strong> a via das pentoses é maisativa.04. Esquematizar o catabolismo da glicose na hemácia enfatizando:
a) O <strong>de</strong>stino do lactatob) A função do NADPHA hemácia é uma célula aeróbica? Ela utiliza o oxigênio transportado pelahemoglobina?05. Ler o Stryer, no cap. referente a Via das Pentoses, o tópico: "A <strong>de</strong>ficiência <strong>de</strong> glicose-6-fosfato <strong>de</strong>sidrogenase causa anemia hemolítica induzida por droga".BIOSSÍNTESE DE ÁCIDOS GRAXOS01. Escrever a equação <strong>de</strong> síntese <strong>de</strong> ácido palmítico (16C) a partir <strong>de</strong> Acetil-CoA.02. Comparar a beta-oxidação com a biossíntese <strong>de</strong> ácidos graxos no complexomultienzimático quanto a:a) Localização celularb) Coenzimas envolvidas e suas vitaminasc) Carregador <strong>de</strong> grupo acilad) Forma em que as unida<strong>de</strong>s <strong>de</strong> carbono são removidas ou adicionadas03. Comparar a <strong>de</strong>gradação <strong>de</strong> ácido palmítico até acetil-CoA com sua síntese a partir <strong>de</strong>acetil-CoA quanto a necessida<strong>de</strong> <strong>de</strong>:a) ATPb) Coenzimas04. Discutir a regulação da síntese <strong>de</strong> ácidos graxos em função da relação ATP/ADP05. A síntese <strong>de</strong> triglicerí<strong>de</strong>os requer glicerol-3-fosfato, mas o tecido adiposo não possui aenzima glicerol quinase. Como os adipócitos obtém esse composto essencial para aestocagem <strong>de</strong> ácidos graxos ?06. Verificar em quais das seguintes situações haverá estímulo da formação <strong>de</strong> corposcetônicos:a) Dieta rica em carboidratos e normal em lipí<strong>de</strong>osb) Jejumc) Dieta rica em lipí<strong>de</strong>os e normal em carboidratosd) Diabetes07. Em caso <strong>de</strong> jejum prolongado o cérebro passa a oxidar também corpos cetônicos, além<strong>de</strong> glicose, como fonte <strong>de</strong> energia. Citar as enzimas que o cérebro <strong>de</strong>ve sintetizar nessaadaptação metabólica.08. Citar as vias <strong>de</strong> produção e <strong>de</strong> utilização <strong>de</strong> acetil-CoA pela célula.09. Explicar com base na regulação <strong>de</strong> enzimas alostéricas o fato <strong>de</strong> uma dieta rica emcarboidratos promover o acúmulo <strong>de</strong> lipí<strong>de</strong>os.NEOGLICOGÊNESE01. O hepatócito po<strong>de</strong> reverter a transformação <strong>de</strong> glicose em piruvato apesar <strong>de</strong> haver trêsreações irreversíveis na glicólise. Em cada uma <strong>de</strong>ssas etapas, comparar as reações no
sentido glicose → piruvato e piruvato → glicose, quanto às enzimas, reagentes, produtose coenzimas.02. Lactato produzido pelo músculo e pelas hemácias po<strong>de</strong> ser utilizado pelo fígado paraconvertê-lo novamente em glicose. Calcular o número <strong>de</strong> moléculas <strong>de</strong> ATP, pormolécula <strong>de</strong> glicose, necessário a essa conversão.03. Lehninger, Princípios <strong>de</strong> Bioquímica. Capítulo, 20, Problema 4. Quais são os efeitos <strong>de</strong>concentração crescente <strong>de</strong> ATP e AMP nas ativida<strong>de</strong>s catalíticas <strong>de</strong> frutose difosfatase efosfofrutoquinase? Quais são as consequências <strong>de</strong>stes efeitos do ATP e AMP no fluxorelativo dos metabolitos através da neoglicogênese e da glicólise?04. Lehninger, Princípios <strong>de</strong> Bioquímica, Capítulo 20, Problema 5. Um procedimentocomum para <strong>de</strong>terminação da efetivida<strong>de</strong> <strong>de</strong> compostos como precursores da glicose écolocar um animal em jejum até que os estoques <strong>de</strong> glicogênio do fígado sejam<strong>de</strong>pletados e então administrar o substrato em questão. Um substrato que leva a umaumento líquido no glicogênio hepático é chamado <strong>de</strong> glicogênico pois ele <strong>de</strong>ve primeiroser convertido em glicose-6-fosfato. Mostre por meio <strong>de</strong> reações enzimáticas conhecidasquais das seguintes substâncias são glicogênicas:(a) succinato, (b) glicerol, (c) acetil CoA, (d) piruvato e (e) butirato.Escreva as fórmulas estruturais das substâncias relacionadas <strong>de</strong> (a) a (e).05. Lehninger, Princípios <strong>de</strong> Bioquímica, Capítulo 20, Problema 6. As concentrações <strong>de</strong>lactato no plasma sanguíneo, antes, durante e <strong>de</strong>pois <strong>de</strong> uma corrida <strong>de</strong> 400 metros serãomostradas no gráfico concentração <strong>de</strong> lactato sanguíneo versus tempo, a ser fornecidodurante a aula. (Ver no livro).(a) O que provoca a rápida elevação na concentração do lactato?(b) O que provoca o <strong>de</strong>clínio do nível do lactato <strong>de</strong>pois do término da corrida? Porque o <strong>de</strong>clínio ocorre mais lentamente <strong>de</strong> que a elevação?(c) Por que a concentração do lactato não é zero durante o estado <strong>de</strong> repouso?SÍNTESE E DEGRADAÇÃO DO GLICOGÊNIO01. Esquematizar simplificadamente a estrutura da molécula do glicogênio indicando osterminais não redutores, redutor e pontos <strong>de</strong> ramificação e mostrar as ações das seguintesenzimas envolvidas na <strong>de</strong>gradação do polissacarí<strong>de</strong>o a glicose-6-fosfato:(a) fosforilase, (b) transferase (enzima <strong>de</strong> <strong>de</strong>sramificação), (c) α-1,6-glicosidase, (d)fosfoglicomutase02. Lehninger, Princípios <strong>de</strong> Bioquímica, Capítulo 20, Problema 9. Escrever a sequência e areação global requeridas para calcular o custo em número <strong>de</strong> moléculas <strong>de</strong> ATPsnecessárias para a conversão <strong>de</strong> glicose-6-fosfato citoplasmática em glicogênio e <strong>de</strong>ste <strong>de</strong>volta a glicose-6-fosfato. Que fração do número máximo <strong>de</strong> ATPs, que é disponível docatabolismo completo da glicose-6-fosfato, este custo representa?03. Lehninger, Princípios <strong>de</strong> Bioquímica, Capítulo 20, Problema 10. Uma amostra <strong>de</strong> tecido<strong>de</strong> fígado foi obtida "post-mortem" do corpo <strong>de</strong> um paciente, o qual acreditava-se sergeneticamente <strong>de</strong>ficiente em uma das enzimas do metabolismo <strong>de</strong> carboidratos. Umhomogenato da amostra do fígado mostrou as seguintes características:1. Degradou glicogênio a glicose-6-fosfato2. Foi incapaz <strong>de</strong> sintetizar glicogênio a partir <strong>de</strong> qualquer açúcar mais simples, ouutilizar galactose como fonte <strong>de</strong> energia, e3. Sintetizou glicose-6-fosfato a partir <strong>de</strong> lactato.
Qual das três enzimas seguintes é <strong>de</strong>ficiente?(a) glicogênio fosforilase, (b) frutose difosfatase, (c) UDP-glicose pirofosforilaseFornecer razões para sua escolha04. Nível alto <strong>de</strong> insulina no sangue indica que o organismo está bem nutrido (período logoapós a refeição). Nível baixo, por outro lado <strong>de</strong>nota estado <strong>de</strong> jejum. Glucagon age <strong>de</strong>maneira oposta à <strong>de</strong> insulina. Adrenalina tem ação semelhante à do glucagon.Relacionar estas afirmações com o papel <strong>de</strong>stes hormônios na síntese e <strong>de</strong>gradaçãodo glicogênio.05. Existem várias doenças relacionadas com alterações no metabolimo do glicogênio.Nestas doenças certas enzimas são produzidas em forma <strong>de</strong>feituosa, ou em quantida<strong>de</strong><strong>de</strong>ficientes ou mesmo não são produzidas.Indicar, nos casos assinalados, na sequência das reações metabólicas, o passo que éafetado e o que isto implica na síntese e/ou <strong>de</strong>gradação do glicogênio.nome da doença enzima <strong>de</strong>ficienteVon Gierke glicose-6-fosfataseCoriα-1,6-glicosidaseMcArdlefosforilase <strong>de</strong> músculoAn<strong>de</strong>rsenenzima ramificadoraMETABOLISMO DE AMINOÁCIDOS01. Esquematizar as reações que permitem a síntese da maioria dos aminoácidos a partir <strong>de</strong>NH 3 , alfa-cetoglutarato e alfa-cetoácidos correspon<strong>de</strong>ntes. Discutir as implicações dareversibilida<strong>de</strong> das reações.02. Lehninger, Princípios <strong>de</strong> Bioquímica, Capítulo 19, Problema 6. Os três átomos <strong>de</strong>carbono no lactato e alanina tem estados <strong>de</strong> oxidação idênticos, e animais po<strong>de</strong>m usarqualquer um <strong>de</strong>les como combustível metabólico. Comparar o rendimento líquido <strong>de</strong>ATP (moles <strong>de</strong> ATP por mol <strong>de</strong> substrato) para a oxidação completa (a CO 2 e H 2 O) <strong>de</strong>lactato versus alanina quando o custo <strong>de</strong> excreção <strong>de</strong> nitrogênio como uréia é incluído.03. A alanina <strong>de</strong>sempenha um papel importante no transporte <strong>de</strong> amônia para o fígado, numaforma não tóxica. A amônia produzida no músculo e outros tecidos, principalmente pela<strong>de</strong>gradação <strong>de</strong> aminoácidos, torna-se o alfa-amino grupo da alanina e <strong>de</strong>sta forma étransportada do músculo (e outros tecidos) para o fígado através da corrente sanguínea.No fígado, a alanina per<strong>de</strong> o amino grupo que é eliminado como uréia. O esqueletocarbônico da alanina é convertido em glicose, que volta através da corrente sanguínea aomúsculo. Esta interrelação entre músculo e fígado é chamada ciclo da alanina-glicose.Esquematize o ciclo da alanina-glicose. I<strong>de</strong>ntifique as vias metabólicas envolvidasem células <strong>de</strong> músculo e fígado.04. Lehninger, Princípios <strong>de</strong> Bioquímica, Capítulo 9, Problema 4. Uma criança <strong>de</strong> dois anos<strong>de</strong> ida<strong>de</strong> foi levada ao hospital. Sua mãe indicou que ela vomitava frequentemente,especialmente após as refeições. O peso da criança e o seu <strong>de</strong>senvolvimento físico eramabaixo do normal. Seus cabelos, embora escuros, continham porções <strong>de</strong> cabelos brancos.Uma amostra <strong>de</strong> urina tratada com cloreto férrico (FeCl 3 ) apresentou cor ver<strong>de</strong>característica da presença <strong>de</strong> ácido fenilpirúvico. A análise quantitativa <strong>de</strong> amostras <strong>de</strong>urina apresentou os resultados mostrados na tabela abaixo:SubstânciaPacienteNormal(mmol/l)(mmol/l)Fenilalanina 7,0 0,01
Fenilpiruvato 4,8 0Fenilactato 10,3 0a) Sugerir a enzima que possa estar <strong>de</strong>ficiente. Propor um tratamento para esta condição.b) Por que a fenilalanina aparece na urina em gran<strong>de</strong>s quantida<strong>de</strong>s?c) Qual é a fonte <strong>de</strong> fenilpiruvato e do fenilactato? Por que estas vias (normalmente nãofuncionais) entram em ação quando a concentração <strong>de</strong> fenilalanina se eleva?d) Por que o cabelo da paciente apresenta porções brancas?05. Analisar as consequências, para o metabolismo geral, <strong>de</strong> uma dieta calórica normal econtendo proteínas <strong>de</strong> baixo valor biológico (proteína com baixo conteúdo emaminoácidos essenciais).Definir balanço <strong>de</strong> nitrogênio. O que significa balanço <strong>de</strong> nitrogênio negativo, zero epositivo?AÇÃO HORMONAL01. Lehninger, Princípios <strong>de</strong> Bioquímica, Capítulo 25, Problema 3. Baseados nas suasproprieda<strong>de</strong>s físicas, os hormônios caem em duas categorias; aqueles que são muitosolúveis em água mas relativamente insolúveis nos lipí<strong>de</strong>os, por exemplo, a adrenalina, eaqueles que são relativamente insolúveis em água mas altamente solúveis nos lipí<strong>de</strong>os,por exemplo, os hormônios esteroídicos. Na sua função <strong>de</strong> reguladores da ativida<strong>de</strong>celular, a maioria dos hormônios hidrossolúveis não penetram no interior das células dostecidos-alvo. Os hormônios lipossolúveis, por outro lado, penetram nas células-alvo efinalmente atuam no núcleo. Qual é a base para a correlação entre solubilida<strong>de</strong>, alocalização dos receptores e o modo <strong>de</strong> ação <strong>de</strong>stas duas categorias <strong>de</strong> hormônios?02. Lehninger, Princípios <strong>de</strong> Bioquímica, Capítulo 25, Problema 4. Na década <strong>de</strong> 50, EarlSutherland e seus colegas realizaram experimentos pioneiros para elucidar o mecanismo<strong>de</strong> ação da adrenalina e do glucagon. À luz da nossa atual compreensão da açãohormonal interprete cada um dos seus experimentos <strong>de</strong>scritos abaixo. I<strong>de</strong>ntifique oscomponentes e indique o significado dos resultados.a) A adição da adrenalina a um homogeneizado ou preparação <strong>de</strong> células rompidas do fígadonormal resulta num aumento da ativida<strong>de</strong> da glicogênio fosforilase. Entretanto, se ohomogeneizado for primeiro centrifugado numa alta velocida<strong>de</strong> e a adrenalina ou oglucagon adicionados à fração sobrenadante límpida, nenhum aumento na ativida<strong>de</strong> dasua fosforilase é observado.b) Quando a fração particulada, sedimentada <strong>de</strong> um homogeneizado do fígado porcentrifugação é preparada e tratada com adrenalina, uma nova substância é produzida.Esta substância foi isolada e purificada. Ao contrário da adrenalina, esta substância ativa aglicogênio fosforilase quando adicionada à fração sobrenadante do homogeneizado.c) A substância formada pela fração particulada era estável ao calor; isto é o tratamento comcalor não impedia sua capacida<strong>de</strong> <strong>de</strong> ativar a glicogênio fosforilase (Dica: seria este ocaso se a substância fosse uma proteína?). A substância era idêntica a um compostoobtido quando ATP puro era tratado com hidróxido <strong>de</strong> bário.03. Lehninger, Princípios <strong>de</strong> Bioquímica, Capítulo 25, Problema 7. Durante uma situação <strong>de</strong>"lutar ou correr", a liberação <strong>de</strong> adrenalina promove a <strong>de</strong>gradação do glicogênio nofígado, coração e músculo esquelético. O produto da <strong>de</strong>gradação do glicogênio no fígadoé a glicose. Ao contrário, o glicogênio do músculo esquelético é <strong>de</strong>gradado pela glicólise:
a) Por que produtos diferentes são observados na <strong>de</strong>gradação do glicogênio nestes doistecidos diferentes?b) Qual é a vantagem para o organismo durante uma condição <strong>de</strong> "lutar ou correr", <strong>de</strong> se terestas vias específicas <strong>de</strong> <strong>de</strong>gradação do glicogênio?04. Lehninger, Princípios <strong>de</strong> Bioquímica, Capítulo 25, Problema 8. Certos tumores malignosdo pâncreas provocam uma excessiva produção <strong>de</strong> insulina pelas células B. Taispacientes apresentam calafrios e tremores, fraqueza e fadiga, sudorese e fome. Se estacondição se prolongar ocorre lesão cerebral. Qual é o efeito do hiperinsulinismo nometabolismo dos carboidratos, aminoácidos e lipí<strong>de</strong>os do fígado? Quais são as causasdos sintomas observados? Sugira por que esta condição, se prolongada leva a lesãocerebral?INTEGRAÇÃO METABÓLICA01. Os nutrientes absorvidos no trato intestinal passam diretamente ao fígado (com excessão<strong>de</strong> uma gran<strong>de</strong> parte <strong>de</strong> triacilgliceróis). Por este gran<strong>de</strong> centro <strong>de</strong> distribuição, açúcares,aminoácidos e aluguns lipí<strong>de</strong>os são processados e distribuídos aos outros órgãos etecidos. Propor um mapa metabólico unificado, integrando as principais vias <strong>de</strong>stesnutrientes neste órgão.02. Ao contrário do músculo esquelético, o músculo cardíaco <strong>de</strong>ve trabalhar constante eritmicamente. O que torna possível, a nível <strong>de</strong> metabolismo e características da célulacardíaca, esta adaptação para o trabalho constante?03. Lehninger, Princípios <strong>de</strong> Bioquímica, Capítulo 24, Problema 14. O glicerol-3-fosfato éum intermediário chave na biossíntese dos triacilgliceróis. As células adiposas, que sãoespecializadas na síntese e <strong>de</strong>gradação dos triacilgliceróis, não po<strong>de</strong>m usar o gliceroldiretamente <strong>de</strong>vido à falta da gliceroquinase, que catalisa a reação:Glicerol + ATP → Glicerol-3-fosfato + ADPComo o tecido adiposo obtém o glicerol-3-fosfato necessário para a síntese dotriacilglicerol? Explicar.04. Lehninger, Princípios <strong>de</strong> Bioquímica, Capítulo 24, Problema 20. Pacientes com<strong>de</strong>ficiência <strong>de</strong> tiamina exibem um conjunto <strong>de</strong> sinais neurológicos característicos: perdados reflexos, estado <strong>de</strong> ansieda<strong>de</strong> e confusão mental. Sugira uma razão por que a<strong>de</strong>ficiéncia <strong>de</strong> tiamina é manifestada na função cerebral.05. A tabela (a ser fornecida na sala <strong>de</strong> aula) indica vários efeitos da <strong>de</strong>ficiência <strong>de</strong> insulina(Diabetes mellitus) no metabolismo. Para cada um dos ítens compare com uma situaçãoem que o organismo foi submetido a jejum severo.(Ver tabela 25-6 do Lehninger, Princípios <strong>de</strong> Bioquímica, Capítulo 25).06.Van Eikeren , Gui<strong>de</strong> to Lehninger’s Principles of Biochemistry, Capítulo 26 (NutriçãoHumana), Challenge Problems, Problema 19.Acidose láctica e hipoglicemia em <strong>de</strong>pen<strong>de</strong>ntes <strong>de</strong> álcool.Pessoas que consomem muita bebida alcoólica <strong>de</strong>senvolvem níveis sangüíneos nãonormal e baixo em glicose (hipoglicemia), maior do que o normal <strong>de</strong> ácido láctico(acidose láctica suave) e ainda apresentam cetose. Explique.
QBQ-211BIOQUÍMICA: ESTRUTURA DE BIOMOLÉCULASe METABOLISMO1996LABORATÓRIOS: I, II, III, IV, V e VI
OBJETIVOSQBQ-211 - 1996 - LABORATÓRIO ITITULAÇÃO E CROMATOGRAFIA DE AMINOÁCIDOSI<strong>de</strong>ntificação <strong>de</strong> um aminoácido através <strong>de</strong> cromatografia em papel e <strong>de</strong> titulação.01. Execução <strong>de</strong> cromatografia em papel e <strong>de</strong> titulação02. I<strong>de</strong>ntificação <strong>de</strong> um aminoácido através <strong>de</strong> seu Rf e <strong>de</strong> seus pKas03. Comparação da curva <strong>de</strong> titulação <strong>de</strong> um aminoácido com a <strong>de</strong> um ácido fracomonoprótico04. Verificação do pH <strong>de</strong> diversos fluidos biológicos mais comuns (<strong>de</strong> origem vegetal eanimal) e não biológicos, conforme mostrado na figura 2-15 do Rawn, Biochemistry, pg39 e na figura 4-9 do Lehninger, Principles of Biochemistry, pg 77.FUNDAMENTOSAs unida<strong>de</strong>s constituintes das proteínas são os L α-aminoácidos. Como o próprionome indica, estes compostos em suas moléculas apresentam pelo menos um grupo amina(-NH 2 ) e um grupo carboxílico (-COOH). Em consequência <strong>de</strong>ste fato, ao serem dissolvidosem água, os aminoácidos apresentam caráter anfotérico, ou seja comportam-se como ácido ecomo base. Os grupos amina e carboxila po<strong>de</strong>m sofrer protonações e <strong>de</strong>sprotonaçõesreversíveis, isto é comportam-se como eletrólitos fracos. Se os consi<strong>de</strong>rarmos em suasformas <strong>de</strong> ácidos conjugados: -NH + e -COOH, veremos que cada um <strong>de</strong>les apresentará um3valor <strong>de</strong> pKa. Assim, um aminoácido apresenta pelo menos dois valores <strong>de</strong> pKa e<strong>de</strong>pen<strong>de</strong>ndo da natureza ionizável ou não do grupo R ligado ao carbono alfa, po<strong>de</strong> ocorrer ounão um terceiro valor <strong>de</strong> pKa.Em pH 7,0 e no estado sólido, o amino grupo apresenta-se protonado (forma ácida) eo grupo carboxila <strong>de</strong>sprotonado (forma básica).Neste experimento utilizaremos um processo <strong>de</strong> separação <strong>de</strong> aminoácidos baseadona polarida<strong>de</strong> dos grupos R <strong>de</strong> ca<strong>de</strong>ia lateral e que <strong>de</strong>termina a preferência do aminoácidopor uma fase líquida polar ou apolar, isto é sua partição entre duas fases. A água que hidrataa celulose, principal constituinte do papel, constitui a fase polar, neste caso a faseestacionária, enquanto que o solvente orgânico que migra pelo papel por capilarida<strong>de</strong>constitui a fase apolar, neste caso a fase móvel. Assim, quanto mais apolar for o grupo R,maior a mobilid<strong>de</strong> do aminoácido com a fase móvel e o seu Rf maior . O Rf é dado pela
elação entre a distância percorrida pelo aminoácido no papel e a distância percorrida pelafase móvel. A Tabela I apresenta valores <strong>de</strong> Rf <strong>de</strong> alguns aminoácidos.Através da cromatografia em papel i<strong>de</strong>ntificaremos um aminoácido <strong>de</strong>sconhecido emcomparação com quatro outros conhecidos e por isso <strong>de</strong>nominados <strong>de</strong> aminoácidos-padrão.Com ajuda da Tabela I e dos valores <strong>de</strong> pKa obtidos na titulação, confirmaremos ai<strong>de</strong>ntida<strong>de</strong> do aminoácido.TABELA IRf <strong>de</strong> vários aminoácidos <strong>de</strong>terminados nas seguintes condições:solvente <strong>de</strong> Partridge, n-butanol/ácido acético glacial/água (4:1:1),papel Whatman n o 1 e temperatura 20 o CAminoácido Rf Aminoácido RfCys 0,08 Ala 0,38Lys 0,14 Pro 0,43His 0,20 Tyr 0,45Arg 0,20 Trp 0,50Asp 0,24 Met 0,55Gly 0,26 Val 0,60Ser 0,27 Phe 0,68Glu 0,30 Ile 0,72Thr 0,35 Leu 0,73TABELA IIAminoácidopKaGlu 2,194,259,67Lys 2,188,9510,53Gly 2,349,6His 1,826,09,17Cys 1,718,3310,78Thr 2,6210,43Asn 2,028,80Ala 2,309,70Leu 2,369,60Pro 1,9910,60
PROCEDIMENTO1. CROMATOGRAFIA EM PAPELTomar uma folha (23 x 16 cm) <strong>de</strong> papel Whatman n o 1 e fazer um traço a lápis aolongo do comprimento maior a 2 cm da borda. Evitar tocar no papel durante toda a operação.Deixar uma margem <strong>de</strong> 1,5cm <strong>de</strong> cada lado.Marcar seis pontos sobre essa linha que distem 4cm um do outro e numerá-los a lápis <strong>de</strong> 1 a 6. As amostras <strong>de</strong>vem ser aplicadas nos pontosnumerados com auxílio <strong>de</strong> um capilar <strong>de</strong> tal modo que a mancha formada sobre o papel sejaa menor possível. Nos números <strong>de</strong> 1 a 4 aplicar os padrões e no número 6, a mistura <strong>de</strong>padrões. A amostra <strong>de</strong>sconhecida é aplicada no número 5. Enrolar o papel <strong>de</strong> modo atransformá-lo em um cilindro e pren<strong>de</strong>r as extremida<strong>de</strong>s superiores com clip. Colocar 25 ml<strong>de</strong> solvente <strong>de</strong> Partridge (n- butanol/ácido acético glacial/água 4:1:1) em uma placa <strong>de</strong> Petri emergulhar o cilindro <strong>de</strong> papel em seu interior <strong>de</strong> modo que este fique perfeitamente navertical. Evitar que o papel toque na pare<strong>de</strong> da placa. Cobrir o sistema com um béquer <strong>de</strong> 2litros e <strong>de</strong>ixar o solvente migrar 10 cm. Retirar o papel e marcar imediatamente a linha <strong>de</strong>frente do solvente. Secar o papel na capela, mergulhar em solução 0,1% <strong>de</strong> ninhidrina emacetona e levar á estufa (80 o C-100 o C) por alguns minutos. Delimitar com lápis as manchasque aparecem no papel. Determinar o Rf dos padrões e do aminoácido <strong>de</strong>sconhecido.2. TITULAÇÃOColocar 50 ml da solução do aminoácido (0,10 M) em pH 1,0 em um béquer e titularcom solução 0,5 M <strong>de</strong> KOH medindo o pH após cada adição <strong>de</strong> 1 ml até atingir pH 11,0.Colocar 50 ml <strong>de</strong> ácido acético 0,15 M em outro béquer e titular com solução 0,5 M<strong>de</strong> KOH medindo o pH após cada adição <strong>de</strong> 0,5 ml até pH 12,0.ANÁLISE DOS RESULTADOS E DISCUSSÃOCROMATOGRAFIA E TITULAÇÃO01. Comparar seus valores <strong>de</strong> Rf para os aminoácidos padrão com os valores da TABELA I.Discutir a respeito das possíveis causas <strong>de</strong> discrepâncias.02. Fazer um gráfico <strong>de</strong> titulação do aminoácido com base. Estimar os valores <strong>de</strong> pKas ecomparar estes valores obtidos para o aminoácido <strong>de</strong>sconhecido com aqueles daTABELA II.Fazer o gráfico <strong>de</strong> titulação do ácido acético.Comparar as curvas <strong>de</strong> titulação do aminoácido e do ácido fraco.03. I<strong>de</strong>ntificar seu aminoácido <strong>de</strong>sconhecido, escrever sua estrutura e suas sucessivasionizações verificadas ao se aumentar o pH.MEDIDA DO pH DE ALGUNS FLUÍDOS BIOLÓGICOS OU NÃO E COMPARAÇÃO DOSVALORES OBTIDOS COM AQUELES APRESENTADOS NA FIGURA 2-15 DO LIVRO DO RAWNOU FIGURA 4-9 DO LIVRO DO LEHNINGER
Selecionar alguns fluidos, com os quais não haja problemas <strong>de</strong> manipulação e medirseu pH. Eventualmente com auxílio <strong>de</strong> uma pipeta Pasteur adicionar uma vez, HCl gota agota e outra vez, KOH. Observar a resistência ou não à variação do pH.
QBQ-211 - 1996 - LABORATÓRIO IIELETROFORESE EM PAPEL E DOSAGEM COLORIMÉTRICA DEPROTEÍNASI<strong>de</strong>ntificação <strong>de</strong> proteínas através da eletroforese em acetato <strong>de</strong> celulose eeletroforese <strong>de</strong> proteínas do soro humano na mesma matriz em tampão barbital-Tris pH =8,6.Determinação da concentração <strong>de</strong> uma proteína em solução aquosa através dacolorimetria.OBJETIVOSExecução <strong>de</strong> uma eletroforese em fita <strong>de</strong> acetato <strong>de</strong> celulose.I<strong>de</strong>ntificação eletroforética <strong>de</strong> proteínas e i<strong>de</strong>ntificação das classes <strong>de</strong> proteínas dosoro humano.Previsão da direção <strong>de</strong> migração proteica em base aos pIs e ao pH da solução.Montagem <strong>de</strong> um protocolo para construção <strong>de</strong> uma curva padrão para <strong>de</strong>terminaçãoda concentração <strong>de</strong> proteínas pelo Método do Biureto.FUNDAMENTOS(I) ELETROFORESEA eletroforese abrange todas as operações nas quais as moléculas carregadas migramnum campo elétrico através <strong>de</strong> soluções.Depen<strong>de</strong>ndo da ausência ou presença <strong>de</strong> uma matriz rígida que sirva como suporte àsolução submetida a um campo elétrico, po<strong>de</strong>m existir dois tipos <strong>de</strong> eletroforese:Eletroforese em solução - O seu uso é limitado. Consiste em se efetuar a operaçãoem tampão aquoso na ausência matriz-suporte. Esse sistema é vulnerável às pertubaçõesmecânicas (choques, correntes <strong>de</strong> convecção) o que leva à mistura das bandas em migração eà consequente perda da resolução. As modificações introduzidas para a estabilizaçãomecânica do sistema não se constituem em refinamentos que possam permitir larga aceitação<strong>de</strong>ste método.Eletroforese <strong>de</strong> zona - Os métodos eletroforéticos aqui englobados são maisutilizados. Consiste basicamente em efetuar a operação com a solução mantida em umamatriz rígida que a suporta (exemplos <strong>de</strong> matriz: papel, acetato <strong>de</strong> celulose, gel <strong>de</strong>poliacrilamida, gel <strong>de</strong> agarose (poligalactose) e outras). Aqui o termo zona quer indicar que aamostra submetida à eletroforese migra <strong>de</strong>limitando uma pequena região ou zona no suporte(papel, fita <strong>de</strong> acetato <strong>de</strong> celulose ou gel). As perturbações mecânicas, neste caso não afetamo sistema.Os dois tipos <strong>de</strong> eletroforese são governados pela expressão:constante • (voltagem aplicada) • (carga líquida)Mobilida<strong>de</strong> =(fricção molecular)
Assim a mobilida<strong>de</strong> <strong>de</strong> uma molécula numa solução aumenta com o aumento davoltagem ou carga da molécula e diminui com o aumento da ficção. Esta última <strong>de</strong>pen<strong>de</strong> dotamanho e da forma da molécula.Macromoléculas, como as proteínas, po<strong>de</strong>m ter suas mobilida<strong>de</strong>s eletroforéticaspreditas pela expressão acima. Porém, efetuar esta previsão po<strong>de</strong> não ser muito simplesporque a forma da molécula influencia na fricção (moléculas filamentosas - um eixoprepon<strong>de</strong>ra sobre o outro - têm menos mobilida<strong>de</strong> que moléculas esféricas). Também, acarga <strong>de</strong> macromoléculas é bastante afetada pela presença <strong>de</strong> outros íons, além do H + . Estesfatores ligados a forma e a carga po<strong>de</strong>m dificultar a previsão da mobilida<strong>de</strong> paramacromoléculas.Proteínas do soro humano - Quando se permite que uma amostra <strong>de</strong> sanguecoagule, obtem-se por centrifugação uma solução <strong>de</strong>nominada soro.Plasma é a solução obtida por centrifugação do sangue total na presença <strong>de</strong> anticoagulante.A diferença entre plasma e soro resi<strong>de</strong> no fato <strong>de</strong> que o primeiro contém, além dasproteínas do soro, fibrinogênio, fibrina e fatores <strong>de</strong> coagulação. Estas três últimas proteínas,no plasma estão em solução.As proteínas do plasma são classificadas em base ao comportamento eletroforético,em seis categorias:ClassePorcentagem em relaçãoao total <strong>de</strong> proteínasAlbumina 55Função/NaturezaMantém a pressão osmótica.Transportadora <strong>de</strong> ânions orgânicos(ex. ânion dos ácidos graxos, <strong>de</strong>fármacos (ex. aspirina).α 1 -Globulinas 5 Glicoproteínas e lipoproteínas HDL.α 2 -Globulinas 9 Transportadoras <strong>de</strong> hemoglobinas livreno plasma (haptoglobina), <strong>de</strong> Cu 2+ ,(ceruloplasmina) e LipoproteínasVDL.β-Globulinas 13 Transportadores <strong>de</strong> Fe 2+ (transferrina)e Lipoproteínas LDLFibrinogênio 7 Formador do coâguloγ-Globulinas 11 ImunoglobulinasA eletroforese <strong>de</strong> proteínas do soro é efetuada em papel <strong>de</strong> acetato <strong>de</strong> celuloseembebido <strong>de</strong> tampão barbital-Tris (as extremida<strong>de</strong>s da fita mergulhadas no mesmo tampão)em pH 8,6. Este pH é maior que os pIs <strong>de</strong> todas as proteínas normais (albumina e globulinas)<strong>de</strong> tal forma que elas se apresentam negativamente carregadas e migram em direção ao anodo(polo positivo). A albumina é a mais negativa e a γ-globulina, a menos negativa dasproteínas.pH < pIpH > pImacromolécula pI macromoléculacom cargacom cargapositivanegativa
As γ-globulinas são sintetizadas por uma classe especial <strong>de</strong> linfócitos e as outrasproteínas plasmáticas são produzidas pelo fígado. Desta forma, a análise do resultado daeletroforese po<strong>de</strong> indicar uma possível doença hepática. De fato, a eletroforese <strong>de</strong> proteínasdo soro constitui-se numa análise clínica importante.Para maiores esclarecimentos, inclusive fotos <strong>de</strong> fita on<strong>de</strong> foi corrida umaeletroforese e sua respectiva <strong>de</strong>nsitometria, consultar o “Biochemistry: a case-orientedapproach” (The C.V. Mosby Company) 5 a ed. autores: Montagomery, Conway e Spector(pag. 67).DOSAGEM DE PROTEÍNA POR COLORIMETRIAA fotometria é frequentemente usada para se <strong>de</strong>terminar a concentração <strong>de</strong> umcomposto que absorve luz monocromática que está presente em solução. A lei <strong>de</strong> Lambert eBeer permite afirmar que:A = abcou seja, ao atravessar uma solução transparente, a fração <strong>de</strong> luz absorvida A é proporcional auma constante a (absortivida<strong>de</strong> molar), à distância b atravessada pela luz na solução e àconcentração molar c. Modificando-se convenientemente a constante, a absorbância A po<strong>de</strong>ser relacionada com a concentração em g/l.A equação <strong>de</strong>rivada da lei <strong>de</strong> Lambert e Beer indica que a projeção <strong>de</strong> A versus c,mantida constante a distância b atravessada pela luz na solução, é uma reta que passa pelaorigem.Dispondo-se <strong>de</strong> tal projeção é possível, a partir <strong>de</strong> valores <strong>de</strong> A, <strong>de</strong>terminargraficamente as concentrações correspon<strong>de</strong>ntes. Neste procedimento o gráfico A versus c échamado curva padrão.O Método do Biureto faz uso da proprieda<strong>de</strong> <strong>de</strong> íons <strong>de</strong> Cu 2+ em meio alcalino <strong>de</strong>formar ligações com o nitrogênio das ligações peptídicas. Desta reação (reação <strong>de</strong> biureto)resulta uma coloração púrpura intensa. Este fato po<strong>de</strong> ser explorado para se <strong>de</strong>terminarcolorimetricamente a quantida<strong>de</strong> <strong>de</strong> proteínas em solução.O Método do Biureto é mais apropriado para proteínas cujas soluções são incolores,ou seja para proteínas não conjugadas (simples). A cor <strong>de</strong>senvolvida numa reação <strong>de</strong> íons <strong>de</strong>Cu 2+ em meio alcalino com estas proteínas <strong>de</strong>ve-se unicamente às ligações peptídicas e a suaintensida<strong>de</strong> é proporcional a quantida<strong>de</strong> <strong>de</strong> tais ligações. Deve-se lembrar que a quantida<strong>de</strong><strong>de</strong> ligações peptídicas é proporcional à massa da proteína em solução.Reforçando o que foi dito acima, po<strong>de</strong>-se afirmar que esta reação, específica paranitrogênios peptídicos, ocorre em igual extensão para uma dada massa proteica qualquer queseja a natureza da proteína em solução.PROCEDIMENTO(1) EletroforeseRetirar uma fita <strong>de</strong> acetato <strong>de</strong> celulose do banho <strong>de</strong> tampão (barbital-Tris pH 8,6).(Atenção: Não manusear a fita, usar pinça). Secá-la entre duas folhas <strong>de</strong> papel <strong>de</strong> filtro.Marcar com lápis o polo positivo e a partir dos pontos médios dos lados maiores <strong>de</strong>marcar aorigem com um traço muito leve. (Unir os pontos médios dos lados maiores).Retornar a fita para o banho. Mergulhar, retirar e secá-la novamente.
Em seguida aplicar num ponto da origem uma pequena quantida<strong>de</strong> <strong>de</strong> mistura <strong>de</strong>citocromo c e albumina bovina. Sobre um outro ponto da origem, aplicar a amostra <strong>de</strong> sorohumano. CUIDADO: as amostras <strong>de</strong> soro humano não estão testadas em relação a presença<strong>de</strong> microorganismos patogênicos. USAR LUVA DE POLIETILENO PARA APLICAR ASAMOSTRAS.Montar as fitas no suporte da cuba <strong>de</strong> eletroforese com todos os polos positivos domesmo lado. Fechar a cuba <strong>de</strong> correr a eletroforese com 5mA/fita durante 60 minutos.Desligar a corrente, mergulhar as fitas no corante Ponceau por 10 minutos e <strong>de</strong>scorarcom ácido acético 5%.Cuidados especiais- Não tocar as fitas com a fonte da corrente contínua ligada.- Prestar atenção para o fato <strong>de</strong> que uma das faces da fita <strong>de</strong> acetato <strong>de</strong> celuloseapresenta-se mais brilhante. Esta face, correspon<strong>de</strong>nte as costas da fita, contém uma película<strong>de</strong> plástico não absorvente sobre o qual assenta-se a verda<strong>de</strong>ira matriz que suporta o tampãoe as amostras, o acetato <strong>de</strong> celulose. As amostras <strong>de</strong>vem ser aplicadas na parte opaca (face <strong>de</strong>acetato <strong>de</strong> celulose).- Antes <strong>de</strong> levar a fita com as aplicações à cuba, fazer uma pequena marca que ai<strong>de</strong>ntifique como pertencente a um <strong>de</strong>terminado grupo.A mistura <strong>de</strong> proteínas contém:pIP.M.Albumina <strong>de</strong> soro bovino 4,7 66.500Citocromo c 10,7 13.000Com base a estes dados prever a posição <strong>de</strong> cada uma <strong>de</strong>ssas proteínas na fita ao finalda operação. Justificar.Examinar o eletroforetograma das proteínas do soro humano. Compará-lo com oresultado final da eletroforese <strong>de</strong> soro apresentado na literatura (p. ex. “Biochemistry: Acase-oriented approach”, The C.V.Mosby Company, 5 a ed., autores: Montgomery, Conway, eSpector, pág. 67).3. DOSAGEM DE PROTEÍNA PELO MÉTODO DO BIURETOElaborar um protocolo para construir uma curva padrão, para a qual se utilizará umasolução estoque <strong>de</strong> Albumina <strong>de</strong> concentração conhecida (8mg/ml) e 2,5 ml <strong>de</strong> Reagente <strong>de</strong>Biureto, num volume final <strong>de</strong> 4,0ml por tubo.Após a adição do reagente, agitar e incubar os tubos por 15 minutos a 37 o C. Ler asabsorbâncias a 550 nm.Construir um tubo a partir <strong>de</strong> 1,0ml <strong>de</strong> Albumina <strong>de</strong> concentração <strong>de</strong>sconhecida,adicionar Biureto, completar o volume final a 4,0ml, medir a Absorbância e <strong>de</strong>terminar aconcentração <strong>de</strong>sconhecida.Agra<strong>de</strong>cimento: As amostras <strong>de</strong> soro humano foram cedidas pelo Laboratório <strong>de</strong>Análises Clínicas da FCFUSP. Agra<strong>de</strong>cemos aos responsáveis por este Laboratório e emespecial à Profa.Dra. Ana Campa.BIBLIOGRAFIA
01. Biochemistry: A Case-Oriented Approach, Montgomery, Conway e Spector, 5 a ed., 1990.The C.V. Mosby Company (Ver pág. 65).02. Biochemistry for Medical Sciences, Danishlfsky, 1980. Little, Brown and Company (Verpágs. 34, 40 e 469).03. Experimental Biochemistry, Clark e Switzer, 2 a ed., 1977. W.H. Freeman and Company.04. Outlines of Biochemistry, Conn e Stumpf, 4 a ed., 1976. John Wiley & Sons, Inc. (Verúltimas págs. do livro, págs. 587 a 609 - Apêndice 2).
QBQ-211 - 1996 - LABORATÓRIO IIICINÉTICA ENZIMÁTICAOBJETIVOEstudar as influências das concentrações <strong>de</strong> enzima e <strong>de</strong> substrato na velocida<strong>de</strong> <strong>de</strong>uma reação enzimática, examinar as curvas obtidas, obter alguns parâmetros cinéticos (K m eV max ) e discutir seus valores e importância.INFORMAÇÕES GERAISA enzima escolhida para este estudo é a invertase <strong>de</strong> levedura que catalisa a hidróliseda sacarose para produzir glicose e frutose.C 12 H 22 O 11 + H 2 O → C 6 H 12 O 6 + C 6 H 12 O 6sacarose glicose frutoseA <strong>de</strong>terminação da velocida<strong>de</strong> da reação (ou da ativida<strong>de</strong> enzimática) po<strong>de</strong> ser feitaatravés da dosagem dos açúcares redutores formados (glicose e frutose). A dosagem baseiasena reação entre o ácido 3,5 dinitro-salicílico (DNS) e os açúcares redutores. Estesmonossacarí<strong>de</strong>os reduzem o DNS fornecendo um produto <strong>de</strong> cor característica, cujaformação po<strong>de</strong> ser acompanhada a 540 nm.Nestas experiências as velocida<strong>de</strong>s da reação serão expressas em µmoles <strong>de</strong> sacarosehidrolisada por minuto.Conhecendo-se por colorimetria a quantida<strong>de</strong> (µmoles) <strong>de</strong> açúcares redutoresformada, por um cálculo estequiométrico simples, po<strong>de</strong>-se <strong>de</strong>terminar a quantida<strong>de</strong>correspon<strong>de</strong>nte (µmoles) <strong>de</strong> sacarose hidrolisada.Para estudos <strong>de</strong> velocida<strong>de</strong>, o tempo <strong>de</strong> reação <strong>de</strong>ve ser medido com a maior exatidãopossível. Para isso, o grupo <strong>de</strong>verá organizar-se <strong>de</strong> maneira a não permitir que a reação seinicie em tempos diferentes nos vários tubos. Para tal, é importante manter os tubos em gelodurante a adição dos reagentes. Esses <strong>de</strong>vem ser adicionados na or<strong>de</strong>m em que aparecem nosprotocolos, com a enzima sendo adicionada por último. Leva-se então os tubos, todos juntos,ao banho a 37 o C para reagir. Transcorrido o tempo <strong>de</strong>terminado , os tubos <strong>de</strong>vem voltartodos juntos, simultaneamente, para o gelo. Aí a reação pára.PROCEDIMENTO1) Curva PadrãoAtenção: A curva padrão será fornecida na forma <strong>de</strong> um xerox do gráfico A 540 versusµmoles <strong>de</strong> sacarose hidrolisada.A finalida<strong>de</strong> da curva padrão é relacionar valores <strong>de</strong> absorbância a 540 nm comµmoles <strong>de</strong> sacarose hidrolisada.Para construir a curva padrão utiliza-se seis tubos (180 x 20 mm), conforme indicadoabaixo, contendo volumes crescentes <strong>de</strong> solução padrão redutora (glicose 5,5 mM maisfrutose 5,5 mM), completando o volume em cada tubo para 2,0 ml com tampão. Como nãoocorrerá hidrólise <strong>de</strong> sacarose nos tubos <strong>de</strong> 1 a 5, po<strong>de</strong>-se acrescentar logo em seguida aotampão, o reagente DNS.
TubosSol. padrãoredutora(ml)Sol. tampãopH 4,77(ml)ReagenteDNS (ml)A 540B - 2,0 2,0 0,000 0,001 0,2 1,8 2,02 0,4 1,6 2,03 0,6 1,4 2,04 0,8 1,2 2,05 1,0 1,0 2,0Sacarose hidrolisada(µmoles)Após a adição do DNS, colocar os tubos em banho-maria fervente por <strong>de</strong>z minutos.Findo este tempo, esfriar em água corrente e adicionar 16 ml <strong>de</strong> água <strong>de</strong>stilada.HOMOGENEIZAR e ler as absorbâncias a 540 nm (A 540 ) contra o branco (tubo B).Construir um gráfico A 540 versus µmoles <strong>de</strong> sacarose hidrolisada (curva padrão).2) Efeito da CONCENTRAÇÃO DA ENZIMANumerar sete tubos <strong>de</strong> ensaio (180 x 20 mm) e adicionar os reagentes segundo oprotocolo abaixo:TubosSacarose5% emtampãoTampãopH 4,77(ml)TUBOS NO GELOSol.Enzima(ml)Conc. <strong>de</strong>EnzimaMicromolarA 540Sacarosehidrolisada pormin(µmoles/min)B 1,0 1,0 - 0,00 0,000 0,001 1,0 0,9 0,12 1,0 0,7 0,33 1,0 0,5 0,54 1,0 0,3 0,75 1,0 0,1 0,96 1,0 - 1,0Após a adição da enzima, agitar suavemente. Retirar os tubos <strong>de</strong> uma temperatura <strong>de</strong>0 o C e colocá-los simultaneamente em banho-maria a 37 o C. MARCAR o tempo inicial.Incubar a 37 o C por 5 minutos. Transcorrido este tempo, os tubos <strong>de</strong>vem voltarimediatamente para o gelo. Assume-se que nesse instante a reação pára. Ainda no gelo,adicionar a cada tubo 2 ml <strong>de</strong> DNS. Na presença <strong>de</strong> DNS, <strong>de</strong>vido à alcalinida<strong>de</strong> do reagente,a enzima em pH muito alto, pára <strong>de</strong> funcionar. Transferir os tubos para banho-maria ferventee esperar 10 minutos. Findo este tempo, esfriar em água corrente e adicionar 16 ml <strong>de</strong> água<strong>de</strong>stilada em cada tubo. AGITAR com inversão da posição na vertical (3 vezes). Ler asabsorbâncias a 540 nm.Fazer um gráfico colocando a concentração da enzima microM nas abcissas e nasor<strong>de</strong>nadas a velocida<strong>de</strong> <strong>de</strong> hidrólise expressa em µmoles <strong>de</strong> sacarose hidrolisada por minuto.Durante a aula <strong>de</strong> laboratório será fornecido valor da concentração da enzima(microM) na solução estoque.3) Efeito da CONCENTRAÇÃO DE SUBSTRATONumerar sete tubos <strong>de</strong> ensaio (180 x 20 mm) e adicionar os reagentes segundo oprotocolo a seguir:
TubosSacarose5% emtampãoTampãopH 4,77(ml)TUBOS NO GELOSol.Enzima(ml)Conc. <strong>de</strong>SubstratoMilimolarA 540Sacarosehidrolisada pormin(µmoles/min)B - 1,5 0.5 0,00 0,000 0,001 0,05 1,45 0,52 0,1 1,40 0,53 0,3 1,20 0,54 0,5 1,0 0,55 0,7 0,8 0,56 1,0 0,5 0,5Proce<strong>de</strong>r EXATAMENTE como no caso do estudo do efeito da concentração daenzima (ítem anterior).Fazer um gráfico da velocida<strong>de</strong> (µmoles <strong>de</strong> sacarose hidrolisada/min.) versusconcentração inicial do substrato (mM <strong>de</strong> sacarose). Estimar os valores <strong>de</strong> V max e K m .Fazer o gráfico <strong>de</strong> Lineweaver e Burk e calcular os valores <strong>de</strong> V max e K m .Comparar o valor <strong>de</strong> K m com o encontrado na literatura.1). Discutir curvas obtidas para:ANÁLISE DOS RESULTADOS E DISCUSSÃOa) efeito da concentração da enzimab) efeito da concentração <strong>de</strong> substrato2). Elaborar um protocolo para estudar o efeito do pH sobre a ativida<strong>de</strong> enzimática.Consultar na biblioteca:1. The enzymes, Boyer (editor) (1971) vol. 5, cap. 102. Técnicas e Experimentos <strong>de</strong> Bioquímica, Villela, Bacila e Tastaldi, (1973) cap. 4, pags222 a 232.3. Asare-Brown, E. and Bullock, C., Simple Practical Investigations Using Invertase,Biochem.Educ. (1988), 16, 98-100.
QBQ 211 - 1996 - LABORATÓRIO IVLIPOSSOMOS e LIPOPEROXIDAÇÃO EM UM MODELO DEMEMBRANAOBJETIVOS1. Ilustrar o uso <strong>de</strong> lipossomos como mo<strong>de</strong>lo <strong>de</strong> membrana.2. Incorporar um marcador colorido (azul <strong>de</strong> metileno, AM) em lipossomos <strong>de</strong> asolecitina eseparar AM incorporado <strong>de</strong> AM extralipossomal por diálise.3. Observar um dos efeitos <strong>de</strong>letéricos da lipoperoxidação em membranas.FUNDAMENTOSLipossomosMembranas biológicas cumprem inúmeras funções: organizam moléculas emdiferentes compartimentos, limitam microambientes a<strong>de</strong>quados para funções vitais econtrolam o transporte <strong>de</strong> várias substâncias. Visando uma simplificação estrutural e químicadas membranas naturais foram propostos diversos sistemas-mo<strong>de</strong>lo <strong>de</strong> membrana. Lipí<strong>de</strong>osextraídos <strong>de</strong> membranas po<strong>de</strong>m ser utilizados para a preparação <strong>de</strong> diversos sistemasreconstituídos que permitem reproduzir, <strong>de</strong> forma selecionada e simplificada, alguns dosfenômenos que ocorrem em membranas naturais (1). Lipossomos são constituídos pormúltiplas bicamadas concêntricas <strong>de</strong> fosfolipí<strong>de</strong>os (2) e po<strong>de</strong>m ser formados por simplesagitação <strong>de</strong> lipí<strong>de</strong>os em solução aquosa. Têm sido utilizados para se medir permeaçãopassiva <strong>de</strong> vários íons e moléculas (3). Como a maior parte do lipí<strong>de</strong>o está presente na formamultilamelar, o volume sequestrado por mol <strong>de</strong> lipí<strong>de</strong>o (eficiência <strong>de</strong> incorporação) érelativamente baixo em comparação com aquele <strong>de</strong> uma população constituída por vesículas.Neste experimento, vamos primeiramente incorporar o azul <strong>de</strong> metileno (AM) emlipossomos <strong>de</strong> asolecitina. Estimaremos a porcentagem <strong>de</strong> incorporação usando aproprieda<strong>de</strong> do azul <strong>de</strong> metileno <strong>de</strong> absorver luz visível (660nm). Para isso eliminaremos aturbi<strong>de</strong>z das partículas lipossomais micelizando-as com um <strong>de</strong>tergente. Numa segunda etapa,como a asolecitina extraída <strong>de</strong> soja é especialmente rica em lipí<strong>de</strong>os com ca<strong>de</strong>ias insaturadas(4), os lipossomos <strong>de</strong> asolecitina serão utilizados para se observar um dos efeitos <strong>de</strong>letériosda lipoperoxidação, o aumento <strong>de</strong> permeação do AM.LipoperoxidaçãoVárias evidências recentes sugerem que radicais livres (e/ou espécies ativas <strong>de</strong>oxigênio) têm um importante papel em vários processos fisiológicos e patológicos (5,6).Dentre esses po<strong>de</strong>-se citar a ativida<strong>de</strong> microbicida das células do sistema imune, oenvelhecimento, a carcinogênese, a artrite reumatói<strong>de</strong>, as injúrias <strong>de</strong>correntes <strong>de</strong> processos<strong>de</strong> isquemia e reperfusão, a catarata, os efeitos terapêuticos e colaterais <strong>de</strong> drogas, etc (6).Alguns dos efeitos <strong>de</strong>letérios <strong>de</strong> radicais livres parecem envolver lipoperoxidação dasmembranas biológicas. Essas são frequentemente ricas em lipí<strong>de</strong>os insaturados e estãobanhadas por fluídos que contêm metais <strong>de</strong> transição e oxigênio. Tais condições favorecem aperoxidação <strong>de</strong> lipí<strong>de</strong>os porque os íons metálicos ajudam a quebrar a regra da conservaçãodo spin que torna lenta as reações entre o oxigênio e moléculas orgânicas. A peroxidação <strong>de</strong>lipí<strong>de</strong>os é um processo radicalar constituído por uma ca<strong>de</strong>ia <strong>de</strong> reações com três estágios:Iniciação, Propagação e Terminação.Iniciação LH → L • + H • (1)
Propagação L • + O 2 → LOO • (2)LOO • + LH → LOOH + L • (3)Terminação LOO • + L • → LOOL (4)LOO • + LOO • → LOOL + O 2 , etc (5)A iniciação da lipoperoxidação po<strong>de</strong> ser promovida por enzimas ou agentesquímicos. Dentre esses, estão os agentes redutores como a vitamina C (ácido ascórbico) empresença <strong>de</strong> metais <strong>de</strong> transição, como Fe(III). O mecanismo pelo qual ascorbato e Fe(III)complexado iniciam a peroxidação não está completamente elucidado mas parece envolver aformação do radical hidroxila, uma espécie extremamente reativa (6). Obviamente, processosenzimáticos que geram o radical hidroxila também po<strong>de</strong>m iniciar a lipoperoxidação. Oradical hidroxila, ou outros radicais livres, po<strong>de</strong>m abstrair um átomo <strong>de</strong> hidrogênio da ca<strong>de</strong>ia<strong>de</strong> ácido graxo, iniciando a ca<strong>de</strong>ia <strong>de</strong> reações (eq 1-5) que resulta em consumo <strong>de</strong> oxigênio,rearranjo das duplas nos lipí<strong>de</strong>os insaturados e, eventualmente, <strong>de</strong>struição dos lipí<strong>de</strong>os comprodução <strong>de</strong> uma série <strong>de</strong> produtos menores tais como al<strong>de</strong>ídos, álcoois e hidrocarbonetos(Esquema 1). O malondial<strong>de</strong>ído, apesar <strong>de</strong> correspon<strong>de</strong>r a apenas 5% do total <strong>de</strong> produtosdos lipí<strong>de</strong>os, tem sido um importante indicador <strong>de</strong> lipoperoxidação em membranasbiológicas porque forma um produto colorido com o ácido tiobarbitúrico (TBA) queabsorve intensamente a 535nm (ε = 1.56 x 10 5 M -1 cm -1 ) (Esquema 1).Esquema 1: Representação esquemática da lipoperoxidação e <strong>de</strong> métodos analíticosutilizados para <strong>de</strong>tectá-la.
PROCEDIMENTO (7)1) Determinação da porcentagem <strong>de</strong> incorporação.Lipossomos 10mM serão obtidos por vortexação <strong>de</strong> asolecitina (L-α-fosfatidilcolina<strong>de</strong> soja tipo IV - S, Sigma Chemical Company, grau comercial) em solução 0.2mM <strong>de</strong> azul<strong>de</strong> metileno (AM).Quatro alíquotas <strong>de</strong> lipossomos com azul <strong>de</strong> metileno (LAM) <strong>de</strong> 1.0 ml cada serãosubmetidas a um processo <strong>de</strong> diálise em tubos <strong>de</strong> celofane contra água (2 l) sob agitaçãoconstante com barra magnética (0.5h). Como controle, simultaneamente será dialisada umasolução <strong>de</strong> azul <strong>de</strong> metileno 0.2mM (AM) (1.0 ml). Após a diálise, uma das quatro tripascontendo lipossomos (LAM) será rompida para <strong>de</strong>terminação da porcentagem daincorporação, que é dada por:A2A2c% incorporação = 100. - , on<strong>de</strong>,A1A1cA 1 e A 2 são as absorbâncias a 660nm <strong>de</strong> uma alíquota <strong>de</strong> 0.2ml <strong>de</strong> LAM adicionada a 2ml<strong>de</strong> água e 1 ml <strong>de</strong> TRITON X-100 (1%) antes e <strong>de</strong>pois da diálise, respectivamente.A 1c e A 2c são as absorbâncias a 660nm <strong>de</strong> uma alíquota <strong>de</strong> 0.2ml da solução <strong>de</strong> azul <strong>de</strong>metileno 0.2mM (AM) adicionada a 2ml <strong>de</strong> água e 1ml <strong>de</strong> TRITON X-100 (1%) antes e<strong>de</strong>pois da diálise, respectivamente.Os dados a serem obtidos estão sumarizados na Tabela I.TABELA IDiálise e <strong>de</strong>terminação da porcentagem <strong>de</strong> incorporação <strong>de</strong> AM em lipossomos<strong>de</strong> asolecitinaAMOSTRAS* ABSORBÂNCIA 660nm % DE INCORPO-RAÇÃOANTES DADIÁLISEAPÓS ADIÁLISELAM A 1 = A 2 =AM A 1c = A 2c =*Note bem que as leituras <strong>de</strong> absorbâncias a 660nm são feitas em 0.2ml <strong>de</strong> amostra, 2ml <strong>de</strong>água e 1ml <strong>de</strong> TRITON X-100.Como branco po<strong>de</strong>-se usar 3ml <strong>de</strong> água <strong>de</strong>stilada2) Determinação da permeação <strong>de</strong> AM induzida pela lipoperoxidaçãoPara induzir a lipoperoxidação, utilizaremos o sistema ácido ascórbico/Fe 3+ /EDTA.Em um tubo CONTROLE I (CI) adicionaremos uma das três tripas dialisadas contendolipossomos (LAM) e 9.0ml <strong>de</strong> água. Em outro tubo CONTROLE II (CII) adicionaremosoutra das três tripas, 7.0ml <strong>de</strong> água e 2.0ml <strong>de</strong> ácido ascórbico (AA) 10mM. No terceiro tuboTESTE (T), coloca-se a terceira tripa, 5.0ml <strong>de</strong> água, 2.0ml <strong>de</strong> AA 10mM e 2.0ml <strong>de</strong>Fe 3+ /EDTA 1mM. Os três tubos serão então incubados durante 0.5h a 40 o C sob agitação.Após esse período <strong>de</strong> incubação, será feita a leitura <strong>de</strong> absorbância a 660nm <strong>de</strong> alíquotas <strong>de</strong>3ml <strong>de</strong> cada uma das soluções externas às tripas em CI, CII e T. As leituras <strong>de</strong> absorbância a660nm <strong>de</strong>vem preencher a Tabela II. Uma vez feitas as leituras, as alíquotas da soluçãoexterna <strong>de</strong>vem ser <strong>de</strong>volvidas aos respectivos tubos <strong>de</strong> origem e as tripas arrebentadas. Oconteúdo interno das tripas é recolhido junto com a solução externa.
Para <strong>de</strong>terminar a extensão <strong>de</strong> lipoperoxidação, alíquotas <strong>de</strong> 1ml <strong>de</strong> CI, CII e Tserão adicionadas a 2ml do reagente TBA. Como BRANCO , será usado 1ml <strong>de</strong> águaadicionados a 2ml <strong>de</strong> TBA. As quatro amostras assim obtidas serão incubadas a 100 o Cdurante 15min. Após esfriar, serão lidas as absorbâncias a 535nm. Essas leituras permitempreencher a Tabela III.TABELA IIPermeação do azul <strong>de</strong> metileno induzida pela lipoperoxidaçãoSOLUÇÕES EXTERNASÀS TRIPAS APÓS INCUBAÇÃO A 660CONTROLE I (CI)(água + LAM)CONTROLE II (CII)(água + ác. ascórbico + LAM)TESTE (T)(água + ác. ascórbico + Fe 3+ /EDTA + LAM)TABELA IIILipoperoxidação em lipossomos <strong>de</strong> asolecitina induzida pelo sistema ácidoascórbico/Fe 3+ /EDTA.AMOSTRAVOLUME DAAMOSTRA(ml)TBA*(ml)água (BRANCO) 1 29.0 ml água + tripa c/ 1.0ml <strong>de</strong> 1 2LAM (CONTROLE I) (CI)7.0 ml água + tripa c/ 1.0ml <strong>de</strong> 1 2LAM + 2.0ml <strong>de</strong> AA 10mM(CONTROLE II) (CII)5.0 ml água + tripa c/ 1.0ml <strong>de</strong> 1 2LAM + 2.0ml <strong>de</strong> AA 10mM +2.0 ml <strong>de</strong> Fe 3+ /EDTA 1mM(TESTE) (T)A 535LIPOPEROXIDAÇÃO(%)*TBA é uma solução contendo 1% do agente micelizante TRITON X-100, HCl 0.25M e0.375% <strong>de</strong> ácido tiobarbitúrico.ANÁLISE DOS RESULTADOS E DISCUSSÃO01. Calcule a porcentagem <strong>de</strong> incorporação do AM em lipossomos <strong>de</strong> asolecitina. Use aexpressão fornecida.02. O que se po<strong>de</strong> dizer da permeabilida<strong>de</strong> dos lipossomos <strong>de</strong> asolecitina ao azul <strong>de</strong> metilenocom os seus dados <strong>de</strong> diálise?03. Calcule a porcentagem <strong>de</strong> lipoperoxidação <strong>de</strong> seus lipossomos nas diferentes condiçõesexperimentais (CI, CII e T) às quais foram submetidos. Consi<strong>de</strong>re que o malondial<strong>de</strong>idocorrespon<strong>de</strong> a apenas 5% da lipoperoxidação total.04. Discuta o efeito da lipoperoxidação sobre a permeação do azul <strong>de</strong> metileno através dasmembranas lipossomais.
BIBLIOGRAFIA01. Gomperts, D.D. (1977) - "The Plasma Membrane: Mo<strong>de</strong>ls for Structure and Function",Aca<strong>de</strong>mic Press (London).02. Bangham, A.D.; Standish, M.M. e Watkins, J.C. (1965) - J. Mol. Biol. 13, 238.03. Bangham, A.D.; <strong>de</strong> Gier, J. e Greville, G.D. (1967) - Chem. Phys. Lipids 1, 225.04. Kagawa, Y. e Racker, E. (1966) - J. Biol. Chem. 241, 2467.05. Meneghini, R. (1987) - A toxicida<strong>de</strong> do oxigênio, Ciência Hoje, 5, 57.06. Halliwell, B. e Gutteridge, J.M.C. (1985) - Free Radicals in Biology & Medicine,Claredon Press, Oxford.07. Augusto, O. e Carmona-Ribeiro, A.M. (1989) - Introducing Mo<strong>de</strong>l Membranes andLipoperoxidation, Biochemical Education 17(4), 209.
QBQ-211 - 1996 - LABORATÓRIO VI - FRACIOAMENTO CELULAR E VERIFICAÇÃO DA ATIVIDADE DASUCCINATO DESIDROGENASE.Fracionamento celular - Sacrificar um rato por concussão cerebral. Remover ofígado, mergulhá-lo em 20 ml <strong>de</strong> uma solução <strong>de</strong> sacarose 0,25 M, previamente resfriada a0 o C e picá-lo bem com tesoura. Decantar a sacarose adicionar outros 20 ml e tornar<strong>de</strong>cantar. Adicionar 20 ml sacarose 0,25 M, também gelada. Homogeneizar o fígado ecentrifugar a 800 x g (4.000 rpm) por 10 minutos.Decantar o sobrenadante e centrifugá-lo a 10.000 x g (10.000 rpm) por 30 minutos.Decantar este precipitado. Recolher o sobrenadante em tubo <strong>de</strong> ensaio e conservá-lo no gelo.Esta será a fração celular I.VERIFICAÇÃO DA ATIVIDADE DA SUCCINATO DESIDROGENASEO azul <strong>de</strong> metileno po<strong>de</strong> apresentar-se na forma oxidada (azul) ou reduzida (incolor).A redução do azul <strong>de</strong> metileno po<strong>de</strong> ser obtida a partir da oxidação do succinato, catalisadapela succinato <strong>de</strong>sidrogenase. Seguir o protocolo 1. Para verificar a oxidação do succinato,as frações <strong>de</strong>vem ser incubadas a 37 o C, por 10 minutos.Antes <strong>de</strong> iniciar a experiência, o grupo <strong>de</strong>ve:1. escrever a reação que está sendo analisada;2. discutir as funções <strong>de</strong> succinato, sacarose, azul <strong>de</strong> metileno e óleo mineral;3. planejar o controle da experiência.II - INIBIÇÃO DA SUCCINATO DESIDROGENASE POR MALONATOSabendo em que fração celular se encontra a ativida<strong>de</strong> da succinato <strong>de</strong>sidrogenase,observe a inibição competititva da enzima por malonato, um processo historicamenteimportante na elucidação das etapas <strong>de</strong> ciclo <strong>de</strong> Krebs. Você utilizará a redução do MTT viasuccinato <strong>de</strong>sidrogenase: o MTT é amarelo quando oxidado e violeta quando reduzido, nãosendo reoxidado pelo O 2 do ar. Seguir o protocolo 2.Deixe os tubos 10 minutos à temperatura ambiente e compare suas cores. Se a reaçãoestiver lenta (isto <strong>de</strong>pen<strong>de</strong>rá da sua preparação mitocondrial), aqueça os tubos a 37 o C por5 minutos e os compare novamente. NÃO ESQUEÇA, a inibição é competitiva, existe ofator cinético e você <strong>de</strong>verá fazer as comparações ATENTAMENTE A CURTOSINTERVALOS DE TEMPO.III - DETERMINAÇÃO DO PONTO DE AÇÃO DE DROGAS NA CADEIA DETRANSPORTE DE ELÉTRONS.Esta <strong>de</strong>terminação <strong>de</strong>ve ser feita com o uso <strong>de</strong> aceptores e doadores artificiais <strong>de</strong>elétrons: a escolha dos aceptores e doadores artificiais <strong>de</strong> elétrons <strong>de</strong>ve ser feita consultandoas tabelas que se seguem.Os aceptores e doadores são fornecidos na forma oxidada, com exceção do reagentep-fenilenodiamina.
PAR REDOXE o'NADH / NAD + -0,32Succinato / Fumarato -0,03FADH 2 / FAD 0,00Azul <strong>de</strong> Metileno red/ox 0,01Cit b (Fe 2+ ) / Cit B (Fe 3+ ) 0,06Cit c 1 (Fe 2+ ) / Cit c 1 (Fe 3+ ) 0,22Cit c (Fe 2+ ) / Cit c (Fe 3+ ) 0,25Cit a-a 3 (Fe 2+ ) / Cit a-a 3 (Fe 3+ ) 0,40H 2 O / 1/2 O 2 0,82ACEPTORES E DOADORES ARTIFICIAIS E o'Piocianina red/ox -0,342,6-diclorofenolindofeno (DCPI) red/ox 0,20Benzil Viológeno red/ox -0,36Ferricianeto Fe(CN) 64- /Fe (CN)6 3- 0,36p. fenilenodiamino (p-FDA) red/ox 0,27COR DOS ACEPTORES E DOADORES ARTIFICIAIS NAS FORMASREDUZIDA E OXIDADA.REDUZIDO OXIDADO VOLUMEUTILIZADOPiocianina incolor azul 0,12,6-diclorofenolindolenolincolor azul 0,3(DCPI)Benzil violágeno incolor violeta 0,3Ferricianeto incolor amarelo 0,2p-fenilenodiamino (p-FDA) incolor violeta 0,5Seguir o protocolo 3Incubar os tubos a 37 o C por 10 minutos e discutir o resultado com os colegas, i<strong>de</strong>ntificandoa droga A e B.PROTOCOLO 1TUBO 1 2 3 4 5Tampão A 0,3 ml 0,3 ml 0,3 ml 0,3 ml 0,3 mlSacarose 0, 7 M 1,0 ml 1,0 ml 1,0 ml 1,0 ml 1,0 mlSuccinato 0,5 M - - 0,2 ml 0,2 ml 0,2 mlAzul <strong>de</strong> Metileno 0,1 ml 0,1 ml 0,1 ml 0,1 ml 0,1 mlÁgua Destilada 1,5 ml 1,5 ml 1,3 ml 1,3 ml 1,4 mlFração Celular 0,1 (I) 0,1 (II) 0,1 (I) 0,1 (II) -Nujol 0,5 cm 0,5 cm 0,5 cm 0,5 cm 0,5 cm
QBQ-211 - 1996 - LABORATÓRIO VITRANSAMINAÇÃOOBJETIVO: Verificar a reação <strong>de</strong> transaminação em homogenato <strong>de</strong> fígado.INTRODUÇÃOA transaminação consiste na transferência reversível do grupo amino <strong>de</strong> umaminoácido a um cetoácido sem que o grupo -NH 2 ou -NH+ 3 fique livre no meio aquoso. Oaminoácido per<strong>de</strong> o grupo amino e se converte no cetoácido correspon<strong>de</strong>nte e o cetoácidoque ganha o grupo amino se converte no aminoácido respectivo.As transaminases se econtram na maioria dos tecidos animais. Todos os aminoácidosque fazem parte das proteínas participam em transaminações enzimáticas, com exceção dalisinaNesta experiência se i<strong>de</strong>ntificarão os produtos <strong>de</strong> uma reação <strong>de</strong> transaminação pormeio <strong>de</strong> cromatografia em papel.MÉTODOUma alíquota <strong>de</strong> um homogenato <strong>de</strong> fígado será incubada com um aminoácido e umcetoácido. A i<strong>de</strong>ntificação dos produtos da reação será feita por cromatografia em papel.PREPARAÇÃO DO HOMOGENATO DE FÍGADO DE RATOO Fígado <strong>de</strong> um rato é picado e lavado 2 vezes com 20 ml <strong>de</strong> tampão fosfato 0,05 M,pH 7,4 e em seguida é homogeneizado com 10 ml <strong>de</strong>ste tampão fosfato. Este homogenato écentrifugado a 800 x g por 15 minutos para eliminar células não <strong>de</strong>struídas e núcleos. Osobrenadante é <strong>de</strong>cantado em um tubo <strong>de</strong> ensaio mantido em gelo e esta fração consiste napreparação enzimática. Notar que não é necessária a enzima pura para que esta catalise areação.REAÇÃO DE TRANSAMINAÇÃOO sistema completo <strong>de</strong> reação é composto por um aminoácido, um cetoácido, apreparação enzimática, arsenito <strong>de</strong> sódio (NaAsO 2 ) e um tampão. O arsenito é empregadocom a finalida<strong>de</strong> <strong>de</strong> evitar a oxidação posterior dos cetoácidos pelo sistema enzimáticopresente no hepatócito.MISTURA DE REAÇÃOα-cetoglutarato 0,2 M, pH 7,4 - 0,1 mlAlanina 0,2 M, pH 7,4 - 0,1 mlPrep. enzimática - 0,2 mlTampão fosfato 0,05 M, pH 7,4 - 0,2 mlArsenito <strong>de</strong> Sódio 0,2 M - 0,2 mlIncubar a 37 o C por 30 minutos. Em seguida colocar em banho-maria fervente por 3minutos. Centrifugar por 10 minutos em centrífuga Eppendorf. Decantar o sobrenadantetransferindo para um segundo tubo Eppendorf e fazer a cromatografia com os padrõesa<strong>de</strong>quados.
CROMATOGRAFIAEm um papel <strong>de</strong> filtro Whatman n o 1 (10x20 cm) traçar com lápis uma linha a 2,5 cmda origem e marcar pontos com 2,5 cm <strong>de</strong> distância entre si. Colocar padrões <strong>de</strong> alanina,glutamato, piruvato e α-cetoglutarato, mistura <strong>de</strong> reação, branco * e 2,4-dinitrofenilhidrazina.Sobre os pontos on<strong>de</strong> foram aplicados o α-cetoglutarato, piruvato e mistura <strong>de</strong> reação,adicionar uma aplicação capilar <strong>de</strong> 2,4-dinitrofenilhidrazina.O solvente utilizado para a cromatografia será n-Butanol/Etanol/NH 4 OH (0,5N).(70:20:30).Após o solvente chega a 1 cm do final do papel, marcar a frente do solvente, secar opapel, marcar as manchas amarelas dos produtos <strong>de</strong> reação da 2,4-dinitrofenilhidrazina e osα-cetoácidos, e revelar o cromatograma com ninhidrina.* branco: mistura <strong>de</strong> apenas alanina e α-cetoglutarato.






![PE]+ + N. Fragmentação por clivagem sigma](https://img.yumpu.com/50134385/1/180x260/pe-n-fragmentaaao-por-clivagem-sigma.jpg?quality=85)