MonatsschrKinderheilkd11_2011_Hoeger 1 - Kinderkrankenhaus ...
MonatsschrKinderheilkd11_2011_Hoeger 1 - Kinderkrankenhaus ...
MonatsschrKinderheilkd11_2011_Hoeger 1 - Kinderkrankenhaus ...
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
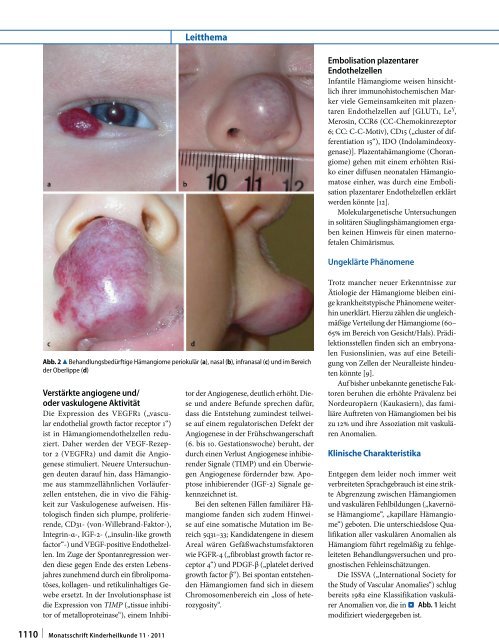
Abb. 2 8 Behandlungsbedürftige Hämangiome periokulär (a), nasal (b), infranasal (c) und im Bereich<br />
der Oberlippe (d)<br />
Verstärkte angiogene und/<br />
oder vaskulogene Aktivität<br />
Die Expression des VEGFR1 („vascular<br />
endothelial growth factor receptor 1“)<br />
ist in Hämangiomendothelzellen reduziert.<br />
Daher werden der VEGF-Rezeptor<br />
2 (VEGFR2) und damit die Angiogenese<br />
stimuliert. Neuere Untersuchungen<br />
deuten darauf hin, dass Hämangiome<br />
aus stammzellähnlichen Vorläuferzellen<br />
entstehen, die in vivo die Fähigkeit<br />
zur Vaskulogenese aufweisen. Histologisch<br />
finden sich plumpe, proliferierende,<br />
CD31- (von-Willebrand-Faktor-),<br />
Integrin-α-, IGF-2- („insulin-like growth<br />
factor“-) und VEGF-positive Endothelzellen.<br />
Im Zuge der Spontanregression werden<br />
diese gegen Ende des ersten Lebensjahres<br />
zunehmend durch ein fibrolipomatöses,<br />
kollagen- und retikulinhaltiges Gewebe<br />
ersetzt. In der Involutionsphase ist<br />
die Expression von TIMP („tissue inhibitor<br />
of metalloproteinase“), einem Inhibi-<br />
1110 | Monatsschrift Kinderheilkunde 11 · <strong>2011</strong><br />
Leitthema<br />
tor der Angiogenese, deutlich erhöht. Diese<br />
und andere Befunde sprechen dafür,<br />
dass die Entstehung zumindest teilweise<br />
auf einem regulatorischen Defekt der<br />
Angiogenese in der Frühschwangerschaft<br />
(6. bis 10. Ges tationswoche) beruht, der<br />
durch einen Verlust Angiogenese inhibierender<br />
Signale (TIMP) und ein Überwiegen<br />
Angiogenese fördernder bzw. Apoptose<br />
inhibierender (IGF-2) Signale gekennzeichnet<br />
ist.<br />
Bei den seltenen Fällen familiärer Hämangiome<br />
fanden sich zudem Hinweise<br />
auf eine somatische Mutation im Bereich<br />
5q31–33; Kandidatengene in diesem<br />
Areal wären Gefäßwachstumsfaktoren<br />
wie FGFR-4 („fibroblast growth factor receptor<br />
4“) und PDGF-β („platelet derived<br />
growth factor β“). Bei spontan entstehenden<br />
Hämangiomen fand sich in diesem<br />
Chromosomenbereich ein „loss of heterozygosity“.<br />
Embolisation plazentarer<br />
Endothelzellen<br />
Infantile Hämangiome weisen hinsichtlich<br />
ihrer immunohistochemischen Marker<br />
viele Gemeinsamkeiten mit plazentaren<br />
Endothelzellen auf [GLUT1, Le Y ,<br />
Merosin, CCR6 (CC-Chemokinrezeptor<br />
6; CC: C-C-Motiv), CD15 („cluster of differentiation<br />
15“), IDO (Indolamindeoxygenase)].<br />
Plazentahämangiome (Chorangiome)<br />
gehen mit einem erhöhten Risiko<br />
einer diffusen neonatalen Hämangiomatose<br />
einher, was durch eine Embolisation<br />
plazentarer Endothelzellen erklärt<br />
werden könnte [12].<br />
Molekulargenetische Untersuchungen<br />
in solitären Säuglingshämangiomen ergaben<br />
keinen Hinweis für einen maternofetalen<br />
Chimärismus.<br />
Ungeklärte Phänomene<br />
Trotz mancher neuer Erkenntnisse zur<br />
Ätiologie der Hämangiome bleiben einige<br />
krankheitstypische Phänomene weiterhin<br />
unerklärt. Hierzu zählen die ungleichmäßige<br />
Verteilung der Hämangiome (60–<br />
65% im Bereich von Gesicht/Hals). Prädilektionsstellen<br />
finden sich an embryonalen<br />
Fusionslinien, was auf eine Beteiligung<br />
von Zellen der Neuralleiste hindeuten<br />
könnte [9].<br />
Auf bisher unbekannte genetische Faktoren<br />
beruhen die erhöhte Prävalenz bei<br />
Nordeuropäern (Kaukasiern), das familiäre<br />
Auftreten von Hämangiomen bei bis<br />
zu 12% und ihre Assoziation mit vaskulären<br />
Anomalien.<br />
Klinische Charakteristika<br />
Entgegen dem leider noch immer weit<br />
verbreiteten Sprachgebrauch ist eine strikte<br />
Abgrenzung zwischen Hämangiomen<br />
und vaskulären Fehlbildungen („kavernöse<br />
Hämangiome“, „kapillare Hämangiome“)<br />
geboten. Die unterschiedslose Qualifikation<br />
aller vaskulären Anomalien als<br />
Hämangiom führt regelmäßig zu fehlgeleiteten<br />
Behandlungsversuchen und prognostischen<br />
Fehleinschätzungen.<br />
Die ISSVA („International Society for<br />
the Study of Vascular Anomalies“) schlug<br />
bereits 1982 eine Klassifikation vaskulärer<br />
Anomalien vor, die in . Abb. 1 leicht<br />
modifiziert wiedergegeben ist.