MC-Handout 4xx - ChemistforChrist
MC-Handout 4xx - ChemistforChrist
MC-Handout 4xx - ChemistforChrist
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
<strong>MC</strong> <strong>Handout</strong> 4: Anionische Polymerisation<br />
Anionische Polymerisation<br />
1920 - 1930 BuNa: Butadien + Natrium<br />
Bei der ionischen Polymerisation gibt es keinen zwangsläufigen Kettenabbruch durch<br />
Rekombination, weil die wachsenden Kettenenden wegen elektrostatischer Abstoßung<br />
ihrer gleichsinnigen Ladungen nicht miteinander reagieren können.<br />
So lassen sich Vinylmonomere, die in der Lage sind, die negative Ladung des Carbanions<br />
zu delokalisieren bevorzugt initiieren.<br />
Elektronenziehende Substituenten:<br />
R = -NO2 > -COR > -COOR > -CN > -C6H5 > - CH=CH2<br />
Im Gegensatz zur radikalischen ist die anionische Polymerisation nicht auf<br />
Vinylmonomerebeschränkt. Es können auch Aldehyde, Epoxide, cyclische Sulfide,<br />
Lactame u.a. polymerisiert werden.<br />
C O S<br />
OMe<br />
O<br />
More resources available at<br />
www.chemistforchrist.de
<strong>MC</strong> <strong>Handout</strong> 4: Anionische Polymerisation<br />
Na<br />
Prinzip Monomere Initiatoren<br />
I +<br />
I + X<br />
X sBu Li<br />
Y<br />
SET<br />
O<br />
HN<br />
COOR<br />
Me<br />
COOR<br />
CN<br />
CN<br />
Me<br />
O O S S<br />
O<br />
O<br />
Si Si<br />
O Si O<br />
O<br />
2x<br />
CN<br />
More resources available at<br />
www.chemistforchrist.de<br />
H 2<br />
C<br />
H 2<br />
C<br />
NaH<br />
OR M<br />
H 2O<br />
OR K<br />
Bu 2SnX 2<br />
Sn(COOR) 2<br />
Bu<br />
difunktioneller Initiator<br />
Grüne Farbe Rote Farbe<br />
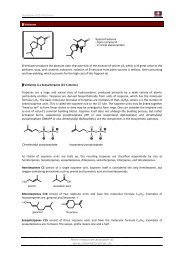
Als Monomere sind insbesondere Vinylverbindungen geeignet, die eine<br />
elektronenziehende Gruppe enthalten.<br />
EWG<br />
Diese sind in der Lage, das bei der Addition der Base entstehende Carbanion zu<br />
stabilisieren. Die Reaktivität der Monomere sinkt daher mit abnehmendem –I/-M Effekt<br />
von EWG.<br />
-NO2 > -C(=O)-R > -CN > -COOR > -Ph > -CH=CH2 >> -CH3<br />
Anionische Vinylpolymerisation<br />
R<br />
Li<br />
O<br />
N<br />
O<br />
Na
<strong>MC</strong> <strong>Handout</strong> 4: Anionische Polymerisation<br />
Die charakteristischen Züge der lebenden anionischen Polymerisation sind:<br />
a) ki>> kp, d.h der Initiator steht schon zu Beginn der Polymerisation quantitativ zur<br />
Verfügung.<br />
b) Wachstum erfolgt für alle Ketten unter gleichen Bedingungen<br />
c) Wachstum erfolgt ohne Abbruch<br />
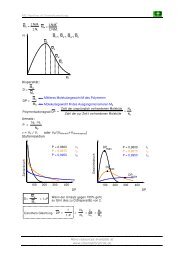
Polymerisationsgrad und Umsatz bei der lebenden anionischen Polymerisation<br />
Beim Wachstum aller Ketten ohne Abbruch folgt für den Polymerisationsgrad:<br />
Monomerkonzentration<br />
DP =<br />
Initiierung<br />
Konzentration an Mono(Di-)anionen<br />
Diese Beziehung besagt, dass sich der Polymerisationsgrad DP direkt aus dem<br />
Verhältnis der eingesetzten Monomer und Initiatorkonzentration berechnen lässt.<br />
a) Basenaddition<br />
M B M B M + B<br />
kovalente<br />
Bindung<br />
Solvens getrenntes<br />
Ionenpaar<br />
vollständig dissoziierte<br />
Ionen<br />
Polarität des LM nimmt zu<br />
Im Initiierungsschritte erfolgt eine Basenaddition, wobei das Kation M + je nach LM<br />
undissoziiert oder dissoziiert vom Carbanion vorliegt. Die benötigte Basizität des<br />
Initiators hängt von der EN von dem am Vinyl hängenden EWG ab. Je größer EN EWG,<br />
desto schwächer die benötigten Basen.<br />
b) Elektronentransfer<br />
Als Elektronendonoren dienen starke Reduktionsmittel (z.B Naphtalin Natrium) in dipolar<br />
aprotischen LM (z.B. THF). Die Monomere müssen eine hohe Elektronenaffinität besitzen,<br />
wie z.B. Styrol (Dimerisiert sofort zum Dianion).<br />
Kettenwachstum:<br />
Das Kettenwachstum erfolgt bei a) und b) durch "Monomerinsertion" in die Bindung<br />
zwischen Carbanion und Metallkation am jeweiligen Kettenende. Die<br />
Reaktionsgeschwindigkeit hängt stark vom Charakter der Bindung zwischen geladenem<br />
Kettenende und Gegenion ab. Zusätzlich kann sie von Assoziatbildungen beeinflusst<br />
werden.<br />
Kintische Beschreibung erschwert durch:<br />
a) Solvensgetrennte / Kontakt / Freien Ionenpaare<br />
b) Aggregatbildung (vgl. n-BuLi)<br />
More resources available at<br />
www.chemistforchrist.de
<strong>MC</strong> <strong>Handout</strong> 4: Anionische Polymerisation<br />
DP<br />
P<br />
anionisch<br />
radikalisch<br />
Stufenreaktion<br />
P (Umsatz) und DP wachsen linear mit der Reaktionszeit. Je höher die<br />
Initiatorkonzentration ist, desto rascher erfolgt die Polymerisation und desto niedriger ist<br />
der DP.<br />
Theoretisch sollte ein Living-Polymerisat umso einheitlicher sein, je größer sein mittlerer<br />
Polymerisationsgrad ist. Praktisch läuft Qw,n mit zunehmendem Pn jedoch durch ein<br />
Minimum, da mit wachsender Kettenlänge des Polymers die Viskosität der Lösung stark<br />
ansteigt, wodurch eine gleichmäßige Verteilung der zugegebenen Monomermoleküle auf<br />
die vorhandenen aktiven Zentren experimentell immer schlechter zu realisieren ist.<br />
Das Zeit / Umsatzverhältnis lässt sich aus der Gleichung für die<br />
Wachstumsgeschwindigket durch Integration ermitteln.<br />
ln [M] 0<br />
[M] t<br />
= k p [I] t<br />
Trägt man ln ([M]0 / [M]t) gegen t auf, so erhält man eine Gerade mit der Steigung kp [I]<br />
Die Auftragung lässt erkennen, dass eine hohe Konzentration an I einen raschen Umsatz<br />
bewirkt.<br />
ln [M] zunehmende<br />
0<br />
Konz. an I<br />
[M] t<br />
Einfluss der Ionensolvatation auf die Kinetik<br />
t/s<br />
In gut solvatisierenden Lösungsmitteln [THF, DME (Dimethoxethan)] dissoziieren die<br />
Initiatoren zum Teil in freie Ionen. Das gleiche gilt für die wachsenden Kettenenden. Ein<br />
Kontaktionenpaar am Kettenende wird somit langsamer polymerisieren, als ein freies<br />
Ionenpaar. In unpolaren LM dissoziieren die kleinen Alkalimetallionen (Li + schlechter als<br />
die großen (Cs + )<br />
Molekulargewichtsverteilung<br />
Da alle Ketten gleichzeitig gestartet werden und ohne Abbruch wachsen können ergeben<br />
sich sehr enge Verteilungen mit Mw/Mn ~1. Die resultierende Molekulargewichtsverteilung<br />
More resources available at<br />
www.chemistforchrist.de
<strong>MC</strong> <strong>Handout</strong> 4: Anionische Polymerisation<br />
entspricht einer Poisson-Verteilung, während bei anderen Polyreaktionen die<br />
wahrscheinlichste Verteilung (Schulz-Flory-Verteilung) gefunden wird. Die Dispersität<br />
D = M w<br />
M n beträgt nahezu 1.<br />
Gewichtsanteil<br />
2 3 4 5<br />
1<br />
Poisson<br />
0 20 40 60 80 100 120 140<br />
Polymerisationsgrad<br />
Lebend anionisch<br />
D=<br />
M W<br />
M n<br />
Dargestellt für kin. Kettenlänge ν = 50<br />
=1.009<br />
Dies ermöglicht zum Beispiel die Verwendung von durch anionischer PM hergestelltem PC<br />
als Standards für die Gelpermeationschromatographie (GPC).<br />
M W<br />
M n<br />
~1<br />
M W<br />
Poisson-Verteilung Schutz-Flory Verteilung<br />
Kettenübertragung und Abbruch:<br />
Wird mit Amiden in polaren LM polymerisiert (z.B. mit KNH2 in flüssigem NH3), so kann<br />
Protonenübertragung auftreten d.h. das Carbanionische Ende kann NH3 wieder zu NH2 -<br />
deprotonieren.<br />
Bei der anionischen Polymerisation mit Acrylnitril kann das Monomere ein H + an das<br />
carbanionische Ende abgeben und somit als Überträger wirken.<br />
Sowohl die Wachstumsgeschwindigkeit als auch der DP ist hierbei abhängig von der<br />
Lösungsmittelkonzentration. Da ktr (Übertragungskonstante) recht groß ist, sind keine<br />
hohen Molekulargewichte zu erwarten. Vermeidung der Übertragungung:<br />
Da die Aktivierungsenergie der Übertragungsreaktion viel größer ist als die der Start- und<br />
der Wachstumsreaktion, kann die Kettenübertragung bei den für ionische<br />
Polymerisationen in der Technik üblichen tiefen Temperaturen zwischen -50 und -100°C<br />
meist vernachlässigt werden. Allerdings verläuft die Polymerisation dann langsamer.<br />
Ansonsten erfolgt bei der anionischen Polymerisation in der Regel kein spontaner<br />
Abbruch, solange O2, H2O und CO2 frei gearbeitet wird. Da die aktiven Kettenenden in<br />
M n<br />
>1<br />
More resources available at<br />
www.chemistforchrist.de
<strong>MC</strong> <strong>Handout</strong> 4: Anionische Polymerisation<br />
ihrer Anzahl und Reaktivität während der gesamten Dauer des Experimentes zur<br />
Verfügung stehen, nennt man eine solche Polymerisation nach dem Vorschlag ihres<br />
Entdeckers M. Szwarc eine „lebende“ („Living“-) anionische Polymerisation.<br />
Lebende Polymerisation, Voraussetzungen:<br />
- Alle Kettenenden aktiv (Michael Szwarc)<br />
- Keine Abbruch<br />
- Keine Übertragungsreaktionen<br />
- Keine Nebenraktionen<br />
- Kettenlänge wird immer größer Pn* + M → Pn+1*<br />
Test, ob lebend oder nicht:<br />
1) Molmasse ~ Umsatz<br />
M n<br />
DP<br />
2) Kinetik:<br />
M 0<br />
I 0<br />
d[<br />
M ]<br />
− = kP<br />
⋅[<br />
Pn<br />
*] ⋅[<br />
M ]<br />
[ M ]<br />
konst.<br />
d M<br />
kP<br />
t<br />
M<br />
'<br />
[ ]<br />
− ∫ =<br />
[ ] ∫ Reaktion erster Ordnung<br />
3) GPC nicht immer!<br />
M W<br />
M n<br />
= 1<br />
P<br />
Kein wichtiges Kriterium für lebende Polymerisation<br />
Vorraussetzung: Alle Ketten wachsen gleichzeitig.<br />
4) Blockcopolymere<br />
Synthese von Blockcopolymeren: Zugabe von anderem Monomer → Block →<br />
Lebend. Pfropfpolymere, Sternpolymere.<br />
More resources available at<br />
www.chemistforchrist.de
<strong>MC</strong> <strong>Handout</strong> 4: Anionische Polymerisation<br />
Bei gewolltem Abbruch lassen sich definierte Kettenenden erzeugen:<br />
Cl<br />
Abbruchreagenz Endfunktion<br />
Säuren, H 2O, ROH, PhOH Alkyl<br />
CO 2 , acyclische Anhydride<br />
N<br />
Si<br />
Si<br />
Carboxyl<br />
Ethylenoxid, Lactone Hydroxyl<br />
Ester, Säurechloride<br />
Keto<br />
Benzyl, Allylhalogenide Benzyl / Allyl<br />
Amino<br />
Phosgen Säurechlorid<br />
O 2<br />
Me<br />
Cl Cl<br />
Me<br />
Ringbildung<br />
Niedrige Konz. < 1%<br />
Me<br />
Cl Cl<br />
Me<br />
+<br />
Kopplung durch SiCl4 - Sternpolymere<br />
Cl<br />
Cl Cl<br />
Cl<br />
+ Si<br />
R Si<br />
Peroxo<br />
Me<br />
Me<br />
Me<br />
Si<br />
Me<br />
Si<br />
Me Me<br />
Me<br />
Si<br />
Me<br />
More resources available at<br />
www.chemistforchrist.de<br />
Me<br />
Si<br />
Me<br />
Cl<br />
z.B. Styrolux (BASF ® )<br />
Bei Dianionen entstehen in diesem Fall Netzwerke, die allerdings nicht in idealer Form<br />
vorliegen, da es wegen anteiliger Ringbildung zur Erniedrigung des Ordnungsgrades<br />
kommt.<br />
- Geringe Schmelzviskosität
<strong>MC</strong> <strong>Handout</strong> 4: Anionische Polymerisation<br />
- Optik<br />
- Schlagzähigkeit / Transport<br />
Propfcopolymerisation von PMMA mit Polystyrol.<br />
Me Me Me<br />
H2 C<br />
H2 C<br />
H2 C + n PS<br />
OMe<br />
O<br />
OMe<br />
O<br />
OMe<br />
O<br />
More resources available at<br />
www.chemistforchrist.de<br />
Me<br />
H 2<br />
C<br />
O<br />
Me<br />
H 2<br />
C<br />
O<br />
Me<br />
PS PS PS<br />
Durch die dynamische Natur der Gleichgewichte kann es also sein, dass eine Kette<br />
spontan das Wachstum einstellt und eine andere, bisher inaktive (weil nicht dissoziierte),<br />
dafür wieder dissoziiert und weiterwächst. Der Kettenabbruch ist aber nur<br />
vorübergehend, denn das inaktive Kettenende kann wieder dissoziieren und hat dann,<br />
sofern noch Monomer vorhanden ist, die gleiche Chance, weiterzuwachsen. Da die<br />
Dissoziation eines jeden inaktiven Kettenendes ganz dem Zufall überlassen ist, werden<br />
alle Ketten, eine genügend lange Polymerisationsdauer vorausgesetzt, gleich lange im<br />
wachstumsfähigen Zustand verweilen. einheitlich lange Makromoleküle. Bei der Living-<br />
Polymerisation ist man in der günstigen Lage, die Polymerisation durch Regulierung des<br />
Monomerzulaufs auf viele Stunden ausdehnen und so das Verhältnis τ / t klein halten zu<br />
können. (τ = Verweilzeit in einem inaktiven Zustand)<br />
Möglichkeiten der anionischen Polymerisation<br />
- Enge MWG Verteilung<br />
Der Polymerisationsgrad der entstehenden Polymeren errechnet sich daher nach:<br />
[Monomer]<br />
P n = .<br />
[Initiator]<br />
- Aktive Kettenenden können als Initiatoren für ein neu hinzugefügtes Monomer<br />
dienen. Blockcopolymere mit gewünschten Blocklängen und sehr enger<br />
Blocklängenverteilung zugänglich.<br />
- Durch Abbruch mit modifizierten Reagenzien lassen sich Makromoleküle mit<br />
speziellen Endgruppen („Telomere“) herstellen. Schließlich sind durch die<br />
Verwendung multifunktioneller anionischer Initiatoren auch ganz spezielle<br />
Makromolekül-Strukturen wie Sternpolymere, Kammpolymere und<br />
Bürstenpolymere, Makrocyclen (Chlorsilane) oder Modellnetzwerke zugänglich.<br />
Nachteil der Anionische Polymerisation<br />
Viele funktionelle Monomere werden beim Einsatz von starken Basen wie BuLi zerstört.<br />
Reaktionsmechanismen<br />
Leitfähigkeitsmessungen haben gezeigt, dass die Dissoziationskonstante für die „livingends“<br />
selbst in polaren Lösungsmitteln nur bei etwa 10 -6 bis 10 -8 Mol/l liegt. Man hat es<br />
also fast ausschließlich mit Ionenpaaren zu tun, die mehr oder weniger stark durch das<br />
Lösungsmittel solvatisiert werden<br />
Praktische Bedeutung besitzen solche bifunktionelle Initiatoren (Styrol + Na-Naphtalin)<br />
bei der Bildung von ABA Blockcopolymeren<br />
PMMA: In unpolaren Lösungsmitteln überwiegt isotaktische Anlagerung, in polaren<br />
Lösungsmitteln die syndiotaktische. Allgemein: dass Faktoren, die eine starke<br />
H 2<br />
C<br />
O
<strong>MC</strong> <strong>Handout</strong> 4: Anionische Polymerisation<br />
Koordination zwischen Anion und Kation begünstigen wie z.B.:kleines Kation, unpolares<br />
Lösungsmittel erhöhen die Taktizität (insebesondere die Isotaktizität )erhöhen<br />
Da die Initiatormenge bei Laboransätzen in der Größenordnung von 10 -3 bis 10 -5 Mol<br />
liegt, kann ein unbeabsichtigter „fahrlässiger“ Abbruch der Polymerisation nur durch<br />
sorgfältige Reinigung der Reaktionsgefäße, der Monomeren, des Lösungsmittels und<br />
unter extremem Ausschluss von Sauerstoff, CO2 und Feuchtigkeit verhindert werden. Das<br />
Befüllen der Apparatur sowie die Polymerisation selbst werden daher stets unter Reinst-<br />
Stickstoff oder Argon durchgeführt.<br />
Nur wenige technische Kunststoffe werden durch anionische Polymerisation hergestellt:<br />
CN<br />
CN<br />
OMe<br />
OMe<br />
CN<br />
O<br />
O<br />
Poly(butadien)<br />
(1,4 cis/trans od. 1,2)<br />
Elastomer,<br />
Reifenherstellung<br />
Poly(isopren)<br />
( 1,4 cis/trans, 1,2 od.<br />
3,4)<br />
Elastomer,<br />
Reifenherstellung<br />
Poly(methylmethacrylat)<br />
PMMA<br />
Plexiglas<br />
Poly(methylcyanacrylat)<br />
Adhäsiv<br />
(Sekundenkleber)<br />
Poly(dicyanacrylat)<br />
Sprühpflaster<br />
POM (Polyoxymethylen) 1959 Dupont<br />
More resources available at<br />
www.chemistforchrist.de<br />
O<br />
H H<br />
O<br />
O<br />
O O<br />
HN<br />
Si<br />
O<br />
O<br />
O<br />
Si<br />
Si<br />
O<br />
Poly(oxymethylen)<br />
POM<br />
Konstruktionswerkstoff<br />
Poly(ethylenoxid)<br />
Verdicker<br />
Poly(oxymethylen)<br />
POM<br />
Technokunsstoff<br />
Poly(ε-caprolactam)<br />
Nylon-6<br />
Fasern, Thermoplaste<br />
Poly(dimethylsiloxan)<br />
Elastomere,<br />
Dichtungsmittel<br />
Synthese durch Anionische Suspensionspolymerisation von Paraformaldehyd und<br />
anschließende Endgruppenstabilisierung z.B. durch Ac2O. Als Suspensionsmittel dienen<br />
aliphatische Kohlenwasserstoffe. Initiatoren z.B. Tributylamin<br />
a) Spaltung des Paraformaldehyds durch Erhitzen.<br />
b)
<strong>MC</strong> <strong>Handout</strong> 4: Anionische Polymerisation<br />
R COO NR 4 + CH 2O<br />
< 0°C<br />
T>T C<br />
O<br />
R O O O O<br />
Endgruppenstabilisierung<br />
O O<br />
Me O<br />
O O<br />
R O O O O<br />
D ~2. Polymere ist hochkristallin, weist daher eine große Härte und Steifigkeit auf.<br />
Polyole<br />
HO OH<br />
HO OH<br />
O<br />
Mit NaOH<br />
O<br />
H 2<br />
KOH<br />
-H 2O<br />
C O<br />
n<br />
Me<br />
+<br />
PUR Chemie<br />
CH 3<br />
H 2<br />
C<br />
NaOH O<br />
HO O<br />
HO OH<br />
H 2<br />
C OH<br />
1-5<br />
N C O<br />
CH 2<br />
Polyamid (1939 IG Farben "Perlon")<br />
K<br />
O<br />
Me<br />
langsam<br />
zugeben<br />
O<br />
O<br />
More resources available at<br />
www.chemistforchrist.de<br />
O<br />
O<br />
Me<br />
H 2<br />
C OH<br />
n<br />
Me<br />
H 2<br />
C O<br />
n<br />
Me<br />
a) VK Verfahren: Geschmolzenes ε−Caprolactam (Tm = 70°C) wird im Rohr mit 0,3-<br />
5% H2O erhitzt, allmählich auf 240°C erwärmt, wobei das H2O abdestilliert wird.<br />
Als Produkt wird geschmolzenens Polymer erhalten. (Tm = 220°C)<br />
b) Alkalische Schnellkondensation:<br />
Geschmolzenes freies Lactam wird mit einem Kat. (p-TsOH) zunächst auf 120°C,<br />
später auf 160-210°C erwärmt. Die Polymerisation wird direkt in der Form<br />
durchgeführt (Guß Polyamid) und dient zur Herstellung technischer Teile. D~2,<br />
Kristallinitätsgrad ca. 30-50% → trübes Material.<br />
Bei der Initiierung entstehen durch Basenzugabe Lactamanionen, die mit cyclischen<br />
Amiden unter Bildung von N-acylierten Lactamringen reagieren.
<strong>MC</strong> <strong>Handout</strong> 4: Anionische Polymerisation<br />
PA-6<br />
H 2<br />
O<br />
Ox. NH 2OH<br />
HN<br />
O<br />
NaH<br />
More resources available at<br />
www.chemistforchrist.de<br />
O R N<br />
Aus dem Mechanismus folgt, dass die Reaktion durch Zusatz von Säurechloriden,<br />
Anhydrden, Isocyanaten beschleunigt werden kann.<br />
Lactonpolymerisation<br />
Erfolgt durch Basenaddition an die C=O Gruppen mit nachfolgender Ringspaltung an der<br />
Esterbindung.<br />
Cyanacrylate<br />
CN<br />
COOR<br />
Lassen sich durch Feuchtigkeitsspuren polymerisieren. Finden Verwendung als LM frei,<br />
kalt und schnellhärtende Einkomponentenklebstoffe, die hochmolekulare Produkte mit<br />
guter Haftung auf Glas, Keramik, Holz, Metall, Gummi und einigen Kunststoffen ergeben.<br />
Sauer reagierende Oberflächen verzögern bzw. verhindern Polymerisation. Cyanacrylate<br />
werden in der Optik und Elektrotechnik, aber auch als Sekundenkleber eingesetzt (Auch<br />
Chirurgie!).<br />
PMMA<br />
Kontrolliert anionische Acrylatpolymerisation<br />
Anionisch Polymerisation an Acrylaten:<br />
Problem:<br />
n-Bu Li<br />
Lösung:<br />
n-Bu Li<br />
n-Bu<br />
MeO<br />
O<br />
- MeO<br />
Ph<br />
Ph<br />
Diphenylethan<br />
Ph<br />
Ph<br />
O<br />
Me<br />
n-Bu<br />
n-Bu<br />
OMe<br />
Micheal-Addition<br />
O<br />
Ph<br />
Ph<br />
Initiator<br />
N<br />
sterisch stark gehindert<br />
O<br />
Me<br />
OMe<br />
O<br />
Me<br />
O<br />
OMe<br />
O<br />
PMMA<br />
PA 6
<strong>MC</strong> <strong>Handout</strong> 4: Anionische Polymerisation<br />
Verhinderung der Nebenreaktion: Addition von Diphenylethan<br />
O<br />
O OR<br />
OR<br />
O<br />
OMe<br />
H<br />
O<br />
OMe<br />
O OR<br />
Diese Reaktionen verhindern lebende PM<br />
Gruppenübertragungspolymerisation (DuPont)<br />
Darstellung lebender Polymerer aus polaren Molekülen (Acryl und Methacrylsäuren). Die<br />
Reaktion ist eine Micheal-Addition einer Organosilicium Verbindung an α,β-ungesättigte<br />
Ester, Ketone, Nitrile und Carboxamide. Das Kettenwachstum verläuft über eine<br />
Übertragungsreaktion der Silylgruppe vom Silylketenacetal-Katalysator auf das<br />
Monomere unter Bildung eines neuen Ketenacetals die wiederholte Addition führt zu<br />
lebender Polymerisation. Allerdings ist die GTP keine echte lebende PM, da Cyclisierung<br />
als langsame Abbruchreaktion eintritt. Cokatalysator: Anionische Spezies oder LS.<br />
Monomere, die protischen Wasserstoff enthalten (z.B. Säuren) sind für die GTP<br />
ungeeignet. GTP eignet sich zur Darstellung von Blockcopolymeren, z.B. unter<br />
Verwendung von MMA (Methylmethacrylat) oder BMA (ButylMA). Die Blocklänge lässt<br />
sich durch Variation des Monomer / Initiator Verhältnisses kontrollieren.<br />
OMe<br />
OTMS<br />
MMA<br />
(PMMA)<br />
OMe<br />
OTMS<br />
More resources available at<br />
www.chemistforchrist.de<br />
O<br />
BMA<br />
H<br />
(PMMA)<br />
Initiator der Polymerisation ist z.B. Dimethylketentrimethylsilylacetal.<br />
Die GTP ist eine Quasilebende PM (Abbruch nur durch Ringbildung)<br />
a) Initiierung:<br />
- Initiator: Silylketenacetal<br />
OMe<br />
O<br />
- Oder mit TMS-Cl<br />
H<br />
O<br />
O<br />
b) Kettenstart<br />
BuLi<br />
HN(SiMe 3) 2<br />
macht eigentlich nur LHMDS<br />
sterisch stärker behindert<br />
LDA<br />
O<br />
O<br />
OMe<br />
OTMS<br />
O<br />
O<br />
TMS-Cl<br />
(PBMA)<br />
OMe<br />
O TMS<br />
O<br />
OTMS<br />
Dimethylketen-trimethylsilylacetal
<strong>MC</strong> <strong>Handout</strong> 4: Anionische Polymerisation<br />
R OMe Nu- Me<br />
Kat.<br />
OTMS<br />
Cokat.,<br />
eventuell<br />
noch LS<br />
- - -<br />
Nu = HF2 , CN , Me3SiF 2<br />
LS = Zn-halogenide, AlR2Cl R<br />
Me<br />
OMe<br />
Nu<br />
O Si<br />
Me<br />
Me<br />
- MMA<br />
Die Reaktion ist eine Micheal Addition einer Organosilicium<br />
Verbindung an α, β ungesättigte Ester, Ketone, Nitrile und<br />
Carboxamide.<br />
Aus dem Silylenolether wird mit Hilfe des Cokat (z.B. F - )<br />
zu einem kleinen Anteil das Enolat gebildet, welches weit<br />
aus Reaktiver ist als der Silylenolether. Dieser reagiert dann<br />
weiter.<br />
TIEKE:<br />
Konzertiert<br />
R<br />
Me<br />
OMe<br />
O<br />
O<br />
Si<br />
OMe<br />
Nu -<br />
Me<br />
Me<br />
Me<br />
R<br />
Me<br />
Me<br />
OMe<br />
More resources available at<br />
www.chemistforchrist.de<br />
O<br />
O<br />
OMe<br />
Nu -<br />
Si<br />
Me<br />
R<br />
Me<br />
Me<br />
Me<br />
R<br />
OMe<br />
O<br />
-NuSi(Me) 3<br />
+NuSi(Me) 3<br />
Nicht wirklich lebend, trotzdem enge Molmassenverteilung → Grund: Die<br />
Geschwindigkeitskonstante zur schlafenden Spezies ist sehr viel größer, als die<br />
Geschwindigkeit der Polymerisation. Somit ist die Konz der aktiven Spezies sehr gering.<br />
Schnelles GG zwischen Silylketenacetal und Enolat verhindert Enolat-Nebenreaktionen.<br />
Bildung von Blockcopolymeren hängt von der Additiionsgeschwindigkeit des zweiten<br />
Monomers und der Polymerisationsgeschwindigkeit ab. Die Blocklänge lässt sich durch<br />
Variation des molaren Monmer Initiator-Verhältnisses kontrollieren. Die Reaktion ist sehr<br />
empfindlich gegenüber Verunreinigungen, so dass alle Reagentien und LM sehr trocken<br />
sein müssen.<br />
Blockcopolymere:<br />
z.B MMA (Methylmethacrylat) und BMA(Butylmethacrylat)<br />
Auch die Bildung telechelischer Polymerer ist möglich, durch Zugabe von TBAF (Bu4NF)<br />
kann TMS schrittweise entfernt werden und man erhält ein Hydroxyendgruppe.<br />
Telechele sind definiert als Polymere mit niedriger Molmasse (Mn < 20 000 g/mol) die<br />
funktionelle Endgruppen tragen welche zum Aufbau von Blockcopolymerisationen und<br />
Netzwerken genutzt werden können.<br />
Anionische PM in der Technik:<br />
SB, SBS, SEBS, Styrolux, Styroflex<br />
Me<br />
Nu -<br />
Si<br />
Me<br />
Me<br />
Me<br />
OMe<br />
O<br />
O<br />
OMe
<strong>MC</strong> <strong>Handout</strong> 4: Anionische Polymerisation<br />
BuLi<br />
PS<br />
PS-b-BR<br />
"tapered" = Spitz zu laufen<br />
7 Kationische Polymerisation<br />
Kationische Polymerisationen sind Kettenreaktionen. Die Polymerisation erfolgt in den<br />
drei Schritten Initiierung, Wachstum und Abbruch. Die Reaktion kann als kationische<br />
Vinylpolymerisation oder kationische ringöffnende Polymerisation erfolgen.<br />
Carbenium Ion Oxonium Ion<br />
Kinetik der kationischen Polymerisation<br />
Initiatoren:<br />
O<br />
Starke Protonensäuren: HClO4, CF3SO3H,....<br />
Lewis Säuren: AlCl3, SnCl4, BF3, FeCl3, SnBr4 (AlCl3 → AlCl4 - AlCl2 + )<br />
Alkylhalogenide + LS: R-Cl + BF3 → R + [ClBF3] -<br />
Alkohole (H2O) + LS: R-OH + BF3 → R + [ROBF3] -<br />
Carbenium Ionen Ph3C + BF4 - , R3S + X - , ArN2 + X -<br />
Fotoinitiatoren: Ph3S + BF4 - → Ph . + Ph2S + HF +..<br />
Fe PF 6<br />
O<br />
hν<br />
O<br />
Fe<br />
O O<br />
PF 6<br />
Initiation<br />
Reaktionsgeschwindigkeit und Mechanismus hängen von der Polarität des LM und der<br />
Natur des Gegenions ab. In polaren L.M. liegt der Initiator in der dissoziierten Form als<br />
freie Ionen, in unpolaren LM undissoziiert, d.h. kovalent vor. Mit der Polarität des LM<br />
nimmt auch die Reaktionsgeschwindigkeit zu.<br />
M A M A M + A<br />
kovalente<br />
Bindung<br />
LM separiertes<br />
Ionenpaar<br />
Polarität des LM nimmt zu<br />
Wachstum<br />
freie Ionen<br />
More resources available at<br />
www.chemistforchrist.de<br />
.......<br />
Mechanismus ist abhängig vom Gegenion, LM, T und Art des Monomeren.<br />
Wachstumsrate: - d[M]<br />
dt<br />
=<br />
k i k p<br />
k t<br />
[HX] [M] 2
<strong>MC</strong> <strong>Handout</strong> 4: Anionische Polymerisation<br />
D.h die Reaktion ist 2. Ordnung bzgl. der Monomerkonzentraion in Abweichung von der<br />
radikaliscchen Additionspolymerisation<br />
Generell erfolgt bei der kationischen Polymerisation die Monomeraddition langsamer als<br />
bei der radikalischen. Es sind aber mehr wachsende Ketten zugegen, so dass die<br />
Reaktion insgesamt schneller erfolgt.<br />
Abbruch<br />
Kettenabbruch kann erfolgen durch:<br />
a) Spontane Zersetzung des Carbeniumions (d.h. Reversion des Initiationsschrittes<br />
oder Reaktion mit dem korrespondierenden Anion).<br />
b) Kettenübertragung durch<br />
- Abgabe eines Protons von dem Carbenium Ion<br />
- Abstraktion eines Cl - von einem anderen Molekül (z.B. LM CCl4)<br />
- Abstraktion eines "lose" (d.h z.B. tertiär gebundenen) Hydrids.<br />
Polymerisationsgrad<br />
Da Rekombination bei der kationischen Polymerisation nicht möglich ist, ist der<br />
Polymerisationsgrad DP gleich der kinetischen Kettenlänge n. DP ist dann einfach der<br />
Quotient aus Wachstums / Initiierungsrate bzw. Wachstums / Abbruchrate, bei Gültigkeit<br />
des stationären Zustands. DP ist sowohl beim spontanen Abbruch, als auch beim Abbruch<br />
durch Kettenübertragung unabhängig von [I], bei Kettenübertragung ist DP sogar<br />
unabhängig von allen Konzentrationen.<br />
Mit stabilen Anionen wie z.B. SbCl6 - , PF6 - lassen sich lebende PM einleiten. Allerdings sehr<br />
schwierig-wird kaum praktiziert.<br />
Temperatureinflüsse auf die Reaktionsgeschwindigkeit<br />
Wieder lässt sich die Temperaturabhängigkeit der Geschwindigkeitskonstanten von<br />
Initiierung, Wachstum und Abbruch durch Arrhenius beschreiben. Da EP <br />
Ep sind, nimmt der Polymerisationsgrad mit zunehmender Temperatur ab.<br />
Stereospezifische kationische Polymerisationen<br />
Bei der kationischen Polymerisation von Isobutylvinylether mit BF3-Etherat wird<br />
hauptsächlich isotaktisches Polymer produiert. Gründe für die stereospezifische<br />
Verknüpfung:<br />
a) Die sterische Abschirmung einer Seite der C=C Dobi.<br />
b) Die Existenz eines zyklischen ÜZ, der als Templat für das angreifende Monomer<br />
wirkt.<br />
Stereospezifische kationische Polymerisationen<br />
Z.B. Polymerisation von MMA mit BuLi. Bei entsprechend polarem LM wird der Initiator<br />
stärker dissoziiert und die Polymerisation löuft anionisch. Dies führt zu ähnlichen<br />
Bedingungen, die denen der freien radikalischen Polymerisation ähneln und bei denen<br />
syndiotaktische Verknüpfungen bei tiefer Temperatur begünstigt sind.<br />
Allgemein gilt:<br />
- Tiefe Temperaturen fördern Stereoregularität<br />
- Der Initiator kann die Stereoregularität beeinflussen<br />
- Die Polarität des LM beeinflusst die Taktizität<br />
Monomere<br />
Die Bereitschaft zur Polymerisation hängt ab von der:<br />
More resources available at<br />
www.chemistforchrist.de
<strong>MC</strong> <strong>Handout</strong> 4: Anionische Polymerisation<br />
a) Um positive Ladung tragen zu können, benötigt es Monomere mit<br />
elektronenreichen Doppelbindungen.<br />
b) Stabilität des gebildeten Carbenium Ions.<br />
Beides wird begünstigt, durch die Gegenwart von Substituenten mit +I / +M<br />
Effekt.<br />
O<br />
OR<br />
O<br />
O<br />
O<br />
O<br />
POM (Polyoxymethylen) – Trioxan Polymerisation<br />
CO + H 2<br />
Synthesegas<br />
R<br />
+<br />
O<br />
O<br />
O<br />
CH 2=O<br />
aber auch Supersäure möglich:<br />
- +<br />
BF3 + H2 HBF3 + H<br />
R<br />
O<br />
O<br />
O<br />
O<br />
Me<br />
Me<br />
O<br />
O<br />
More resources available at<br />
www.chemistforchrist.de<br />
N<br />
O<br />
Trioxan<br />
O<br />
O<br />
O<br />
R<br />
H<br />
Ph<br />
O<br />
O O<br />
O<br />
O<br />
O<br />
O O O OH<br />
O O O OH 2 O O O Depolymerisation<br />
Problem ist beim POM, dass die Kette depolymerisieren kann (thermodynamischer Effekt)<br />
Um dies zu vermeiden, werden die OH-Endgruppen mit Ac2O blockiert. Geht nur mit<br />
Anhydrit, Carbonsäure würde Depolymerisation beschleungigen.<br />
O O<br />
O O O OH<br />
Me O<br />
Ac 2O<br />
THF (Tetrahydrofuran) kann Analog polymerisieren<br />
Me<br />
O O O O<br />
T m = 185°C<br />
90% Kristallin<br />
Der Startschritt ist beim THF stark behindert, daher setzt man Beschleuniger wie<br />
Ethylenoxid ein, die leichter Oxoniumionen bilden. Abbruch erfolgt in der Regel durch<br />
Kettenübertragung, z.B. durch Reaktion des Carbenium Ions mit H2O.<br />
Technische Anwendung<br />
O<br />
Me
<strong>MC</strong> <strong>Handout</strong> 4: Anionische Polymerisation<br />
Die kationsiche Polymerisation findet nur in vergleichsweise geringem Maße technische<br />
Anwendung. Z.B. bei der Polymerisation von Isobutylen mit AlCl3.<br />
Inifer-Methode:<br />
Übertragung zum Initiator, bei der Intiator gleichzeitig initiiert und transferiert.<br />
Initiatoren sind hier Salze R[BCl4] aus BCl3 und RCl.<br />
R [BCl 4] + n<br />
LM: ChCl 3 oder Ethen<br />
CH3 H2 C C Cl<br />
CH 3<br />
More resources available at<br />
www.chemistforchrist.de<br />
CH3 H2 C C<br />
CH 3<br />
BCl 3<br />
[BCl 4]<br />
überschüssiges<br />
RX<br />
R [BCl 4]<br />
Wachstum der Makrokationen wird durch Gegenion beendet. Entstehendes BCl3 wird<br />
durch überschüssiges RCl zu R + [BCl4] - komplexiert, das neue Kette startet. Methode<br />
eignet sich besonders für Isobuten, da hier die Makrokationen unterhalb 0°C praktisch<br />
werder Abbruch noch Übertragung aufweisen.<br />
Vorteile:<br />
- Über LM lässt sich Reaktivität steuern<br />
- Gute Stereoregularität der Produkte<br />
- Schnelles GG<br />
- Kontrollierte lebende Polymerisation<br />
- Reversible Abbruchreaktionen<br />
Nachteile:<br />
- Empfindlichkeit gegenüber H2O Spuren und anderen Verunreinigungen.<br />
Machen Anwendung von Vakuum und Inertgas notwendig.<br />
- Außerdem sind tiefe Temperaturen zum Erhalt hoher Molekulargewichte<br />
nötig → teuer!!