Die Boltzmann Verteilung
Die Boltzmann Verteilung
Die Boltzmann Verteilung
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
<strong>Die</strong> <strong>Boltzmann</strong> <strong>Verteilung</strong><br />
Bisher: <strong>Die</strong> mittlere molare thermische Energie pro Freiheitsgrad steigt mit zunehmender<br />
R⋅T Temperatur an: E = (1)<br />
therm 2<br />
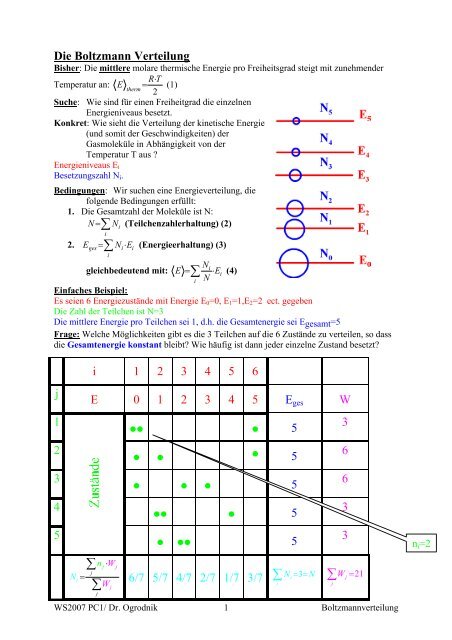
Suche: Wie sind für einen Freiheitgrad die einzelnen<br />
Energieniveaus besetzt.<br />
Konkret: Wie sieht die <strong>Verteilung</strong> der kinetische Energie<br />
(und somit der Geschwindigkeiten) der<br />
Gasmoleküle in Abhängigkeit von der<br />
Temperatur T aus ?<br />
Energieniveaus Ei<br />
Besetzungszahl Ni.<br />
Bedingungen: Wir suchen eine Energieverteilung, die<br />
folgende Bedingungen erfüllt:<br />
1. <strong>Die</strong> Gesamtzahl der Moleküle ist N:<br />
N=∑ Ni(Teilchenzahlerhaltung)<br />
(2)<br />
i<br />
2. Eges = ∑ Ni⋅Ei(Energieerhaltung) (3)<br />
i<br />
Ni<br />
gleichbedeutend mit: E = ∑ ⋅Ei(4)<br />
i N<br />
Einfaches Beispiel:<br />
Es seien 6 Energiezustände mit Energie E0=0, E1=1,E2=2 ect. gegeben<br />
<strong>Die</strong> Zahl der Teilchen ist N=3<br />
<strong>Die</strong> mittlere Energie pro Teilchen sei 1, d.h. die Gesamtenergie sei Egesamt=5<br />
Frage: Welche Möglichkeiten gibt es die 3 Teilchen auf die 6 Zustände zu verteilen, so dass<br />
die Gesamtenergie konstant bleibt? Wie häufig ist dann jeder einzelne Zustand besetzt?<br />
j<br />
1<br />
2<br />
3<br />
4<br />
5<br />
N<br />
i<br />
=<br />
i 1 2 3 4 5 6<br />
E 0 1 2 3 4 5 Eges W<br />
∑<br />
n ⋅W<br />
•• • 5<br />
• • • 5<br />
• • • 5<br />
•• • 5<br />
• •• 5<br />
j<br />
j<br />
∑ Wj<br />
j<br />
j<br />
6/7 5/7 4/7 2/7 1/7 3/7 ∑<br />
i<br />
i 3<br />
N = = N<br />
WS2007 PC1/ Dr. Ogrodnik 1 <strong>Boltzmann</strong>verteilung<br />
∑<br />
j<br />
3<br />
6<br />
6<br />
3<br />
3<br />
W = 21<br />
j<br />
nj=2
INFOBOX: Wahrscheinlichkeitsrechnung (Kombinatorik):<br />
Wieviele Realisierungsmöglichkeiten W gibt es, jeweils die drei unterscheidbaren<br />
Teilchen auf N Zellen einer Zeile (Zeilenummer j) der obigen Tabelle zu verteilen?<br />
2. Zeile (j=2): <strong>Die</strong> möglichen Reihenfolgen mit der drei Teilchen angeordenet werden<br />
kann=Zahl der Permutationen = 3!<br />
<br />
<br />
<br />
<br />
<br />
<br />
Analog ist die 3. Zeile zu behandeln<br />
1. Zeile (j=1): Es gibt drei Möglichkeiten die drei Moleküle anzuordnen<br />
(die Reihenfolge innerhalb einer Zelle spielt keine Rolle, denn es kommt nur auf die<br />
Tatsache an, dass das eine oder andere Teilchen eine bestimmte Energie hat, nicht aber in<br />
welcher Reihenfolge wir die Teilchen gleicher Energie notiert haben )<br />
Zahl aller Permutationsmöglichkeiten N !<br />
=<br />
Zahl Permutationsmöglichkeiten n ! innerhalb jeder Zelle n !<br />
<br />
<br />
<br />
n1!=2!=2 n3!=0!=1 n5!=1!=1<br />
Analog Zeile 4 und 5.<br />
i<br />
3x2=6 Möglichkeiten<br />
= Zahl der<br />
Permutationsmöglichkeiten<br />
W2=N!<br />
Um die gesamte <strong>Verteilung</strong> zu erhalten, muss man nun "lediglich" die Zahl der Teilchen in<br />
den Zellen der ersten Spalte jeweils mit der Zahl der Realisierungsmöglichkeiten Wj<br />
multiplizieren und zusammenaddieren, dann die Zahl aller Teilchen in der 2. Spalte mit Wi<br />
gewichten und so fort.<br />
WS2007 PC1/ Dr. Ogrodnik 2 <strong>Boltzmann</strong>verteilung<br />
∑<br />
i<br />
i<br />
3 Möglichkeiten<br />
N !<br />
W1<br />
=<br />
n ! ⋅n ! ⋅n<br />
!:.... ⋅n<br />
!<br />
=<br />
1<br />
N !<br />
n !<br />
∏<br />
i<br />
i<br />
2 3<br />
3! 6<br />
= = = 3<br />
2!0!0!0!0!1 ⋅ ⋅ ⋅ ⋅ ! 2<br />
m
Für obiges Beispiel erhalten wir:<br />
1. Spalte (Energie 0): 2. Spalte (Energie 1):<br />
2⋅ W = 2⋅ 3<br />
1<br />
1⋅ W = 6<br />
2<br />
1⋅ W = 6<br />
0<br />
0<br />
∑<br />
2<br />
= 6+ 6+ 6+ 0+ 0= 18<br />
<strong>Die</strong>se Besetzungswahrscheinlichkeit kann noch auf die Gesamtzahl der<br />
Realisationsmöglichkeiten ∑ Wj<br />
normiert werden und ist in der letzten Zeile<br />
j<br />
0<br />
1⋅ W = 6<br />
zusammengetragen.<br />
Wir bekommen folgende Besetzungswahrscheinlichkeit als Funktion der Energie:<br />
Suche nach der am häufigsten vorkommenden Anordnung<br />
Natürlich ist die Statistik dieser <strong>Verteilung</strong> von nur 3 Teilchen noch sehr schlecht. Bei einer<br />
sehr großen Zahl von Teilchen (10 23 !) wird diese extrem genau. Andererseits ist es nicht<br />
möglich, wie oben, alle denkbaren Kombinationen durchzuspielen.<br />
Ansatz: Da hilft uns folgende Überlegung weiter: Es gibt viele Anordnungsmuster, die sich<br />
sehr ähnlich sind und sehr häufig vorkommen (viele Permutationsmöglichkeiten haben).<br />
Als Gegenbeispiel betrachten wir den extrem unwahrscheinlichen Fall, dass ein Teilchen die<br />
gesamte Energie trägt, und alle anderen 10 23 Teilchen keine kinetische Energie haben (erste<br />
Zeile in der Tabelle: ein Teilchen ist im letzten rechten Kasten, alle anderen sind im ersten<br />
N !<br />
linken Kasten). Für diesen Fall ist W1= = N<br />
( N −1!<br />
)<br />
Der andere Extremfall wäre wenn jeder Zustand nur einfach besetzt wäre. Da gilt: W2 = N!<br />
WS2007 PC1/ Dr. Ogrodnik 3 <strong>Boltzmann</strong>verteilung<br />
2<br />
0<br />
2⋅ W = 2⋅ 3<br />
1<br />
1⋅ W = 6<br />
∑<br />
2<br />
= 0+ 6+ 0+ 6+ 6= 18
W N !<br />
= = − 1! wahrscheinlicher!!!<br />
W1N Gehen wir vom zweiten Fall aus und besetzen nur eine Zelle doppelt, so erhalten wir:<br />
N !<br />
W 3=<br />
2!<br />
2<br />
Der zweite Fall wäre um den Faktor ( N )<br />
Suche nach dem maximalen W<br />
Es stellt sich heraus, dass es bei sehr großen Zahlen genügt, das <strong>Verteilung</strong>smuster mit den<br />
meisten Permutation zu finden, ( das wäre die am häufigsten vorkommende Zeile in obiger<br />
Tabelle). Sie ist representativ für die gesamte <strong>Verteilung</strong> (die übrigen <strong>Verteilung</strong>smuster sind<br />
entweder sehr ähnlich, und damit ebenfalls sehr häufig, oder unterschieden sich signifikant<br />
und kommen dann sehr selten vor, und tragen zur <strong>Verteilung</strong> praktisch nicht bei).<br />
Wir wollen also die Anordnung finden, für die Zahl der Permutationsmöglichkeiten W<br />
maximal wird.<br />
N !<br />
Wir gehen aus von: W =<br />
∏ Ni<br />
!<br />
i<br />
(5).<br />
Bei den großen Werten von N und Ni mit denen wir es zu tun haben, ist es nützlich den<br />
Logarithmus von (5) zu nehmen, und davon das Maximum zu suchen:<br />
⎛ ⎞<br />
ln( W) = ln( N!) − ln ⎜∏ Ni! ⎟=<br />
ln( N!) −∑ln<br />
( Ni!<br />
) (6)<br />
⎝ i ⎠<br />
i<br />
Das maximale W bzw. das maximale ln(W) finden wir, wenn die Ableitung von W nach einer<br />
kleinern Veränderung der <strong>Verteilung</strong> gleich Null wird. Da ln(W) eine Funktion vieler<br />
Variabler Ni ist betrachten wir das vollständige Differenzial<br />
( W) ( W)<br />
∂ln d ln ( W ) =<br />
∂N1 ∂ln<br />
⋅ dN1+ ∂N2<br />
⋅ dN2+<br />
....... und setzen dies gleich Null.<br />
∂ ln( N !) ⎛∂ln( N !) ⎞!<br />
i<br />
Aus (6) erhalten wir somit: d ln( W ) = dN + ∑⎜<br />
⋅ dNi<br />
⎟=<br />
0 (7)<br />
∂N i ⎝ ∂Ni⎠<br />
dN=<br />
0<br />
da N konst.!<br />
Mit der Stirling´schen Formel ln( x!) ≈x⋅ln( x) − x (für große x) können wir uns der<br />
mathematisch unhandlichen Fakultäten entledigen und erhalten für (7):<br />
∂{ Ni⋅ln( Ni) −Ni}<br />
dln( W) = ∑ ⋅ dNi=<br />
0 (8)<br />
i ∂Ni<br />
Wir können nun die einzelnen Therme der Summe in (8) ableiten:<br />
⎡∂{ Ni⋅ln( Ni) } ∂{<br />
Ni}<br />
⎤ ⎧<br />
⎢ − ⎥dNi=<br />
⎨ln( Ni) ⎣ ∂Ni ∂Ni ⎦ ⎩<br />
∂N ln( ) 1<br />
i ∂ Ni<br />
⋅ ln( Ni) + Ni⋅<br />
∂Ni ∂Ni<br />
<br />
1<br />
Ni<br />
und erhalten somit für (8):<br />
∑ ln( Ni) ⋅ dNi=<br />
0 (10)<br />
i<br />
1 ⎫<br />
+ Ni⋅ −1⎬dNi<br />
(9)<br />
Ni<br />
⎭<br />
0<br />
Wir können nun auch die Bedingung 1 und 2 in differentieller Form fassen:<br />
WS2007 PC1/ Dr. Ogrodnik 4 <strong>Boltzmann</strong>verteilung
<strong>Die</strong> Teilchenzahlerhaltung (2) N = ∑ Ni = konst!<br />
ist gleichbedeutend mit: 0<br />
i<br />
∑ dN i = 0 (11)<br />
i<br />
∑ ⇒ dE = 0⇒<br />
Ebenso die Energieerhaltung: (3) E = N ⋅ E = konst!<br />
ges i i<br />
i<br />
(Beachte: da die Zustandsenergien fest sind dE i = 0)⇒<br />
∑ dNi⋅ Ei=<br />
0 (12)<br />
i<br />
dN = ⇒<br />
Es müssen nun alle drei Bedingungen (10), (11) und (12) gleichzeitig erfüllt werden.<br />
„Methode der unbestimmten Lagrange´schen Multiplikatoren“<br />
Mit dieser Methode kann die gleichzeitige Erfüllung von mehreren unabhängigen<br />
Bedingungen mathematisch gewährleistet werden. Nach dieser Methode werden obige<br />
Zusatzbedingungen (10) und (11) mit vorerst unbekannten Faktor α bzw. β (das sind die<br />
Lagrange´schen Multiplikatoren) multipliziert und anschließend zu Bedingung (12) addiert:<br />
α⋅ 0+ β⋅ 0+ 0= α⋅ dN + β⋅<br />
dN ⋅ E + ln( N ) ⋅ dN = 0<br />
∑ ∑ ∑ oder:<br />
i i i i i<br />
i i i<br />
∑ { α+ β⋅ Ei+ ln( Ni) } ⋅ δNi=<br />
0 (13)<br />
i<br />
Einschub: Zum „Beweis“ sei hier ein einfaches Beispiel gerechnet:<br />
Ges.: Welches Rechteck ergibt bei konstant gehaltenem Umfang die größte Fläche?<br />
Ansatz: Fläche: A= xy ⋅ (14)<br />
Umfang: U= 2x+ 2y<br />
(15)<br />
Wir suchen das Maximum von A ⇒ δ A= x⋅ δ y+ y⋅ δx=<br />
0 (16)<br />
Umfang konstant ⇒ δU= 2δx+ 2δ y=<br />
0 (17)<br />
Mit dem unbestimmten Multiplikator α fassen wir (16) und (17) zusammen:<br />
δA+ α⋅ δU= x⋅ δ y+ y⋅ δx+ α⋅ 2δx+ 2δ y = 0<br />
( )<br />
δx und δy Terme zusammengefasst: ( ) ( )<br />
y+ 2α ⋅ δx+ x+ 2α δ y=<br />
0 (18)<br />
Wir betrachten x und y als Größen die unabhängig voneinander variiert werden.<br />
Dann ist (18) nur dann erfüllt, wenn beide Terme unabhängig Null sind, d.h. wenn<br />
( y+ 2α) = 0 und ( x+ 2α) = 0.<br />
Daraus folgt unmittelbar: x=y.<br />
Ergebnis: Ein Quadrat hat bei vorgegebenem Umfang die größte Fläche.<br />
Auf Gleichung (13) angewandt bedeutet dies, dass jeder der Summenterme unabhängig Null<br />
sein muss:<br />
α + β ⋅ Ei+ ln( Ni)<br />
für alle Werte von i.<br />
Nach Ni aufgelöst erhält man:<br />
Ei<br />
Nie e β α − ⋅ −<br />
= ⋅ (19)<br />
Ni<br />
Man kann nun (19) in (4): E = ∑ ⋅Eieinsetzen<br />
und die mittlere Energie berechnen, die<br />
i N<br />
R⋅T 1<br />
laut Gl. (1) ergeben muss. Daraus folgt, dass β = (20)<br />
2<br />
R⋅T WS2007 PC1/ Dr. Ogrodnik 5 <strong>Boltzmann</strong>verteilung<br />
ges
Betrachten wir nur das Verhältnis der Besetzungszahlen zweier Energieniveaus Ei und Ei, so<br />
kürzt sich der konstante Faktor e -α heraus und man erhält:<br />
( Ei−Ej) N −<br />
i RT ⋅ = e (21) <strong>Boltzmann</strong>faktor<br />
N<br />
j<br />
Der <strong>Boltzmann</strong>faktor ist ein zentrales Ergebnis der statistischen Thermodynamik und wurde<br />
anhand von puren statistischen Überlegungen abgeleitet.<br />
Der <strong>Boltzmann</strong>faktor gibt das Verhältnis der Besetzungswahrscheinlichkeiten zweier<br />
Zustände unterschiedlicher Energie an. Ist Ei>Ej (der Zustand i liegt oberhalb von j), dann ist<br />
der Quotient Ni/Nj < 1, d.h. der höher gelegene Zustand ist weniger stark besetzt als der<br />
energetisch tiefere.<br />
Fall: T→0: der Exponent geht → -∞, d.h. die e - Funktion geht gegen 0, d.h. der unteres<br />
Zustand ist ausschließlich besetzt.<br />
Fall: T→∞: der Exponent geht → 0, d.h. die e - Funktion geht gegen 1, d.h. beide Zustände<br />
sind im Grenzfall maximal gleich besetzt.<br />
Beachte: Ni ist immer kleiner als Nj. Es gibt im thermischen Gleichgewicht keine sogenannte<br />
Besetzungszahlinversion (Ni>Nj). <strong>Die</strong>se benötigt man z.B. um Laseremission zu erzielen.<br />
<strong>Die</strong> gesamte <strong>Verteilung</strong>sfunktion ergibt sich, wenn man den <strong>Boltzmann</strong>faktor auf die Summe<br />
aller Besetzungszahlen normiert:<br />
Ei<br />
−<br />
RT ⋅ Ni e<br />
i = = E j ∑ N j<br />
−<br />
RT ⋅<br />
j ∑e<br />
j<br />
f<br />
<strong>Boltzmann</strong>verteilung<br />
<strong>Die</strong> Zustandssumme: Der Summenterm im Nenner heißt die molekulare Zustandssumme.<br />
Sie gibt an wie viele Zustände insgesamt bei einer bestimmten Temperatur für ein Molekül<br />
thermisch zugänglich sind. Um sie berechnen zu können muss man die Energien Ej aller<br />
Zustände kennen. <strong>Die</strong> statistische Mechanik beschäftigt sich damit, wie man diese<br />
Zustandssumme für die verschiedenen Freiheitsgrade berechnen kann. Ist die Zustandssumme<br />
einmal ermittelt, dann lassen sich aus ihr alle thermodynamischen Funktionen einfach<br />
berechnen.<br />
WS2007 PC1/ Dr. Ogrodnik 6 <strong>Boltzmann</strong>verteilung