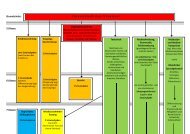
Lehrplan der K12 - Humboldt-gym.de
Lehrplan der K12 - Humboldt-gym.de
Lehrplan der K12 - Humboldt-gym.de
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
Leistungskurs<br />
Jahrgangsstufe 12<br />
Themenbereiche<br />
1. Chemische Analytik<br />
2. Kernchemie<br />
3. Struktur, Reaktivität und Be<strong>de</strong>utung von Kohlenwasserstoffen<br />
4. Der Einfluss funktioneller Gruppen<br />
Hinweise:<br />
1. Für die schriftliche Abiturprüfung sind die rot markierten Themen und Lernziele ausgeschlossen, d.h.<br />
Prüfungsfragen dürfen Kenntnisse zu diesen Themen nicht voraussetzen!<br />
2. Zum Ausdrucken <strong>de</strong>s <strong>Lehrplan</strong>s kann die Datei auch mit "WORD" geöffnet wer<strong>de</strong>n.<br />
1 Chemische Analytik* (ca. 46 Std.)<br />
Aufbauend auf Vorkenntnissen und experimentellen Fähigkeiten aus <strong><strong>de</strong>r</strong> allgemeinen und anorganischen Chemie setzen<br />
sich die Schüler mit <strong>de</strong>n Grundprinzipien wichtiger einfacher Analyseverfahren auseinan<strong><strong>de</strong>r</strong>. Anhand ausgewählter<br />
Beispiele sollen ihnen die große Leistungsfähigkeit und Be<strong>de</strong>utung mo<strong><strong>de</strong>r</strong>ner Nachweismetho<strong>de</strong>n in <strong>de</strong>n verschie<strong>de</strong>nsten<br />
Anwendungsbereichen, z.B. <strong><strong>de</strong>r</strong> Umweltanalytik und <strong><strong>de</strong>r</strong> Medizin <strong>de</strong>utlich wer<strong>de</strong>n.<br />
Die Praktika för<strong><strong>de</strong>r</strong>n dabei nicht nur Selbständigkeit und Eigenverantwortlichkeit im Experimentieren und Auswerten, sie<br />
erziehen auch zu einer kritischen Haltung gegenüber <strong>de</strong>n erzielten Ergebnissen und zur gewissenhaften Analyse<br />
möglicher Fehlerquellen
£<br />
Gaschromatographie<br />
£<br />
Säure<br />
Base<br />
Titration<br />
Aufgabenfeld <strong><strong>de</strong>r</strong> analytischen Chemie<br />
chromatographische Trennverfahren<br />
¡<br />
Grundlagen<br />
Begriffsklärung; Aufzeigen einiger Einsatzbereiche; Hinweis<br />
auf die Leistungsfähigkeit mo<strong><strong>de</strong>r</strong>ner Spurenanalytik<br />
Demonstration von Adsorption und Verteilung; ggf.<br />
Computersimulation zur Veranschaulichung<br />
¢<br />
Dünnschicht o<strong><strong>de</strong>r</strong> Papierchromatographie Durchführen <strong><strong>de</strong>r</strong> Trennung und Auswerten (Rf Wert)<br />
eines einfachen Chromatogramms; Hinweis auf die<br />
¢<br />
I<strong>de</strong>ntifizierung von Substanzen durch Co<br />
Chromatographie<br />
Auswerten eines einfachen Chromatogramms; ggf.<br />
Demonstrationsversuch; Hinweis auf die Be<strong>de</strong>utung, z.B. in<br />
<strong><strong>de</strong>r</strong> Umweltanalytik und Kriminaltechnik<br />
(ca. 7 Std.)<br />
maßanalytische Verfahren<br />
Durchführung und Auswertung von Titrationen<br />
Aufgreifen und<br />
£<br />
Wie<strong><strong>de</strong>r</strong>holen von Grundlagen<br />
£<br />
£<br />
Aufzeigen <strong>de</strong>s Einflusses von Indikatoren auf <strong>de</strong>n Endpunkt;<br />
experimentelle Ermittlung <strong><strong>de</strong>r</strong> Titrationskurve einer starken<br />
und <strong><strong>de</strong>r</strong> einer schwachen einprotonigen Säure; ggf.<br />
Computereinsatz,<br />
(ca. 6 Std.)<br />
Konduktometrie Demonstration <strong><strong>de</strong>r</strong> elektrischen Leitfähigkeit verschie<strong>de</strong>ner<br />
Elektrolytlösungen; Aufzeigen <strong><strong>de</strong>r</strong> Abhängigkeit von Ionenart<br />
und Konzentration; keine Titration von Säuregemischen;<br />
Hinweis auf die Be<strong>de</strong>utung als automatisches Verfahren, z.B.<br />
bei Schadstoffbestimmungen<br />
(ca. 4 Std.)<br />
Redoxtitration: Manganometrie<br />
Reaktionen in saurer Lösung; Vorstellen <strong>de</strong>s Prinzips <strong><strong>de</strong>r</strong><br />
Rücktitration; Hinweis auf Anwendungen, z.B. in <strong><strong>de</strong>r</strong><br />
Wasseranalytik<br />
(ca. 4 Std.)<br />
spektroskopische Verfahren Bewusst machen <strong><strong>de</strong>r</strong> Wechselwirkung zwischen<br />
elektromagnetischer Strahlung und Materie;<br />
Photometrie:<br />
Vorstellen <strong>de</strong>s Funktionsprinzips <strong>de</strong>s Photometers;<br />
Grundlagen Transmission, Extinktion, Lambert Beersches Gesetz;<br />
Durchführung und Auswertung von Messungen Gehaltsbestimmungen, evtl. unter Verwendung von<br />
Eichkurven; ggf. Aufnahme <strong>de</strong>s Absorptionsspektrums einer<br />
Farbstofflösung; Hinweis auf die Be<strong>de</strong>utung <strong>de</strong>s Verfahrens, z.<br />
B. medizinische Diagnostik, Materialprüfung, Wasseranalytik
£<br />
mo<strong><strong>de</strong>r</strong>ne<br />
¡<br />
Isolierung<br />
o<strong><strong>de</strong>r</strong><br />
(ca. 7 Std.)<br />
spektroskopische Metho<strong>de</strong>n:<br />
Atomabsorptions<br />
£<br />
Emissionsspektroskopie Aufzeigen <strong><strong>de</strong>r</strong> Grundlagen; ggf. experimentelle<br />
Demonstration; Hinweis auf die Anwendung in <strong><strong>de</strong>r</strong><br />
Spurenanalyse von Schwermetallen;Ansprechen <strong><strong>de</strong>r</strong><br />
Be<strong>de</strong>utung von NMR o<strong><strong>de</strong>r</strong> IR Spektroskopie an<br />
Beispielen, auch im weiteren Unterricht<br />
(ca. 4 Std.)<br />
Verfahrensschritte zur Bestimmung <strong><strong>de</strong>r</strong><br />
Summenformel organischer Verbindungen<br />
Herausstellen <strong><strong>de</strong>r</strong> Leistungen be<strong>de</strong>uten<strong><strong>de</strong>r</strong> Chemiker<br />
¡<br />
eines Reinstoffs Aufgreifen von Grundwissen zu wichtigen Trenn und<br />
Reinigungsschritten; Durchführen z.B. einer Extraktion,<br />
Destillation<br />
qualitative Elementaranalyse<br />
Durchführen einfacher Nachweisreaktionen für ausgewählte<br />
Elemente in einer organischen Verbindung<br />
(ca. 5 Std.)
¡<br />
Bestimmung<br />
¡<br />
Strahlung<br />
quantitative Elementaranalyse: Prinzip <strong><strong>de</strong>r</strong><br />
Verbrennungsanalyse<br />
¡<br />
Ermitteln <strong>de</strong>s Kohlenstoffgehalts einer Kohlenwasserstoff<br />
¡<br />
verbindung, z.B. nach <strong>de</strong>m Schöniger Verfahren; Berechnen<br />
<strong><strong>de</strong>r</strong> empirischen Formel<br />
(ca. 4 Std.)<br />
¡<br />
<strong><strong>de</strong>r</strong> molaren Masse einer leicht<br />
flüchtigen Verbindung:<br />
Messung <strong><strong>de</strong>r</strong> Luftverdrängung<br />
Ermittlung <strong><strong>de</strong>r</strong> Summenformel aus empirischer<br />
Formel und Molekülmasse<br />
Durchführen eines geeigneten Verfahrens; Auswerten <strong><strong>de</strong>r</strong><br />
Ergebnisse unter Verwendung <strong><strong>de</strong>r</strong> allgemeinen Gasgleichung;<br />
Bewusst machen <strong><strong>de</strong>r</strong> Unterschie<strong>de</strong> zwischen <strong><strong>de</strong>r</strong> historischen<br />
und <strong><strong>de</strong>r</strong> instrumentellen Analytik, z.B. Einsatz <strong>de</strong>s<br />
Massenspektrometers<br />
(ca. 5 Std.)<br />
2 Kernchemie (ca. 40 Std.)<br />
Ausgehend von geschichtlichen Aspekten <strong><strong>de</strong>r</strong> Ent<strong>de</strong>ckung <strong><strong>de</strong>r</strong> natürlichen und künstlichen Kernumwandlung soll <strong>de</strong>n<br />
Schülern die Tragweite <strong><strong>de</strong>r</strong> sich an diese Erkenntnisse knüpfen<strong>de</strong>n Entwicklungen bewußt wer<strong>de</strong>n. Die Schüler erfassen<br />
dabei, dassauch Atomkerne in Abhängigkeit von ihrer Zusammensetzung verän<strong><strong>de</strong>r</strong>lich sein können und dass aufgrund<br />
<strong><strong>de</strong>r</strong> hochenergetischen Reaktionen und <strong><strong>de</strong>r</strong> damit verbun<strong>de</strong>nen Gefahren beson<strong><strong>de</strong>r</strong>e Arbeitstechniken und<br />
Sicherheitsbestimmungen notwendig sind.<br />
Die sich aus Kernspaltung und Kernfusion ergeben<strong>de</strong>n Möglichkeiten <strong><strong>de</strong>r</strong> Energiegewinnung sollen die Schüler auch im<br />
Hinblick auf fächerübergreifen<strong>de</strong> Bezüge wie Verantwortlichkeit in Forschung, Technik und Politik sehen und beurteilen<br />
lernen.<br />
Radioaktivität Aufgreifen und Wie<strong><strong>de</strong>r</strong>holen von Grundkenntnissen;<br />
Darstellen wichtiger Etappen <strong><strong>de</strong>r</strong> Ent<strong>de</strong>ckungsgeschichte<br />
¢<br />
radioaktiver Stoffe: Formulieren <strong><strong>de</strong>r</strong> Vorgänge im Kern durch Kern gleichungen;<br />
Trennung und I<strong>de</strong>ntifizierung von α−, β− und γ−<br />
Strahlung<br />
Nachweis durch Ionisation<br />
Interpretation <strong>de</strong>s Verhaltens im elektrischen Feld, wichtige<br />
Eigenschaften;<br />
Demonstration <strong>de</strong>s Nachweises <strong><strong>de</strong>r</strong> Strahlung radioaktiver<br />
£<br />
Stoffe; Übersicht über das Funktionsprinzip <strong>de</strong>s Geiger<br />
£<br />
Müller Zählrohres, <strong><strong>de</strong>r</strong> Nebelkammer und <strong><strong>de</strong>r</strong> Kernspurplatte<br />
(ca. 6 Std.)<br />
Zerfallsgesetz:<br />
Aktivität (Bq), Halbwertzeit<br />
ggf. Demonstration <strong>de</strong>s zeitlichen Verlaufs einer<br />
Zerfallsreaktion; Ableiten <strong>de</strong>s Zerfallsgesetzes ausgehend von<br />
Messdaten; Bewusst machen <strong><strong>de</strong>r</strong> statistischen Natur <strong>de</strong>s<br />
radioaktiven Zerfalls, ggf. mit Computersimulation
¡<br />
Nutzung<br />
Metho<strong>de</strong>;<br />
£ £<br />
Anwendung zur Altersbestimmung Vorstellen <strong><strong>de</strong>r</strong> C 14 Hinweis auf ihre Be<strong>de</strong>utung<br />
und Grenzen; einfache Rechenbeispiele für die Anwendung<br />
dieser Metho<strong>de</strong><br />
(ca. 5 Std.)<br />
biologische Strahlenwirkung und Strahlenschutz<br />
£<br />
Unterschied Energiedosis (Gy)<br />
(Sv)Strahlenbelastung<br />
Äquivalentdosis<br />
Gegenüberstellen <strong><strong>de</strong>r</strong> natürlich und <strong><strong>de</strong>r</strong> zivilisatorisch<br />
bedingten Strahlenbelastung; Unterschei<strong>de</strong>n zwischen<br />
stochastischen und nicht stochastischen Strahlenschä<strong>de</strong>n;<br />
Ansprechen <strong><strong>de</strong>r</strong> Grenzwertproblematik und <strong><strong>de</strong>r</strong> Überwachung;<br />
bewusst machen, dass zur Klärung bestimmter Fragestellungen<br />
nur bestimmte Messverfahren geeignet sind<br />
(ca. 4 Std.)<br />
natürliche und künstliche Elementumwandlungen<br />
natürliche Zerfallsreihen exemplarische Besprechung einer Zerfallsreihe unter<br />
Mitverwendung <strong><strong>de</strong>r</strong> Nuklidkarte; Ableiten und Anwen<strong>de</strong>n <strong><strong>de</strong>r</strong><br />
Verschiebungssätze<br />
(ca. 3 Std.)<br />
künstliche Elementumwandlungen und<br />
¡<br />
zusätzliche Zerfallsarten:Einfang und<br />
Austauschreaktionen<br />
¡<br />
Hinweis auf historische Versuche mit α Teilchen und die<br />
Ent<strong>de</strong>ckung von Neutron und Positron; Hinweis auf die<br />
¡<br />
Be<strong>de</strong>utung von Teilchen beschleunigern<br />
künstlicher Radioisotope Berichten über <strong>de</strong>n Einsatz in Medizin, Forschung und<br />
Technik, z.B. Diagnostik, Therapie, Isotopenmarkierung,<br />
Materialprüfung<br />
(ca. 6 Std.)<br />
Grundlagen <strong><strong>de</strong>r</strong> Kernenergietechnik<br />
Massen<strong>de</strong>fekt und Kernbindungsenergie:<br />
Äquivalenz von Masse und Energie<br />
Bewusstmachen <strong>de</strong>s Phänomens; Berechnungen; Begrün<strong>de</strong>n<br />
<strong><strong>de</strong>r</strong> Möglichkeit <strong>de</strong>s Energiegewinns durch Spaltung bzw.<br />
Fusion aus <strong><strong>de</strong>r</strong> Kernbindungsenergiekurve<br />
(ca. 4 Std.)<br />
Energiegewinnung durch Kernspaltung<br />
Hinweis auf die Ent<strong>de</strong>ckung <strong><strong>de</strong>r</strong> Kernspaltung;<br />
Kettenreaktion<br />
Ansprechen wesentlicher. Voraussetzungen für <strong>de</strong>n Eintritt<br />
einer Kettenreaktion; Erläutern <strong>de</strong>s Prinzips <strong><strong>de</strong>r</strong> Steuerung;
Spaltungsreaktor<br />
Erklären <strong>de</strong>s Funktionsprinzips am Beispiel eines mo<strong><strong>de</strong>r</strong>nen<br />
Reaktortyps;<br />
Brennstoffkreislauf Überblick über wichtige Etappen: Anreicherung,<br />
Wie<strong><strong>de</strong>r</strong>aufarbeitung und Endlagerung sowie ihre Problematik;<br />
Diskussion aktueller technischer, ökologischer und politischer<br />
Aspekte <strong><strong>de</strong>r</strong> Nutzung <strong><strong>de</strong>r</strong> Kernspaltung<br />
(ca. 9 Std.)<br />
Energiegewinnung durch Kernfusion<br />
Herausstellen <strong>de</strong>s Plasmazustands als Voraussetzung für die<br />
Fusion leichter Atomkerne; Formulieren <strong><strong>de</strong>r</strong> Schritte <strong><strong>de</strong>r</strong> D T<br />
Fusion; Ausblick auf Möglichkeiten <strong><strong>de</strong>r</strong> technischen Nutzung<br />
(ca. 3 Std.)<br />
3 Struktur, Reaktivität und Be<strong>de</strong>utung von Kohlenwasserstoffen (ca.40 Std.)<br />
¡<br />
Die Schüler erkennen, dassdie Vielfalt <strong><strong>de</strong>r</strong> Kohlenwasserstoffverbindungen auf die unter schiedlichen<br />
Bindungsverhältnisse in ihren Molekülen zurückgeführt wer<strong>de</strong>n kann. Mit <strong><strong>de</strong>r</strong> Einführung <strong>de</strong>s Orbitalmo<strong>de</strong>lls<br />
und seiner Anwendung zur bildhaften Beschreibung von Molekülstrukturen wer<strong>de</strong>n einerseits Grundlagen für<br />
die immer wie<strong><strong>de</strong>r</strong>kehren<strong>de</strong> Erörterung <strong>de</strong>s Zusammenhangs von Eigenschaften und Struktur organischer<br />
Verbindungen geschaffen, an<strong><strong>de</strong>r</strong>erseits Hilfsfunktion und Grenzen von Mo<strong>de</strong>llvorstellungen exemplarisch<br />
ver<strong>de</strong>utlicht.<br />
An ausgewählten Beispielen gewinnen die Schüler eine Vorstellung von <strong><strong>de</strong>r</strong> Be<strong>de</strong>utung verschie<strong>de</strong>ner<br />
Verbindungen in Technik und Alltag, wobei auch ersichtlich wird, in welchem Umfang unsere Wirtschaft heute<br />
auf Erdöl, Erdgas und Kohle aufbaut. Vor <strong>de</strong>m Hintergrund <strong><strong>de</strong>r</strong> Gefahren, die vom Einsatz bestimmter<br />
Kohlenwasserstoffe und Halogen<strong><strong>de</strong>r</strong>ivate für Gesundheit und Umwelt ausgehen, soll <strong>de</strong>n Schülern die<br />
gemeinsame wie die eigene Verantwortung bewusst wer<strong>de</strong>n.<br />
Begriff "organische Chemie"<br />
gesättigte aliphatische und zyklische<br />
Kohlenwasserstoffe<br />
Reaktionsverhalten:<br />
Brennbarkeit, Halogenierung<br />
Aufzeigen <strong><strong>de</strong>r</strong> historischen und mo<strong><strong>de</strong>r</strong>nen Abgrenzung<br />
zur anorganischen Chemie; experimentelle<br />
Demonstration von Kennzeichen organischer<br />
Verbindungen<br />
Vorstellen ausgewählter Verbindungen und ihrer<br />
Be<strong>de</strong>utung, z.B. als Flüssiggas, Kraftstoff;<br />
Auswerten von Demonstrationsversuchen; Erläutern <strong>de</strong>s<br />
Mechanismus <strong><strong>de</strong>r</strong> radikalischen Substitution;<br />
Radikalstabilität und Konkurrenzreaktionen bei höheren<br />
Alkanen<br />
(ca. 5 Std.)
¡<br />
Toluol<br />
aromatischer<br />
trans<br />
p<br />
Mo<strong>de</strong>ll;<br />
Molekülstruktur:<br />
Molekülgeometrie, Einfachbindung,<br />
Konstitutionsisomerie<br />
Anwen<strong>de</strong>n <strong>de</strong>s Tetrae<strong><strong>de</strong>r</strong>mo<strong>de</strong>lls auf Alkane und Cycloalkane;<br />
Beschreiben <strong><strong>de</strong>r</strong> Einfachbindung durch das Orbitalmo<strong>de</strong>ll:<br />
Grundzustand, sp 3 Hybridisierung; Nomenklaturregeln;<br />
Unterschied Konstitution Konformation<br />
(ca.4 Std.)<br />
homologe Reihe Untersuchen und Erklären physikalischer Eigenschaften:<br />
Löslichkeit, Sie<strong>de</strong>punkt; zwischenmolekulare Kräfte<br />
(ca. 3 Std.)<br />
ungesättigte Kohlenwasserstoffe Vorstellen ausgewählter Verbindungen und ihrer Be<strong>de</strong>utung, z.<br />
B. als Ausgangsstoffe für die Synthese von Kunststoffen<br />
Reaktionsverhalten:<br />
Brennbarkeit, Baeyer Reaktion, Halogen addition<br />
Vergleichen mit <strong>de</strong>m Verhalten von Alkanen; Erläutern <strong>de</strong>s<br />
Mechanismus <strong><strong>de</strong>r</strong> elektrophilen Addition von<br />
Wasserstoffhalogenid und Halogen an Alkene; Erklären <strong><strong>de</strong>r</strong><br />
Regel von Markownikow; Hinweis auf Metho<strong>de</strong>n zur<br />
Aufklärung <strong>de</strong>s ionischen Mechanismus<br />
(ca. 6 Std.)<br />
Molekülstruktur:<br />
Mehrfachbindung, Molekülgeometrie<br />
Beschreiben durch das Orbitalmo<strong>de</strong>ll: sp 2 bzw. sp<br />
¡ ¡<br />
Hybridisierung, s Erklären <strong><strong>de</strong>r</strong> Ursachen und<br />
¡ ¡<br />
Folgen <strong><strong>de</strong>r</strong> cis Isomerie<br />
(ca. 4 Std.)<br />
aromatische Verbindungen<br />
Hinweis auf die Be<strong>de</strong>utung, z.B. für die Synthese von<br />
Kunststoffen, Farbstoffen, Waschmitteln, Arzneimitteln<br />
Benzol:<br />
Reaktionsverhalten<br />
¢<br />
Charakter Klären <strong>de</strong>s Wi<strong><strong>de</strong>r</strong>spruchs zwischen erwartetem<br />
("Cyclohexatrien") und beobachtetem Reaktionsverhalten;<br />
Molekülstruktur<br />
¡<br />
Mesomerie,<br />
Grenzstrukturformel, Mesomerieenergie<br />
Beschreiben <strong>de</strong>s aromatischen Zustands mit Hilfe <strong>de</strong>s<br />
Orbitalmo<strong>de</strong>lls; Aufzeigen <strong><strong>de</strong>r</strong> Molekülgeometrie; Erläutern<br />
<strong>de</strong>s Mechanismus <strong><strong>de</strong>r</strong> elektrophilen Substitution:<br />
Halogenierung, Nitrierung<br />
Erarbeiten <strong><strong>de</strong>r</strong> Konkurrenzreaktion bei <strong><strong>de</strong>r</strong> Halogenierung von<br />
Alkylbenzolen: Radikal bzw. Ionenmechanismus in<br />
Abhängigkeit von <strong>de</strong>n Reaktionsbedingungen<br />
(ca. 6 . Std.)
¡<br />
an<strong><strong>de</strong>r</strong>e<br />
¡<br />
aromatische Verbindungen Hinweis auf kon<strong>de</strong>nsierte Systeme und N Heterocyclen;<br />
Bewusstmachen <strong><strong>de</strong>r</strong> cancerogenen Wirkung bestimmter<br />
Aromaten<br />
(ca. 2 Std.)<br />
Halogenkohlenwasserstoffe:<br />
technische Be<strong>de</strong>utung und ökologische Pro<br />
¢<br />
blematik<br />
exemplarisches Eingehen auf Eigenschaften und<br />
Verwendungsbereiche; Bewußtmachen <strong><strong>de</strong>r</strong> Anreicherung von<br />
Pestizi<strong>de</strong>n in <strong><strong>de</strong>r</strong> Nahrungskette; Aufzeigen <strong><strong>de</strong>r</strong> globalen<br />
Dimension <strong><strong>de</strong>r</strong> Umweltbelastung, z.B. durch<br />
Fluorchlorkohlenwasserstoffe, und <strong><strong>de</strong>r</strong> Notwendigkeit<br />
internationaler Vereinbarungen<br />
Petro und Kohlechemie Hinweis auf die aktuelle Energie und Rohstoffsituation<br />
(ca. 4 Std.)<br />
Erdöl, Erdgas und Kohle als Energieträger und<br />
Rohstoffe<br />
ökologische Konsequenzen <strong><strong>de</strong>r</strong> Nutzung<br />
fossiler Brennstoffe<br />
Beschreiben wichtiger Verfahren: Erdöl<strong>de</strong>stillation,<br />
Entschwefelung, , Cracken, Reformieren; Hydrieren,<br />
Verkoken und Vergasen von Kohle<br />
Hinweis auf "Kohlendioxidproblem" und "Treibhauseffekt";<br />
Ausblick auf an<strong><strong>de</strong>r</strong>e Möglichkeiten <strong><strong>de</strong>r</strong> Energiegewinnung<br />
(ca. 6 Std.)<br />
4 Der Einfluss funktioneller Gruppen (ca.42 Std.)<br />
Die Schüler erkennen die Auswirkungen wichtiger funktioneller Gruppen auf die Eigenschaften von organischen<br />
Verbindungen und damit das grundlegen<strong>de</strong> Ordnungsprinzip <strong><strong>de</strong>r</strong> organischen Chemie. Darüber hinaus wird für sie<br />
<strong>de</strong>utlich, dass die Ausprägung bestimmter Eigenschaften durch die funktionellen Gruppen von <strong><strong>de</strong>r</strong> Natur <strong>de</strong>s übrigen<br />
Molekülteils mitbeeinflusst wird.<br />
An Beispielen wer<strong>de</strong>n Bezüge zur Chemie <strong><strong>de</strong>r</strong> Biomoleküle hervorgehoben, um <strong>de</strong>n Schülern die Verständnisgrundlage<br />
für viele Eigenschaften von Naturstoffen zu vermitteln. Die Be<strong>de</strong>utung verschie<strong>de</strong>ner Stoffgruppen für unser tägliches<br />
Leben erfassen die Schüler anhand ausgewählter Vertreter.<br />
Alkohole<br />
Vorstellen wichtiger Vertreter: Methanol, Ethanol, Glykol,<br />
Glycerin; Aufzeigen einer technisch be<strong>de</strong>utsamen Synthese;<br />
Hydroxylgruppe als funktionelle Gruppe; Erkennen <strong><strong>de</strong>r</strong><br />
Einteilung und Anwen<strong>de</strong>n <strong><strong>de</strong>r</strong> Nomenklatur
¡<br />
Phenol<br />
¢<br />
Anilin<br />
und<br />
physikalische Eigenschaften:<br />
Löslichkeit, Sie<strong>de</strong>punkt<br />
Bewußtmachen <strong><strong>de</strong>r</strong> Abhängigkeit von <strong><strong>de</strong>r</strong> Molekülgröße und<br />
<strong><strong>de</strong>r</strong> Zahl <strong><strong>de</strong>r</strong> Hydroxylgruppen; Vergleichen mit<br />
Kohlenwasserstoffen entsprechen<strong><strong>de</strong>r</strong> Molekülmasse; Hinweis<br />
auf die Verwendung von Alkoholen als Lösungs und<br />
Frostschutzmittel<br />
(ca. 4 Std.)<br />
Reaktionsverhalten: Alkoholatbildung<br />
Vergleichen <strong><strong>de</strong>r</strong> Reaktionen von Wasser bzw. Alkohol mit<br />
Natrium;<br />
Protonierung <strong><strong>de</strong>r</strong> Hydroxylgruppe<br />
Bildung von Ether und Alken in Konkurrenzreaktionen;<br />
Oxidierbarkeit Verhalten primärer, sekundärer und tertiärer Alkohole<br />
gegenüber angesäuerter Dichromatlösung; Aufstellen <strong><strong>de</strong>r</strong><br />
Redoxgleichungen<br />
(ca. 6 Std.)<br />
Strukturaufklärung<br />
Vergleichen <strong>de</strong>s Reaktionsverhaltens von Alkohol bzw. Ether<br />
mit Natrium; Hinweis auf Metho<strong>de</strong>n <strong><strong>de</strong>r</strong> instrumentellen<br />
Analytik: IR und Kernresonanzspektroskopie<br />
(ca. 3 Std.)<br />
Phenole Vorstellen <strong><strong>de</strong>r</strong> Stoffklasse; Aufzeigen von<br />
Verwendungsmöglichkeiten, z.B. zur Herstellung von Kunst<br />
und Farbstoffen;<br />
Phenol als Säure Acidität <strong><strong>de</strong>r</strong> Hydroxylgruppe (pK s<br />
Wert); Vergleichen von<br />
¡ ¡<br />
Phenol und Alkohol sowie von Phenolat Alkoholat Ion;<br />
Erklären <strong>de</strong>s Unterschieds mit <strong><strong>de</strong>r</strong> Mesomeriestabilisierung<br />
als Aromat:<br />
Nitrierung, Halogenierung<br />
Vergleichen mit <strong>de</strong>m Reaktionsverhalten von Benzol; Erklären<br />
<strong>de</strong>s Einflusses <strong><strong>de</strong>r</strong> Hydroxylgruppe auf Geschwindigkeit und<br />
Orientierung <strong><strong>de</strong>r</strong> Zweitsubstitution; Unterschei<strong>de</strong>n von<br />
induktiven und mesomeren Effekten<br />
(ca. 6 Std.)<br />
Amine<br />
Begriffsklärung; Hinweis auf Anilinfarben; Ansprechen <strong><strong>de</strong>r</strong><br />
cancerogenen Wirkung von Nitrosaminen; ggf. Aufzeigen <strong><strong>de</strong>r</strong><br />
Be<strong>de</strong>utung biogener Amine, z.B. als Neurotransmitter<br />
als Base Vergleichen mit Ammoniak und Methylamin
¡<br />
Acidität<br />
£<br />
Esterbildung<br />
¢<br />
Werte;<br />
H<br />
Bindungen<br />
Zweitsubstitution beim Anilin<br />
Vergleichen mit Phenol; Anwen<strong>de</strong>n <strong><strong>de</strong>r</strong> Vorkenntnisse<br />
(ca. 4 Std.)<br />
Al<strong>de</strong>hy<strong>de</strong> und Ketone Vorstellen wichtiger Vertreter; Carbonylgruppe als<br />
funktionelle Gruppe; Nomenklatur; Aufzeigen einiger<br />
Verwendungsmöglichkeiten, z.B. als Desinfektionsmittel, zur<br />
Kunststoffherstellung; Bewusstmachen <strong><strong>de</strong>r</strong> Problematik <strong>de</strong>s<br />
Formal<strong>de</strong>hy<strong>de</strong>insatzes<br />
Al<strong>de</strong>hy<strong>de</strong> als Reduktionsmittel:<br />
Silberspiegelprobe, Fehlingprobe<br />
experimentelle Untersuchung <strong>de</strong>s Verhaltens von Al<strong>de</strong>hy<strong>de</strong>n<br />
und Ketonen; Formulieren <strong><strong>de</strong>r</strong> Redoxgleichungen ohne<br />
Berücksichtigung <strong><strong>de</strong>r</strong> Komplexbildung<br />
(ca. 5 Std.)<br />
Additionsreaktionen: Reaktionsprinzip<br />
experimentelle Demonstration einer Addition; Formulieren <strong><strong>de</strong>r</strong><br />
Schritte <strong><strong>de</strong>r</strong> nucleophilen Addition; Beispiele: Addition von<br />
Wasser, Alkohol und Ammoniak<br />
C H Acidität: Keto Enol Tautomerie<br />
Aldoladdition<br />
¡ ¡<br />
Erklären <strong><strong>de</strong>r</strong> Aktivierung von C durch <strong>de</strong>n<br />
Einfluss <strong><strong>de</strong>r</strong> benachbarten Carbonylgruppe<br />
(ca. 4 Std.)<br />
Carbonsäuren Vorstellen wichtiger Vertreter; Carboxylgruppe als<br />
funktionelle Gruppe; Nomenklatur; Herstellung und<br />
Be<strong>de</strong>utung von Essigsäure;<br />
<strong><strong>de</strong>r</strong> Carboxylgruppe:<br />
Einfluß von Substituenten<br />
¢<br />
Mesomeriestabilisierung <strong>de</strong>s Carboxylat Ions; Vergleichen <strong><strong>de</strong>r</strong><br />
pK s<br />
Erklären <strong><strong>de</strong>r</strong> Unterschie<strong>de</strong> mit <strong>de</strong>m Einfluß<br />
¢<br />
induktiver Effekte; experimentelle Ermittlung <strong>de</strong>s pKs Werts<br />
durch Halbtitration; Salzbildung<br />
(ca. 6 Std.)<br />
und Esterhydrolyse:<br />
Säurekatalyse Gleichgewichtsreaktion<br />
Be<strong>de</strong>utung von Estern<br />
Erarbeitung ausgehend von Experimenten; Formulieren<br />
<strong>de</strong>s Reaktionsmechanismus;Aufzeigen von<br />
Möglichkeiten zur Erhöhung <strong><strong>de</strong>r</strong> Ausbeute; keine<br />
Berechnungen mit Hilfe <strong>de</strong>s Massenwirkungsgesetzes;<br />
Beispiele für Lösungsmittel, Aromastoffe und Kunststoffe<br />
(ca. 4 Std.)