Chemie und ihre Didaktik, Universität Wuppertal - Bergische ...
Chemie und ihre Didaktik, Universität Wuppertal - Bergische ...
Chemie und ihre Didaktik, Universität Wuppertal - Bergische ...
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
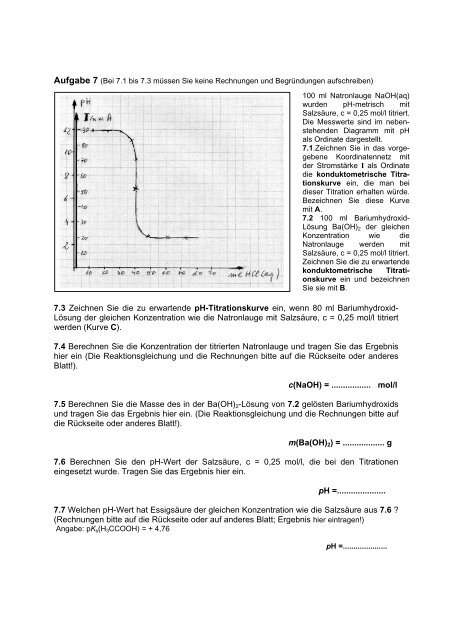
Aufgabe 7 (Bei 7.1 bis 7.3 müssen Sie keine Rechnungen <strong>und</strong> Begründungen aufschreiben)<br />
100 ml Natronlauge NaOH(aq)<br />
wurden pH-metrisch mit<br />
Salzsäure, c = 0,25 mol/l titriert.<br />
Die Messwerte sind im nebenstehenden<br />
Diagramm mit pH<br />
als Ordinate dargestellt.<br />
7.1.Zeichnen Sie in das vorgegebene<br />
Koordinatennetz mit<br />
der Stromstärke I als Ordinate<br />
die konduktometrische Titrationskurve<br />
ein, die man bei<br />
dieser Titration erhalten würde.<br />
Bezeichnen Sie diese Kurve<br />
mit A.<br />
7.2 100 ml Bariumhydroxid-<br />
Lösung Ba(OH)2 der gleichen<br />
Konzentration wie die<br />
Natronlauge werden mit<br />
Salzsäure, c = 0,25 mol/l titriert.<br />
Zeichnen Sie die zu erwartende<br />
konduktometrische Titrationskurve<br />
ein <strong>und</strong> bezeichnen<br />
Sie sie mit B.<br />
7.3 Zeichnen Sie die zu erwartende pH-Titrationskurve ein, wenn 80 ml Bariumhydroxid-<br />
Lösung der gleichen Konzentration wie die Natronlauge mit Salzsäure, c = 0,25 mol/l titriert<br />
werden (Kurve C).<br />
7.4 Berechnen Sie die Konzentration der titrierten Natronlauge <strong>und</strong> tragen Sie das Ergebnis<br />
hier ein (Die Reaktionsgleichung <strong>und</strong> die Rechnungen bitte auf die Rückseite oder anderes<br />
Blatt!).<br />
c(NaOH) = ................. mol/l<br />
7.5 Berechnen Sie die Masse des in der Ba(OH)2-Lösung von 7.2 gelösten Bariumhydroxids<br />
<strong>und</strong> tragen Sie das Ergebnis hier ein. (Die Reaktionsgleichung <strong>und</strong> die Rechnungen bitte auf<br />
die Rückseite oder anderes Blatt!).<br />
m(Ba(OH)2) = .................. g<br />
7.6 Berechnen Sie den pH-Wert der Salzsäure, c = 0,25 mol/l, die bei den Titrationen<br />
eingesetzt wurde. Tragen Sie das Ergebnis hier ein.<br />
pH =.....................<br />
7.7 Welchen pH-Wert hat Essigsäure der gleichen Konzentration wie die Salzsäure aus 7.6 ?<br />
(Rechnungen bitte auf die Rückseite oder auf anderes Blatt; Ergebnis hier eintragen!)<br />
Angabe: pKs(H3CCOOH) = + 4,76<br />
pH =.....................