Anästhesie in der Thoraxchirurgie
Anästhesie in der Thoraxchirurgie
Anästhesie in der Thoraxchirurgie
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
<strong>Anästhesie</strong> <strong>in</strong> <strong>der</strong> <strong>Thoraxchirurgie</strong><br />
U. Kle<strong>in</strong><br />
E<strong>in</strong>leitung<br />
<strong>Thoraxchirurgie</strong> mit E<strong>in</strong>griffen an Lungenparenchym, grossen Atemwegen und an<strong>der</strong>en<br />
extrakardialen Thoraxorganen bed<strong>in</strong>gt die unmittelbare E<strong>in</strong>wirkung auf die Organe des<br />
Gaswechsels und, eng damit verknüpft, auf die Funktion von Herz und Kreislauf. Der<br />
Sicherung bei<strong>der</strong> Vitalfunktionen gerecht zu werden, ist für die <strong>Anästhesie</strong> an umfangreiche<br />
Kenntnisse ihrer Physiologie und Pathophysiologie geknüpft, aus denen alle<strong>in</strong> sich<br />
<strong>der</strong> E<strong>in</strong>satz von Verfahren begründet, die sich teilweise nicht unerheblich vom sonstigen<br />
Vorgehen unterscheiden. Der Erfolg fußt auf Verständnis <strong>der</strong> präoperativen Untersuchungsverfahren,<br />
des Vorgehens während <strong>Anästhesie</strong> mit speziellen Verfahren des Atemwegsmanagements<br />
sowie <strong>der</strong> Beatmungsstrategie und <strong>in</strong> <strong>der</strong> postoperativen Phase unter<br />
beson<strong>der</strong>er Berücksichtigung <strong>der</strong> Schmerztherapie. Dies erklärt, dass die e<strong>in</strong>drucksvolle<br />
Senkung von Mortalität und Morbidität des Thoraxe<strong>in</strong>griffs bei gleichzeitigem Anstieg<br />
von Begleiterkrankungen und Patientenalter während <strong>der</strong> letzten Jahrzehnte <strong>in</strong> hohem<br />
Maße <strong>der</strong> <strong>Anästhesie</strong> zugerechnet wird.<br />
Präoperative Befun<strong>der</strong>hebung<br />
Im Mittelpunkt steht die Wertung von:<br />
• Atemfunktion,<br />
• kardiovaskulären Begleiterkrankungen und<br />
• Raucheranamnese.<br />
Anamnese und körperliche Untersuchung<br />
Wichtige Symptomgruppen s<strong>in</strong>d Dyspnoe (mit und ohne Zeichen für Obstruktion),<br />
Husten und Auswurf, Thoraxschmerz, Zyanose sowie e<strong>in</strong> pathologischer Befund bei<br />
Auskultation. Tabak-Rauchen ist Hauptursache von chronisch-obstruktiver Bronchitis,<br />
Emphysem, malignen Lungentumoren und kardiovaskulären Erkrankungen. Deren<br />
Schwere korreliert mit dem Tabak-Konsum ebenso wie die Verschlechterung <strong>der</strong> Lungenfunktion.<br />
Rauchen ist e<strong>in</strong> Risikofaktor für pulmonale Komplikationen nach Lungene<strong>in</strong>griffen<br />
[10].<br />
Dyspnoe als Symptom alle<strong>in</strong> ist wenig aussagefähig, erlaubt jedoch <strong>in</strong> Beziehung zu<br />
Alltagsaktivitäten, z.B. Treppensteigen [18], die Schätzung des perioperativen Risikos.<br />
Schwere Dyspnoe mit M<strong>in</strong><strong>der</strong>ung <strong>der</strong> Atemstoßstärke (E<strong>in</strong>-Sekunden-Kapazität bzw.<br />
FeV1 unter 1,5 l) bedeutet erhöhtes postoperatives Risiko für e<strong>in</strong>e respiratorische Insuffizienz.<br />
Patienten, die weniger als drei Etagen steigen können, haben nach Thorakotomie häufiger<br />
pulmonale Komplikationen und verlängerte Beatmungszeiten.<br />
Dyspnoe ist aber auch Zeichen e<strong>in</strong>er kardialen Insuffizienz. Bei <strong>Thoraxchirurgie</strong> besteht<br />
für KHK-Patienten mit unter 5% e<strong>in</strong> mittleres Risiko von Herztod o<strong>der</strong> perioperativem<br />
Infarkt. Bei Rechtsherz-Insuffizienz bzw. pulmonaler Hypertonie f<strong>in</strong>den sich neben dem<br />
Symptom Dyspnoe Verän<strong>der</strong>ungen im EKG, wie P pulmonale und verm<strong>in</strong><strong>der</strong>te präkordiale<br />
R-Progression, verkle<strong>in</strong>erter QRS-Komplex bei Lungenblähung o<strong>der</strong> bei schwerer<br />
Störung T-Negativierung <strong>in</strong> V1-V3. Hier soll, beson<strong>der</strong>s bei geplanter Pneumonektomie,<br />
die Abklärung per Echokardiographie (u.U. Rechtsherzkatheterisierung) erfolgen [96].<br />
13
E<strong>in</strong>e bedenkliche pulmonale Hypertonie ist aber außer bei Patienten mit Emphysemchirurgie<br />
und Lungentransplantation selten.<br />
Husten kann Symptom von Begleiterkrankungen (oft chronische Bronchitis) aber auch<br />
<strong>der</strong> zur Operation führenden Erkrankung se<strong>in</strong>.<br />
Trockener Husten über Monate ist Verdachtssymptom für Bronchialkarz<strong>in</strong>om.<br />
Auswurf mit grossen Mengen eitrigen Sputums zeigen Bronchiektasen an. Beimischungen<br />
von Blut bis zur Haemoptoe beruhen überwiegend auf entzündlichen Erkrankungen,<br />
s<strong>in</strong>d aber auch auf Tumore<strong>in</strong>bruch <strong>in</strong> die Atemwege verdächtig.<br />
Obstruktion mit Zeichen verlängerter Ausatmung zeigt e<strong>in</strong>e COPD an. Beschleunigte,<br />
flache Atemzüge sprechen für Restriktion durch Gewebsverdichtung (z.B. Fibrose o<strong>der</strong><br />
Pneumonie) bzw. extrapulmonale Raumfor<strong>der</strong>ung wie Schwarte, Erguss, Empyem. Oft<br />
f<strong>in</strong>det sich die Beh<strong>in</strong><strong>der</strong>ung <strong>der</strong> Atemexkursionen e<strong>in</strong>seitig ipsilateral. Paradoxe Atembewegungen<br />
(<strong>in</strong>spiratorische E<strong>in</strong>ziehung und exspiratorische Vorwölbung des Abdomens<br />
bei gegens<strong>in</strong>niger Thoraxbewegung) s<strong>in</strong>d Zeichen von Zwerchfellparese o<strong>der</strong> Erschöpfung<br />
<strong>der</strong> Atempumpe bei chronischen Lungenerkrankungen.<br />
„Paradoxe Atmung“ spricht für Verlegung grosser Atemwege durch Tumor o<strong>der</strong> Fremdkörper<br />
bzw. extralum<strong>in</strong>ale Kompression durch mediast<strong>in</strong>ale Raumfor<strong>der</strong>ung. Verstärkung<br />
<strong>der</strong> Symptome <strong>in</strong> Rückenlage ist e<strong>in</strong> wichtiges Zeichen für Beatmungsprobleme<br />
bei <strong>Anästhesie</strong>-E<strong>in</strong>leitung.<br />
Allgeme<strong>in</strong>e und bildgebende Diagnostik<br />
Dr<strong>in</strong>glichkeit und Ziel des Thoraxe<strong>in</strong>griffs bestimmen Art und Umfang <strong>der</strong> Voruntersuchungen.<br />
Die anästhesiologischen Sicherheitsanfor<strong>der</strong>ungen s<strong>in</strong>d für <strong>in</strong>vasiv-diagnostische E<strong>in</strong>griffe<br />
ebenso hoch wie bei ggf. folgen<strong>der</strong> Operation. Vor Mediast<strong>in</strong>oskopie, Thorakoskopie<br />
und Bronchoskopie sollen Ergebnisse von Standarduntersuchungen, Spirometrie,<br />
Blutgasanalyse und EKG vorliegen.<br />
Das EKG <strong>in</strong> Ruhe ist vor <strong>Thoraxchirurgie</strong> obligat. Belastungsuntersuchungen s<strong>in</strong>d bei<br />
mittelgradigem Risiko e<strong>in</strong>er KHK angezeigt. Die Blutgasanalyse ist zusammen mit<br />
an<strong>der</strong>en Funktionsparametern zu werten. Therapieresistente Global<strong>in</strong>suffizienz, also<br />
Hyperkapnie mit Hypoxämie, lässt die Resektion von Lungenparenchym nur mit hohem<br />
Risiko zu. Mässige Hypoxie (PaO < 50 mm Hg), die sich während Belastung bessert,<br />
2<br />
zeigt e<strong>in</strong>e Störung des V/Q-Verhältnisses an, das medikamentös zu bessern ist. Bei<br />
Rechts-L<strong>in</strong>ks-Shunt durch Nichtbelüftung <strong>der</strong> zur Resektion stehenden Lungenareale<br />
wird mit diesen auch die Ursache <strong>der</strong> Hypoxie entfernt. Jedoch gibt es ke<strong>in</strong>en Grenzwert<br />
des paO für e<strong>in</strong> e<strong>in</strong>deutig erhöhtes Risiko e<strong>in</strong>er Parenchymresektion [18].<br />
2<br />
Hyperkapnie (PaCO >45 mm Hg) zeigt zwar e<strong>in</strong>e Störung <strong>der</strong> Atempumpe an, ist aber<br />
2<br />
lediglich Warnzeichen und ke<strong>in</strong> unabhängiger Voraussagewert für postoperative pulmonale<br />
Komplikationen, und muss zu weiteren Funktionsuntersuchungen (s.u.) veranlassen.<br />
Die bildgebende Diagnostik liefert wichtige Informationen auch für Narkosetechnik und<br />
-führung. Die Thoraxaufnahme im anterio-posterioren (a.p.) und seitlichen Strahlengang<br />
erleichtert mit Abschätzung des Durchmessers von Trachea und Hauptbronchien die<br />
Grössenwahl des Doppellumentubus (s.u.), Trachea-Verlagerung und Aufspreizung <strong>der</strong><br />
Hauptkar<strong>in</strong>a weisen auf schwierige Plazierung von DLT o<strong>der</strong> Bronchusblocker h<strong>in</strong>. Kompression<br />
von Trachea durch Struma o<strong>der</strong> mediast<strong>in</strong>ale Raumfor<strong>der</strong>ung lässt erschwerte<br />
Beatmung während Narkose-E<strong>in</strong>leitung erwarten. E<strong>in</strong>e Bronchus-Verlegung kann Sekret-<br />
14
Verhalt anzeigen, <strong>der</strong> bronchoskopisch zu beheben ist. Die Lokalisation von Raumfor<strong>der</strong>ungen,<br />
Atelektasen, Bronchiektasen und Abszessen ist für die Führung <strong>der</strong> E<strong>in</strong>lungen-<br />
Ventilation und die Seitentrennung <strong>der</strong> Atemwege wichtig.<br />
Das Computer-Tomogramm ist Standard <strong>in</strong> <strong>der</strong> präoperativen Diagnostik. Es <strong>in</strong>formiert<br />
über Lagebeziehungen von Raumfor<strong>der</strong>ungen zu Tracheo-Bronchial-System, Herz,<br />
Gefässen und Brustwand. Ausmass und Ausdehnung von Pneumothorax, Erguss und<br />
Pleuraverschwartung, Lungenzysten und Bullae können besser als <strong>in</strong> <strong>der</strong> Thoraxaufnahme<br />
erkannt werden.<br />
Ebenso leistet die Bronchoskopie, Standarduntersuchung bei jedem thoraxchirurgischen<br />
E<strong>in</strong>griff zur Abklärung des Krankheitsbildes, wichtige Informationen für Narkosetechnik<br />
und -führung (s.o.). Die Befunde müssen dem Anästhesisten bekannt se<strong>in</strong>.<br />
Kardiopulmonale Funktionsdiagnostik - Resektionskriterien<br />
In <strong>der</strong> Risikobeurteilung muss grundsätzlich unterschieden werden zwischen<br />
- E<strong>in</strong>griffen mit postoperativer Funktionsverschlechterung durch Resektion funktionsfähigen<br />
Parenchyms: Pneumonektomie, Lobektomie, Segment-o<strong>der</strong> Keilresektion<br />
und<br />
- E<strong>in</strong>griffen zur postoperativen Funktionsverbesserung: Emphysemchirurgie (Lungenvolumenreduktion),<br />
Entleerung von Erguss, Hämatom, Empyem, Dekortikation.<br />
Bei <strong>Thoraxchirurgie</strong> handelt es sich heute meist um maligne Grun<strong>der</strong>krankungen, die e<strong>in</strong>e<br />
Parenchymresektion erfor<strong>der</strong>n. Darauf bezieht sich im Wesentlichen die Risikobeurteilung<br />
aus <strong>der</strong> Lungenfunktionsdiagnostik [29]. Sie soll zwei Fragen beantworten:<br />
- s<strong>in</strong>d pulmonale Begleiterkrankungen vorhanden, die mit medikamentöser o<strong>der</strong> physikalischer<br />
Therapie gebessert werden können?<br />
- Genügen das postoperativ verbleibende Lungenparenchym und die postoperative<br />
Atemmechanik für Gasaustausch und Lebensführung?<br />
Die Risiko-Beurteilung (Tab. 1) stützt sich wesentlich auf Bestimmung <strong>der</strong> globalen<br />
Größen von:<br />
- Atemmechanik (FeV1 [l]): dasjenige Atemvolumen, das während <strong>der</strong> ersten Sekunde<br />
e<strong>in</strong>er forcierten Exspiration aus maximaler Inspiration ausgeatmet wird,<br />
- kardiopulmonale Funktion (V · O 2 max [ml/m<strong>in</strong> × kg]): maximale Sauerstoffaufnahme<br />
unter symptom-begrenzter Ergometer-Belastung.<br />
- alveolo-kapilläre Funktion (TLco [ml/ml × mm Hg]): Diffusions-Kapazität für Kohlenmonoxyd.<br />
Die Bestimmung <strong>der</strong> regionalen Verteilung <strong>der</strong> Lungen-Perfusion mittels Lungen-Perfusionssz<strong>in</strong>tigrafie<br />
(i.v.-Injektion o<strong>der</strong> Inhalation von 99mTechnetium-markierten Makroaggregaten)<br />
o<strong>der</strong> auch mittels quantitativem CT dient <strong>der</strong> Unterscheidung von funktionsfähigem<br />
und funktionslosem Lungengewebe. E<strong>in</strong>e Untersuchung ist angezeigt, wenn bei<br />
den globalen Tests bestimmte Grenzwerte unterschritten werden.<br />
Die Absolutwerte <strong>der</strong> Testergebnisse müssen auf die Normwerte für Alter, Geschlecht<br />
und Körpergrösse bezogen werden, um nicht e<strong>in</strong>er schmächtigen Patient<strong>in</strong> fälschlich<br />
e<strong>in</strong> Risiko zuzurechnen, das e<strong>in</strong> bestimmter Messwert nur für e<strong>in</strong>en stämmigen Mann<br />
mittleren Alters anzeigt, und werden als Prozentwerte <strong>der</strong> Norm, % (of) pred(icted),<br />
angegeben.<br />
15
Risiko:<br />
Funktion bei<strong>der</strong> Lungen<br />
Kl<strong>in</strong>ik:<br />
niedrig vertretbar sehr hoch o<strong>der</strong><br />
Kontra<strong>in</strong>dikation<br />
Dyspnoe (Grad 0-4)<br />
Rauchen (gegenwärtig)<br />
Sputum (1 – 4)<br />
Spirometrie<br />
FeV1 FVC<br />
FeV 1 /FVC (Tiffeneau-Test)<br />
Verbesserung nach<br />
Bronchodilatation<br />
Gasaustausch<br />
Ruhe-pO mm Hg (R aumluft)<br />
2<br />
Ruhe-pCO mm Hg<br />
2<br />
Ruhe - TL ml/m<strong>in</strong> × mmHg<br />
CO<br />
Belastungstests<br />
Submaximale Belastung:<br />
Treppensteigen<br />
Belastungs-Pulsoximetrie<br />
Maximale Belastung:<br />
O 2 -Aufnahme unter Belastung:<br />
V · O 2 max ml /m<strong>in</strong> × kg<br />
16<br />
0 – 1<br />
0<br />
0<br />
> 2,0 l<br />
> 3.0 l<br />
> 50 % pred<br />
> 70 %<br />
>15 %<br />
60-80<br />
< 45<br />
> 50 % pred<br />
> 3 Etagen<br />
> 20<br />
> 75 % pred<br />
2 – 3<br />
++<br />
1 - 2<br />
0.8 – 2.0 l<br />
1.5 – 3.0 l<br />
< 50 % pred<br />
< 70 %<br />
1% - 15 %<br />
45 – 60<br />
45 – 50<br />
30% - 50% pred<br />
≤ 3 Etagen<br />
12 – 19<br />
3 – 4<br />
+++<br />
3 – 4<br />
< 0.8 l<br />
< 1.5 l<br />
< 30 % pred<br />
< 50 %<br />
ke<strong>in</strong>e<br />
< 45<br />
> 50<br />
< 30 % pred<br />
≤ 1 Etage<br />
Ruhe-SpO 2 < 90%<br />
Abfall > 4% unter Test<br />
< 11<br />
< 40 % pred<br />
Perfusionssz<strong>in</strong>tigramm, quantitatives Lungen-CT zur Schätzung <strong>der</strong> postoperativen Restfunktion<br />
(predicted postoperative ~ ppo):<br />
FeV ppo > 1,2 l 0.8 – 1.2 l
ausgeprägten Funktionsstörung die Grundlage zur Indikation des E<strong>in</strong>griffs, so dass Ausgangswerte<br />
für FeV1 % pred von 25-27% nicht selten s<strong>in</strong>d [67].<br />
Ebenso bewegen auch bei e<strong>in</strong>geschränkter Lungenfunktion zum resezierenden E<strong>in</strong>griff:<br />
- Hämoptysen von mehr als 600 ml/24 Std., wenn die Quelle zu orten ist.<br />
- Atemwegs-Verlegung durch maligne Raumfor<strong>der</strong>ung mit Sekretverhalt und den Folgen<br />
Atelektase, Pneumonie, Abszess und Empyem.<br />
Präoperative Vorbereitung<br />
Atemtherapie<br />
- Sekretverflüssigung, -mobilisation und -expektoration durch kontrollierte Flüssigkeitszufuhr,<br />
Mukolytika, Vibrationsmassage, Lagerungsdra<strong>in</strong>age und Hustenübungen.<br />
- Broncholyse mittels β 2 -Mimetika, Antichol<strong>in</strong>ergika und Methylxanth<strong>in</strong>en. Die entzündliche<br />
Komponente <strong>der</strong> Obstruktion wird mit <strong>in</strong>halativen o<strong>der</strong> systemischen Kortikoiden<br />
behandelt. Bronchospastik als Symptom e<strong>in</strong>er Herz<strong>in</strong>suffizienz ist ebenso zu<br />
therapieren.<br />
- Pulmonale Infekte müssen resistenzgerecht saniert werden, wobei zur Diagnostik<br />
bevorzugt bronchoskopische Proben dienen. Retentionspneumonie o<strong>der</strong> <strong>in</strong>trapulmonaler<br />
Abzess, sofern nicht durch endoskopische Rekanalisierung zu bessern, s<strong>in</strong>d<br />
Indikationen zur raschen Operation.<br />
- Tra<strong>in</strong><strong>in</strong>g <strong>der</strong> Atemmuskulatur und Steigerung <strong>der</strong> FRC. Zwerchfellatmung, Thorax-<br />
Dehnung mittels Incentive Spirometer sowie Lippenbremse verbessern die Ausgangslage<br />
und dienen beson<strong>der</strong>s bei COPD zur Prophylaxe postoperativer pulmonaler<br />
Komplikationen. Diese Maßnahmen ermöglichen u.U. e<strong>in</strong>e Lungenresektion bei vormals<br />
<strong>in</strong>operabel e<strong>in</strong>geschätzten Patienten [27].<br />
Kardio-zirkulatorische Funktionsstörungen<br />
Rechtsherz-Insuffizienz und pulmonale Hypertonie: e<strong>in</strong>e Parenchymresektion birgt<br />
das Risiko <strong>der</strong> Verschlechterung, was e<strong>in</strong>e vorbereitende Therapie erfor<strong>der</strong>t. Hierzu bieten<br />
sich Kalziumblocker an, die sich ebenso bei supraventrikulärer Tachykardie eignen [44].<br />
Bei chronischer Hypoxämie mit Ruhe-PaO 2 < 55 mmHg ist O 2 -Therapie <strong>der</strong> erste<br />
Behandlungsschritt des pulmonalen Hypertonus [96].<br />
L<strong>in</strong>ksherz-Insuffizienz und KHK: Revaskularisation <strong>der</strong> Koronar-Arterien soll nur bei<br />
grundsätzlicher Indikation vorgenommen werden [42]. An<strong>der</strong>erseits rechtfertigt es nicht,<br />
Patienten mit behandelbarem Malignom die <strong>in</strong>vasive Therapie vorzuenthalten. Diese wird<br />
nicht selten mit dem Thoraxe<strong>in</strong>griff zusammengelegt. S<strong>in</strong>d Kl<strong>in</strong>ik und Befund nach<br />
Behandlung stabil, ist die Thorakotomie 4-6 Wochen nach Infarkt möglich. Auch bei<br />
hohem Risiko bietet <strong>der</strong> Thoraxe<strong>in</strong>griff bei präoperativer V · O 2 max > 15 ml/kg × m<strong>in</strong> e<strong>in</strong>e<br />
ca. 3-fach höhere mediane Überlebenszeit als die konservative Malignombehandlung<br />
[96]. Bei behandelter KHK und stabiler Ang<strong>in</strong>a kann <strong>der</strong> Thoraxe<strong>in</strong>griff ohne beson<strong>der</strong>e<br />
Massnahmen stattf<strong>in</strong>den, da das perioperative Infarktrisiko mit 1,1% kaum über dem <strong>der</strong><br />
Normalbevölkerung mit 0,7% liegt.<br />
Raucher-Entwöhnung<br />
90% <strong>der</strong> Patienten mit Bronchialkarz<strong>in</strong>om rauchen Tabak. Sie haben e<strong>in</strong> 2-6 fach höheres<br />
Risiko postoperativer pulmonaler und kardialer Komplikationen. Da die Funktionsstörungen,<br />
vorwiegend <strong>der</strong> Sekretelim<strong>in</strong>ation und <strong>der</strong> Sauerstoffversorgung des Körpers, unterschiedlich<br />
abkl<strong>in</strong>gen, muss die präoperative Rauch-Karenz frühzeitig gefor<strong>der</strong>t werden<br />
17
(Tab. 2). Weil erst nach 2 Monaten e<strong>in</strong> Rückgang <strong>der</strong> bronchialen Hypersekretion sicher<br />
zu erwarten, zunächst sogar <strong>der</strong> vermehrte Auswurf zu befürchten ist, wird die Zweckmässigkeit<br />
dieser For<strong>der</strong>ung bezweifelt. Doch führt e<strong>in</strong>e kurzfristige präoperative Rauchkarenz<br />
nicht häufiger zu pulmonalen Komplikationen nach Lungenparenchym-Resektionen<br />
als fortgesetztes Rauchen [10]. Die konsequente, auch kurzfristige Rauch-Karenz ist<br />
zudem s<strong>in</strong>nvoll, um den Vorteil <strong>der</strong> raschen Erholung <strong>der</strong> Sauerstoff-Versorgung zu nutzen.<br />
An<strong>der</strong>erseits ist es ungerechtfertigt, e<strong>in</strong>em Raucher den Thoraxe<strong>in</strong>griff zu versagen,<br />
weil die Normalisierung <strong>der</strong> Sekretproduktion erst b<strong>in</strong>nen e<strong>in</strong>er für das Fortschreiten des<br />
Malignoms bedenklichen Zeitspanne e<strong>in</strong>träte. Unterscheidet man zwischen den Risiken<br />
des Tabak-Rauchens und denen des Suchtstoffes Nikot<strong>in</strong>, ergibt sich die For<strong>der</strong>ung nach<br />
präoperativer Rauchkarenz nötigenfalls unter Nikot<strong>in</strong>-Substitution. Kann diese schon<br />
beim ersten Arztkontakt begonnen werden, ist auch beim Bronchial-Karz<strong>in</strong>om e<strong>in</strong> Zeitraum<br />
von 4-6 Wochen bis zur Operation nutzbar, um so die auf das Rauchen bezogene<br />
Komplikationsrate zu senken [75].<br />
Was die Frage <strong>der</strong> Rauch-Karenz vor Lungenresektion betrifft, ist die Antwort JA und<br />
<strong>der</strong> Zeitpunkt JETZT.<br />
Kurzzeit-Effekte Erholungs-Zeitraum<br />
Nikot<strong>in</strong>-Elim<strong>in</strong>ation 2-5 Stunden<br />
CO-Elim<strong>in</strong>ation 12-48 Stunden (O 2 -Versorgung, spez. kardiale<br />
Ökonomie verbessert)<br />
Bronchiolentonus verm<strong>in</strong><strong>der</strong>t 20 m<strong>in</strong><br />
Zilienfunktion verbessert Stunden bis Tage<br />
Bronchoreaktivität Tage – 4 Wochen<br />
Langzeit -Effekte Erholungs-Zeitraum<br />
NO-Produktion 6 – 12 Monate<br />
Lipid-Profil 6 – 12 Wochen<br />
Sputum-Verm<strong>in</strong><strong>der</strong>ung 2 – 8 Wochen<br />
Pulmonale Morbidität nach ca. 8 Wochen normal<br />
Immunsystem nach ca. 8 Wochen normal<br />
Ger<strong>in</strong>nungssystem nach ca. 1 Jahr normal<br />
Infarkt-Risiko nach 2 – 3 Jahren normal<br />
Tab. 2: Zeiträume <strong>der</strong> Normalisierung gestörter Organfunktionen nach Beg<strong>in</strong>n <strong>der</strong> Rauchkarenz [106].<br />
Atemwegsmanagement<br />
Kernpunkt des Atemwegsmanagements für die meisten thoraxchirurgischen E<strong>in</strong>griffe ist<br />
die Seitentrennung <strong>der</strong> Atemwege zur E<strong>in</strong>lungen-Ventilation (ELV) [60]. Dies betrifft<br />
neben E<strong>in</strong>griffen an <strong>der</strong> Lunge die Herz- und Ösophaguschirurgie aber auch die Orthopädie<br />
bzw. Traumatologie bei E<strong>in</strong>griffen an <strong>der</strong> thorakalen Wirbelsäule. Die operative Versorgung<br />
von Patienten mit Thoraxtrauma erfor<strong>der</strong>t <strong>in</strong> jedem Falle die Planung von Lungenseparation<br />
für Atemwegssicherung, seitengetrennte Beatmung bzw. ELV [62].<br />
Dabei ist auch das Vorgehen bei schwierigen Atemwegsverhältnissen zu betrachten,<br />
wobei neben dem Problem <strong>der</strong> schwierigen Intubation im herkömmlichen S<strong>in</strong>n, H<strong>in</strong><strong>der</strong>nisse,<br />
wie z.B. Stenosen, Tumor<strong>in</strong>vasion o<strong>der</strong> Verletzungen im Bereich <strong>der</strong> zentralen<br />
Atemwege subglottisch, tracheal o<strong>der</strong> im Bereich <strong>der</strong> Bifurkation geme<strong>in</strong>t s<strong>in</strong>d.<br />
18
Indikationen zur Lungenseparation<br />
Absolute Indikationen zur Seitentrennung <strong>der</strong> Atemwege s<strong>in</strong>d:<br />
- Vermeidung von Sekret-Übertritt (Eiter, Sputum, Blut) von <strong>der</strong> erkrankten, zu operierenden<br />
auf die an<strong>der</strong>e Lungenseite wie bei Bronchiektasen, <strong>in</strong>trapulmonalen<br />
Abszessen, Hämoptysen. Mögliche Folgen bei sog. „feuchter Lunge“ wären sonst<br />
Kontam<strong>in</strong>ation <strong>der</strong> nicht exponierten Seite, Atelektasen-Bildung, Gefährdung <strong>der</strong><br />
Ventilation sowie Komplikationen im postoperativen Verlauf.<br />
- Sicherung <strong>der</strong> Lungenventilation. Leckagen an Lungenparenchym (bronchopleurale/kutane<br />
Fistel, durch E<strong>in</strong>griffe wie Pleurektomie/Dekortikation) und Atemwegen<br />
(Trauma, chirurgische Eröffnung größerer Luftwege) erfor<strong>der</strong>n die seitengetrennte<br />
Beatmung <strong>der</strong> nicht befallenen Lunge, da es sonst je nach Verlust des Atemhubvolumens<br />
zur M<strong>in</strong><strong>der</strong>ventilation käme.<br />
Dies gilt auch für größere Bullae o<strong>der</strong> Zysten, die überdehnt werden bzw. platzen<br />
könnten und die funktionstüchtige Ventilationsfläche e<strong>in</strong>schränken o<strong>der</strong> zum Spannungspneumothorax<br />
führen würden. Nach Parenchymzerstörung durch Stich, Schuss<br />
o<strong>der</strong> Zerreißung ist die frühzeitige ELV angezeigt, um zudem alveolo-pulmonalvenöse<br />
und dadurch systemarterielle Gasembolien zu verhüten.<br />
Relative Indikationen zur Seitentrennung <strong>der</strong> Atemwege s<strong>in</strong>d von <strong>der</strong> besseren Zugänglichkeit<br />
des Operationsfeldes durch sog. „Ruhigstellung“ bei parenchymsparenden Lungenresektionen,<br />
Ösophagus- und m<strong>in</strong>imal-<strong>in</strong>vasiver Herz- und Aortenchirurgie bestimmt.<br />
Die erwartete Präzision des operativen Vorgehens unter guten Sichtverhältnissen, <strong>in</strong>sbeson<strong>der</strong>e<br />
bei Video-assistierter <strong>Thoraxchirurgie</strong> (VATS: Video-Assisted Thoracic Surgery),<br />
kann tatsächlich nur unter ELV verwirklicht werden.<br />
Die Seitentrennung <strong>der</strong> Atemwege ist unbed<strong>in</strong>gt notwendig bei Risiko von Sekretverschleppung,<br />
Spannungspneumothorax, e<strong>in</strong>seitiger Lungenüberblähung und hohem<br />
Gasverlust durch Leckage. Indikation ist ebenso die Ruhigstellung <strong>der</strong> chirurgisch<br />
exponierten Seite. Die Unterscheidung von absoluter und relativer Indikation zur Seitentrennung<br />
<strong>der</strong> Atemwege und ELV ist somit obsolet.<br />
Techniken <strong>der</strong> Lungenseparation<br />
Die endobronchiale Intubation ist die e<strong>in</strong>fachste Form <strong>der</strong> Lungenseparation. Sie<br />
beschränkt sich auf die Revision nach rechtsseitiger Pneumonektomie (Bronchusstumpf-<br />
Insuffizienz), wenige E<strong>in</strong>griffe im Säugl<strong>in</strong>gsalter und <strong>in</strong> Notfällen. Bei Thoraxtrauma<br />
kann zur kurzzeitigen Überbrückung e<strong>in</strong>er kritischen Situation (zentrale Leckage, z.B.<br />
kar<strong>in</strong>anaher Tracheal- o<strong>der</strong> Bronchusriss) versucht werden, mit e<strong>in</strong>em dünnen Trachealtubus<br />
zunächst endobronchial zu <strong>in</strong>tubieren und diese Lungenseite mit re<strong>in</strong>em O 2 zu<br />
beatmen. Wegen des kurzen rechten Stamm-Bronchus mit Gefahr <strong>der</strong> Verlegung des<br />
Oberlappen-Bronchus ist es günstig, wenn <strong>der</strong> Tubus l<strong>in</strong>ksseitig platziert werden kann.<br />
Bei endobronchialer Intubation ist die von <strong>der</strong> Ventilation ausgeschlossene Lunge nicht<br />
für Absaugmanöver, Bronchoskopie o<strong>der</strong> zusätzliche O 2 -Applikation zugänglich.<br />
Doppellumentubus (DLT)<br />
Der Doppellumentubus ist das am meisten für Seitentrennung <strong>der</strong> Atemwege (Lungenseparation)<br />
und E<strong>in</strong>lungen-Ventilation (ELV) e<strong>in</strong>gesetzte Instrument [106].<br />
19
20<br />
DLT li DLT re<br />
Abb. 1: jeweils distaler Anteil e<strong>in</strong>es l<strong>in</strong>ks- bzw. rechtsseitigen DLT nach Robertshaw <strong>in</strong> situ (schematisch);<br />
Weiteres s. Text.<br />
Je<strong>der</strong> DLT hat parallellaufend e<strong>in</strong>en kürzeren trachealen und e<strong>in</strong>en längeren bronchialen<br />
Tubusschenkel (Abb. 1). Entsprechend Anatomie des Bronchialbaumes werden l<strong>in</strong>ks- und<br />
rechtsseitige DLT unterschieden, die jeweils <strong>in</strong> den l<strong>in</strong>ken o<strong>der</strong> rechten Hauptbronchus<br />
platziert werden. Die seitengetrennte Beatmung wird ermöglicht durch:<br />
- e<strong>in</strong>en Tracheal-Cuff, <strong>der</strong> die Abdichtung nach außen sichert und<br />
- e<strong>in</strong>en endobronchialen Cuff, <strong>der</strong> die Separation <strong>der</strong> e<strong>in</strong>en von <strong>der</strong> an<strong>der</strong>en Lunge<br />
gewährleistet.<br />
Den Vorzug genießen heute DLT aus Poly-V<strong>in</strong>yl-Chlorid (PVC) ohne Kar<strong>in</strong>asporn (DLT<br />
nach Robertshaw). Ursprünglich und z.T. bis <strong>in</strong> die Gegenwart benutzte DLT nach Carlens<br />
(l<strong>in</strong>ksseitig) bzw. White (rechtsseitig) besitzen e<strong>in</strong>en solchen Kar<strong>in</strong>asporn, <strong>der</strong> am<br />
Beg<strong>in</strong>n des bronchialen DLT-Anteils angebracht ist. Dieser soll sich beim Vorschieben<br />
des Tubus <strong>in</strong> <strong>der</strong> Hauptkar<strong>in</strong>a „festhaken“ und als merklicher Wi<strong>der</strong>stand die zu tiefe<br />
Intubation vermeiden. Allerd<strong>in</strong>gs erschwert e<strong>in</strong> Kar<strong>in</strong>ahaken die Intubation und erhöht<br />
das Risiko laryngealer und tracheobronchialer Verletzungen [41]. Auch schließt er die zu<br />
tiefe Intubation nicht aus [87]. Letzteres spricht gegen die Begründung für die zuweilen<br />
propagierte Bevorzugung spornbewährter DLT, um damit auf den E<strong>in</strong>satz <strong>der</strong> fiberoptischen<br />
Bronchoskopie zur exakten Tubus-Positionierung verzichten zu können (s.u.).<br />
Verletzungen s<strong>in</strong>d allerd<strong>in</strong>gs auch mit Robertshaw-Tuben möglich. Ursachen s<strong>in</strong>d Fehlposition<br />
<strong>der</strong> DLT-Spitze (häufig zu tiefe Intubation), hoher Cuffdruck (übermäßige Blähung<br />
des Bronchial-Cuffs bei meist bei zu kle<strong>in</strong>em DLT, N 2 O-Diffusion), zu große Tuben<br />
bei meist kle<strong>in</strong>en Frauen o<strong>der</strong> auch über die Tubusspitze h<strong>in</strong>aus ragende Mandr<strong>in</strong>s zur<br />
Unterstützung <strong>der</strong> Tubuse<strong>in</strong>führung <strong>in</strong> die Trachea [41]. Die Umlagerung des Patienten<br />
stellt, <strong>in</strong>sbeson<strong>der</strong>e bei geblockter Bronchialmanschette, e<strong>in</strong> eigenes Verletzungs-Risiko<br />
dar.<br />
Günstige Eigenschaften mo<strong>der</strong>ner DLT nach Robertshaw s<strong>in</strong>d:<br />
- Weniger traumatische Platzierung, Gewebefreundlichkeit sowie gute Anpassung an<br />
die anatomischen Strukturen <strong>in</strong>folge Erwärmung.<br />
- Bestückung mit Nie<strong>der</strong>druckmanschetten sowohl tracheal als auch bronchial.<br />
- Komfortable Innenlum<strong>in</strong>a bezüglich Beatmungswi<strong>der</strong>standes, Passage für Absaugkatheter<br />
und fiberoptische Bronchoskopie (FOB).<br />
- Gute Sicht-Orientierung bei fiberoptischer Kontrolle durch farbliche Kennzeichnung<br />
des bronchialen DLT-Anteils bei transparenter Tubuswand. Letztere ermöglicht zudem
das Erkennen von In- und Exspiration (Beschlagen durch Feuchtigkeit <strong>in</strong> <strong>der</strong> Ausatemluft)<br />
sowie Sekretion.<br />
Die Kontra<strong>in</strong>dikationen relativieren sich bei mo<strong>der</strong>nen DLT, beson<strong>der</strong>s unter E<strong>in</strong>satz<br />
<strong>der</strong> fiberoptischen Bronchoskopie (s.u.). Abzuwägen s<strong>in</strong>d dennoch:<br />
- Aspirationsrisiko,<br />
- H<strong>in</strong><strong>der</strong>nisse entlang <strong>der</strong> Tubuspassage: Tumor-Stenose, Missbildung o<strong>der</strong> Kompression<br />
von außen (mediast<strong>in</strong>ale Raumfor<strong>der</strong>ung, Struma, Tracheal-Verdrehung/-Verbiegung,<br />
Tumor<strong>in</strong>vasion,<br />
- E<strong>in</strong>satz bei K<strong>in</strong><strong>der</strong>n (
liche Bestimmung <strong>der</strong> Bronchiallänge (für die Tubusgröße auch des Bronchialdurchmessers)<br />
erfor<strong>der</strong>lich [50]. Um die tatsächlichen Bronchusmaße zu ermitteln, müssen dabei<br />
die aus <strong>der</strong> posterior-anterioren Thoraxübersichtsaufnahme gewonnenen Bronchuslänge<br />
(bzw. -durchmesser) um ca. 10% verr<strong>in</strong>gert werden.<br />
Für jede Intubation mittels DLT müssen Befunde von Thoraxröntgen, Bronchoskopie<br />
und Computertomografie berücksichtigt werden, um die <strong>in</strong>dividuell für den Patienten<br />
richtige Tubuswahl treffen zu können und H<strong>in</strong><strong>der</strong>nisse <strong>in</strong> Trachea und großen Bronchien<br />
vorab zu erkennen.<br />
Allerd<strong>in</strong>gs ist <strong>der</strong> E<strong>in</strong>satz des rechtsseitigen DLT für l<strong>in</strong>ksseitige Thorakotomien nach<br />
dem Pr<strong>in</strong>zip, den Hauptbronchus <strong>der</strong> E<strong>in</strong>griffsseite zu meiden, ebenso gerechtfertigt. Dies<br />
bietet den Vorteil, auch bei <strong>in</strong>traoperativer Entscheidung zur E<strong>in</strong>griffsausweitung bis h<strong>in</strong><br />
zu Pneumonektomie DLT-Position und ELV ungestört zu erhalten. Für bronchoplastische<br />
E<strong>in</strong>griffe, wenn Teile des Hauptbronchus zusammen mit dem Lungenlappen als sog.<br />
Bronchusmanschette reseziert werden, bewährt sich die vorausschauend kontralaterale<br />
endobronchiale Intubation beson<strong>der</strong>s. Unter Voraussetzung <strong>der</strong> fiberoptisch-bronchoskopischen<br />
Überwachung (s.u.) s<strong>in</strong>d mit dem rechtsseitigen DLT bis auf o.g. E<strong>in</strong>zelfälle<br />
ke<strong>in</strong>e entscheidenden Nachteile zu erwarten [25, 97]. Dies unterstreicht e<strong>in</strong>e neuere<br />
umfangreiche Studie an ca. 700 Patienten, bei <strong>der</strong> im Vergleich von rechts- und l<strong>in</strong>ksseitiger<br />
DLT-Version bezüglich des Auftretens von Hypoxämie, Hyperkapnie und hoher<br />
Atemwegsdrücke ke<strong>in</strong>e Unterschiede gefunden wurden [39].<br />
Die jeweils zu wählende DLT-Größe kann nach Alter, Geschlecht und Körpergröße<br />
geschätzt werden [97]. Danach ergibt sich folgende Orientierung:<br />
- Frauen bis 150 cm Körperhöhe erhalten e<strong>in</strong>en 32 Ch-, bis 160 cm e<strong>in</strong>en 35 Ch- und<br />
über 160 cm e<strong>in</strong>en 37 Ch-DLT,<br />
- Männer bis 160 cm Körperhöhe erhalten e<strong>in</strong>en 37 Ch-, bis 170 cm e<strong>in</strong>en 39 Ch- und<br />
über 170 cm e<strong>in</strong>en 41 Ch-DLT.<br />
Zuverlässiger jedoch sche<strong>in</strong>t die Wahl durch Abschätzung <strong>der</strong> lichten Weite des Hauptbronchus<br />
aus dem Trachealdurchmesser im a.p.-Röntgenbild (� Hauptbronchus = � Trachea<br />
· 0,68; [23]) o<strong>der</strong>, unlängst präzisiert, CT-gestützt (� Hauptbronchus = � Trachea ·<br />
0,75 für Männer bzw. 0,77 für Frauen; [22]). Danach ist es durchaus möglich, bei großen<br />
Frauen e<strong>in</strong>en DLT bis zu 39 Ch e<strong>in</strong>zusetzen. Die Erfahrung lehrt aber auch, dass sich<br />
beson<strong>der</strong>s bei kle<strong>in</strong>en Frauen (vorzugsweise aus dem asiatischen Raum) selbst <strong>der</strong> DLT<br />
von 32 Ch als zu groß erweist und e<strong>in</strong> DLT von 28 Ch e<strong>in</strong>gesetzt werden muss. Dies<br />
allerd<strong>in</strong>gs erfor<strong>der</strong>t bei E<strong>in</strong>satz <strong>der</strong> Fiberoptik Schaftgrößen unter 4 mm �. Bei Wi<strong>der</strong>ständen<br />
während <strong>der</strong> Intubation ist stets die nächst kle<strong>in</strong>ere Tubusgröße angezeigt.<br />
Die meist geeigneten DLT-Größen für Frauen s<strong>in</strong>d 35–37 Ch. und für Männer 39–41<br />
Ch.<br />
Die DLT-Intubation hat höchst sorgsam zu erfolgen.<br />
- Sie wird erleichtert, wenn <strong>der</strong> DLT mittels Plastik-Mandr<strong>in</strong>s im bronchialen Schenkel<br />
armiert und damit gleichzeitig durch Streckung se<strong>in</strong>es bronchialen Anteils <strong>der</strong> Form<br />
des Magill-Tubus angeglichen wird. Dies erspart die vom Carlens-Tubus her bekannten<br />
und empfohlenen Drehbewegungen, um die gebogene Tubusspitze bzw. auch den<br />
Kar<strong>in</strong>asporn im S<strong>in</strong>ne <strong>der</strong> Schonung des Kehlkopfes durch die vor<strong>der</strong>e Kommissur zu<br />
führen sowie auch das Anb<strong>in</strong>den des Kar<strong>in</strong>asporns, um e<strong>in</strong> Verhaken im laryngealen<br />
und trachealen Bereich zu vermeiden.<br />
- Im Moment <strong>der</strong> E<strong>in</strong>führung <strong>der</strong> DLT-Spitze <strong>in</strong> den Larynx-E<strong>in</strong>gang bef<strong>in</strong>det sich <strong>der</strong><br />
tracheale Cuff <strong>in</strong> Höhe <strong>der</strong> oberen Schneidezähne, was schonende Handhabung voraussetzt.<br />
- Als wichtige Orientierung bei <strong>der</strong> Passage des Tubus durch den Larynx dient beim<br />
22
Erwachsenen die Krikoid-Enge als fühlbare Durchtrittsbegrenzung für e<strong>in</strong>en unpassend<br />
großen Tubus. Aus <strong>der</strong> verlässlichen Korrelation zwischen Weite von Krikoid<br />
und l<strong>in</strong>kem Hauptbronchus kann abgeleitet werden, dass nach ungeh<strong>in</strong><strong>der</strong>tem Durchtritt<br />
e<strong>in</strong>es DLT dessen bronchialer Schenkel ohne Verletzungsrisiko im l<strong>in</strong>ken Hauptbronchus<br />
platziert werden kann [93].<br />
- Hat <strong>der</strong> bronchiale Schenkel die Glottis passiert, wird <strong>der</strong> Mandr<strong>in</strong> entfernt und <strong>der</strong><br />
Tubus unter ger<strong>in</strong>ger Streckung und leichter Drehung von Kopf und Hals <strong>in</strong> Richtung<br />
des zu <strong>in</strong>tubierenden Hauptbronchus vorgeführt.<br />
- E<strong>in</strong> erster fe<strong>der</strong>n<strong>der</strong> Wi<strong>der</strong>stand zeigt das Erreichen <strong>der</strong> Hauptkar<strong>in</strong>a an, e<strong>in</strong> zweiter<br />
die schon zu tiefe Intubation. Die DLT-Platzierung <strong>in</strong> den jeweiligen Hauptbronchus<br />
soll jedoch ohne zu großen Wi<strong>der</strong>stand (Tubus zu groß gewählt) erfolgen. Die zu tiefe<br />
Intubation (bei meist zu kle<strong>in</strong>em DLT) ist zu vermeiden, da hierbei häufiger als mit zu<br />
großen DLT Verletzungen <strong>der</strong> Atemwege auftreten [41].<br />
- Es gilt, dass korrekter DLT-Sitz bei 170 cm Körperhöhe gut mit <strong>der</strong> E<strong>in</strong>führungstiefe<br />
von 29 cm korreliert, für +/-10 cm Körpergröße muss die Intubationstiefe um +/-1 cm<br />
korrigiert werden. Dann wird <strong>der</strong> Tracheal-Cuff vorsichtig gebläht, die endobronchiale<br />
Blockade erfolgt später.<br />
Die Blähung des bronchialen Cuffs muss ebenso sorgsam erfolgen, um Druckschäden<br />
am Hauptbronchus zu vermeiden, so erst nach Sicherung <strong>der</strong> regelrechten DLT-Position<br />
o<strong>der</strong> sogar erst nach Lagerung des Patienten zur Operation, am besten unter fiberoptischer<br />
Sicht. Nur bei „feuchter Lunge“ ist nach <strong>der</strong> trachealen sofort auch die „bl<strong>in</strong>de“ bronchiale<br />
Blockade mit 1 bis maximal 3 ml Luft s<strong>in</strong>nvoll, wonach die subtile Funktionskontrolle<br />
erfolgt. Steht ke<strong>in</strong> Fiberskop zur Verfügung, wird <strong>der</strong> bronchiale DLT-Cuff mit 1-2 ml<br />
Luft befüllt und unter gemessener o<strong>der</strong> digital gefühlter Erhöhung des Cuff-Druckes bl<strong>in</strong>d<br />
<strong>in</strong> den Hauptbronchus geschoben. Mit Platzierung des bronchialen Schenkels soll sich <strong>der</strong><br />
Cuff-Druck merklich, etwa auf das Doppelte erhöhen [8]. Inkomplette bronchiale Abdichtung<br />
wird durch Austritt von Atemgas über den trachealen Schenkel nach dessen Ausschluss<br />
von <strong>der</strong> Ventilation und Beatmung über die endobronchial <strong>in</strong>tubierte Seite angezeigt.<br />
Um Verletzungen durch den DLT zu vermeiden, muss <strong>in</strong> allen Phasen se<strong>in</strong>er Platzierung<br />
höchst sorgsam vorgegangen werden. Pr<strong>in</strong>zipiell soll <strong>der</strong> DLT mit vertretbar größtmöglichem<br />
Durchmesser gewählt werden:<br />
- um die Atemwegswi<strong>der</strong>stände zu m<strong>in</strong>imieren,<br />
- da e<strong>in</strong> größerer DLT seltener zu tief und somit zuverlässiger platziert wird,<br />
- da bei diesem <strong>der</strong> endobronchiale Cuff bereits mit ger<strong>in</strong>ger Füllung von 1-3 ml dicht<br />
sitzt und<br />
- so das Risiko e<strong>in</strong>es Bronchustraumas ger<strong>in</strong>ger ist [41].<br />
Die kl<strong>in</strong>ische Prüfung <strong>der</strong> DLT-Position erfolgt durch wechselweises Abklemmen <strong>der</strong><br />
Tubusschenkel bei manueller Beatmung unter Inspektion und Auskultation. Die Prüfung<br />
nach dem Pr<strong>in</strong>zip „looks good, feels good, sounds good“ dient vorrangig <strong>der</strong> Kontrolle,<br />
ob das bronchiale DLT-Ende im seitengerechten Hauptbronchus liegt. Die Häufigkeit<br />
primärer Fehl<strong>in</strong>tubation des falschen Hauptbronchus bei „bl<strong>in</strong><strong>der</strong>“ Platzierung liegt zwischen<br />
7 und 30% [60].<br />
23
Der DLT liegt:<br />
korrekt, wenn beidseits atemsynchrone Thoraxbewegung und Atemgeräusch vorhanden<br />
s<strong>in</strong>d, die bei Abklemmen e<strong>in</strong>es Tubusschenkels auf <strong>der</strong> ipsilateralen Seite verschw<strong>in</strong>den,<br />
im falschen Hauptbronchus, wenn bei Abklemmung e<strong>in</strong>es Schenkels Atemgeräusch<br />
und -exkursion ipsilateral fortbestehen,<br />
zu tief, wenn schon vor Abklemmen e<strong>in</strong>es Schenkels nur e<strong>in</strong>e Lunge belüftet wird und<br />
nach Abklemmen <strong>der</strong> Gegenseite <strong>der</strong> Atemwi<strong>der</strong>stand, oft mit Giemen und Brummen,<br />
deutlich steigt,<br />
<strong>in</strong> <strong>der</strong> Trachea, wenn trotz Abklemmen e<strong>in</strong>es Tubusschenkels beide Lungen belüftet<br />
bleiben.<br />
Bei Verdacht auf Fehllage soll anstatt mehrmaliger Korrekturversuche bereits hier die<br />
fiberoptische Bronchoskopie zur Platzierung des Tubus e<strong>in</strong>gesetzt werden.<br />
Es ist mit kl<strong>in</strong>ischen Mitteln schwer, Fehllagen e<strong>in</strong>es DLT außerhalb <strong>der</strong> beschriebenen<br />
Extreme zu erkennen. Zudem erschweren pulmonale Erkrankungen Inspektion, Auskultation<br />
und Ventilation. Während <strong>der</strong> Operation, speziell <strong>in</strong> Seitenlage, ist e<strong>in</strong>e verlässliche<br />
alle<strong>in</strong> kl<strong>in</strong>ische DLT-Funktionskontrolle praktisch unmöglich.<br />
Fiberoptische Bronchoskopie (FOB) bei DLT-Anwendung<br />
Auch wenn die kl<strong>in</strong>ische Lagekontrolle zunächst als Anzeichen e<strong>in</strong>er unkomplizierten<br />
„bl<strong>in</strong>den“ DLT-E<strong>in</strong>führung gelten mag, ergibt die Überprüfung mittels FOB oft Lageabweichungen,<br />
die <strong>in</strong> ca. 25% durch <strong>in</strong>suffiziente Seitentrennung o<strong>der</strong> Beatmungsprobleme<br />
relevant werden können [61, 87]. Wegen <strong>der</strong> anatomischen Gegebenheiten s<strong>in</strong>d rechtsseitige<br />
DLT häufiger (über 80%) betroffen als l<strong>in</strong>ksseitige.<br />
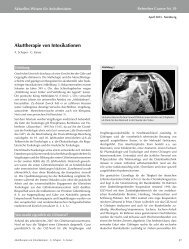
FOB-Kriterien für die regelrechte DLT-Position s<strong>in</strong>d (Abb. 2):<br />
- Blick durch tracheales Lumen: ungeh<strong>in</strong><strong>der</strong>te Sicht auf die Bifurkation sowie <strong>in</strong> die<br />
Ostien des jeweils nicht <strong>in</strong>tubierten Stammbronchus (die Hauptkar<strong>in</strong>a darf nicht<br />
durch den bronchialen Cuff verdrängt se<strong>in</strong>). Der Oberrand <strong>der</strong> bronchialen Manschette<br />
soll, sicher distal <strong>der</strong> Hauptkar<strong>in</strong>a liegend, noch zu sehen se<strong>in</strong>.<br />
- Blick durch bronchiales Lumen: une<strong>in</strong>geschränkte Sicht auf die jeweilige Aufzweigung<br />
<strong>der</strong> Hauptbronchien (Identifizierung des Unterlappenspitzensegments B6 ist<br />
dabei wichtig). Beim rechtsseitigen DLT soll sich mit Blick durch das seitliche<br />
„Auge“ <strong>der</strong> OL-Bronchus darstellen.<br />
Abb. 2: L<strong>in</strong>ks: Regelrechte Lage e<strong>in</strong>es rechtsseitigen DLT, rechts: Regelrechte Lage e<strong>in</strong>es l<strong>in</strong>ksseitigen DLT<br />
(jeweils n. Robertshaw); OL re: rechter Oberlappen-Bronchus; OL li: l<strong>in</strong>ker Oberlappen-Bronchus; UL re: rechter<br />
Unterlappen-Bronchus; UL li: l<strong>in</strong>ker Unterlappen-Bronchus; ML: Mittellappen-Bronchus; B6: Segmentbronchus<br />
des rechten bzw. l<strong>in</strong>ken Unterlappen-Spitzensegments. Das „Auge“ weist auf Orientierungspunkte für die<br />
fiberoptische Inspektion (weiterführende Bilddokumentation hierzu s. [62]).<br />
24
Während Umlagerung des Patienten auf die Seite kommt es häufig zu DLT-Dislokation,<br />
vorwiegend nach proximal und dabei durchaus so weit, dass sich <strong>der</strong> bronchiale DLT-<br />
Anteil dann komplett <strong>in</strong> <strong>der</strong> Trachea o<strong>der</strong> sogar auf <strong>der</strong> Gegenseite bef<strong>in</strong>det [61]. Dies ist<br />
kl<strong>in</strong>isch nicht immer sofort erkennbar. Zudem erweist sich die DLT-Replatzierung ohne<br />
Fiberskop, das neben se<strong>in</strong>er optischen Funktion ebenso als Platzierungshilfe dient, als<br />
schwierig. Intraoperativ ergeben sich erneut Indikationen zur FOB. Dazu zählen wie<strong>der</strong>um<br />
DLT-Korrekturen, jetzt meist hervorgerufen durch chirurgische Manipulation o<strong>der</strong><br />
Blut bzw. Sekret <strong>in</strong> den Atemwegen.<br />
Die Ausführungen werden damit unterstrichen, dass offenbar e<strong>in</strong> Zusammenhang zwischen<br />
DLT-Fehlposition und Beatmungsproblemen mit <strong>in</strong>sbeson<strong>der</strong>e Hypoxämie<br />
besteht [58, 80]. Auch s<strong>in</strong>d Risiken wie gefährden<strong>der</strong> Sekretüberlauf <strong>in</strong> die gesunde<br />
Lunge und Bee<strong>in</strong>trächtigung <strong>der</strong> Operationsbed<strong>in</strong>gungen ohne FOB vermehrt. Der<br />
rechtsseitige DLT ist ohne FOB kaum problemlos zu nutzen [28, 44]. Kapnografie und<br />
Spirografie können Lageverän<strong>der</strong>ungen des DLT zwar anzeigen, die Reposition gel<strong>in</strong>gt<br />
jedoch am sichersten mittels FOB [106].<br />
DLT-Fehllagen s<strong>in</strong>d Haupt-Ursache für Sekretüberlauf mit Kontam<strong>in</strong>ation <strong>der</strong> „gesunden“,<br />
beatmeten Lunge sowie für Beatmungsprobleme und <strong>in</strong>sbeson<strong>der</strong>e Hypoxämien<br />
während ELV.<br />
Es erweist sich somit vorteilhaft, die fiberoptisch-bronchoskopische Tubusüberwachung<br />
bei je<strong>der</strong> DLT-Anwendung zu benutzen, da die alle<strong>in</strong>ige kl<strong>in</strong>ische DLT-Prüfung als zwar<br />
notwendiges, aber unzureichendes Verfahren zur Kontrolle dieses Luftwegs anzusehen<br />
ist. Die Überlegenheit <strong>der</strong> FOB ist seit <strong>der</strong> ersten Untersuchung im Bereich <strong>der</strong> pädiatrischen<br />
<strong>Thoraxchirurgie</strong> 1982 schnell durch e<strong>in</strong>e große Anzahl von Studien h<strong>in</strong>reichend<br />
belegt worden [57, 58, 61, 87, 104]. Bereits 1993 erfolgte die Empfehlung zur rout<strong>in</strong>emäßigen<br />
fiberoptischen DLT-Überwachung [14]. Dies wurde bis auf wenig Wi<strong>der</strong>spruch [21,<br />
85, 94] <strong>in</strong>ternationaler Konsens [14, 39, 58, 61, 80, 97, 106, 107].<br />
Im Übrigen dient die Fiberoptik <strong>in</strong> verschiedenen Situationen bei „Schwierigem Atemweg“<br />
zur primären DLT-Intubation und -Platzierung (s.u.) sowie <strong>der</strong> Unterscheidung von<br />
Tubusfehllagen und Blut- bzw. Sekretverlegung aber auch zur Verhütung o<strong>der</strong> Erkennung<br />
möglicher Verletzungen durch DLT. Alle<strong>in</strong> ihr regelmäßiger E<strong>in</strong>satz verschafft die notwendige<br />
Übung, auch <strong>in</strong> schwierigen Situationen, wo <strong>der</strong> FOB-E<strong>in</strong>satz unumgänglich<br />
wird, erfolgreich DLT-Position zu sichern sowie Hypoventilation, Hypoxämie und<br />
Sekretverschleppung zu vermeiden.<br />
Die fiberoptische Bronchoskopie soll nach Intubation, spätestens aber nach (je<strong>der</strong>)<br />
Umlagerung des Patienten sowie <strong>in</strong>traoperativ e<strong>in</strong>gesetzt werden, wann immer sich <strong>der</strong><br />
Verdacht auf DLT-Lageverän<strong>der</strong>ung abzeichnet, Probleme <strong>der</strong> Seitentrennung o<strong>der</strong><br />
H<strong>in</strong>weise für e<strong>in</strong>e Tubusverlegung auftreten. E<strong>in</strong>e e<strong>in</strong>zige Bronchoskopie dient:<br />
- als sichere, optische Kontrolle <strong>der</strong> funktionsgerechten DLT-Position<br />
- dem schonenden Absaugen unter direkter Sicht<br />
- als Platzierungshilfe für den DLT (im S<strong>in</strong>ne e<strong>in</strong>es Mandr<strong>in</strong>s).<br />
Bei DLT-Anwendung s<strong>in</strong>d Fiberbronchoskope mit größerer Steifigkeit und e<strong>in</strong>er Arbeitslänge<br />
von 600 mm (sog. Intubationsfiberskope) am besten geeignet. Der Außendurchmesser<br />
<strong>der</strong> Geräte sollten etwa 4 mm und ihr Instrumentierkanal nicht wesentlich unter 1,5<br />
mm betragen.<br />
Komb<strong>in</strong>ation von Fiberbronchoskopie und Videotechnik bietet schnelles Erlernen <strong>der</strong><br />
Methodik, bessere Befunddokumentation und unterstützt die Kooperation mit dem<br />
Operateur.<br />
25
Bronchusblocker (BB)<br />
Das Pr<strong>in</strong>zip von Bronchusblockern zur Atemwegstrennung besteht dar<strong>in</strong>, dass die Beatmung<br />
<strong>der</strong> Lunge, unabhängig ob Zwei- o<strong>der</strong> E<strong>in</strong>lungenventilation, über e<strong>in</strong>en endotracheal<br />
platzierten Tubus (ETT) erfolgt, und <strong>der</strong> Ausschluss <strong>der</strong> jeweiligen Lungenseite durch<br />
e<strong>in</strong>en <strong>in</strong> den entsprechenden Hauptbronchus platzierten dünnen Katheter mit endständigem<br />
Ballon sowie zentralem Lumen für Absaugung und Gas<strong>in</strong>sufflation erreicht wird<br />
(Abb. 3). Voraussetzung zur Platzierung jedes BB ist <strong>der</strong> E<strong>in</strong>satz des fiberoptischen Bronchoskops.<br />
Außer dem nicht vor<strong>der</strong>gründigen Aspekt <strong>der</strong> e<strong>in</strong>facheren Intubation liegen die<br />
Vorteile <strong>der</strong> BB-Anwendung (beim Erwachsenen) <strong>in</strong> <strong>der</strong> Nutzung von Universal-Bronchoskopen<br />
mit größerem Arbeitskanal. Dies erlaubt bessere Sekretentfernung, nicht<br />
jedoch auf <strong>der</strong> blockierten Seite! Außerdem ist leicht <strong>der</strong> Wechsel des BB zwischen beiden<br />
Hauptbronchien möglich, was die Verwendung bei Lungentransplantation beliebt<br />
macht.<br />
Abb. 3: BB-Anwendung zur Seitentrennung <strong>der</strong> Atemwege (schematisch); a: Platzierung des Blockers im l<strong>in</strong>ken<br />
Hauptbronchus, b: Durch Inflation des Blocker-Cuffs wird die l<strong>in</strong>ke Lunge von <strong>der</strong> Ventilation über den<br />
liegenden Trachealtubus ausgeschlossen.<br />
Bei den Möglichkeiten <strong>der</strong> Separation mittels BB, <strong>der</strong> Anwendung des Univent ® -Tubus<br />
mit <strong>in</strong>tegriertem BB o<strong>der</strong> <strong>der</strong> Komb<strong>in</strong>ation e<strong>in</strong>es ETT mit s<strong>in</strong>gulärem BB, sche<strong>in</strong>t sich<br />
letztere <strong>in</strong> <strong>der</strong> Variante nach Arndt (Fa. COOK) mit <strong>in</strong>tegrierter Führungsschlaufe durchzusetzen.<br />
Der BB wird <strong>in</strong> <strong>der</strong> Regel durch e<strong>in</strong> Bronchoskopie-Diaphragma <strong>in</strong>nerhalb des ETT <strong>in</strong> die<br />
Trachea e<strong>in</strong>geführt. Danach wird e<strong>in</strong> Fiberbronchoskop, dessen äußerer Durchmesser<br />
Raum sowohl für die Bewegung des BB als auch Beatmung lassen muss, ebenfalls durch<br />
den Tubus e<strong>in</strong>geführt und dieser <strong>in</strong> Richtung des zu blockierenden Hauptbronchus vorgeschoben.<br />
Nun kann <strong>der</strong> BB unter FOB-Sicht platziert werden. Nach Rückzug des Tubus<br />
<strong>in</strong> die Trachea wird die Blockermanschette unter FOB-Kontrolle bis zur Abdichtung<br />
gebläht. E<strong>in</strong> den mo<strong>der</strong>nen Sets beigefügter Mehrwegadapter fungiert zugleich als Konnektor<br />
für Tubus und Beatmungsgerät sowie für die dichte und vone<strong>in</strong>an<strong>der</strong> unabhängige<br />
Passage von Fiberbronchoskop und BB, was die Platzierung ohne Undichtigkeit bei <strong>der</strong><br />
Beatmung erleichtert. Reicht <strong>der</strong> Querschnitt des Tubuslumens nicht aus, den BB und<br />
zugleich e<strong>in</strong> dünnes Fiberskop aufzunehmen (z.B. Atemwegstrennung bei Säugl<strong>in</strong>gen),<br />
muss <strong>der</strong> BB neben dem Tubus <strong>in</strong> den Bronchus geführt werden. Da dann die Bewegung<br />
des Katheters oft durch den Tubus beh<strong>in</strong><strong>der</strong>t wird, muss <strong>der</strong> BB vor Intubation des Endotrachealtubus<br />
unter bronchoskopischer Sicht <strong>in</strong> den zu blockierenden Hauptbronchus<br />
gebracht werden.<br />
Der Univent ® -Tubus ist e<strong>in</strong> E<strong>in</strong>lumentubus aus Silikonpolymer, <strong>in</strong> dessen vor<strong>der</strong>er (konkaver)<br />
Wand <strong>der</strong> Katheter e<strong>in</strong>es BB verschieblich geführt ist. Die BB s<strong>in</strong>d mit mo<strong>der</strong>nem<br />
Nie<strong>der</strong>druck-Cuff ausgestattet. Bei <strong>der</strong> Intubation ist <strong>der</strong> Blockerkatheter mit entleerter<br />
Manschette vollständig <strong>in</strong> den Seitenkanal zurückgezogen. Wegen <strong>der</strong>, bed<strong>in</strong>gt durch die<br />
Blockerführung, verdickten Wandung ist das Verhältnis Außen- zu Innendurchmesser<br />
26
(ID) ungünstiger als beim herkömmlichen ETT. So hat <strong>der</strong> kle<strong>in</strong>ste Univent ® -Tubus mit<br />
3.5 mm ID bereits e<strong>in</strong>en äußeren Durchmesser von 7.5 mm; e<strong>in</strong> normaler Tubus mit diesem<br />
Außendurchmesser 5.5-6 mm ID. Für die Seitentrennung <strong>der</strong> Luftwege bei K<strong>in</strong><strong>der</strong>n<br />
unter 6 Jahren bzw. 20 kg KM s<strong>in</strong>d Univent ® -Tubi deshalb ungeeignet. Zur l<strong>in</strong>ksseitigen<br />
Blockade wird <strong>der</strong> Tubus mit se<strong>in</strong>er konkaven Biegung und dem schrägen Anschnitt <strong>der</strong><br />
Spitze entsprechend zum l<strong>in</strong>ken Hauptbronchus gedreht. Zur Blockade des rechten<br />
Hauptbronchus ist dieses Manöver aus anatomischen Gründen meist entbehrlich. Der BB<br />
wird nun unter FOB-Kontrolle und unter Nutzung <strong>der</strong> Abknickung <strong>in</strong> den Hauptbronchus<br />
e<strong>in</strong>geführt. Dann wird die BB-Manschette behutsam bis zur zuverlässigen Abdichtung<br />
gebläht.<br />
Vergleich zwischen DLT und BB<br />
Neuere Studien zeigen bezüglich Qualität <strong>der</strong> Seitentrennung, Dislokationen <strong>der</strong> Manschetten<br />
aus dem Hauptbronchus, Anzahl notwendiger Bronchoskopien ke<strong>in</strong>e entscheidenden<br />
Unterschiede zwischen DLT, mo<strong>der</strong>nen Univent-Tubi und Arndt-BB [24, 60, 68].<br />
Allerd<strong>in</strong>gs sche<strong>in</strong>t <strong>der</strong> Zeitaufwand für die Platzierung bei Arndt-BB höher. Zudem kann<br />
die Lungenentlüftung, speziell bei rechtsseitiger Blockade mittels BB durch dessen dünnes<br />
Katheterlumen erschwert se<strong>in</strong>. An<strong>der</strong>erseits s<strong>in</strong>d BB gegenüber DLT bezüglich postoperativer<br />
Heiserkeit und Rachenbeschwerden offenbar etwas schonen<strong>der</strong> [63].<br />
Nachteile von Bronchusblockern s<strong>in</strong>d [76]:<br />
- Katheter engen ETT-Lumen e<strong>in</strong>, was auch bei Erwachsenen die suffiziente Ventilation<br />
beh<strong>in</strong><strong>der</strong>n kann. E<strong>in</strong> Tubus-Lumen von > 4–5 mm soll erhalten bleiben.<br />
- Das ger<strong>in</strong>ge Lumen des Bronchusblockers erschwert, beson<strong>der</strong>s bei rechtsseitiger<br />
Blockade, e<strong>in</strong>e schnell erfor<strong>der</strong>liche Be- o<strong>der</strong> Entlüftung <strong>der</strong> von <strong>der</strong> Ventilation<br />
ausgeschlossenen Seite. So kann die Operationsfeld-Darstellung zur VATS ggf. beh<strong>in</strong><strong>der</strong>t<br />
o<strong>der</strong> e<strong>in</strong>e notwendige Blähung bei Oxygenierungs- Störung verzögert werden.<br />
- Die bronchoskopische Kontrolle <strong>der</strong> nichtventilierten Lunge ist bei BB ohne Aufhebung<br />
<strong>der</strong> Blockade nicht möglich. Für Pneumonektomie und bronchoplastische E<strong>in</strong>griffe<br />
s<strong>in</strong>d sie deshalb generell ungeeignet.<br />
- Verlegung des dünnen BB-Katheterlumens durch Sekret o<strong>der</strong> Blut ist leicht möglich<br />
und so das Sekret-Management schlecht gewährleistet.<br />
- Wurde <strong>der</strong> BB primär zum Schutz vor Überlauf aus <strong>der</strong> erkrankten <strong>in</strong> die gesunde<br />
Lunge gelegt, ist beim Zurückgleiten <strong>der</strong> Blockermanschette <strong>in</strong> die Trachea mit<br />
Sekretüberflutung <strong>der</strong> gesunden Lunge zu rechnen.<br />
- Darüber h<strong>in</strong>aus besteht bei Dislokation des geblockten Blocker-Ballons <strong>in</strong> die Trachea<br />
(z.B. durch chirurgische Manipulation) das Risiko e<strong>in</strong>er gefährlichen Atemwegsobstruktion.<br />
- Differenzierte Beatmungsverfahren, wie die Anwendung <strong>der</strong> Hochfrequenz-Jet-Beatmung<br />
(HFJV), ist bei Anwendung von BB ohne Aufhebung <strong>der</strong> Seitentrennung nicht<br />
möglich, ebenso ist die CPAP-Applikation auf <strong>der</strong> von <strong>der</strong> Ventilation ausgeschalteten<br />
Lungen-Seite wegen <strong>der</strong> ger<strong>in</strong>gen Blockerlum<strong>in</strong>a erschwert.<br />
Dies begründet die weitreichende Anwendung von DLT. Unter sorgfältiger Abwägung<br />
zwischen den verschiedenen Techniken zur Seitentrennung <strong>der</strong> Atemwege ergeben sich<br />
dennoch die nachfolgend aufgeführten Indikationen für BB [76]:<br />
- Aspirationsrisiko, beson<strong>der</strong>s wenn weitere Faktoren h<strong>in</strong>zukommen.<br />
- Intubationsh<strong>in</strong><strong>der</strong>nis für DLT <strong>in</strong> Trachea und Stammbronchus (Tumor<strong>in</strong>filtration,<br />
Stenose, anatomische Abweichung).<br />
- Schwierige orotracheale Intubation des Erwachsenen und im Notfall.<br />
- Umgehen <strong>der</strong> Um<strong>in</strong>tubation bei Nachbeatmung o<strong>der</strong> bereits <strong>in</strong>tubiertem Patienten.<br />
- K<strong>in</strong><strong>der</strong> und kle<strong>in</strong>wüchsige Erwachsene (zumeist Frauen). Für die Seitentrennung <strong>der</strong><br />
27
Atemwege beim Kle<strong>in</strong>k<strong>in</strong>d und Säugl<strong>in</strong>g ist <strong>der</strong> BB unabd<strong>in</strong>gbar.<br />
- Selektive Blockade e<strong>in</strong>zelner, (zumeist) distaler Bronchien bei erhaltener Belüftung<br />
<strong>der</strong> übrigen Lungenbereiche (evtl. Unterstützung <strong>der</strong> Darstellung <strong>der</strong> Lappengrenzen),<br />
- Bei Hämoptyse ist die Bronchusblockade über den liegenden Endotrachealtubus das<br />
e<strong>in</strong>fachere Verfahren zur Seitentrennung <strong>der</strong> Atemwege.<br />
Es ist <strong>in</strong>dividuell abzuwägen, welches Verfahren <strong>der</strong> Lungenseparation, ob DLT o<strong>der</strong><br />
BB, zum E<strong>in</strong>satz kommen soll.<br />
Lungenseparation bei schwierigen Atemwegen<br />
Dabei s<strong>in</strong>d zwei pr<strong>in</strong>zipiell verschiedene Probleme zu berücksichtigen [60]:<br />
1. Schwierige Intubation im herkömmlichen S<strong>in</strong>n,<br />
2. H<strong>in</strong><strong>der</strong>nisse, wie z.B. Stenosen, Tumor<strong>in</strong>vasion o<strong>der</strong> Verletzungen im Bereich <strong>der</strong><br />
zentralen Atemwege subglottisch, tracheal o<strong>der</strong> im Bereich <strong>der</strong> Bifurkation, welche<br />
sowohl Platzierung von Luftwegen als auch Seitentrennung e<strong>in</strong>schließlich ELV erschweren<br />
o<strong>der</strong> unmöglich machen.<br />
Die fiberoptische Wach<strong>in</strong>tubation e<strong>in</strong>es DLT ist durch dessen ger<strong>in</strong>gere Flexibilität und<br />
den vergleichsweise größeren Außendurchmesser erschwert und so nicht immer durchführbar.<br />
Stattdessen erweist sich die Verwendung von BB unter Berücksichtigung o.g.<br />
Vor- und Nachteile für Patienten, die fiberoptisch nasotracheal <strong>in</strong>tubiert werden können<br />
und Tracheotomierte, als nützlich. Bei Passageh<strong>in</strong><strong>der</strong>nissen für DLT o<strong>der</strong> Univent ® -Tubus<br />
kann e<strong>in</strong> passen<strong>der</strong> ETT, den Verhältnissen gerecht, höhenvariabel e<strong>in</strong>gelegt werden,<br />
durch welchen dann e<strong>in</strong> BB unter FOB-Sicht platziert wird. Im Vorfeld erweist sich die<br />
CT-gestützte 3D-Rekonstruktion <strong>der</strong> Atemwege für die Wahl des passenden Lufweges<br />
hilfreich [38]. BB s<strong>in</strong>d außer <strong>in</strong> Komb<strong>in</strong>ation mit passenden ETT auch <strong>in</strong> Komb<strong>in</strong>ation<br />
mit Larynxmaske (LMA) als sicherer extratrachealer Luftweg für die <strong>Thoraxchirurgie</strong><br />
und als Führungsschiene, z.B. im Falle e<strong>in</strong>er subglottischen E<strong>in</strong>engung, wo sich zum<strong>in</strong>dest<br />
zwischenzeitlich selbst e<strong>in</strong> ETT verbietet o<strong>der</strong> zur Schonung des laryngo-trachealen<br />
Raumes, so bei Sängern, e<strong>in</strong>setzbar [105].<br />
Bei subglottischen Anomalien (z.B. Trachealverletzung nach Thoraxtrauma) muss jegliche<br />
Platzierung von Atemwegen strikt unter fiberoptischer Sicht erfolgen.<br />
Bei e<strong>in</strong>igen Indikationen zur ELV (Lavage e<strong>in</strong>er Lunge, nicht lokalisierte <strong>in</strong>trapulmonale<br />
Blutung, bronchoplastischer E<strong>in</strong>griff) kann allerd<strong>in</strong>gs auch beim Vorliegen von schwierigen<br />
Atemwegen auf e<strong>in</strong>e Intubation mittels DLT kaum verzichtet werden.<br />
Die fiberoptische Intubation ist, Übung mit <strong>der</strong> Technik vorausgesetzt, unter folgenden<br />
Bed<strong>in</strong>gungen am sedierten o<strong>der</strong> narkotisierten Patienten durchzuführen [60]:<br />
- ke<strong>in</strong>e Notfallsituation bzw. zeitliche Bedrängnis,<br />
- M<strong>in</strong>dest-Mundöffnung,<br />
- gute Schleimhautanästhesie für kooperativen, adäquat sedierten Patienten,<br />
- DLT <strong>in</strong> Warmwasserbad vorbereiten,<br />
- Laryngoskope<strong>in</strong>satz verbessert Passage und senkt Risiko von Weichteilschäden an<br />
Pharynx und Larynx (cave: Läsion <strong>der</strong> trachealen DLT-Manschette durch Zähne des<br />
Patienten).<br />
Unter direkter, fiberoptischer DLT-Führung können H<strong>in</strong><strong>der</strong>nisse passiert und e<strong>in</strong>e schonende<br />
def<strong>in</strong>itive Platzierung des Atemweges vorgenommen werden.<br />
Erweist sich die Intubation e<strong>in</strong>es DLT mittels Fiberoptik als nicht praktikabel, sollte<br />
zunächst auf fiberoptischem Weg e<strong>in</strong> üblicher Endotrachealtubus appliziert o<strong>der</strong> e<strong>in</strong>e<br />
LMA e<strong>in</strong>gesetzt werden. Hiernach bietet sich folgendes Vorgehen an:<br />
28
- über LMA: tracheale, fiberoptische Platzierung e<strong>in</strong>es A<strong>in</strong>tree ® -Katheters (Fa. COOK;<br />
Länge und Innenlumen s<strong>in</strong>d exakt auf Intubationsfiberskope bis � 4 mm abgestimmt,<br />
die somit problemlos durch das Katheterlumen zu führen s<strong>in</strong>d). Von e<strong>in</strong>er Intubation<br />
über LMA ohne FOB-Kontrolle wird wegen Verletzungsrisikos abgeraten.<br />
- Nach Rückzug des FOB wird jetzt im Austausch e<strong>in</strong> speziell für DLT-E<strong>in</strong>satz entwikkelter,<br />
längerer Tubuswechselkatheter (Fa. COOK) durch das Lumen des A<strong>in</strong>tree ® -<br />
Katheters <strong>in</strong> die Trachea platziert, da jener für den Wechsel auf DLT zu kurz ist. Beide<br />
Katheter s<strong>in</strong>d durch entsprechende Adapter zur O 2 -Insufflation zu nutzen.<br />
- Nunmehr wird <strong>der</strong> A<strong>in</strong>tree ® -Katheter über den liegenden DLT-Katheter entfernt und<br />
danach e<strong>in</strong> passen<strong>der</strong> DLT über diesen <strong>in</strong> die Trachea e<strong>in</strong>geführt. Nach Entfernung<br />
auch dieses Katheters erfolgt die korrekte DLT-Platzierung mittels FOB.<br />
- über ETT wird <strong>der</strong> DLT-Wechsel-Katheter <strong>in</strong> die Trachea platziert, was mehrere<br />
Schritte spart.<br />
Der E<strong>in</strong>satz von Tubuswechselkathetern ist nicht ohne Risiken. Sie dürfen niemals gegen<br />
Wi<strong>der</strong>stand vorgeschoben werden, und man muss sich immer <strong>der</strong> Insertionstiefe des<br />
Katheters bewusst se<strong>in</strong>. Darüber h<strong>in</strong>aus soll stets die O 2 -Insufflation möglich se<strong>in</strong>, falls<br />
sich <strong>der</strong> DLT nicht über den Wechselkatheter <strong>in</strong> die Trachea vorschieben lässt [28].<br />
Atemfunktion bei <strong>Thoraxchirurgie</strong><br />
Störungen des pulmonalen Gasaustauschs bei thoraxchirurgischen E<strong>in</strong>griffen stehen <strong>in</strong><br />
engem Zusammenhang zu negativen Effekten bei grundsätzlich je<strong>der</strong> Narkose. Beim<br />
Thoraxe<strong>in</strong>griff werden diese durch Ventilations/Perfusions-Missverhältnis <strong>in</strong>folge Seitenlagerung,<br />
Thoraxeröffnung und speziell E<strong>in</strong>lungen-Ventilation, aber auch durch<br />
typische respiratorische Begleiterkrankungen sowie chirurgisches Vorgehen moduliert<br />
und verstärkt.<br />
Ventilations-Perfusions-Verteilung (V/Q-Verteilung) unter <strong>Anästhesie</strong><br />
und Beatmung<br />
Gasaustauschstörung <strong>in</strong> Narkose ist vorrangig Folge e<strong>in</strong>es Ventilations-Perfusions-<br />
Missverhältnisses.<br />
Grund für e<strong>in</strong>e gestörte von V/Q-Verteilung ist die Abnahme <strong>der</strong> Funktionellen Residualkapazität<br />
(FRC) bereits bei Narkose-E<strong>in</strong>leitung, eng verbunden mit Entstehen von Atelektasen<br />
<strong>in</strong> abhängigen, <strong>in</strong> Rückenlage dorsobasalen Lungenabschnitten [37, 71]. Die Verän<strong>der</strong>ungen<br />
s<strong>in</strong>d mit Abnahme <strong>der</strong> pulmonalen Compliance, Atemwegsverschluss mit „air<br />
trapp<strong>in</strong>g“ durch FRC-Absenkung unterhalb <strong>der</strong> Verschlusskapazität und Anstieg des pulmonalen<br />
Gefäßwi<strong>der</strong>stands (PVR) verbunden. Dabei s<strong>in</strong>d pulmonal-vaskuläre Leckage<br />
sowie gestörte Rechtsherzfunktion möglich. E<strong>in</strong> weiterer Grund ist, dass die dorsobasalen<br />
Lungenbereiche besser perfundiert werden als die apikoventralen. Mit Narkose und Beatmung<br />
erhöht sich damit die Ventilation ventraler, schlecht durchbluteter Lungenbereiche.<br />
Folgen davon s<strong>in</strong>d vermehrte Totraumventilation und, schwerwiegen<strong>der</strong>, die Zunahme<br />
des <strong>in</strong>trapulmonalen Rechts-L<strong>in</strong>ks-Shunts durch Entstehung gut perfundierter, jedoch<br />
unzureichend (V/Q-Quotient
Atelektasen<br />
Pulmonale Atelektasen als wichtige Ursache für die E<strong>in</strong>schränkung <strong>der</strong> Oxygenierung <strong>in</strong><br />
Narkose s<strong>in</strong>d seit langem thematisiert, <strong>der</strong> Nachweis konnte jedoch erst durch hyperdense<br />
Zonen im CT erbracht werden [37]. Es handelt sich bei diesen Atelektasen fast immer um<br />
kollabierte Lungenareale und kaum alveoläre Flüssigkeitsansammlungen. Sie bilden sich<br />
bereits unter Induktion <strong>der</strong> Narkose, danach s<strong>in</strong>d immerh<strong>in</strong> ca. 10% des Lungengewebes<br />
atelektatisch [70]. Dies betrifft unabhängig vom Alter 90% <strong>der</strong> Patienten. Individuell<br />
korreliert die Höhe des Shunts direkt mit dem Ausmaß <strong>der</strong> atelektatischen Areale, dies<br />
ebenso ohne Altersabhängigkeit [51]. Die erwähnte altersabhängige Zunahme <strong>der</strong> Oxygenierungsstörung<br />
ist also nicht Folge <strong>der</strong> Atelektasenbildung son<strong>der</strong>n <strong>der</strong> Ausprägung <strong>der</strong><br />
V/Q-Störung <strong>in</strong>sgesamt. Dabei ist v.a. erhöhtes Verschlussvolumen <strong>in</strong> Relation zu FRC-<br />
Abnahme mit <strong>der</strong> Folge vermehrten air-trapp<strong>in</strong>gs im Alter verantwortlich, was bei COPD<br />
noch verstärkt wird. Bei Adipositas dagegen s<strong>in</strong>d v.a. Atelektasen e<strong>in</strong> wesentlicher Faktor<br />
des erhöhten Risikos e<strong>in</strong>er Oxygenierungsstörung.<br />
Kompressionsatelektasen<br />
Sie s<strong>in</strong>d unmittelbare Folge <strong>der</strong> <strong>in</strong>trathorakalen Volumenm<strong>in</strong><strong>der</strong>ung durch Narkosee<strong>in</strong>leitung<br />
und Muskelrelaxation. Voraussetzungen bilden die Senkung bzw. Aufhebung des<br />
Muskeltonus von Diaphragma sowie Interkostalmuskulatur und, <strong>in</strong>folge des <strong>in</strong>traabdom<strong>in</strong>ellen<br />
Druckes damit eng verbunden, die kraniale Verschiebung <strong>der</strong> Diaphragmaebene.<br />
Entscheidend für die Atelektasen-Bildung s<strong>in</strong>d Abnahme von FRC sowie <strong>der</strong> Gesamt-<br />
Compliance. Der FRC-Verlust liegt für Erwachsene bei ca. 0,5-0,8 l (~20%), u.U. auch<br />
deutlich darüber [37, 71]. Die Verän<strong>der</strong>ungen betreffen vorrangig die abhängigen, <strong>in</strong><br />
Rückenlage dorsobasalen Lungenabschnitte.<br />
Resorptionsatelektasen<br />
Zusätzlich entwickeln sich, wie<strong>der</strong>um v.a. <strong>in</strong> den abhängigen Lungenabschnitten und<br />
ziemlich schnell, Atelektasen durch Gasresorption. Regionen mit niedrigem V/Q-Quotient<br />
s<strong>in</strong>d dabei umso mehr betroffen, je höher die FiO 2 ist. Dies belegen Befunde direkt nach<br />
Narkosee<strong>in</strong>leitung [84] aber auch bei kurzzeitiger Gabe von 100% Sauerstoff vor Extubation<br />
[13]. Bei FiO 2 0,3 h<strong>in</strong>gegen prägen sich wesentlich weniger Atelektasen aus als bei<br />
1,0. An<strong>der</strong>erseits war unter FiO 2 0,3 o<strong>der</strong> 0,8 die Ausbildung von Atelektasen postoperativ<br />
bei Patienten nach Darme<strong>in</strong>griffen identisch [3]. E<strong>in</strong> M<strong>in</strong>destanteil Stickstoff <strong>in</strong> <strong>der</strong> Beatmungsluft<br />
kann somit das Problem offenbar lösen. Ke<strong>in</strong>esfalls ist damit die Notwendigkeit<br />
<strong>der</strong> Präoxygenierung zur Narkose <strong>in</strong> Frage gestellt, da die Atemwegs-Sicherung beim<br />
Thoraxe<strong>in</strong>griff schwierig und zeitaufwändig se<strong>in</strong> kann. Es wird aber, beson<strong>der</strong>s die ELV<br />
betreffend, <strong>der</strong> Blick bezüglich unkritisch hoher FiO 2 über längere Zeiträume geschärft.<br />
Ursachen für Atelektasen unter Narkose s<strong>in</strong>d Kompression von Lungenparenchym<br />
durch Abnahme des <strong>in</strong>trathorakalen Volumens (Kompressionsatelektasen) (s.o.) und<br />
Gasabsorption aus m<strong>in</strong><strong>der</strong>belüfteten bzw. verschlossenen Alveolarbereichen (Resorptionsatelektasen).<br />
Daneben hat auch die E<strong>in</strong>schränkung <strong>der</strong> Surfactant-Funktion Bedeutung.<br />
Vermeidung von Atelektasen<br />
Durch frühzeitige Maßnahmen zur Verhütung von Atelektasen wird neben Stabilisierung<br />
<strong>der</strong> Sauerstoffreserve <strong>in</strong>traoperativ das Risiko postoperativer Komplikationen e<strong>in</strong>schließlich<br />
nosokomialer Pneumonien gem<strong>in</strong><strong>der</strong>t [37]. Dies be<strong>in</strong>haltet die Rekrutierung m<strong>in</strong><strong>der</strong>belüfteter<br />
Lungenareale mittels Lungenblähung und effektiver PEEP-Applikation, mit<br />
Ziel von Normalisierung und Erhaltung <strong>der</strong> FRC unmittelbar nach Narkosee<strong>in</strong>leitung und<br />
beson<strong>der</strong>s auch dann, wenn e<strong>in</strong>e hohe FiO 2 länger zur Anwendung kam [77]. Zudem kann<br />
PEEP, schon während Präoxygenierung appliziert, Atelektasen m<strong>in</strong><strong>der</strong>n und bei Adiposi-<br />
30
tas zudem die Oxygenierung verbessern [31, 52]. Vorhandene atelektatische Areale erfor<strong>der</strong>n<br />
für ihre Rekrutierung Blähmanöver mit Hubvolum<strong>in</strong>a im Bereich <strong>der</strong> Vitalkapazität<br />
[84]. Dies hat zudem positive Wirkung auf die dort e<strong>in</strong>geschränkte Funktion des Surfactant,<br />
dessen Freisetzung und Verteilung über die Alveolarfläche begünstigt werden. Das<br />
Vorgehen stellt bezüglich Druck- bzw. Volumen-bed<strong>in</strong>gter Lungenschädigung ke<strong>in</strong> Risiko<br />
dar. Zudem sche<strong>in</strong>t PEEP alle<strong>in</strong> unzureichend, da <strong>der</strong> PaO 2 nicht zuverlässig steigt und<br />
m<strong>in</strong><strong>der</strong>belüftete Bereiche fortbestehen. PEEP-Rücknahme führt erneut zur Atelektasen-<br />
Bildung. Allerd<strong>in</strong>gs ist die PEEP-Wirkung auf die V/Q-Verteilung unterschiedlich. Meist<br />
kommt es zielgemäß zu Anpassung an die höhere regionale Perfusion und <strong>der</strong> Shunt<br />
nimmt ab. PEEP kann jedoch im E<strong>in</strong>zelfall durch die <strong>in</strong>trapulmonale Druckerhöhung<br />
lediglich zu Umverteilung von Perfusion <strong>in</strong> Richtung <strong>der</strong> atelektatischen Bereiche und<br />
somit Shunt-Zunahme führen. Auch kann e<strong>in</strong> sonst geschlossenes Foramen ovale bei<br />
PEEP-Erhöhung e<strong>in</strong>en kardialen Rechts-L<strong>in</strong>ks-Shunt <strong>in</strong>duzieren.<br />
Optimierung <strong>der</strong> Lungenventilation nach Intubation erfolgt durch:<br />
- sorgsame, manuelle Blähung um 40 cm H 2 O bis zu 10 sec pro Zyklus (cave: traumatisierte<br />
Lunge, Bullae, Blutdruckabfall, Hirndruck),<br />
- PEEP-Applikation >5 cm H 2 O schon unmittelbar während Exspiration nach Blähung,<br />
- FiO 2 < 0,6 - 0,8.<br />
E<strong>in</strong>fluss von Seitenlage und Thorax-Eröffnung<br />
Seitenlagerung des Patienten führt unter Zunahme <strong>der</strong> Höhendifferenz zwischen oberer<br />
und unterer Lunge durch Umverteilung zu stärkerer Perfusion <strong>der</strong> unteren, abhängigen<br />
Lunge, während die obere Lunge weniger durchblutet wird. Dabei reduziert sich <strong>der</strong> Blutfluss<br />
<strong>in</strong> <strong>der</strong> oben liegend rechten Lunge von 55 auf ca. 45%, o<strong>der</strong>, bei oben bef<strong>in</strong>dlicher<br />
l<strong>in</strong>ker Lunge, von 45 auf ca. 35% [76]. Dagegen ist die Ventilation <strong>der</strong> unteren, gut perfundierten<br />
Lunge <strong>in</strong> Seitenlage e<strong>in</strong>geschränkt. Ursache ist Parenchym-Kompression<br />
durch das Mediast<strong>in</strong>um und stärkere kraniale Verlagerung <strong>der</strong> unteren Diaphragmakuppel<br />
[47]. H<strong>in</strong>zu kommen beh<strong>in</strong><strong>der</strong>te Exkursion von Thoraxwand und Zwerchfell durch Lagerung<br />
und Lagerungshilfen. In <strong>der</strong> unteren Lunge nehmen zusätzlich zur E<strong>in</strong>schränkung<br />
mit Narkosebeg<strong>in</strong>n FRC und Compliance (bis < 20 ml/cm H 2 O) weiter ab. Das anteilige<br />
Atemvolumen <strong>der</strong> oberen Lunge steigt dagegen auf jetzt 55%, bed<strong>in</strong>gt durch Zunahme<br />
von FRC (bis zu 75%!) und Compliance. Die verm<strong>in</strong><strong>der</strong>te Durchblutung allerd<strong>in</strong>gs<br />
bed<strong>in</strong>gt, gemessen an <strong>der</strong> CO 2 -Elim<strong>in</strong>ation, nur 48% Ventilations-Effektivität. Nach<br />
Thorax-Eröffnung fallen für die obere Lunge die elastischen Retraktionskräfte <strong>der</strong> Thoraxwand<br />
weg, was mit nochmaliger Zunahme von Compliance und Hubvolumen verbunden<br />
ist. In <strong>der</strong> unteren Lunge h<strong>in</strong>gegen fallen FRC sowie Compliance weiter, womit<br />
Atelektasen und Bee<strong>in</strong>trächtigung <strong>der</strong> Oxygenierung nun erst recht Vorschub geleistet<br />
wird.<br />
Das mit Narkosebeg<strong>in</strong>n entstandene V/Q-Missverhältnis wird mit Seitenlagerung des<br />
Patienten und nochmals bei Thoraxeröffnung verstärkt. Basis dafür ist M<strong>in</strong><strong>der</strong>belüftung<br />
<strong>der</strong> gut perfundierten unteren Lunge im Gegensatz zu vorrangiger Belüftung <strong>der</strong> ger<strong>in</strong>ger<br />
durchbluteten, oberen Lunge.<br />
Gasaustausch bei E<strong>in</strong>lungen-Ventilation<br />
Bei <strong>in</strong>trathorakalen E<strong>in</strong>griffen ist es meist erfor<strong>der</strong>lich, die zu operierende Lungenseite<br />
von <strong>der</strong> Ventilation auszuschließen. Die Beatmung des Patienten erfolgt dann alle<strong>in</strong> über<br />
die an<strong>der</strong>e, <strong>in</strong> Seitenlage untere Lunge. Die E<strong>in</strong>lungen-Ventilation (ELV) hat grundsätzliche<br />
Konsequenzen:<br />
• pulmonaler Rechts-L<strong>in</strong>ks-Shunt durch Ausschluss <strong>der</strong> operierten Lunge von <strong>der</strong> Ventilation,<br />
31
•<br />
•<br />
32<br />
Zunahme des pulmonalvaskulären Wi<strong>der</strong>stands,<br />
verän<strong>der</strong>te Ventilation <strong>der</strong> beatmeten Lunge.<br />
Hypoxisch-pulmonale Vasokonstriktion<br />
Bei Übergang auf ELV <strong>in</strong> Seitenlage würde den Perfusionsverhältnissen entsprechend <strong>der</strong><br />
pulmonale Shunt von ca. 10% (oben und unten je 5%) um 30% (Ausschluss <strong>der</strong> l<strong>in</strong>ken<br />
Seite) bzw. um 40% (Ausschluss <strong>der</strong> rechten Seite) auf 40% bis 50% zunehmen. Dem<br />
aber wirkt kompensatorisch die hypoxisch-pulmonale Vasokonstriktion (HPV; Reflex<br />
nach Euler-Liljestrand) zur Stabilisierung <strong>der</strong> pulmonalen Oxygenierung entgegen [47,<br />
76]. Stimulus ist <strong>der</strong> Abfall <strong>der</strong> alveolären, <strong>in</strong> atelektatischen Bereichen auch des gemischt<br />
venösen PO 2 , woraus Gefäßkonstriktion und Erhöhung des pulmonalen Gefäßwi<strong>der</strong>stands<br />
resultieren. Ziel ist die Blutumleitung aus hypoxischen <strong>in</strong> nicht hypoxische Lungenareale.<br />
Bei kompletter Ausprägung <strong>der</strong> HPV beträgt die Abnahme <strong>der</strong> Durchblutung <strong>in</strong> den exponierten<br />
Arealen <strong>in</strong>nerhalb von 15 M<strong>in</strong>uten etwa 50%. Entsprechend s<strong>in</strong>kt <strong>der</strong> Blutfluss <strong>in</strong><br />
<strong>der</strong> ausgeschalteten Lunge, was für die ELV e<strong>in</strong>en allerd<strong>in</strong>gs immer noch beachtlichen<br />
Shunt von 20–35% ergibt [30]. Die reduzierte Perfusion <strong>der</strong> nicht ventilierten Lunge geht<br />
mit Zunahme <strong>der</strong> Durchblutung <strong>der</strong> ventilierten Lunge auf ca. 65-80% des HZV e<strong>in</strong>her,<br />
was die Oxygenierung verbessert.<br />
Auch auf <strong>der</strong> beatmeten Seite kann die HPV <strong>in</strong> m<strong>in</strong><strong>der</strong>belüfteten Regionen, wenn daraus<br />
e<strong>in</strong>e günstigere V/Q-Abstimmung resultiert, zur Oxygenierung beitragen. E<strong>in</strong>e Verschlechterung<br />
tritt dann e<strong>in</strong>, wenn es zur Blutumleitung auf die von <strong>der</strong> Ventilation ausgeschlossene<br />
Seite kommt. Dies ist bei Zunahme des pulmonalvaskulären Wi<strong>der</strong>stands<br />
denkbar. Bei vorbestehen<strong>der</strong> pulmonaler Hypertonie kann dieser bei ELV-Beg<strong>in</strong>n deutlich<br />
ansteigen [106]. Damit entsteht die Gefahr <strong>der</strong> akuten Rechtsherz-Dekompensation.<br />
Bei ELV ist e<strong>in</strong> Shunt von 20 - 35% zu kalkulieren, womit unter FiO = 1,0 im Durch-<br />
2<br />
schnitt PaO -Werte von 150 mmHg und darüber erreicht werden. Außerdem nimmt<br />
2<br />
häufig, bed<strong>in</strong>gt durch pulmonalarteriellen Druckanstieg, die Belastung des rechten<br />
Herzens zu.<br />
Bezüglich <strong>der</strong> Ventilation besteht trotz jetzt isolierter Beatmung <strong>der</strong> unteren Lunge die<br />
akute Restriktion mit verm<strong>in</strong><strong>der</strong>ter Compliance bei zudem erhöhter Resistance <strong>in</strong>folge<br />
Seitenlage, Verlagerung von Diaphragma und Mediast<strong>in</strong>um fort. Somit steigen Beatmungsdruck<br />
und exspiratorisches Lungenvolumen. Entstehen<strong>der</strong> (auto)-PEEP kann die<br />
V/Q-Verteilung verbessern und so die Entstehung m<strong>in</strong><strong>der</strong>belüfteter Regionen <strong>in</strong> <strong>der</strong> unteren<br />
Lunge verh<strong>in</strong><strong>der</strong>n. An<strong>der</strong>erseits ist damit durch o.g. Anstieg des pulmonalvaskulären<br />
Wi<strong>der</strong>stands e<strong>in</strong>e Blutumleitung auf die nicht ventilierte Seite mit Shuntzunahme und<br />
PaO -Abfall möglich (s.u.).<br />
2<br />
Oxygenierung unter ELV<br />
Modulation <strong>der</strong> HPV<br />
Die Oxygenierung unter ELV wird über komplexe Wechselwirkungen erwähnter Gegebenheiten<br />
h<strong>in</strong>aus durch E<strong>in</strong>flüsse, die sich aus Operation und <strong>Anästhesie</strong> sowie Begleitumständen<br />
während des E<strong>in</strong>griffs ergeben, bestimmt. Konkretes Interesse besteht, dass<br />
e<strong>in</strong>gesetzte Anästhetika und Adjuvantien wenig mit HPV und damit Oxygenierung <strong>in</strong>terferieren.<br />
Intravenöse Anästhetika und Opioide werden als unbedenklich angesehen, da sie offenbar<br />
ke<strong>in</strong>en direkt hemmenden Effekt auf die HPV haben und den pulmonalen Shunt nicht<br />
erhöhen [17, 100]. Volatile Anästhetika e<strong>in</strong>schließlich Stickoxydul h<strong>in</strong>gegen zeigen <strong>in</strong><br />
tierexperimentellen Studien unter ELV dosisabhängig <strong>in</strong>hibitorische Effekte auf die HPV<br />
[59, 69]. Zwischen den neueren Anästhetika Isofluran, Sevofluran und Desfluran, bei
<strong>der</strong>en Anwendung ger<strong>in</strong>gere PaO 2 -Abfälle zu verzeichnen s<strong>in</strong>d als bei den älteren Halothan<br />
und Enfluran, bestehen ke<strong>in</strong>e Unterschiede [89].<br />
Dagegen s<strong>in</strong>d kl<strong>in</strong>ische Studien im Vergleich <strong>in</strong>travenöser mit Inhalationsanästhetika<br />
une<strong>in</strong>heitlich. E<strong>in</strong>ige sprechen für bessere Oxygenierung unter Propofol gegenüber Isofluran,<br />
Desfluran und Sevofluran, an<strong>der</strong>e zeigen bei Isofluran und Sevofluran ke<strong>in</strong>e<br />
Unterschiede bezüglich Shunt und PaO 2 , dabei schränkt Desfluran die Oxygenierung<br />
weniger e<strong>in</strong> als Isofluran [1, 12, 17, 47].<br />
Anästhetika-Effekte auf die Oxygenierung unter ELV dürfen allerd<strong>in</strong>gs nicht isoliert auf<br />
die HPV-Än<strong>der</strong>ung betrachtet werden, son<strong>der</strong>n stets mit Wirkung auf das HZV [76]. Es<br />
besteht e<strong>in</strong>e <strong>in</strong>direkt proportionale Beziehung zwischen HPV-Ausprägung und HZV. So<br />
kann die Anästhetika-<strong>in</strong>duzierte Abnahme des HZV und <strong>der</strong> damit e<strong>in</strong>hergehende Abfall<br />
<strong>der</strong> zentralvenösen O 2 -Sättigung unter ELV e<strong>in</strong>e Verstärkung <strong>der</strong> HPV hervorrufen, und<br />
so <strong>der</strong> pulmonale Blutfluss mehr <strong>in</strong> die ventilierte Lungenseite umverteilt werden,<br />
wodurch sich <strong>der</strong> Shunt verm<strong>in</strong><strong>der</strong>t. Bei HZV-Senkung jedoch steigt die O 2 -Extraktion,<br />
was den Vorteil erhaltener HPV z.T. aufhebt. Dies erklärt, dass im Vergleich von TIVA<br />
mit Propofol gegenüber Isofluran mit thorakaler Epiduralanalgesie <strong>der</strong> PaO 2 -Abfall mit<br />
Steigerung des HZV unter ELV bei TIVA deutlicher war (s.u.) [36].<br />
H<strong>in</strong>weise für e<strong>in</strong>e maßgebende Rolle volatiler Anästhetika als Ursache von Hypoxämie<br />
durch HPV-Dämpfung unter ELV s<strong>in</strong>d nicht gegeben.<br />
Weitere relevante E<strong>in</strong>flüsse auf die HPV unter ELV s<strong>in</strong>d [47]:<br />
- Die HPV ist am stärksten bei Normwerten von PAP, pvO und paCO . Niedrige als<br />
2 2<br />
auch hohe Werte schränken sie e<strong>in</strong>. Dies ist bei ausgeprägter COPD häufig <strong>der</strong> Fall.<br />
- Kollaps o<strong>der</strong> Kompression <strong>der</strong> nicht ventilierten Lunge können als mechanisches<br />
H<strong>in</strong><strong>der</strong>nis wirken, wodurch <strong>der</strong>en Durchblutung reduziert und die Oxygenierung verbessert<br />
werden [30]. An<strong>der</strong>seits führen Manipulationen am Parenchym zu Freisetzung<br />
vasodilatorischer Mediatoren (Prostagland<strong>in</strong>e, NO), so dass Shunt, aber auch Durchlässigkeit<br />
<strong>der</strong> Pulmonalgefäße, zunehmen.<br />
- HPV wird durch Hypothermie, metabolische Alkalose, Volumen-Überlastung (auch<br />
rasche Infusion) und Infektionen e<strong>in</strong>geschränkt.<br />
- Vasodilatatoren wie Glyceroltr<strong>in</strong>itrat hemmen die HPV höchstens ger<strong>in</strong>ggradig.<br />
- Vasokonstriktoren wirken v.a. auf <strong>der</strong> ventilierten Seite, wodurch Blutumleitung <strong>in</strong><br />
atelektatische Lungenbereiche zu erwarten ist (cave Noradrenal<strong>in</strong>).<br />
- Inotropika (Katecholam<strong>in</strong>e, Theophyll<strong>in</strong>) schwächen die HPV bei Steigerung des<br />
HZV ab.<br />
Risiko <strong>der</strong> Hypoxämie bei ELV<br />
Initial s<strong>in</strong>kt <strong>der</strong> PaO 2 am deutlichsten. Innerhalb <strong>der</strong> folgenden 10-15 M<strong>in</strong>uten verr<strong>in</strong>gert<br />
sich <strong>der</strong> Abfall und <strong>der</strong> PaO 2 stabilisiert sich <strong>in</strong> <strong>der</strong> Regel bei >150 mmHg (FiO 2 =1,0) auf<br />
ausreichendem Niveau [47]. Im E<strong>in</strong>zelfall kaum vorauszusagen und pr<strong>in</strong>zipiell <strong>in</strong> je<strong>der</strong><br />
Phase <strong>der</strong> ELV, s<strong>in</strong>d jedoch bei 1-5% <strong>der</strong> Patienten PaO 2 -Abfälle unter 70 mmHg bzw. <strong>der</strong><br />
O 2 -Sättigung unter 90% zu verzeichnen [90, 95]. Diese werden als kritische Grenze für<br />
unzureichende O 2 -Versorgung angesehen.<br />
Es ist möglich, das Risiko arterieller Hypoxämie unter ELV abzuschätzen [47]:<br />
1. Erhebliches Risiko besteht, wenn die Funktion <strong>der</strong> ventilierten Lunge deutlich e<strong>in</strong>geschränkt<br />
ist.<br />
2. Hypoxämie ist eher möglich, wenn <strong>der</strong> Perfusionsanteil <strong>der</strong> auszuschließenden Lunge<br />
präoperativ > 45 % beträgt, was per se bei l<strong>in</strong>ksseitiger ELV zutrifft.<br />
3. Pulmonale Malignome führen oft zu verm<strong>in</strong><strong>der</strong>ter Perfusion <strong>der</strong> auszuschaltenden<br />
Lunge, wodurch e<strong>in</strong> ger<strong>in</strong>gerer PaO 2 -Abfall resultiert.<br />
4. Dagegen ist gerade bei normaler Lungenfunktion die Gefahr <strong>der</strong> Hypoxämie gegeben<br />
(präoperativ höhere FeV1 korreliert unter ELV mit niedrigerem paO 2 ).<br />
33
5. Bei niedriger FeV1 (z.B. COPD) dagegen ist die Oxygenierung, bed<strong>in</strong>gt durch verzögerten<br />
Kollaps <strong>der</strong> von <strong>der</strong> Ventilation ausgeschlossenen Lunge, weniger bedroht. So<br />
fand sich bei Emphysem- Patienten bei l<strong>in</strong>ksseitiger ELV zur VATS e<strong>in</strong> verzögerter<br />
PaO 2 -Abfall [7].<br />
6. ELV <strong>in</strong> Rückenlage stört die Oxygenierung früher und öfter als <strong>in</strong> Seitenlage [9].<br />
Durchführung <strong>der</strong> ELV<br />
Bei schneller Entlüftung <strong>der</strong> stillgelegten Lunge treten Oxygenierungsstörungen häufiger<br />
auf [81]. Die Zunahme des pulmonalen Shunts bei noch nicht ausgeprägter HPV wird oft<br />
schlecht toleriert. Dabei s<strong>in</strong>d kardio-zirkulatorische Komplikationen möglich. Dies gilt es<br />
stets von e<strong>in</strong>er Dislokation bzw. Verlegung des Tubus, die vordr<strong>in</strong>glich zu beheben s<strong>in</strong>d,<br />
zu unterscheiden. Zudem s<strong>in</strong>d Situationen, die e<strong>in</strong>e HPV-E<strong>in</strong>schränkung und damit die<br />
Shunterhöhung bed<strong>in</strong>gen, sorgfältig zu beachten.<br />
Behandlung <strong>der</strong> ventilierten Lunge während ELV<br />
Das Vorgehen unter ELV ist nicht nur wichtige Voraussetzung für den Gasaustausch des<br />
Patienten während <strong>der</strong> Operation son<strong>der</strong>n sche<strong>in</strong>t bezüglich größtmöglicher Schonung <strong>der</strong><br />
verbleibenden Restlunge ebenso bedeutsam [30, 76].<br />
Bezüglich des zu applizierenden Atemhubvolumens plädieren auf Grund o.g. restriktiver<br />
Ventilationsstörung e<strong>in</strong>ige Autoren dafür, unter ELV e<strong>in</strong> Hubvolum<strong>in</strong>a von 10-12 ml/kg,<br />
wie vor dem Ausschluss e<strong>in</strong>er Lunge beizubehalten, um so Atelektasen zu vermeiden und<br />
die V/Q-Beziehung <strong>in</strong> <strong>der</strong> hyperperfundierten Lunge zu bessern [45]. Das Risiko <strong>der</strong><br />
Shunterhöhung <strong>in</strong>folge Blutumleitung <strong>in</strong> die ausgeschaltete Lunge durch <strong>in</strong>trapulmonalen<br />
Druckanstieg ist dabei kaum relevant. Allerd<strong>in</strong>gs kann dabei entstehen<strong>der</strong> auto-PEEP, <strong>der</strong><br />
zwar zur Oxygenierung beiträgt, die dynamische Überblähung begünstigen [99]. Zudem<br />
s<strong>in</strong>d aus hohen Hubvolum<strong>in</strong>a resultierende Beatmungs-(Spitzen)-drücke speziell bei<br />
Emphysem Risikofaktor für Barotrauma wie z. B. ipsilateraler Pneumothorax [106]. Aus<br />
dieser Sicht sche<strong>in</strong>t die druckbegrenzte bzw. druckkontrollierte Beatmung s<strong>in</strong>nvoll.<br />
Zusätzlich wird damit die gleichmäßige Gasverteilung geför<strong>der</strong>t.<br />
Durch die Beatmungspraxis unter ELV s<strong>in</strong>d jedoch eigens hervorgerufene pulmonale<br />
Schädigungen im S<strong>in</strong>ne e<strong>in</strong>es „Baro-Volu-Traumas” möglich, <strong>der</strong>en Konsequenzen erst<br />
postoperativ deutlich werden [46, 66]. Das Schädigungsmuster entspricht e<strong>in</strong>em ARDS,<br />
wobei tatsächlich die beatmete, nicht operierte Lunge betroffen ist [78]. Als wesentliche<br />
Faktoren dabei werden angesehen:<br />
1. Druck-Volumen-Belastung <strong>der</strong> ventilierten Lunge bereits bei Hubvolum<strong>in</strong>a um 10<br />
ml/kg. Problematisch s<strong>in</strong>d <strong>in</strong>traoperativ hohe (>40 cm H 2 O) Spitzendrücke und längere<br />
ELV-Dauer.<br />
2. Permeabilitätsschaden durch stärkere kapilläre Belastung <strong>in</strong>folge von Druck- und<br />
Blutflusssteigerung auf <strong>der</strong> abhängigen, beatmeten Lungenseite.<br />
3. Ischämie/Reperfusions-Schaden durch Lungenkollaps auf <strong>der</strong> operierten, von <strong>der</strong><br />
Ventilation ausgeschlossenen Lungenseite mit E<strong>in</strong>fluss auf die pro-/anti<strong>in</strong>flammatorische<br />
Balance, endothelialer Dysfunktion sowie kapillärer Leckage. Reaktionen betreffen<br />
sowohl die nicht ventilierte, aber auch die abhängige, ventilierte Lunge.<br />
4. „Oxidativer Stress“ durch Bildung freier Sauerstoffradikale bei ELV unter hoher FiO 2<br />
mit Schaden beidseits, wobei ebenfalls die ELV-Dauer E<strong>in</strong>fluss zu haben sche<strong>in</strong>t<br />
[73].<br />
Die Reduktion lungensschädigen<strong>der</strong> Effekte unter ELV basiert auf Senkung des Hubvolumens<br />
bei fallbezogener PEEP-E<strong>in</strong>stellung [95]. Erste Belege dafür s<strong>in</strong>d ger<strong>in</strong>gere<br />
pro<strong>in</strong>flammatorische Effekte bzw. endotheliale Schäden, die kl<strong>in</strong>isch <strong>in</strong> postoperativ besserer<br />
pulmonaler Funktion, weniger Atem<strong>in</strong>suffizienz bzw. ger<strong>in</strong>gerer Beatmungsdauer<br />
resultieren [40, 72, 86].<br />
34
Die Beatmungsstrategie bei ELV soll darauf gerichtet se<strong>in</strong>, die Oxygenierung zu sichern<br />
und potenzielle, beatmungsbed<strong>in</strong>gte pulmonale Schädigung zu verh<strong>in</strong><strong>der</strong>n [47, 91].<br />
PEEP-Applikation während ELV wirkt <strong>der</strong> Atelektasenbildung <strong>in</strong> <strong>der</strong> abhängigen Lunge<br />
entgegen und verbessert die Oxygenierung [47]. Deutlicher Druckanstieg durch die auf<br />
den jeweiligen PEEP aufgelagerten <strong>in</strong>-/exspiratorischen Druckwechsel kann jedoch <strong>in</strong>folge<br />
erhöhten pulmonalen Gefäß-Wi<strong>der</strong>stands zu Blutumleitung <strong>in</strong> die nicht ventilierten<br />
Seite mit PaO 2 -Abfall führen. Dies zu verh<strong>in</strong><strong>der</strong>n, soll die PEEP-Applikation strikt im<br />
S<strong>in</strong>ne <strong>der</strong> Regulierung des Lungenvolumens im Bereich <strong>der</strong> FRC erfolgen [98]. Neben<br />
Oxygenierung und Vermeidung von Atelektasen wird damit zur schonenden Beatmung<br />
beigetragen [95]:<br />
- Die Inspiration beg<strong>in</strong>nt auf FRC-Niveau, die Lunge ist atemmechanisch „homogener“.<br />
- Die Compliance ist verbessert, wozu neben günstigerer Druck-Volumen-Verhältnisse<br />
die Vermeidung von regionalem exspiratorischem Alveolarkollaps beiträgt.<br />
- Bei höherer Compliance auf FRC-Niveau besteht <strong>der</strong> ger<strong>in</strong>gste pulmonalvaskuläre<br />
Wi<strong>der</strong>stand, was entsprechend dann gegebener guter V/Q-Abstimmung den Gasaustausch<br />
wirkungsvoll optimiert.<br />
- Blutumleitung <strong>in</strong> die nicht ventilierte Lunge ist so am wenigsten zu befürchten.<br />
- Die FiO 2 kann niedriger gehalten werden.<br />
Von <strong>der</strong> PEEP-Applikation profitieren vorrangig Patienten mit normaler Lungenfunktion<br />
und restriktiver Störung, Patienten mit COPD dagegen weniger, da sie per se auto-PEEP<br />
entwickeln. Bezüglich Stabilisierung von Oxygenierung unter ELV sche<strong>in</strong>t PEEP um 5<br />
cmH 2 O als ausreichend, PEEP >8 cmH 2 O dagegen nicht von Vorteil zu se<strong>in</strong>. Dies umso<br />
mehr, wenn auto-PEEP entsteht, <strong>der</strong> durch externen PEEP verstärkt wird, was beson<strong>der</strong>s<br />
bei unzureichen<strong>der</strong> Exspirationszeit auftritt [98].<br />
Zusätzlich werden Recruitment-Manöver auch bei ELV (s.o.), für besseren Gasaustausch<br />
und Vermeidung von Atelektasen explizit empfohlen [102].<br />
Erhöhung <strong>der</strong> FiO 2 auf 1,0 mit ELV-Beg<strong>in</strong>n wird vielerorts als e<strong>in</strong>fachster Schritt e<strong>in</strong>gesetzt,<br />
die Oxygenierung zu sichern. Neben Steigerung des PaO 2 kommt es dabei zu pulmonaler<br />
Gefäßdilatation und so Perfusionszunahme <strong>in</strong> <strong>der</strong> ventilierten Lunge [76]. Hypoxämie<br />
ist dennoch nicht immer zu verh<strong>in</strong><strong>der</strong>n. Der Effekt ist umso mehr e<strong>in</strong>geschränkt,<br />
je höher <strong>der</strong> pulmonale Shunt ist. Bei Shunt > 25-30%, führt e<strong>in</strong>e FiO 2 -Anhebung über<br />
0,8 h<strong>in</strong>aus, normale Kreislauffunktion vorausgesetzt, <strong>in</strong> e<strong>in</strong>em nur noch ger<strong>in</strong>gen PaO 2 -<br />
Anstieg. Darüber h<strong>in</strong>aus s<strong>in</strong>d Nebeneffekte e<strong>in</strong>er hohen FiO 2 Resorptionsatelektasen und<br />
toxische Effekte, die z.B. bei neoadjuvanter Chemotherapie <strong>in</strong>s Kalkül zu ziehen s<strong>in</strong>d<br />
[56]. Demnach soll, wann immer möglich, e<strong>in</strong>e FiO 2 unter 1,0 angestrebt werden.<br />
Im Notfall und für die kurzfristige Stabilisierung <strong>der</strong> Oxygenierung ist die Erhöhung<br />
<strong>der</strong> FiO 2 auf 1,0 e<strong>in</strong>fachster und effektiver Schritt.<br />
Behandlung <strong>der</strong> operierten Lunge während ELV<br />
Kont<strong>in</strong>uierlich positiver Atemwegsdruck (CPAP), auf <strong>der</strong> nicht ventilierten Lunge appliziert,<br />
ist die verbreitetste Methode zur Verbesserung <strong>der</strong> Oxygenierung unter ELV (Abb.<br />
4).<br />
35
Abb. 4: CPAP-Anwendung, hier über l<strong>in</strong>ksseitigen DLT (Konfiguration schematisch).<br />
Der Effekt beruht auf erhaltener Belüftung durch apnoische Oxygenierung [106]. Hierzu<br />
schließt man am DLT-Schenkel <strong>der</strong> stillgelegten Seite e<strong>in</strong> CPAP-System mit e<strong>in</strong>em<br />
O 2 -Fluss von 2-5 l/m<strong>in</strong> an. Zur Thorakotomie wird am PEEP-Ventil e<strong>in</strong> Druck von 3-5 cm<br />
H 2 O e<strong>in</strong>gestellt, zur VATS 1-2 cm H 2 O. Die Konnektierung des Systems erfolgt unmittelbar<br />
nach Ausschalten <strong>der</strong> entsprechenden Seite von <strong>der</strong> Ventilation, bei noch geschlossenem<br />
Throax. Die stillgelegte, noch nicht kollabierte Lunge „atmet“ somit durch die <strong>in</strong>-/<br />
exspiratorischen Druck- und Volumenän<strong>der</strong>ungen <strong>der</strong> <strong>in</strong>itiierten ELV Sauerstoff, <strong>der</strong> im<br />
Austausch zu Stickstoff e<strong>in</strong>gewaschen wird [81]. Dies beugt Oxygenierungsproblemen<br />
am ELV-Beg<strong>in</strong>n vor. Zudem beschleunigt es durch rasche O 2 -Resorption die Volumenreduktion<br />
<strong>der</strong> operierten Lunge nach Thoraxeröffnung. Bei COPD kann dies durch manuelle<br />
Beatmungshübe per CPAP-System vor OP-Beg<strong>in</strong>n zusätzlich unterstützt werden. Bei<br />
VATS wird vor E<strong>in</strong>br<strong>in</strong>gen des Troikars, um Verletzungen zu vermeiden, die CPAP-E<strong>in</strong>heit<br />
vom Druck entlastet. Im Weiteren kann <strong>der</strong> Lungen-Kollaps visuell gesteuert werden.<br />
Die alle<strong>in</strong>ige O 2 -Insufflation über das DLT-Lumen <strong>der</strong> stillgelegten Seite ist nicht so<br />
effektiv. Gasverteilung <strong>in</strong> kollabierte Lungenanteile kann den Shunt sogar erhöhen.<br />
Die per CPAP mögliche, an die jeweiligen Operationsbed<strong>in</strong>gungen anzupassende Volumenreduktion<br />
<strong>der</strong> operierten Lunge bietet bei offener Thorakotomie aber auch bei VATS,<br />
wo sich CPAP schwieriger gestaltet und primär nicht immer e<strong>in</strong>setzbar ist, optimale Voraussetzungen<br />
sowohl für die Sicherung <strong>der</strong> Oxygenierung als auch das chirurgische Vorgehen.<br />
Bei guter Kooperation von Operateur und Anästhesist kann e<strong>in</strong> kompletter Kollaps<br />
<strong>der</strong> operierten Lunge oft vermieden o<strong>der</strong> auf kurze Phasen beschränkt werden (s. Bilddokumentation:<br />
[62]). Somit ist CPAP-Applikation auf <strong>der</strong> nicht ventilierten Seite zugleich<br />
fester Bestandteil schonen<strong>der</strong> ELV.<br />
Anwendung von PEEP auf <strong>der</strong> ventilierten <strong>in</strong> Komb<strong>in</strong>ation mit CPAP auf <strong>der</strong> nicht<br />
ventilierten Lunge [43] garantiert <strong>in</strong> <strong>der</strong> Regel mit FiO < 0,6 die sichere Oxygenierung<br />
2<br />
unter ELV.<br />
Bei E<strong>in</strong>griffen mit Atemwegs-Eröffnung, z.B. des Stammbronchus bei Manschettenresektion,<br />
funktioniert die CPAP-Applikation durch die vorübergehende Leckage nicht. Dann<br />
können mittels Hochfrequenz-Jetventilation (HFJV) per Katheter über das entsprechende<br />
DLT-Lumen die Lungenbereiche <strong>der</strong> zu operierenden Seite distal <strong>der</strong> Atemwegseröffnung<br />
<strong>in</strong> den Gasaustausch e<strong>in</strong>bezogen werden (s.u.). Außer zur Oxygenierung trägt HFJV<br />
auch zur CO -Elim<strong>in</strong>ation bei [64].<br />
2<br />
36
Praktisches Vorgehen bei ELV<br />
Hubvolum<strong>in</strong>a von 5-7 ml/ kg lassen Lungenüberblähung vermeiden, was bei angepasstem<br />
PEEP selten Spitzendrücke >35 bzw. Plateaudrücke >25 cm H 2 O erfor<strong>der</strong>t. Neben <strong>der</strong><br />
Oxygenierung wird damit für e<strong>in</strong>e „protektive ELV“ gesorgt [95].<br />
Die ELV ist unter folgenden Kriterien zu empfehlen (nach [91]):<br />
- Druck-kontrollierte Beatmung mit Atemwegsdrücken
verm<strong>in</strong><strong>der</strong>t gegenüber Thiopental und Etomidat den durch Intubation o<strong>der</strong> Instrumentation<br />
<strong>in</strong> den Atemwegen verursachten Anstieg des Atemwegswi<strong>der</strong>stands. Ketam<strong>in</strong> wirkt<br />
bronchodilatorisch und β-mimetisch, jedoch ist mit Hypersekretion zu rechnen.<br />
Opioide: Fentanyl, Sufentanil, Alfentanil und Remifentanil s<strong>in</strong>d auch bei obstruktiver<br />
pulmonaler Funktionsstörung e<strong>in</strong>setzbar, wenn hohe Bolusdosen vermieden werden, bei<br />
denen Histam<strong>in</strong>freisetzung, vagal bewirkte Bronchokonstriktion o<strong>der</strong> Thoraxrigidität<br />
beobachtet werden.<br />
Muskelrelaxantien mit kl<strong>in</strong>isch relevantem Risiko für Histam<strong>in</strong>freisetzung und Bronchokonstriktion<br />
s<strong>in</strong>d Atracurium, Mivacurium, Rocuronium und Succ<strong>in</strong>ylchol<strong>in</strong>. Verstärkung<br />
e<strong>in</strong>er vagal vermittelten Konstriktion durch Blockade von bronchialen m2-Rezeptoren ist<br />
ebenso von Atracurium und Cis-Atracurium bekannt. Mivacurium eignet sich beson<strong>der</strong>s<br />
für kurze diagnostische E<strong>in</strong>griffe o<strong>der</strong> die Emphysemchirurgie, wo wegen Gefahr von<br />
Parenchymfisteln (s.u.) postoperativ die sofortige Spontanatmung erwünscht ist.<br />
Volatile Anästhetika können unmittelbar an <strong>der</strong> glatten Muskulatur und durch Dämpfung<br />
nerval vermittelter Reflexaktivität Bronchokonstriktion blockieren und Bronchodilatation<br />
bewirken. Dies ist wegen <strong>der</strong> vielfältigen bronchokonstriktiven Stimuli unter Intubation,<br />
Bronchoskopie, Absaugung und chirurgischer Manipulation und dem hyperreagiblen<br />
Bronchialsystem von Rauchern und COPD-Patienten vorteilhaft. Schleimhautirritation<br />
unter Isofluran, deutlicher unter Desfluran, ist nur bei Narkosee<strong>in</strong>leitung durch Inhalation<br />
bedeutsam.<br />
N 2 O diffundiert <strong>in</strong> präformierte gasgefüllte Räume und erhöht damit <strong>der</strong>en Volumen<br />
o<strong>der</strong> den <strong>in</strong>trakavitären Druck. N 2 O ist daher bei Zysten, Emphysemblasen, Pneumothorax<br />
und Thoraxtrauma mit Parenchym-Schäden kontra<strong>in</strong>diziert.<br />
TIVA vs. Inhalationsanästhesie <strong>in</strong> <strong>der</strong> <strong>Thoraxchirurgie</strong><br />
Technische Gesichtspunkte: Inhalationsanästhetika verbieten sich, wenn die Umgebungsluft<br />
kontam<strong>in</strong>iert werden kann, wie bei grossen bronchopleuralen Fisteln und ausgedehnten<br />
Parenchymverletzungen, beson<strong>der</strong>s aber <strong>in</strong> <strong>der</strong> tracheobronchialen Chirurgie.<br />
Bei HFJV (s.u.) können volatile Anästhetika nicht benutzt werden.<br />
Pathophysiologischer Aspekt: Volatile Anästhetika m<strong>in</strong><strong>der</strong>n konzentrationsabhängig die<br />
HPV (s.o.). Der Effekt auf die Oxygenierung ist kl<strong>in</strong>isch jedoch kaum relevant [47].<br />
Da es ke<strong>in</strong>en H<strong>in</strong>weis auf e<strong>in</strong>e massgebliche kl<strong>in</strong>ische Rolle <strong>der</strong> Inhalationsanästhetika<br />
<strong>in</strong> <strong>der</strong> Dämpfung <strong>der</strong> HPV und damit e<strong>in</strong>er bedeutenden Ursache von Hypoxämie während<br />
ELV gibt, ist es nicht begründet, diese Substanzen zugunsten von TIVA während<br />
ELV zu vermeiden.<br />
Die Komb<strong>in</strong>ation von thorakaler Epiduralanalgesie (TEA) mit Allgeme<strong>in</strong>anästhesie ist<br />
gerade für thoraxchirurgische E<strong>in</strong>griffe vorteilhaft.<br />
1. Das Vorgehen ermöglicht frühes Erwachen, raschere Extubation und Spontanatmung<br />
[36, 110].<br />
2. Die kont<strong>in</strong>uierliche Unterdrückung schmerzhafter Stimuli trägt zur Stabilität von<br />
systemischem und pulmonalem Kreislauf bei.<br />
E<strong>in</strong>e HPV-E<strong>in</strong>schränkung ist dabei nach Studien des pulmonalarteriellen Blutflusses und<br />
speziell angesichts e<strong>in</strong>es unverän<strong>der</strong>ten pulmonalen Blutvolumens beim Menschen [49]<br />
nicht zu befürchten.<br />
Hochfrequenz-Jet-Ventilation (HFJV)<br />
HFJV bedeutet gepulste Abgabe von Gasportionen hoher k<strong>in</strong>etischer Energie durch englumige<br />
Röhren <strong>in</strong> die Atemwege. Mit Frequenzen von 100–300/m<strong>in</strong> ergeben sich bei<br />
Atemhubvolum<strong>in</strong>a von 1,5–5 ml/kg Gasflüsse bis zu 60 l/m<strong>in</strong>, die e<strong>in</strong>e gasdichte Kopplung<br />
zwischen Jetapplikator und Atemweg entbehrlich machen [106]. Für <strong>Thoraxchirurgie</strong><br />
ergeben sich drei Indikationen:<br />
38
Durchtrennung von Trachea o<strong>der</strong> Bronchien. Hier wird e<strong>in</strong> geeigneter Jetkatheter <strong>in</strong> die<br />
distalen Atemwege e<strong>in</strong>geführt, um die entsprechenden Lungenbereiche <strong>in</strong> den Gasaustausch<br />
e<strong>in</strong>zubeziehen. Dies gilt für E<strong>in</strong>griffe an Trachea und großen Bronchien (z.B.<br />
Manschetten-Resektion des Stammbronchus). Zudem ist die Operation erleichtert, wenn<br />
e<strong>in</strong> Tubus vor Ort stören würde.<br />
Ruhiges Op-Feld durch hohe Impulsfrequenz bei niedrigen Atemhubvolum<strong>in</strong>a. Mittels<br />
HFJV kann, ähnlich wie mit CPAP (s.o.), die stillgelegte, zu operierende Lunge zur Verbesserung<br />
des Sichtfeldes <strong>in</strong> den Gasaustausch e<strong>in</strong>bezogen werden. Dabei trägt HFJV zur<br />
CO 2 -Elim<strong>in</strong>ation bei. Dies ist bei deutlicher Funktionse<strong>in</strong>schränkung <strong>der</strong> zur ELV benutzten<br />
Lunge (z.B. Restriktion durch Fibrose, Pleuraschwarte, vorangegangene Parenchym-<br />
Resektion) o<strong>der</strong> aber <strong>in</strong> Fällen von Missverteilung <strong>der</strong> Perfusion zur operierten Lunge<br />
bedeutsam, wo die operierte Lunge per se <strong>in</strong> den Gaswechsel e<strong>in</strong>zubeziehen ist [64]. Auch<br />
s<strong>in</strong>d damit E<strong>in</strong>griffe an <strong>der</strong> Restlunge nach Pneumonektomie möglich.<br />
Bei größeren Leckagen, so bei bronchopleuralen Fisteln, s<strong>in</strong>d alle Charakteristika <strong>der</strong><br />
HFJV nützlich, allem voran Kompensation von Gasverlust aus Parenchymlecks, weil die<br />
operierte Lunge zum Gaswechsel mitbenutzt werden muss.<br />
Jetkatheter zur HFJV werden über den liegenden Tubus o<strong>der</strong> über das Operationsfeld<br />
platziert. Bei Leckage zentraler Atemwege erfolgt die sichere Überbrückung unter visueller<br />
Kontrolle. Der Abstrahldruck am Jet-Gerät ist stets, von niedrigen Werten ausgehend,<br />
langsam zu erhöhen. Damit werden die entsprechenden Lungenbereiche ventiliert<br />
und bei hohen Impulsfrequenzen „ruhiggstellt“ (s.o.) und ihr Volumen den Erfor<strong>der</strong>nissen<br />
von E<strong>in</strong>griff und Gasaustausch angepasst. Der Jetkatheter darf den Bronchus <strong>der</strong> zu ventilierenden<br />
Lungenabschnitte nicht okkludieren.<br />
Intraoperative Überwachung<br />
Hämodynamik<br />
Die EKG-Ableitung dient zur Erkennung von Rhythmusstörung und Myokardischämie.<br />
Arrhythmien s<strong>in</strong>d bei Manipulation nahe Herz und Lungenhilus häufig, manchmal auch<br />
h<strong>in</strong>weisend für Druckanstieg im kle<strong>in</strong>en Kreislauf bzw. Rechtsherzbelastung. Vektorän<strong>der</strong>ungen<br />
<strong>in</strong>folge Seitenlagerung können Ischämie-Zeichen vortäuschen.<br />
Arterielle <strong>in</strong>vasive Druckmessung ist bei Thorakotomie aber häufig auch VATS zweckmäßig,<br />
speziell um hämodynamische Än<strong>der</strong>ungen durch herznahe Manipulation, Beh<strong>in</strong><strong>der</strong>ung<br />
des venösen Rückstroms o<strong>der</strong> Rechtsherzbelastung rasch zu erkennen. Bei Seitenlagerung<br />
des Patienten ist die Punktion <strong>der</strong> jeweils unteren Arterie empfehlenswert.<br />
Über zentralvenöse Katheter ist die Aussagekraft <strong>der</strong> erhaltenen Druckwerte durch Lagerungsän<strong>der</strong>ung,<br />
venöse Kompression, Beatmung und PEEP deutlich e<strong>in</strong>geschränkt. Wichtig<br />
ist die Option <strong>der</strong> Blutgasanalyse zur Bewertung <strong>der</strong> globalen Sauerstoffversorgung.<br />
Der Pulmonalarterienkatheter wird bei hohem kardiopulmonalem Risiko (z. B. vorbestehende<br />
pulmonale Hypertension) e<strong>in</strong>gesetzt. Katheter mit kont<strong>in</strong>uierlicher Messung von<br />
HZV und gemischtvenöser Sättigung s<strong>in</strong>d vorzuziehen. Um Fehl<strong>in</strong>terpretationen von<br />
Drucken (PCWP) und HZV zu vermeiden, ist die Platzierung <strong>in</strong> die ventilierte, nicht<br />
operierte Lunge erfor<strong>der</strong>lich.<br />
Die transösophageale Echokardiografie (TEE) ist wegen hoher Kosten und Abhängigkeit<br />
von <strong>der</strong> Erfahrung des Untersuchers bis jetzt <strong>in</strong> <strong>der</strong> <strong>Thoraxchirurgie</strong> nicht h<strong>in</strong>reichend<br />
verbreitet. Neben Aussagen zu Auswurfleistung und Wi<strong>der</strong>ständen im kle<strong>in</strong>en Kreislauf<br />
s<strong>in</strong>d gute Informationen zur Kontraktilität und diastolischen Volum<strong>in</strong>a, v.a. auch des rechten<br />
Ventrikels sowie Flussvolum<strong>in</strong>a <strong>in</strong> den großen Gefäßen erhältlich. Auch werden<br />
Ischämien und nichtpulmonale Shunts gut erkannt.<br />
Das <strong>in</strong>trathorakale Blutvolumen, gemessen mit <strong>der</strong> transthorakalen Farbstoff-Verdün-<br />
39
nungs-Methode gibt die kardiale Vorlast besser wie<strong>der</strong> als PCWP o<strong>der</strong> ZVD und korreliert<br />
gut mit den Befunden <strong>der</strong> TEE. Der Parameter ersche<strong>in</strong>t zur Unterscheidung zwischen<br />
Volumenmangel und Än<strong>der</strong>ung des pulmonalarteriellen Wi<strong>der</strong>standes bei Klemmung<br />
e<strong>in</strong>es Pulmonalarterienastes o<strong>der</strong> Überblähung <strong>der</strong> beatmeten Lunge mit akuter Rechtsherz<strong>in</strong>suffizienz<br />
als Ursache für e<strong>in</strong>e niedriges HZV wichtig.<br />
Gasaustausch und Ventilation<br />
Die Pulsoximetrie, zur Überwachung <strong>der</strong> Oxygenierung unentbehrlich, liefert allerd<strong>in</strong>gs<br />
ke<strong>in</strong>e Trendaussagen bei PaO 2 -Werten über 80 mmHg. So wird <strong>der</strong> Abfall <strong>der</strong> Oxygenierung<br />
bei ELV unter hoher FiO 2 erst bei deutlich erhöhtem Shunt erfasst. Darum ist die<br />
arterielle Blutgasanalyse bei mittleren bis großen thoraxchirurgischen E<strong>in</strong>griffen fester<br />
Bestandteil des Patientenmonitor<strong>in</strong>gs.<br />
Bei Kapnographie während ELV ist zu beachten, dass <strong>in</strong> Abhängigkeit <strong>der</strong> Durchblutungsverteilung<br />
zwischen beiden Lungen, beson<strong>der</strong>s wenn die HPV (noch) nicht greift,<br />
niedrigere endtidale PCO 2 -Werte mit erhöhter Differenz zum PaCO 2 auftreten [122]. Erst<br />
bei effektiver HPV nähert sich <strong>der</strong> Gradient wie<strong>der</strong> sonst üblichen Werten. Außerdem<br />
besteht e<strong>in</strong>e im Vergleich zu üblicher Beatmung größere Variabilität <strong>der</strong> endtidal-arteriellen<br />
PCO 2 -Differenz [125]. Deshalb soll die Korrektur <strong>der</strong> Beatmung eher als sonst mittels<br />
Blutgasanalyse entschieden werden. Formän<strong>der</strong>ungen des Kapnogramms s<strong>in</strong>d außerdem<br />
H<strong>in</strong>weis auf distale Dislokation des DLT.<br />
Postoperative Betreuung<br />
Unmittelbare postoperative Phase<br />
Bei Lungenresektionen wegen Bronchialkarz<strong>in</strong>om betragen die Morbidität 24-38 % und<br />
die Letalität 2–5.2 % [4, 33]. Pulmonale Komplikationen s<strong>in</strong>d am häufigsten, gefolgt von<br />
kardiovaskulären Ereignissen. E<strong>in</strong>fluss darauf haben Allgeme<strong>in</strong>zustand, Vorbehandlung<br />
und Ausmass <strong>der</strong> Resektion.<br />
Die kl<strong>in</strong>ische Überwachung ist beim Thoraxe<strong>in</strong>griff hervorzuheben. Auskultation des<br />
Thorax ist das e<strong>in</strong>fachste Mittel zur Erkennung von Sekret-Retention und E<strong>in</strong>blutung <strong>in</strong><br />
die Atemwege (Rasseln), Bronchokonstriktion (Giemen) sowie Atelektase und Pneumothorax<br />
(fehlendes Atemgeräusch).<br />
Die Röntgen-Thorax-Aufnahme im Liegen erfolgt unmittelbar postoperativ, danach täglich,<br />
zusätzlich nach Klemmen <strong>der</strong> Thorax-Dra<strong>in</strong>agen sowie 24 h nach <strong>der</strong>en Entfernung.<br />
Beurteilt werden:<br />
• Ausdehnung bei<strong>der</strong> Lungen<br />
• Lage und Konfiguration des Mediast<strong>in</strong>ums<br />
• Stellung und Sichtbarkeit bei<strong>der</strong> Zwerchfell-Hälften<br />
• Infiltrate und Atelektasen, Flüssigkeitsansammlungen, evtl. Spiegelbildung<br />
• Gasansammlung <strong>in</strong> Thoraxwand, Mediast<strong>in</strong>um, Pleurahöhle<br />
• Lage von Tubus, Dra<strong>in</strong>agen, Gefässkathetern<br />
Spontanatmung und Extubation werden generell, bei Risiko bronchopleuraler Fisteln<br />
jedoch, z.B. nach Atemwegse<strong>in</strong>griffen o<strong>der</strong> bei Emphysemchirurgie (auch bei Hyperkapnie),<br />
beson<strong>der</strong>s rasch erwünscht. Voraussetzung dafür ist die entsprechende <strong>Anästhesie</strong>führung<br />
(adäquate Ansprechbarkeit, Erholung nach Muskelrelaxation, zentrale Körpertemperatur<br />
> 36,0°C, weitgehende Schmerzfreiheit).<br />
Prolongierte Beatmung ist bei gestörtem Gasaustausch wegen pulmonaler Prozesse (Re-<br />
Expansions-Ödem, Parenchym-Trauma bei Resektion multipler Keile, schwere Infektion)<br />
o<strong>der</strong> bee<strong>in</strong>trächtigter Thoraxmechanik (grosse Brustwand-Resektionen) vorzusehen.<br />
H<strong>in</strong>zu treten Indikationen wie massiver Volumenersatz, myokardiale Insuffizienz und<br />
40
Hypothermie. Zur Erleichterung von Bronchialtoilette und Entwöhnung wird <strong>der</strong> DLT<br />
durch e<strong>in</strong>en ETT ersetzt.<br />
•<br />
Die Extubation kann <strong>in</strong> <strong>der</strong> Regel erfolgen, wenn nach 30 m<strong>in</strong> Spontanatmung unter<br />
FiO 0,4 e<strong>in</strong> paO > 65 mm Hg und e<strong>in</strong> paCO < 50 mm Hg vorliegen.<br />
2 2 2<br />
Bei schwerer COPD ist e<strong>in</strong> paCO > 65 mm Hg ke<strong>in</strong> Extubationsh<strong>in</strong><strong>der</strong>nis.<br />
• 2<br />
Ist bei hämodynamischen Problemen nach grosser Parenchymresektion kardiale Dysfunktion<br />
von <strong>in</strong>travasalem Volumenmangel zu differenzieren, s<strong>in</strong>d TEE [55] und ösophageale<br />
Dopplersonde [34] dem Pulmonalarterienkatheter <strong>in</strong> <strong>der</strong> Aussagekraft überlegen.<br />
Thoraxdra<strong>in</strong>age<br />
Zur Entleerung von Luft und Flüssigkeit aus dem Pleuraraum und zur Sicherung von<br />
Entfaltung <strong>der</strong> Lunge werden nach lateraler Thorakotomie e<strong>in</strong>e dorsale Dra<strong>in</strong>age zum<br />
Zwerchfell und e<strong>in</strong>e ventrale Dra<strong>in</strong>age zur Pleurakuppel e<strong>in</strong>gelegt. Bei VATS genügt e<strong>in</strong>e<br />
Dra<strong>in</strong>age. Sie werden abgeklemmt und entfernt, wenn die Sekretför<strong>der</strong>ung unter 50 ml/d<br />
fällt. Nach Pneumonektomie dient e<strong>in</strong>e e<strong>in</strong>zelne Dra<strong>in</strong>age für 24 h vorwiegend <strong>der</strong> Erkennung<br />
e<strong>in</strong>er postoperativen Blutung.<br />
Die Thoraxdra<strong>in</strong>age besteht bei mo<strong>der</strong>nen Systemen aus drei Kammern. Kammer 1 ist mit<br />
<strong>der</strong> Dra<strong>in</strong>age verbunden und nimmt das abgeleitete Sekret auf. Kammer 2 dient als Wasserschloss,<br />
um die Rücksaugung von Luft o<strong>der</strong> Flüssigkeit <strong>in</strong> den Thorax bei tiefer E<strong>in</strong>atmung<br />
zu verh<strong>in</strong><strong>der</strong>n. Kammer 3 enthält e<strong>in</strong> Tauch-Manometer, das mit e<strong>in</strong>em Vakuum-<br />
Generator verbunden ist. Das zur Atmosphäre offene Glasrohr bestimmt durch se<strong>in</strong>e<br />
E<strong>in</strong>tauchtiefe den maximalen Unterdruck. Die Saugleistung wird am Vakuum-Generator<br />
geregelt. Bei Fehlen grösserer bronchopleuraler Fisteln wird die Saugung rasch durch e<strong>in</strong><br />
e<strong>in</strong>faches Wasserschloss o<strong>der</strong> e<strong>in</strong> Heimlich-Ventil mit Sekretbeutel ersetzt, um, die vollständige<br />
Mobilität des Patienten zu erreichen.<br />
• Nach Pneumonektomie ist Unterdruck <strong>in</strong> <strong>der</strong> Pleurahöhle wegen Risikos <strong>der</strong><br />
Mediast<strong>in</strong>al-Verlagerung mit Abknickung grosser Venen und <strong>der</strong> Trachea sowie<br />
Überblähung <strong>der</strong> verbliebenen Lunge (s.u.) strikt zu vermeiden.<br />
• Um Lungenkollaps, gar Spannungspneumothorax zu verhüten, dürfen Dra<strong>in</strong>s zum<br />
Transport nicht abgeklemmmt werden.<br />
• Bei atemsynchronem Pendeln von Sekret im Dra<strong>in</strong>age-Schlauch ist die Restlunge<br />
wegen Fistel o<strong>der</strong> Sekretverschluss von Bronchien nicht genügend ausgedehnt.<br />
• Perlende Luftblasen im Dra<strong>in</strong>age-Sekret sprechen für Fistel aus Parenchym o<strong>der</strong><br />
Bronchusnaht.<br />
Bronchopleurale Fisteln (BPF) durch Parenchymdefekte nach Resektion schliessen<br />
sich <strong>in</strong> <strong>der</strong> Regel bis zum 5. postoperativen Tag [35]. Neue BPF treten nach 1-12 Tagen<br />
auf und s<strong>in</strong>d meist durch Naht-Insuffizienz bed<strong>in</strong>gt. Diagnose-Sicherung durch Röntgen<br />
und Bronchoskopie erfolgen umgehend. Wirksame Thoraxdra<strong>in</strong>age kann nur zwischenzeitlich<br />
den Kollaps <strong>der</strong> Lunge e<strong>in</strong>schränken. Unklare Befunde werden unter fiberoptischer<br />
Inspektion durch bronchiale Instillation wasserlöslicher Kontrastmittel o<strong>der</strong> Farbstoffe<br />
abgeklärt. BPF <strong>in</strong>s Mediast<strong>in</strong>um führt zu Emphysem <strong>der</strong> Halsweichteile und evtl.<br />
Kompression (s.u.). BPF nach Pneumonektomie wird unter Infektzeichen und Infiltration<br />
<strong>der</strong> Restlunge durch plötzliche Expektoration grosser Mengen dünnen, rotbraunen<br />
Sputums deutlich. Nachweis ist <strong>der</strong> Abfall des Flüssigkeitsspiegels im leeren Hemithorax.<br />
Bei bronchopleuraler Fistel nach Pneumonektomie ist Aspiration aus <strong>der</strong> Thoraxhöhle<br />
<strong>in</strong> die Restlunge durch Dra<strong>in</strong>age, Lagerung, ggf. endobronchiale Intubation strikt zu<br />
begrenzen.<br />
41
Flüssigkeitszufuhr<br />
Die perioperative Flüssigkeitszufuhr bei Parenchymresektion muss zwischen Sicherung<br />
<strong>der</strong> Organperfusion und Schutz <strong>der</strong> Lunge vor Volumenüberladung ausgerichtet werden.<br />
Bei üblicher Lungenchirurgie entsteht ke<strong>in</strong> „dritter Raum“ und diesbezüglich ke<strong>in</strong> Ersatzbedarf.<br />
Überschiessende Flüssigkeitsbilanz >4000 ml ist e<strong>in</strong> bedeuten<strong>der</strong> Risikofaktor für pulmonale<br />
Komplikationen nach Pneumonektomie [74].<br />
• Die Infusion von Kristalloiden soll für Erwachsene am Operationstag auf 3000 ml<br />
(verteilt auf ~2000 ml <strong>in</strong>traoperativ und 50 ml/h postoperativ) beschränkt werden.<br />
• Die positive Flüssigkeitsbilanz soll 20 ml/kg, also 1400-1800 ml, <strong>in</strong> 24 h nicht überschreiten.<br />
• Blutverluste bis Hb 9 g/dl werden darüber h<strong>in</strong>aus mit Kolloiden ersetzt.<br />
• Ur<strong>in</strong>ausscheidung bis h<strong>in</strong>ab zu 0,5 ml/kg.h ist normalerweise nicht behandlungsbedürftig.<br />
• Bei grossem Gewebstrauma, wie z.B. Pneumonektomie mit Diaphragma- und Perikardresektion<br />
o<strong>der</strong> Ösophagektomie, ist die erweiterte Überwachung angebracht.<br />
• Bei <strong>in</strong>stabiler Kreislaufsituation, wie auch Vasodilatation durch TEA, ist die Gabe von<br />
Vasokonstriktoren <strong>der</strong> „Auffüllung“ des erweiterten Gefässraumes vorzuziehen.<br />
Schmerzbehandlung<br />
Die Thorakotomie zählt zu den schmerzhaftesten E<strong>in</strong>griffen. Schmerz und muskuloskeletale<br />
Funktionsm<strong>in</strong><strong>der</strong>ung s<strong>in</strong>d bei anterolateraler, Muskel-schonen<strong>der</strong>er Thorakotomie<br />
ger<strong>in</strong>ger als bei posterolateraler mit Durchtrennung des M. latissimus dorsi, bei<br />
tranversalem Zugang hoch und bei Sternotomie am ger<strong>in</strong>gsten. Auch nach VATS ist <strong>der</strong><br />
Schmerz ger<strong>in</strong>ger. Das Ausmass des Akut-Schmerzes korreliert mit demjenigen chronischer<br />
Schmerzen des sog. Post-Thorakotomie-Syndroms, das sich nach 40-80% aller<br />
Thorakotomien entwickelt [19].<br />
•<br />
•<br />
42<br />
Nach thoraxchirurgischen E<strong>in</strong>griffen f<strong>in</strong>det sich e<strong>in</strong>e akute restriktive Ventilationsstö-<br />
rung mit M<strong>in</strong><strong>der</strong>ung von FVC und FEV1 auf 75%. Dem Schmerz wird davon e<strong>in</strong><br />
Anteil von 25% zugerechnet.<br />
Effiziente postoperative Schmerztherapie trägt wesentlich zur Besserung <strong>der</strong> Lungenfunktion<br />
bei.<br />
Die Schmerzen entstehen durch Traumatisierung und Entzündung von Thoraxorganen,<br />
Knochen und Gelenken sowie <strong>der</strong> Interkostalnerven. Die nozizeptiven Stimuli erfolgen<br />
über:<br />
• Interkostalnerven aus Brustwand und parietaler Pleura<br />
• Sp<strong>in</strong>alnerven aus kostovertrebralen und kostotransversalen Gelenken<br />
• N. phrenicus vom Diaphragma (mit Projektion <strong>in</strong> die ipsilaterale Schulter)<br />
• N. vagus von Lunge und Mediast<strong>in</strong>alorganen<br />
• Sympathicus aus kranialen Lungenbereichen (mit Projektion auf die Schulter-Arm-<br />
Region).<br />
Wichtig ist die reflektorische Hemmung <strong>der</strong> Zwerchfell-Aktivität nach thorakalem und<br />
abdom<strong>in</strong>alem Operationstrauma. Aus <strong>der</strong> Vielzahl von Quellen und Leitungswegen<br />
erklärt sich, dass e<strong>in</strong> multimodales Konzept zur Schmerztherapie nach Thoraxe<strong>in</strong>griffen<br />
mit nichtsteroidalen Analgetika (NSAIDs), Opioiden und Lokalanästhetika nötig ist.<br />
Interkostalblockade: Sie wird am e<strong>in</strong>fachsten durch den Operateur vor Verschluss <strong>der</strong><br />
Thoraxhöhle ausgeführt; sie soll drei Interkostalräume kranial und kaudal <strong>der</strong> Schnittführung<br />
erfassen. Mit Bupivaca<strong>in</strong> 0,5% wird Analgesie <strong>der</strong> Brustwand für 6-24 h erzielt,<br />
doch kann <strong>der</strong> Ramus dorsalis des Interkostal(Sp<strong>in</strong>al-)nervs nicht erreicht werden. Das<br />
Verfahren ist deshalb für posterolaterale weniger als für anterolaterale Thorakotomie
geeignet, sollte aber als Komponente multimodaler Analgesie stets genutzt werden, wenn<br />
neuraxiale <strong>Anästhesie</strong>-Techniken ausscheiden.<br />
Paravertebrale Katheter-Analgesie: Die Anlage kann, so zur VATS, präoperativ o<strong>der</strong><br />
<strong>in</strong>traoperativ erfolgen. Bei Letzterem wird <strong>der</strong> Katheter durch die Brustwand <strong>in</strong> Höhe des<br />
h<strong>in</strong>teren Rippenw<strong>in</strong>kels vom Chirurgen unter die im Bereich je zweier Segmente oberhalb<br />
und unterhalb <strong>der</strong> Thorax<strong>in</strong>zision abgelöste Pleura parietalis e<strong>in</strong>gelegt. Das Anästhetikum<br />
erreicht Interkostalnerven und Grenzstrang und bewirkt <strong>in</strong>tensive e<strong>in</strong>seitige Sympathikus-<br />
Blockade. Bei vergleichbarem Effekt kann das Verfahren die thorakale Periduralanästhesie<br />
ersetzen [32]. Das Risiko rascher Resorption erfor<strong>der</strong>t Lokalanästhetika mit Vasokonstriktor-Zusatz.<br />
Thorakale (Katheter)-Epiduralanalgesie (TEA) ist vielerorts Standard zur postoperativen<br />
Schmerzbekämpfung nach <strong>Thoraxchirurgie</strong>. Das Risiko neurologischer Komplikationen<br />
wird durch die Vorteile aufgewogen.<br />
•<br />
•<br />
•<br />
•<br />
•<br />
Epidural applizierte Lokalanästhetika und Opioide führen zu umfassen<strong>der</strong> segmenta-<br />
ler Analgesie. Der Vergleich zur PCA zeigt bessere Schmerzausschaltung nach Thoraxe<strong>in</strong>griff<br />
<strong>in</strong> Ruhe und Aktivität [16] sowie Patientenzufriedenheit und Vigilanz [20].<br />
Unter TEA werden nach Thorakotomien die Lungenfunktion verbessert [48] und pulmonale<br />
und kardiale Komplikationen verm<strong>in</strong><strong>der</strong>t [11, 83].<br />
Bei Risikopatienten ist unter neuraxialer Analgesie die postoperative Mortalität um<br />
63% verr<strong>in</strong>gert, nach Lungenresektion das Risiko von Mortalität und Morbidität unter<br />
TEA deutlich gesenkt.<br />
Die Katheter-Anlage im Zentrum <strong>der</strong> betroffenen Segmente bed<strong>in</strong>gt ger<strong>in</strong>geren Sub-<br />
stanzbedarf, E<strong>in</strong>grenzung <strong>der</strong> vegetativen Blockade sowie, unter Verwendung lipophiler<br />
Opioide, <strong>der</strong> Analgesie auf das Op-Gebiet und weniger Pruritus, Ur<strong>in</strong>retention<br />
sowie motorische Blockaden.<br />
Chronische Schmerzen s<strong>in</strong>d nach präoperativ begonnener TEA ger<strong>in</strong>ger [92].<br />
TEA ist für jede Thorakotomie angezeigt. Dr<strong>in</strong>gliche Indikationen s<strong>in</strong>d:<br />
- hohe Schmerz<strong>in</strong>tensität (Pleurektomie),<br />
- Bee<strong>in</strong>trächtigung <strong>der</strong> Atemmechanik (Brustwandresektion),<br />
- erhebliche Störung <strong>der</strong> Lungenfunktion (COPD, Emphysem),<br />
- vordr<strong>in</strong>gliche Spontanatmung postoperativ (Emphysem-Chirurgie; somit ist die TEA<br />
auch bei VATS s<strong>in</strong>nvoll).<br />
Frühe postoperative Komplikationen<br />
Sekretverhalt, Atelektase, Pneumonie<br />
Ursachen für postoperative Störungen von Gasaustausch und mukoziliärem Transport<br />
s<strong>in</strong>d v.a.<br />
- bee<strong>in</strong>trächtigte Atem-Mechanik, Husten, Zilienfunktion und verän<strong>der</strong>te Sekretkonsistenz<br />
bei<br />
- akuter restriktiver Ventilationsstörung.<br />
Die Häufigkeit <strong>der</strong> Pneumonie nach <strong>Thoraxchirurgie</strong> beträgt 25–40 % [88]. Die Intensivtherapie<br />
ist dann verlängert, und die postoperative Mortalität bis zu 20 % gesteigert.<br />
Mehr als drei <strong>der</strong> Symptome Fieber, Leukozytose, purulentes Sekret, positver Kultur-<br />
Nachweis und neues pulmonales Infiltrat bedeuten die Diagnose „Pneumonie“. Der<br />
Übergang von Sekret-Retention über Atelektase bis postoperativer Pneumonie ist fließend.<br />
Postoperative Pneumonie bildet die führende Todesursache bei <strong>Thoraxchirurgie</strong>.<br />
Behandlung <strong>der</strong> mite<strong>in</strong>an<strong>der</strong> verbundenen Komplikationen erfolgt durch [37]:<br />
• Schmerztherapie: Sorge für aktive Atemmanöver bei Erhalt von Vigilanz und Atemantrieb<br />
(s.o.).<br />
43
• Sekretmobilisation: Verflüssigung, broncholytische Therapie, Klopf- und Vibrationsmassage.<br />
• Sekretabsaugung (nasotracheal) bei gestörter Hustenmechanik und mangeln<strong>der</strong><br />
Kooperation.<br />
• Fiberbronchoskopie <strong>in</strong> LA bei zähem, purulentem Sekret sowie bei Verdacht auf<br />
Atelektasen. Neben Sekretentfernung dient sie <strong>der</strong> Lavage, Instillation von Sekretolytika<br />
und Beobachtung von Atemwegs-Mechanik und Bronchus-Anastomosen. FOB<br />
stets unter EKG und Pulsoximeter sowie O -Zufuhr. Bei SpO
Herz-Insuffizienz<br />
Myokardiale Ischämie und postoperativer Infarkt nach Lungenchirurgie s<strong>in</strong>d mit 3,8%<br />
bzw. 2% nicht höher als <strong>in</strong> <strong>der</strong> Allgeme<strong>in</strong>-Chirurgie [33]. Der Infarkt trägt mit 0,7% zur<br />
Gesamtmortalität <strong>der</strong> <strong>Thoraxchirurgie</strong> bei. Für KHK-Patienten besteht wie erwähnt e<strong>in</strong><br />
Risiko für Herztod o<strong>der</strong> perioperativem Infarkt von < 5%. Wie Arrhythmien treten auch<br />
ischämische Episoden gehäuft am 2. bis 3. postoperativen Tag auf. Rechtsherzbelastung<br />
durch Thorachirurgie ist Folge von Lungenresektion mit verr<strong>in</strong>gertem pulmonalen<br />
Gefässbett, was sich <strong>in</strong> verm<strong>in</strong><strong>der</strong>ter rechtsventrikulärer Ejektionsfraktion zeigt [53]. Die<br />
Steigerung <strong>der</strong> Lungenperfusion, bei Belastung o<strong>der</strong> Sepsis weitgehend kompensierbar,<br />
ist v.a. bei COPD durch Gefässumbau aber auch HPV e<strong>in</strong>geschränkt. Dann drohen pulmonale<br />
Drucksteigerung und Rechts-Herz-Dekompensation. Neben Therapie von Hypoxämie<br />
und Schmerzen sowie Steuerung des Flüssigkeitsregimes ist die selektive Erweiterung<br />
<strong>der</strong> pulmonalen Strombahn durch Inhalation von NO, e<strong>in</strong>facher des Prostacycl<strong>in</strong>-<br />
Analogons Iloprost, <strong>in</strong> Anlehnung an die Therapie primärer pulmonaler Hypertension<br />
[54] zu erwägen.<br />
Postoperative Blutung<br />
E<strong>in</strong> Hämatokrit über 20% <strong>in</strong> <strong>der</strong> Dra<strong>in</strong>age-Flüssigkeit zeigt e<strong>in</strong>e <strong>in</strong>trathorakale Blutung<br />
an. Nimmt dieser zu, wird die Blutung massiver. Das Sistieren <strong>der</strong> Dra<strong>in</strong>age-För<strong>der</strong>ung<br />
bei fortdauern<strong>der</strong> Hypovolämie bedeutet nicht Blutungs-Stillstand, son<strong>der</strong>n korrekturbedürftige<br />
Dra<strong>in</strong>age-Verlegung.<br />
Die Hoffnung auf Selbst-Tamponade <strong>der</strong> Blutung muss durch den Entschluss zur Revision<br />
ersetzt werden, bevor e<strong>in</strong>e Mediast<strong>in</strong>alverlagerung die Hämodynamik zusätzlich<br />
bee<strong>in</strong>trächtigt.<br />
Blutverluste über 200 ml/h, die länger als 6 h anhalten, s<strong>in</strong>d Anlass zur Re-Thorakotomie.<br />
Intrathorakale Kompressions-Syndrome<br />
Mediast<strong>in</strong>al-Emphysem bedeutet subkutane Gasansammlung im Gesichts- und Halsbereich<br />
mit evtl. Ausbreitung über den Rumpf. Als Ursachen zählen Spannungs-Pneumothorax,<br />
tracheobronchiale und ösophageale Läsionen (<strong>in</strong>kl. Naht-Insuffizienz). Bei V.cava<br />
superior-Kompression ist <strong>der</strong> Blut-Rückstrom bis zum Kreislauf-Zusammenbruch beh<strong>in</strong><strong>der</strong>t.<br />
Kompression oberer Atemwege führt zu Atemnot.<br />
• Notfall: kollare Mediast<strong>in</strong>otomie zur Dekompression von Gefässen und Atemwegen.<br />
• Danach muss die Ursache des Emphysems behoben werden.<br />
• Bei Intubation ist mit erheblicher Beh<strong>in</strong><strong>der</strong>ung zu rechnen.<br />
Spannungs-Pneumothorax führt zu Hypoxämie mit Tachykardie und Tachypnoe. Überschreitet<br />
<strong>der</strong> <strong>in</strong>trapleurale Druck den Vorhofdruck, kommen Halsvenen-Stauung und<br />
Hypotension h<strong>in</strong>zu. Oft tritt e<strong>in</strong> Gewebsemphysem auf. Ursachen s<strong>in</strong>d Dyskonnektion<br />
bzw. Fehllage o<strong>der</strong> Verlegung von Thoraxdra<strong>in</strong>agen <strong>in</strong> Gegenwart e<strong>in</strong>er BPF. Nach<br />
Dra<strong>in</strong>age-Entfernung neu auftreten<strong>der</strong> (Spannungs)-Pneumothorax weist auf Bronchusstumpf-Insuffizienz<br />
h<strong>in</strong>.<br />
• Notfall: Punktion <strong>der</strong> Pleurahöhle im 2.-3. ICR medioklavikulär, sorgfältige Prüfung<br />
<strong>der</strong> Thoraxdra<strong>in</strong>agen auf Lage und Funktion.<br />
• Grundsätzlich Anlage e<strong>in</strong>er neuen Dra<strong>in</strong>age (4.-5. ICR; <strong>in</strong> vor<strong>der</strong>er Axillarl<strong>in</strong>ie),<br />
anschliessend Korrektur <strong>der</strong> Ursachen.<br />
Perikard-Tamponade ist durch zunehmende Tachykardie und Hypotension bei gleichzeitiger<br />
Halsvenen-Stauung gekennzeichnet und ähnelt dar<strong>in</strong> an<strong>der</strong>en Kompressionssyndromen.<br />
Ursachen nach <strong>Thoraxchirurgie</strong> s<strong>in</strong>d Naht-Insuffizienz an Vorhöfen o<strong>der</strong> Pulmonal-<br />
45
venen, selten Verletzung von Koronararterien. Der Verdacht ist rasch, am besten durch<br />
Echokardiografie zu erhärten.<br />
• Notfall: Entlastung durch Ultraschall-gestützte Punktion mit anschließen<strong>der</strong> Dra<strong>in</strong>age<br />
vom l<strong>in</strong>ken Kosto-Xiphoidal-W<strong>in</strong>kel aus <strong>in</strong> Richtung auf die l<strong>in</strong>ke Klavikula.<br />
•<br />
Die rasche chirurgische Therapie ist unabd<strong>in</strong>gbar.<br />
46
Kernaussagen<br />
• Die Präoperative Befun<strong>der</strong>hebung mit kl<strong>in</strong>ischen und radiologischen Mitteln<br />
sowie <strong>der</strong> Lungenfunktionsprüfung dient <strong>der</strong> E<strong>in</strong>schätzung von Operabilität,<br />
Risiko und Prognose.<br />
• Zur <strong>in</strong>dividuellen Beurteilung <strong>der</strong> Resektabilität s<strong>in</strong>d kl<strong>in</strong>ische Befunde und<br />
Funktionstests stets <strong>in</strong> <strong>der</strong> Zusammenschau zu bewerten.<br />
• Thoraxchirurgische Patienten weisen e<strong>in</strong> mittleres OP-Risko auf. Neben üblichen<br />
Begleiterkrankungen muss manchmal mit Rechtsherzbelastung und pulmonalem<br />
Hypertonus gerechnet werden.<br />
• Die präoperative Vorbereitung dient <strong>der</strong> Motivation des Patienten, dem Tra<strong>in</strong><strong>in</strong>g<br />
<strong>der</strong> Atemmuskulatur, <strong>der</strong> Verbesserung <strong>der</strong> Atemmechanik und des Gasaustausches<br />
sowie <strong>der</strong> Sekretentfernung aus den Atemwegen.<br />
• Die E<strong>in</strong>stellung des Rauchens ist dabei zu jedem Zeitpunkt s<strong>in</strong>nvoll.<br />
• Lungenseparation dient zur Vermeidung des Übertritts von Eiter, Sekret und<br />
Blut, <strong>in</strong>sbeson<strong>der</strong>e aber auch <strong>der</strong> Sicherung <strong>der</strong> Lungenventilation sowie weiterh<strong>in</strong><br />
zur Verbesserung <strong>der</strong> operativen Bed<strong>in</strong>gungen durch Ruhigstellung <strong>der</strong> chirurgisch<br />
exponierten Seite.<br />
• Techniken<br />
zur Atemwegstrennung s<strong>in</strong>d die Anwendung e<strong>in</strong>es Doppellumen-<br />
Tubus o<strong>der</strong> alternativ die e<strong>in</strong>es Bronchusblockers.<br />
• Die fiberoptische Bronchoskopie ist grundsätzlicher Bestandteil des Vorgehens<br />
zur Atemwegssicherung <strong>in</strong> <strong>der</strong> Thoraxanästhesie.<br />
• Als schwieriger Atemweg <strong>in</strong> <strong>der</strong> Thoraxanästhesie müssen neben den Proble-<br />
men bei sonst üblicher Intubation h<strong>in</strong>aus H<strong>in</strong><strong>der</strong>nisse <strong>der</strong> zentralen Atemwege<br />
beachtet werden, welche sowohl Platzierung von Luftwegen als auch Seitentrennung<br />
e<strong>in</strong>schließlich ELV erschweren o<strong>der</strong> unmöglich machen. Hier erweist sich<br />
die <strong>in</strong>tegrative Anwendung verschiedener Instrumente zur Atemwegssicherung<br />
als vorteilhaft.<br />
• Verän<strong>der</strong>ungen <strong>der</strong> Atemfunktion bei thoraxchirurgischen E<strong>in</strong>griffen basieren<br />
auf Störungen, die bei je<strong>der</strong> Narkose auftreten. Sie s<strong>in</strong>d charakterisiert durch<br />
V/Q-Missverhältnis, FRC-Reduktion, Atelektasenbildung und verän<strong>der</strong>te Atemmechanik.<br />
• Beim Thoraxe<strong>in</strong>griff werden sie durch Seitenlagerung, Thoraxeröffnung und<br />
speziell E<strong>in</strong>lungen-Ventilation (ELV), chirurgisches Vorgehen sowie Begleiterkrankungen<br />
moduliert und verstärkt.<br />
• ELV führt zu verän<strong>der</strong>ter Ventilation <strong>der</strong> beatmeten Lunge, pulmonalem Rechts-<br />
L<strong>in</strong>ks-Shunt und Zunahme des pulmonalvaskulären Wi<strong>der</strong>stands.<br />
• Die mit ELV verbundene Hypoxisch-pulmonale Vasokonstriktion unterliegt<br />
zahlreichen E<strong>in</strong>flüssen; Effekte auf die Oxygenierung s<strong>in</strong>d im E<strong>in</strong>zelfall nicht<br />
konkret vorhersehbar.<br />
• Die schonende Beatmung <strong>der</strong> ventilierten Lunge mit PEEP bei Anwendung von<br />
CPAP auf <strong>der</strong> nicht ventilierten Seite sichert <strong>in</strong> <strong>der</strong> Regel mit FiO < 0,6 die<br />
2<br />
Oxygenierung bei ELV.<br />
• Die Postoperative Betreuung dient neben Überwachung des Patienten <strong>der</strong><br />
Schmerzbehandlung, Mobilisation und Behandlung möglicher Komplikationen.<br />
• Systemische und regionale Schmerzbehandlung <strong>in</strong>kl. thorakaler Katheter-PDA<br />
trägt zur Vermeidung von Komplikationen und zur Sicherung des Operationserfolgs<br />
bei.<br />
• Als wichtige Komplikationen zählen Atelektase, Pneumonie, Rhythmusstörun-<br />
gen und myokardiale Ischämie sowie Blutung, Fistel und <strong>in</strong>trathorakale Kompressionssyndrome.<br />
47
Literatur<br />
1. Abe K, Shimizu T, Takash<strong>in</strong>a M, Shiozaki H, Yoshiya I. The effects of propofol, isoflurane and sevoflurane<br />
on oxygenation and shunt fraction dur<strong>in</strong>g one-lung ventilation. Anesth Analg 1998; 87: 1164–1169.<br />
2. Akca O. Optimiz<strong>in</strong>g the <strong>in</strong>traoperaive management of carbon dioxide concentration. Curr Op<strong>in</strong> Anaesthesiol<br />
2006; 19: 19-25.<br />
3. Akca O, Podolsky A, Eisenhuber E, Panzer O, Hetz H, Lampl K, Lackner F, Wittmann K, Grabenwoeger<br />
F, Kurz A, Schultz AM, Negishi C, Sessler D. Comparable postoperative pulmonary atelectasis <strong>in</strong> patients<br />
given 30% or 80% oxygen dur<strong>in</strong>g and 2 hours after colon resection. Anesthesiology 1999; 91: 991-998.<br />
4. Allen MS, Darl<strong>in</strong>g GE, Pechet TTV, Mitchell JD, Herndon JE, Landreneau RJ, Inculet RI, Jones DR,<br />
Meyers BF, Harpole DH, Putnam JB, Rusch VW. Morbidity and mortality of major pulmonary resections<br />
<strong>in</strong> patients with early-stage lung cancer: Initial results of the randomized, prospective ACOSOG Z0030<br />
trial. Ann Thorac Surg 2006; 81: 1013-1020.<br />
5. Alvarez JM. Postpneumonectomy pulmonary edema. In: Sl<strong>in</strong>ger PD ed. Progress <strong>in</strong> thoracic anesthesia.<br />
Baltimore: Lipp<strong>in</strong>cott Williams & Wilk<strong>in</strong>s; 2004, 187-219.<br />
6. Amar D. Postthoracotomy atrial fibrillation. Curr Op<strong>in</strong> Anaesthesiol 2007; 20: 43-47.<br />
7. Aschkenasy SV, Hofer CK, Zalunardo MP, Zaugg M, We<strong>der</strong> W, Seifert B, Pasch T, Zoll<strong>in</strong>ger A. Patterns<br />
of changes <strong>in</strong> arterial PO 2 dur<strong>in</strong>g one-lung ventilation: a comparison between patients with severe pulmonary<br />
emphysema and patients with preserved lung function. J Cardiothorac Vascular Anesth 2005; 19:<br />
479-484.<br />
8. Bahk JH, Lim YJ, Kim CS. Position<strong>in</strong>g of double lumen endobronchial tube without the aid of any <strong>in</strong>strument:<br />
An implication for emergency management. J Trauma 2000; 49: 899-902.<br />
9. Bardoczky GI, Szegedi LL, d'Hollan<strong>der</strong> AA, Moures JM, de Franquen P, Yernault JC. Two-lung and onelung<br />
ventilation <strong>in</strong> patients with chronic obstructive pulmonary disease: the effects of position and FiO 2 .<br />
Anesth Analg 2000; 90: 35-41.<br />
10. Barrera R, Shi W, Amar D, Thaler HT, Gabovich N, Ba<strong>in</strong>s MS, White DA. Smok<strong>in</strong>g and tim<strong>in</strong>g of cessation.<br />
Impact on pulmonary complications after thoracotomy. Chest 2005; 127: 1977-1983.<br />
11. Beattie WS, Badner NH, Choi P. Epidural analgesia reduces postoperative myocardial <strong>in</strong>farction: a metaanalysis.<br />
Anesth Analg 2001; 93: 853-858.<br />
12. Beck DH, Doepfmer UR. S<strong>in</strong>emus C, Bloch A, Schenk MR, Kox WJ. Effects of sevoflurane and propofol<br />
on pulmonary shunt fraction dur<strong>in</strong>g one-lung ventilation for thoracic surgery. Br J Anaesth 2001; 86:<br />
38-43.<br />
13. Benoit Z, Wicky S, Fischer JF, Frascarolo P, Chapuis C, Spahn DR, Magnusson L. The effect of <strong>in</strong>creased<br />
FIO 2 before tracheal extubation on postoperative atelectasis. Anesth Analg 2002; 95: 1777-1781.<br />
14. Benumof JL. The position of double-lumen tubes should be rout<strong>in</strong>ely determ<strong>in</strong>ed by fiberoptic bronchoscopy.<br />
J Cardiothorac Vasc Anesth 1993; 7: 513-514.<br />
15. Benumof JL, Partridge BL, Salvatierra C, Keat<strong>in</strong>g J. Marg<strong>in</strong> of safety <strong>in</strong> position<strong>in</strong>g mo<strong>der</strong>n double-lumen<br />
endotracheal tubes. Anesthesiology 1987; 67: 729-738.<br />
16. Block BM, Liu SS, Rowl<strong>in</strong>gson AJ, Cowan AR, Cowan JA, Wu CL. Efficacy of postoperative epidural<br />
analgesia. A meta-analysis. JAMA 2003; 290: 2455-2463.<br />
17. Boldt J, Muller M, Uphus D, Padberg W, Hempelmann G. Cardiorespiratory changes <strong>in</strong> patients un<strong>der</strong>go<strong>in</strong>g<br />
pulmonary resection us<strong>in</strong>g different anesthetic management techniques. J Cardiothorac Vasc Anesth.<br />
1996; 10: 854-859.<br />
18. Bolliger CT, Koegelenberg CFN, Kendal R. Preoperative assessment for lung cancer surgery. Curr Op<strong>in</strong><br />
Pulm Med 2005; 11: 301-306.<br />
19. Bong CL, Samuel M, Ng JM, Ip-Yam C. Effects of preemptive epidural analgesia on post-thoracotomy<br />
pa<strong>in</strong>. J Cardiothorac Vasc Anesth 2005: 786-793.<br />
20. Brodner G, van Aken H, Gogarten W. Postoperative Akutschmerztherapie: Die Rolle <strong>der</strong> Regionalanästhesie.<br />
Anästhesiol Intensivmed Notfallmed Schmerzther 2007; 42: 32-41.<br />
21. Brodsky JB, Lemmens HJ. Left double-lumen tubes: cl<strong>in</strong>ical experience with 1.170 patients. J Cardiothorac<br />
Vasc Anesth 2003; 15: 216-217.<br />
22. Brodsky JB, Malott K, Angst M, Fitzmaurice BG, Kee SP, Logan L. The relationship between tracheal<br />
width and left bronchial width: implications for left-sided double-lumen tube selection. J Cardiothorac<br />
Vasc Anesth 2001; 15: 216-217.<br />
23. Brodsky JB, Macario A, Mark JBD. Tracheal diameter predicts double-lumen tube size: a method for<br />
select<strong>in</strong>g left double-lumen tubes. Anesth Analg 1996; 82: 861-864.<br />
24. Campos JH, Kernst<strong>in</strong>e KH. A comparison of a left sided Broncho-Cath ® with the torque control blocker<br />
Univent and the wire-guided blocker. Anesth Analg 2003; 96: 283-289<br />
25. Campos JH, Massa FC, Kernst<strong>in</strong>e KH. The <strong>in</strong>cidence of right upper lobe collapse when compar<strong>in</strong>g a rightsided<br />
double-lumen tube for left sided thoracic surgery. Anesth Analg 2000; 90: 535-540.<br />
26. Cerfolio R, Allen M, Trastek V, Deschamps C, Scanlon PD, Pairolero PC:Lung resection <strong>in</strong> patients with<br />
compromised pulmonary function.Ann Thorac Surg 1996;62:348-351<br />
27. Cesario A, Ferri L, Galetta D, Cardaci V, Biscione C, Pasqua F, Pira<strong>in</strong>o A, Bonassi S, Russo P, Sterzi S,<br />
48
Margaritora S, Granone P. Pre-operative pulmonary rehabilitation and surgery for lung cancer. Lung Cancer<br />
2007; 57: 118-119<br />
28. Cohen E. Methods of lung separation. M<strong>in</strong>erva Anesthesiol 2004; 70: 313–318.<br />
29. Colice GL, Shafazand S, Griff<strong>in</strong> JP, Keenan R, Bolliger CT: Physiologic evaluation of the patient with lung<br />
cancer be<strong>in</strong>g consi<strong>der</strong>ed for resectional surgery. ACCP evidence-based cl<strong>in</strong>ical practice guidel<strong>in</strong>es (2nd<br />
ed). Chest 2007; 132 Suppl: 161 S-177 S<br />
30. Conacher ID. 2000 - Time to apply Occam´s razor to failure of hypoxic pulmonary vasoconstriction dur<strong>in</strong>g<br />
one lung ventilation. Br J Anaesth 2000; 84: 434–436.<br />
31. Coussa M, Proietti S, Schny<strong>der</strong> P, Frascarolo Ph, Suter M,. Spahn DR, Magnusson L. Prevention of atelectasis<br />
formation dur<strong>in</strong>g the <strong>in</strong>duction of general anesthesia <strong>in</strong> morbidly obese patients. Anesth Analg 2004;<br />
98: 1491-1495.<br />
32. Davies RG, Myles PS, Graham JM. A comparison of the analgesic efficacy and side-effects of paravertebral<br />
vs epidural blockade for thoracotomy-a systematic review and meta-analysis of randomized trials. Br<br />
J Anaesth 2006; 96: 418-426.<br />
33. De Decker K, Jorens PG, Van Schil P: Cardiac complications after noncardiac thoracic surgery: an evidence-based<br />
current review. Ann Thorac Surg 2003; 75: 1340-1348.<br />
34. Della Rocca G, Costa MG. Preload <strong>in</strong>dexes <strong>in</strong> thoracic anesthesia. Curr Op<strong>in</strong> Anaesth 2003; 16: 69-73.<br />
35. Deslauriers J, Merhan R eds. Handbook of perioperative care <strong>in</strong> general thoracic surgery. Philadelphia:<br />
Elsevier Mosby; 2005, 9-19 resp. 435-444.<br />
36. v. Dossow V, Welte M, Zaune U, Mart<strong>in</strong> E, Walter M, Rückert J, Kox WJ, Spies C. Thoracic epidural<br />
anesthesia comb<strong>in</strong>ed with general anesthesia: the preferred anesthetic technique for thoracic surgery.<br />
Anesth Analg 2001; 92: 848-854.<br />
37. Duggan M, Kavanagh BP. Pulmonary atelectasis. Anesthesiology 2005; 102: 838-854.<br />
38. Eberle B, Weiler N, Vogel N, Kauczor HU, He<strong>in</strong>richs W. Computed tomography-based tracheobronchial<br />
image reconstruction allows selection of the <strong>in</strong>dividually appropriate double-lumen tube size. J Cardiothorac<br />
Vasc Anesth 1999; 13: 532-537.<br />
39. Ehrenfeld JM, Walsh JL, Sandberg WS. Right-sided and left-sided Mall<strong>in</strong>ckrodt double-lumen tubes have<br />
identical cl<strong>in</strong>ical performance. Anesth Analg 2008; 106: 1847-1852.<br />
40. Fernandez-Perez ER, Keegan MT, Brown DR, Hubmayr RD, Gajic O. Intraoperative Tidal Volume as a<br />
Risk Factor for Respiratory Failure after Pneumonectomy. Anesthesiology 2006; 105: 14-18.<br />
41. Fitzmaurice BG, Brodsky JB. Airway rupture from double- lumen tubes. J Cardiothorac Vasc Anesth 1999;<br />
13: 322–329.<br />
42. Fleisher LA, Beckman JA, Brown KA, Calk<strong>in</strong>s H, Chaikof E, Fleischmann KE, Freeman WK, Froehlich<br />
JB, Kasper EK, Kersten JR, Riegel B, Robb JF. ACC/AHA Guidel<strong>in</strong>es on preoperative cardiovascular<br />
evaluation and care for noncardiac surgery. J Am Coll Cardiol 2007; 50: 1707-32<br />
43. Fujiwara M, Abe K, Mashimo T. The effect of positive end-expiratory pressure and cont<strong>in</strong>uous positive<br />
airway pressure on the oxygenation and shunt fraction dur<strong>in</strong>g one-lung ventilation with propofol anesthesia.<br />
J Cl<strong>in</strong> Anesth 2001; 13: 473-477.<br />
44. Fuster V, Ryden LE, Cannom DS, Crijns HJ, Curtis AB, Ellenbogen KA, Halper<strong>in</strong> JL, Le Heuzey JY, Kay<br />
GN, Lowe JE, Olsson B, Prystowsky EN, Tamargo JL, Wann S. ACC/AHA/ESC 2006 guidel<strong>in</strong>es for the<br />
management of patients with atrial fibrillation-Executive summary. Circulation 2006; 114: 700-752.<br />
45. Gal TJ. Con: low tidal volumes are <strong>in</strong>dicated dur<strong>in</strong>g one-lung ventilation. Anesth Analg 2006; 103: 271-<br />
273.<br />
46. Gothard J. Lung <strong>in</strong>jury after thoracic surgery and one-lung ventilation. Curr Op<strong>in</strong> Anaesthesiol 2006; 19:<br />
5-10.<br />
47. Grichnik KP. Advances <strong>in</strong> the management of one-lung ventilation. In: Sl<strong>in</strong>ger PD (ed.). Progress <strong>in</strong> thoracic<br />
anesthesia. Baltimore: Lipp<strong>in</strong>cott Williams & Wilk<strong>in</strong>s; 2004: 47-79.<br />
48. Groeben HJ. Epidural anesthesia and pulmonary function. J Anesth 2006; 20: 290-299.<br />
49. Hachenberg T, Holst D, Ebel C, Pfeiffer B, Thomas H, Wendt M, Hedenstierna G. Effects of thoracic<br />
epidural anaesthesia on ventilation-perfusion distribution and <strong>in</strong>trathoracic blood volume before and after<br />
<strong>in</strong>duction of general anaesthesia. Acta Anaesthesiol Scand 1997; 41: 1142-1148.<br />
50. Hannallah MS, Benumof JL, Ruttimann WE. The relationship between left ma<strong>in</strong>stem bronchial diameter<br />
and patient size. J Cardiothorac Vasc Anesth 1995; 9: 119-121.<br />
51. Hedenstierna G. Contribution of multiple <strong>in</strong>ert gas elim<strong>in</strong>ation technique to pulmonary medic<strong>in</strong>e. 6. Ventilation-perfusion<br />
relationships dur<strong>in</strong>g anaesthesia. Thorax 1995; 50: 85-91.<br />
52. Herriger A, Frascarolo Ph, Spahn DR, Magnusson L. The effect of positive airway pressure dur<strong>in</strong>g preoxygenation<br />
and <strong>in</strong>duction of anaesthesia upon duration of non-hypoxic apnoea. Anaesthesia 2004; 59:<br />
243-247.<br />
53. Heerdt PM, Malhotra J. The right ventricular response to lung resection.In: Sl<strong>in</strong>ger PD ed. Progress <strong>in</strong><br />
thoracic anesthesia. Baltimore: Lipp<strong>in</strong>cott Williams & Wilk<strong>in</strong>s; 2004, 221-246.<br />
54. Hoeper MM, Markevych I, Spiekerkoetter E, Welte T, Nie<strong>der</strong>meyer J. Goal-oriented treatment and comb<strong>in</strong>ation<br />
therapy for pulmonary arterial hypertension. Eur Respir J 2005; 26: 858-863.<br />
55. Hofer CK, Zoll<strong>in</strong>ger A, Rak M, Matter-Ensner S, Klaghofer R, Pasch T, Zalunardo MP. Therapeutic impact of<br />
<strong>in</strong>tra-operative transoesophageal echocardiography dur<strong>in</strong>g noncardiac surgery. Anaesthesia 2004; 59: 3-9.<br />
49
56. Huettemann E, Sakka S. Anaesthesia and anti-cancer chemotherapeutic drugs. Curr Op<strong>in</strong> Anaesth 2005;<br />
18: 307-314.<br />
57. Hurford WE, Alfille PH. A quality improvement study of the placement and complications of doublelumen<br />
endobronchial tubes. J Cardiothorac Vasc Anesth. 1993; 7: 517-20.<br />
58. Inoue, N. Nishim<strong>in</strong>e, K. Kitaguchi, H. Furuya, and S. Taniguchi. Double lumen tube location predicts tube<br />
malposition and hypoxaemia dur<strong>in</strong>g one lung ventilation. Br J Anaesth 2004; 92: 195-201.<br />
59. Karzai W, Haberstroh J, Priebe HJ. Effects of desflurane and propofol on arterial oxygenation dur<strong>in</strong>g onelung<br />
ventilation <strong>in</strong> the pig. Acta Anaesthesiol Scand 1998;42:648-652.<br />
60. Klafta JM. Advances <strong>in</strong> lung isolation for chest surgery. In: Sl<strong>in</strong>ger PD (ed.). Progress <strong>in</strong> thoracic anesthesia.<br />
Baltimore: Lipp<strong>in</strong>cott Williams & Wilk<strong>in</strong>s; 2004: 29-45.<br />
61. Kle<strong>in</strong> U, Karzai W, Bloos F, Wohlfarth M, Gottschall R, Fritz H, Gugel M, Seifert A. Role of fiberoptic<br />
bronchoscopy <strong>in</strong> conjunction with the use of double-lumen tubes for thoracic anesthesia. Anesthesiology<br />
1998; 88: 346-350.<br />
62. Kle<strong>in</strong> U, Laub<strong>in</strong>ger R, Malich A, Hapich A, Gunkel W. Erstversorgung bei Thoraxtrauma. Anaesthesist<br />
2006; 55: 1172-1188.<br />
63. Knoll H, Ziegeler S, Schreiber JU, Buch<strong>in</strong>ger H, Bialas P, Semyonov K, Graeter T, Mencke T. Airway<br />
Injuries after One-lung Ventilation: A Comparison between Double-lumen Tube and Endobronchial Blokker.<br />
Anesthesiology. 2006; 105: 471-7.<br />
64. Knüttgen D, Zeidler D, Vorweg M, Doehn M. E<strong>in</strong>seitige High Frequency Jet Ventilation als Ergänzung <strong>der</strong><br />
E<strong>in</strong>lungenbeatmung bei thoraxchirurgischen E<strong>in</strong>griffen. Anaesthesist 2001; 50: 585-589.<br />
65. Koegelenberg CF, Bolliger CT: Assess<strong>in</strong>g regional lung function. Thorac Surg Cl<strong>in</strong> 2008; 18: 19-29<br />
66. Kozian A, Schill<strong>in</strong>g T, Strang C, Hachenberg T. Anesthetic consi<strong>der</strong>ations <strong>in</strong> patients with previous thoracic<br />
surgery. Curr Op<strong>in</strong> Anaesthesiol 2006; 19: 26-33.<br />
67. Le<strong>der</strong>er DJ, Tomashow BM, G<strong>in</strong>sburg ME, Aust<strong>in</strong> JHM, Bartels MN, Yip CK, Jellen PA, Brogan FL,<br />
Kawut SM, Maxfield RA, DiMango AM, Simonelli PF, Gorenste<strong>in</strong> LA, Pearson GDN, Sonett JR: Lungvolume<br />
reduction surgery for pulmonary emphysema: improvement <strong>in</strong> body mass <strong>in</strong>dex, airflow obstruction,<br />
dyspnea and exercise capacity <strong>in</strong>dex after 1 year. J Thorac Cardiovasc Surg 2007; 133: 1434-1438<br />
68. Lehmann A, Zeitler C, Lang J, Isgro F, Kiessl<strong>in</strong>g AH. Boldt J. E<strong>in</strong> Vergleich des Arndt ® -Bronchusblockers<br />
mit e<strong>in</strong>em Doppellumentubus im Rahmen robotergestützter E<strong>in</strong>griffe <strong>in</strong> <strong>der</strong> Herzchirurgie. Anästhesiol<br />
Intensivmed Notfallmed Schmerzther 2004; 39: 353-359.<br />
69. Loehr SA, Scheeren TWL, Tarnow J. Desflurane <strong>in</strong>hibits hypoxic pulmonary vasoconstriction <strong>in</strong> isolated<br />
rabbit lungs. Anesthesiology 1995; 83: 552-556.<br />
70. Magnusson L, Spahn DR. New concepts of atelectasis dur<strong>in</strong>g general anesthesia. Br J Anaesth 2003;91:61–<br />
72.<br />
71. Max M, Demb<strong>in</strong>ski R. Pulmonaler Gasaustausch <strong>in</strong> Narkose. Anaesthesist 2000; 49: 771–783.<br />
72. Michelet P, D'Journo XB, Roch A, Doddoli C, Mar<strong>in</strong> V, Papazian L, Decamps I, Bregeon F, Thomas P,<br />
Auffray JP. Protective ventilation <strong>in</strong>fluences systemic <strong>in</strong>flammation after Esophagectomy. Anesthesiology<br />
2006; 105: 911-919.<br />
73. Misthos P, Katsaragakis S, Mil<strong>in</strong>gos N, Kakaris S, Sepsas E, Athanassiadi K, Theodorou D, Skottis I.<br />
Postresectional pulmonary oxidative stress <strong>in</strong> lung cancer patients: the role of one-lung ventilation. Eur J<br />
Cardio-thorac Surg 2005; 27: 378-383.<br />
74. Møller AM, Pe<strong>der</strong>sen T, Svendsen PE, Engquist A. Perioperative risk factors <strong>in</strong> elective pneumonectomy:<br />
the impact of excessive fluid balance. Eur J Anaesth 2002; 19: 57-62.<br />
75. Møller AM, Villebro N, Pe<strong>der</strong>sen T, Tønnesen H. Effects of preoperative smok<strong>in</strong>g <strong>in</strong>tervention on postoperative<br />
complications: a randomised cl<strong>in</strong>ical trial. Lancet 2002b; 359: 114-117.<br />
76. Motsch J, Wiedemann K, Roggenbach J. Atemwegsmanagement bei <strong>der</strong> E<strong>in</strong>-Lungen-Ventilation. Anaesthesist<br />
2005; 54: 601-624.<br />
77. Oczenski W, Schwarz S, Fitzgerald RD. Vital capacity manoeuvre <strong>in</strong> general anaesthesia: useful or useless?<br />
European Journal of Anaesthesiology 2004; 21: 253-259.<br />
78. Padley SPG, Jordan SJ, Goldstraw P, Wells AU, Hansell DM. Asymmetric ARDS follow<strong>in</strong>g pulmonary<br />
resection: CT f<strong>in</strong>d<strong>in</strong>gs - <strong>in</strong>itial observations. Radiology 2002; 223: 468-473.<br />
79. Partridge L, Russell WJ. The marg<strong>in</strong> of safety of a left double-lumen tracheo-bronchial tube depends on<br />
the length of the bronchial cuff and tip. Anaesth Intensive Care 2006; 34: 618-620.<br />
80. Pennefather SH, Russell GN. Placement of double-lumen tubes – time to shed light on an old problem<br />
(editorial). Br J Anaesth 2000; 84: 308-310.<br />
81. Pfitzner J, Peacock MJ, Daniels BW. Ambient pressure oxygen reservoir apparatus for use dur<strong>in</strong>g one-lung<br />
anaesthesia. Anaesthesia 1999; 54: 454-458.<br />
82. Pompeo E, DeDom<strong>in</strong>icis E, Ambrogi V, M<strong>in</strong>eo D, Elia S,M<strong>in</strong>eo TC. Quality of life after tailored comb<strong>in</strong>ed<br />
surgery for stage I non-small cell lung cancer and severe emphysema. Ann Thorac Surg 2003; 76: 1821-<br />
1827<br />
83. Rodgers A, Walker N, Schug S, McKee A, Kehlet H, van Zun<strong>der</strong>t A, Sage D, Futter M, Saville G, Clark<br />
T, McMahon S. Reduction of postoperative mortality and morbidity with epidural or sp<strong>in</strong>al anaesthesia:<br />
results from overview of randomized trials. BMJ 2000; 321: 1493-1497.<br />
50
84. Rothen HU, Sporre B, Engberg G, Wegenius G, Reber A, Hedenstierna G. Prevention of atelectasis dur<strong>in</strong>g<br />
general anaesthesia. Lancet. 1995; 345: 1387-91.<br />
85. Russell WJ. A logical approach to selection and <strong>in</strong>sertion of double-lumen tubes. Curr Op<strong>in</strong> Anaesthesiol<br />
2008; 21:37-40.<br />
86. Schill<strong>in</strong>g T, Kozian A, Huth C, Bühl<strong>in</strong>g F, Kretzschmar M, Welte T, Hachenberg T. The pulmonary immun<br />
effects of mechanical ventilation <strong>in</strong> patients un<strong>der</strong>go<strong>in</strong>g thoracic surgery. Anesth Analg 2005; 101: 957-<br />
965.<br />
87. Schottke-Henn<strong>in</strong>gs H, Klippe HJ, Schmied<strong>in</strong>g B. Die Fiberbronchoskopie als Hilfsmittel zur Plazierung<br />
und Überwachung von Doppellumen-Tuben <strong>in</strong> <strong>der</strong> Thoraxanästhesie. Anästhesiol Intensivmed Notfallmed<br />
Schmerzther 1989; 24: 327–333.<br />
88. Schussler O, Alifano M, Derm<strong>in</strong>e H, Strano S, Casetta A, Sepulveda S, Chafik A, Coignard S, Rabbat A,<br />
Regnard JF. Postoperative pneumonia after major lung resection. Am J Respir Crit Care Med 2006; 173:<br />
1161-1169.<br />
89. Schwarzkopf K, Schreiber T, Preussler NP, Gaser E, Hüter L, Bauer R, Schubert H, Karzai W. Lung perfusion:<br />
fraction, and oxygenation dur<strong>in</strong>g one-lung ventilation <strong>in</strong> pigs: the effects of desflurane, isoflurane,<br />
and propofol. J Cardiothorac Vasc Anesth 2003; 17: 73–75.<br />
90. Schwarzkopf K, Kle<strong>in</strong> U, Schreiber T, Preußler NP, Bloos F, Helfritsch H, Sauer F, Karzai W. Oxygenation<br />
dur<strong>in</strong>g one-lung ventilation: the effects of <strong>in</strong>haled nitric oxide and <strong>in</strong>creas<strong>in</strong>g levels of <strong>in</strong>spired fraction<br />
of oxygen. Anesth Analg 2001; 92: 842–847.<br />
91. Sentürk M. New concepts of the management of one-lung ventilation. Curr Op<strong>in</strong> Anaesthesiol 2006; 19:1-<br />
4.<br />
92. Sentürk M, Özcan PE, Talu GK, Kiyan E, Camci E, Özyalc<strong>in</strong> S, Dilege S, Pembeci K. The effects of three<br />
different analgesia techniques on long-term postthoracotomy pa<strong>in</strong>.Anesth Analg 2002; 94: 11-15.<br />
93. Seymour AH. The relationship between the diameters for the adult cricoid r<strong>in</strong>g and ma<strong>in</strong> tracheobronchial<br />
tree: a cadaver study to <strong>in</strong>vestigate the basis for double-lumen tube selection. J Cardiothorac Vasc Anesth<br />
2003; 17: 299-301<br />
94. Seymour AH, Lynch L. An audit of Robertshaw double lumen tube placement us<strong>in</strong>g the fibreoptic bronchoscope.<br />
Br J Anaesth 2000; 85: 661-662.<br />
95. Sl<strong>in</strong>ger P. Pro: low tidal volume is <strong>in</strong>dicated dur<strong>in</strong>g one-lung ventilation. Anesth Analg 2006; 103: 268-<br />
270.<br />
96. Sl<strong>in</strong>ger PD, Johnston MR. Preoperative assessment for lung cancer surgery. In: Sl<strong>in</strong>ger PD ed. Progress <strong>in</strong><br />
thoracic anesthesia. Baltimore: Lipp<strong>in</strong>cott Williams & Wilk<strong>in</strong>s; 2004, 1-27.<br />
97. Sl<strong>in</strong>ger P. A view of and through double-lumen tubes. J Cardiothorac Vasc Anesth 2003; 17: 287-288.<br />
98. Sl<strong>in</strong>ger PD, Kruger M, McRae K, W<strong>in</strong>ton T. Relation of the static compliance curve and positive endexpiratory<br />
pressure to oxygenation dur<strong>in</strong>g one-lung ventilation. Anesthesiology 2001; 95: 1096–1102.<br />
99. Sl<strong>in</strong>ger P, Hickey DR. The <strong>in</strong>teraction between PEEP and auto-PEEP dur<strong>in</strong>g one-lung ventilation. J Cardiothorac<br />
Vasc Anesth 1998; 12: 142-144.<br />
100. Spies C, Zaune U, Pauli MH, Boeden G, Mart<strong>in</strong> E. Vergleich von Enfluran und Propofol bei thoraxchirurgischen<br />
E<strong>in</strong>griffen. Anaesthesist. 1991; 40: 14-8.<br />
101. Sticher J, Müller M, Scholz S, Sch<strong>in</strong>dler, Hempelmann G. Controlled hypercapnia dur<strong>in</strong>g one-lung ventilation<br />
<strong>in</strong> patients un<strong>der</strong>go<strong>in</strong>g pulmonary resection. Acta Anaesthesiologica Scand<strong>in</strong>avica. 2001; 45: 842-<br />
847.<br />
102. Tusman G, Böhm SH, Melkun F, Staltari D, Qu<strong>in</strong>zio C, Nador C, Turchetto E. Alveolar Recruitment strategy<br />
<strong>in</strong>creases arterial oxygenation dur<strong>in</strong>g one-lung ventilation. Ann Thorac Surg 2002; 73: 1204-1209.<br />
103. Varela G, Brunelli A, Rocco G, Novoa N, Refai M, Jimenez MF, Salati M, Gatani T: Measured FEV1 <strong>in</strong><br />
the first postoperative day, and not ppoFEV1, is the best predictor of cardio-respiratory morbidity after<br />
lung resection. Eur J Cardiothorac Surg 2007; 31: 518-521<br />
104. Watson CB, Bowe EA, Burk W. One-lung anesthesia for pediatric thoracic surgery: a new use for the<br />
fiberoptic bronchoscope. Anesthesiology 1982; 56: 314-315.<br />
105. Wiedemann K, Limberg D. Die Larynxmaske beim schwierigen Atemweg und <strong>in</strong> <strong>der</strong> <strong>Thoraxchirurgie</strong>.<br />
Anästhesiol Intensivmed Notfallmed Schmerzther 2004; 39: 501-506.<br />
106. Wiedemann K, Männle C, Layer M, Herth F. <strong>Anästhesie</strong> <strong>in</strong> <strong>der</strong> <strong>Thoraxchirurgie</strong>. Anästhesiol Intensivmed<br />
Notfallmed Schmerzther 2004; 39: 616-650.<br />
107. Wiedemann K, Kle<strong>in</strong> U. Der Doppellumen-Tubus - Aspekte <strong>der</strong> kl<strong>in</strong>ischen Anwendung. C<strong>in</strong>ema-Studios<br />
Hörstel-Dreierwalde. Wissenschaftliches Lehrvideo, 1996<br />
108. Wyser C, Stulz P, Soler M, Tamm M, Müller-Brand J, Habicht J, Perruchoud AP, Bolliger CT: Prospective<br />
evaluation of an algorithm for the functional assessment of lung resection candidates. Am J Respir Crit<br />
Care Med 1999; 159: 1450-1456<br />
109. Yam IPC, Innes PA, Jackson M, Snowdon SL, Russell GN. Variation <strong>in</strong> the arterial to end-tidal PCO 2<br />
difference dur<strong>in</strong>g one-lung thoracic anaesthesia. Br J Anaesth. 1994; 72: 21-4.<br />
110. Zoll<strong>in</strong>ger A, Zaugg M, Wecker W, Russi EW, Blumenthal S, Zalunardo MP, Stoehr S, Thurnheer R,<br />
Stammberger U, Spahn DR. Video-assisted thoracoscopic volume reduction surgery <strong>in</strong> patients with diffuse<br />
pulmonary emphysema: gas exchange and anesthesiological management. Anesth Analg 1997; 84:<br />
845-851.<br />
51