COMBO ĐỀ HSG MÔN TOÁN, VẬT LÝ, HÓA HỌC LỚP 8 CẤP HUYỆN NHỮNG NĂM GẦN ĐÂY (CÓ ĐÁP ÁN CHI TIẾT)
https://app.box.com/s/8zu9uan6fp6a5appv6hbmr8iy6wzshdo
https://app.box.com/s/8zu9uan6fp6a5appv6hbmr8iy6wzshdo
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
www.facebook.com/daykem.quynhon<br />
https://daykemquynhon.blogspot.com<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa Quy Nhơn 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
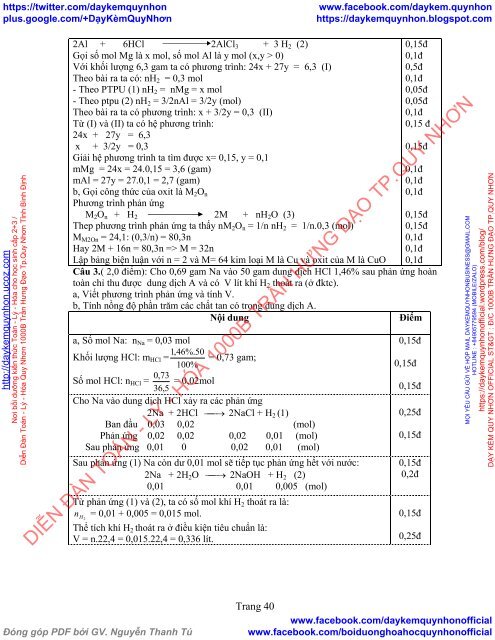
2Al + 6HCl 2AlCl 3 + 3 H 2 (2)<br />
Gọi số mol Mg là x mol, số mol Al là y mol (x,y > 0)<br />
Với khối lượng 6,3 gam ta có phương trình: 24x + 27y = 6,3 (I)<br />
Theo bài ra ta có: nH 2 = 0,3 mol<br />
- Theo PTPU (1) nH 2 = nMg = x mol<br />
- Theo ptpu (2) nH 2 = 3/2nAl = 3/2y (mol)<br />
Theo bài ra ta có phương trình: x + 3/2y = 0,3 (II)<br />
Từ (I) và (II) ta có hệ phương trình:<br />
24x + 27y = 6,3<br />
x + 3/2y = 0,3<br />
Giải hệ phương trình ta tìm được x= 0,15, y = 0,1<br />
mMg = 24x = 24.0,15 = 3,6 (gam)<br />
mAl = 27y = 27.0,1 = 2,7 (gam)<br />
b, Gọi công thức của oxit là M 2 O n<br />
Phương trình phản ứng<br />
M 2 O n + H 2 2M + nH 2 O (3)<br />
Thep phương trình phản ứng ta thấy nM 2 O n = 1/n nH 2 = 1/n.0,3 (mol)<br />
M M2On = 24,1: (0,3/n) = 80,3n<br />
Hay 2M + 16n = 80,3n => M = 32n<br />
Lập bảng biện luận với n = 2 và M= 64 kim loại M là Cu và oxit của M là CuO<br />
0,15đ<br />
0,1đ<br />
0,5đ<br />
0,1đ<br />
0,05đ<br />
0,05đ<br />
0,1đ<br />
0,15 đ<br />
0,15đ<br />
0,1đ<br />
0,1đ<br />
0,1đ<br />
0,15đ<br />
0,15đ<br />
0,1đ<br />
0,1đ<br />
0,1đ<br />
Câu 3.( 2,0 điểm): Cho 0,69 gam Na vào 50 gam dung dịch HCl 1,46% sau phản ứng hoàn<br />
toàn chỉ thu được dung dịch A và có V lít khí H 2 thoát ra (ở đktc).<br />
a, Viết phương trình phản ứng và tính V.<br />
b, Tính nồng độ phần trăm các chất tan có trong dung dịch A.<br />
Nội dung<br />
Điểm<br />
a, Số mol Na: n Na = 0,03 mol<br />
1,46%.50<br />
Khối lượng HCl: m HCl = = 0,73 gam;<br />
100%<br />
0,73<br />
Số mol HCl: n HCl = = 0,02mol<br />
36,5<br />
Cho Na vào dung dịch HCl xảy ra các phản ứng<br />
2Na + 2HCl 2NaCl + H 2 (1)<br />
Ban đầu 0,03 0,02 (mol)<br />
Phản ứng 0,02 0,02 0,02 0,01 (mol)<br />
Sau phản ứng 0,01 0 0,02 0,01 (mol)<br />
Sau phản ứng (1) Na còn dư 0,01 mol sẽ tiếp tục phản ứng hết với nước:<br />
2Na + 2H 2 O 2NaOH + H 2 (2)<br />
0,01 0,01 0,005 (mol)<br />
Từ phản ứng (1) và (2), ta có số mol khí H 2 thoát ra là:<br />
n<br />
H 2<br />
= 0,01 + 0,005 = 0,015 mol.<br />
Thể tích khí H 2 thoát ra ở điều kiện tiêu chuẩn là:<br />
V = n.22,4 = 0,015.22,4 = 0,336 lít.<br />
0,15đ<br />
0,15đ<br />
0,15đ<br />
0,25đ<br />
0,15đ<br />
0,15đ<br />
0,2đ<br />
0,15đ<br />
0,25đ<br />
DIỄN ĐÀN <strong>TO<strong>ÁN</strong></strong> - <strong>LÝ</strong> - <strong>HÓA</strong> 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi GV. Nguyễn Thanh Tú<br />
Trang 40<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial