La fuerza protón-motriz
La fuerza protón-motriz
La fuerza protón-motriz
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
370 21 <strong>La</strong> <strong>fuerza</strong> <strong>protón</strong>-<strong>motriz</strong><br />
? PREGUNTA RÁPIDA 1 ¿Por qué las<br />
subunidades F1 de la ATP sintasa<br />
aisladas catalizan la hidrólisis de ATP?<br />
O<br />
ADP + P i<br />
α<br />
β β<br />
γ<br />
α α<br />
β<br />
ATP<br />
ADP + P i<br />
T<br />
ADP + P i<br />
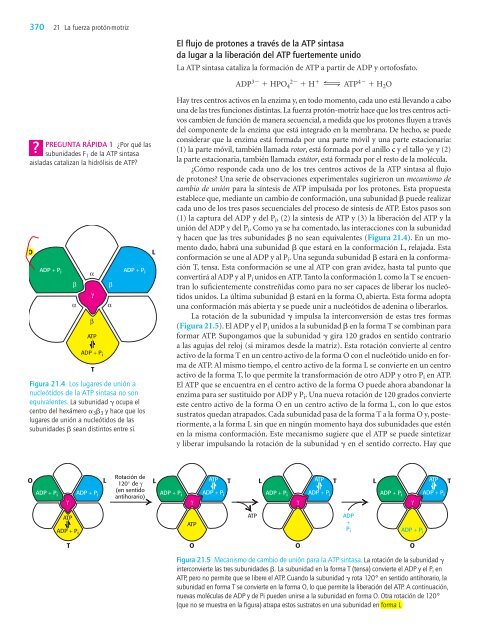
Figura 21.4 Los lugares de unión a<br />
nucleótidos de la ATP sintasa no son<br />
equivalentes. <strong>La</strong> subunidad g ocupa el<br />
centro del hexámero a 3b 3 y hace que los<br />
lugares de unión a nucleótidos de las<br />
subunidades b sean distintos entre sí.<br />
L<br />
El flujo de protones a través de la ATP sintasa<br />
da lugar a la liberación del ATP fuertemente unido<br />
<strong>La</strong> ATP sintasa cataliza la formación de ATP a partir de ADP y ortofosfato.<br />
ADP 32 1 HPO 4 22 1 H 1 N ATP 42 1 H2O<br />
Hay tres centros activos en la enzima y, en todo momento, cada uno está llevando a cabo<br />
una de las tres funciones distintas. <strong>La</strong> <strong>fuerza</strong> <strong>protón</strong>-<strong>motriz</strong> hace que los tres centros activos<br />
cambien de función de manera secuencial, a medida que los protones fluyen a través<br />
del componente de la enzima que está integrado en la membrana. De hecho, se puede<br />
considerar que la enzima está formada por una parte móvil y una parte estacionaria:<br />
(1) la parte móvil, también llamada rotor, está formada por el anillo c y el tallo g y (2)<br />
la parte estacionaria, también llamada estátor, está formada por el resto de la molécula.<br />
¿Cómo responde cada uno de los tres centros activos de la ATP sintasa al flujo<br />
de protones? Una serie de observaciones experimentales sugirieron un mecanismo de<br />
cambio de unión para la síntesis de ATP impulsada por los protones. Esta propuesta<br />
establece que, mediante un cambio de conformación, una subunidad b puede realizar<br />
cada uno de los tres pasos secuenciales del proceso de síntesis de ATP. Estos pasos son<br />
(1) la captura del ADP y del P i, (2) la síntesis de ATP y (3) la liberación del ATP y la<br />
unión del ADP y del P i. Como ya se ha comentado, las interacciones con la subunidad<br />
g hacen que las tres subunidades b no sean equivalentes (Figura 21.4). En un momento<br />
dado, habrá una subunidad b que estará en la conformación L, relajada. Esta<br />
conformación se une al ADP y al P i. Una segunda subunidad b estará en la conformación<br />
T, tensa. Esta conformación se une al ATP con gran avidez, hasta tal punto que<br />
convertirá al ADP y al P i unidos en ATP. Tanto la conformación L como la T se encuentran<br />
lo suficientemente constreñidas como para no ser capaces de liberar los nucleótidos<br />
unidos. <strong>La</strong> última subunidad b estará en la forma O, abierta. Esta forma adopta<br />
una conformación más abierta y se puede unir a nucleótidos de adenina o liberarlos.<br />
<strong>La</strong> rotación de la subunidad g impulsa la interconversión de estas tres formas<br />
(Figura 21.5). El ADP y el P i unidos a la subunidad b en la forma T se combinan para<br />
formar ATP. Supongamos que la subunidad g gira 120 grados en sentido contrario<br />
a las agujas del reloj (si miramos desde la matriz). Esta rotación convierte al centro<br />
activo de la forma T en un centro activo de la forma O con el nucleótido unido en forma<br />
de ATP. Al mismo tiempo, el centro activo de la forma L se convierte en un centro<br />
activo de la forma T, lo que permite la transformación de otro ADP y otro P i en ATP.<br />
El ATP que se encuentra en el centro activo de la forma O puede ahora abandonar la<br />
enzima para ser sustituido por ADP y P i. Una nueva rotación de 120 grados convierte<br />
este centro activo de la forma O en un centro activo de la forma L, con lo que estos<br />
sustratos quedan atrapados. Cada subunidad pasa de la forma T a la forma O y, posteriormente,<br />
a la forma L sin que en ningún momento haya dos subunidades que estén<br />
en la misma conformación. Este mecanismo sugiere que el ATP se puede sintetizar<br />
y liberar impulsando la rotación de la subunidad g en el sentido correcto. Hay que<br />
O L<br />
Rotación de<br />
120° de γ L ATP T L ATP T L ATP T<br />
ADP + Pi γ<br />
ADP + Pi (en sentido<br />
antihorario)<br />
ADP + Pi γ<br />
ADP + Pi ADP + Pi γ<br />
ADP + Pi ADP + Pi γ<br />
ADP + Pi ATP ATP ADP<br />
ATP<br />
+<br />
ADP + P P<br />
i<br />
i<br />
T O<br />
ADP + P i<br />
O O<br />
Figura 21.5 Mecanismo de cambio de unión para la ATP sintasa. <strong>La</strong> rotación de la subunidad g<br />
interconvierte las tres subunidades b. <strong>La</strong> subunidad en la forma T (tensa) convierte el ADP y el P i en<br />
ATP, pero no permite que se libere el ATP. Cuando la subunidad g rota 120° en sentido antihorario, la<br />
subunidad en forma T se convierte en la forma O, lo que permite la liberación del ATP. A continuación,<br />
nuevas moléculas de ADP y de Pi pueden unirse a la subunidad en forma O. Otra rotación de 120°<br />
(que no se muestra en la figura) atrapa estos sustratos en una subunidad en forma L