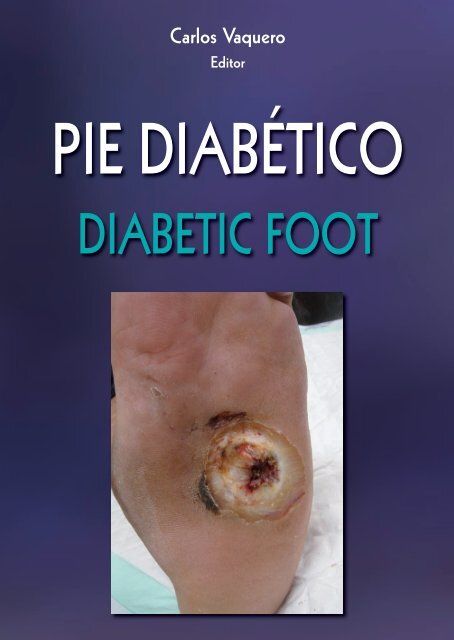
Descargar - Úlceras.net
Descargar - Úlceras.net
Descargar - Úlceras.net
- No tags were found...
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
Carlos VaqueroEditorPIE DIABÉTICODIABETIC FOOT
Pie diabéticoDiabetic Foot
CARLOS VAQUERO (Editor)Pie diabéticoDiabetic FootVALLADOLID 2012
Editor: CARLOS VAQUEROPROCIVAS S.L.N.E.© De los textos: SUS AUTORES© De las fotografías: SUS AUTORESImprime: Gráficas Andrés Martín, S. L.Juan Mambrilla, 9. 47003 ValladolidISBN: 978-84-615-9336-1Depósito Legal: VA. 570.–2012
ÍndicePresentación .............................................................................................................................................. 9GENERALIDADES SOBRE EL PIE DIABÉTICO .............................................................................. 11DIABETIC ANGIOPATHY ..................................................................................................................... 19DIAGNÓSTICO DE LA ARTERIOPATÍA DIABÉTICA Y PIE DIABÉTICO ............................... 31MANIFESTACIONES CLÍNICAS EN LA INFECCIÓN DEL PIE DIABÉTICO ......................... 39ÚLCERA NEUROPÁTICA .................................................................................................................... 49MANEJO Y CUIDADOS DE LA ÚLCERA DIABÉTICA ................................................................ 61CURAS DEL PIE DIABÉTICO .............................................................................................................. 67ANESTESIA Y PIE DIABÉTICO ............................................................................................................ 77OPEN SURGERY FOR REVASCULARIZATION OF THE DIABETIC FOOD ......................... 83TRATAMIENTO ENDOVASCULAR DE LAS ARTERIAS DISTALESDEL MIEMBRO INFERIOR ............................................................................................................... 97TRATAMIENTO DE LA ARTERIOPATÍA DIABÉTICA, MEDIANTE LA UTILIZACIÓNDE BALÓN IMPREGNADO DE DROGA ................................................................................... 107NEGATIVE PRESSURE WOUND THERAPY IN DIABETIC FOOT WOUNDS ...................... 113THE ROLE OF HYPERBARIC OXYGEN THERAPY IN THE TREATMENT OF DIABETICFOOT ULCERS .................................................................................................................................... 121EXPERIENCIA DEL PROGRAMA DE ATENCIÓN INTEGRAL A PACIENTESCON PIE DIABÉTICO ...................................................................................................................... 135
8 ■ PIE DIABÉTICOTERAPIA DE CÉLULAS MADRE Y GÉNICA DE LA ISQUEMIA CRÍTICA DIABÉTICADE LOS MIEMBROS INFERIORES .................................................................................................. 141AMPUTACIONES EN EL PIE DIABÉTICO ....................................................................................... 151NUEVOS AVANCES EN EL TRATAMIENTO DEL PIE DIABÉTICO .......................................... 161ORGANIZACIÓN FUNCIONAL DE UNA UNIDAD DE PIE DIABÉTICO. POSIBILIDADESDE INTEGRACIÓN CON PODOLOGÍA ........................................................................................ 171
PresentaciónProf. CARLOS VAQUERO PUERTAEditorLa patología vascular diabética, son un conjunto de procesos que se presentan conuna alta incidencia y prevalencia a nivel de todo tipo de pacientes, tanto los integradosen sociedades consideradas muy avanzadas como otras menos desarrolladas.La gravedad de sus repercusiones es tal, que condiciona en muchas ocasiones lapropia supervivencia de los individuos, ocasionando en otras graves repercusiones enforma de amputaciones lo que deriva en importantes minusvalías, no sólo desde elpunto de vista físico, sino también psicológico. En los últimos años se han puesto enmarcha novedosas estrategias con el fin de poder paliar los efectos de este tipo de procesos,en muchas ocasiones con la aplicación de nuevas técnicas, pero lo que puedeser más relevante es la puesta en marcha de nuevos conceptos estratégicos en la queen la mayoría de las ocasiones están involucrados diferentes profesionales tanto desdeel punto de vista médico como social, por lo que el problema es abordado desde unpunto de vista multidisciplinario.El presente libro, trata de presentar diferentes aportaciones sobre el tema, abordandovariados aspectos problemáticos englobados en un denominador común quepodría enmarcarse como pie diabético, en referencia con las repercusiones que en estaparte del organismo tiene la patología vascular diabética. Se presentan las diferentesaportaciones relacionadas en apartados diferenciados, y en algunos casos estos aspectospresentados por diferentes autores, abordan los temas con coincidencia de contenido,pero que hemos creído oportuno respetar su presentación, al considerar que enriquecenla aportación de la información, al mostrarse relacionada desde diferentes puntosde vista que más que repetitivos son enriquecedores. Agradecemos el esfuerzo quelos autores han aportado a los diferentes capítulos del libro, y muy especialmente aaquellos que lo han tenido que realizar en inglés, en vez de su lengua de expresiónhabitual, pero necesario hacerlo en un vehículo generalizado de transmisión de la informacióncientífica internacional.
Generalidades sobre el pie diabéticoJOSÉ ANTONIO BRIZUELA, MARÍA ANTONIA IBÁÑEZ, NOELIA CENIZO,ENRIQUE SAN NORBERTO, LOURDES DEL RÍO Y CARLOS VAQUEROServicio de Angiología y Cirugía Vascular. Hospital Clínico Universitario de Valladolid. EspañaINTRODUCCIÓNEl pie diabético es una entidad clínica complejaformada por tres pilares, el neuropático, elisquémico y el infeccioso. Los tres componentescoexisten en distintas proporciones en unmismo paciente y la evaluación y manejo clínicohan de basarse en la actuación sobre todosellos.El desarrollo del pie diabético parece correlacionarsecon el control metabólico de la enfermedad,aunque también puede aparecer endiabéticos con buen control glucémico, mientrasque pacientes con diabetes mal controladapueden verse libres de ello. A veces es la primeramanifestación de la enfermedad en pacientesen los que no se conocía que eran diabéticos.El abordaje del pie diabético debe ser multidisciplinario,involucrando Médicos de AtenciónPrimaria, Endocrinólogos, Neurólogos, Podólogos,Traumatólogos, Rehabilitadores y CirujanosVasculares, siendo de especial importancia loscuidados de Enfermería en esta patología.EPIDEMIOLOGÍAEl pie diabético es epidemiológicamenteun problema de primer orden, dada la granprevalencia de la diabetes mellitus en las sociedadesoccidentales y las graves consecuenciasen términos de amputaciones y calidadde vida que conllevan para los pacientes, asícomo en costes sociosanitarios.La primera causa de ingreso en los diabéticoses precisamente esta entidad. Se estimaque en EEUU aproximadamente el 20% de losdiabéticos precisarán ingreso hospitalarioalguna vez en su vida por este problema, conuna tasa de amputación de hasta un 25%.FISIOPATOLOGÍANeuropatíaLa neuropatía es la base fundamental sobrela que se desarrollan las manifestacionesdel pie diabético. Se trata de una polineuropatíaque afecta tanto al sistema vegetativocomo al somático. La aparición de esta complicación,al igual que la nefropatía y la retinopatía,va ligada al tiempo de progresión de laenfermedad, así como al control metabólico.Se han invocado principalmente dos teo -rías patogénicas. La primera se establece apartir de observaciones sobre el engrosamientode las paredes de los vasa nervorum,lo que llevaría a obstrucción de los mismos ya una lesión isquémica del nervio. La segundase basa en el acúmulo de sorbitol secundarioa la hiperglucemia, lo que produciría la desmielinizacióny alteración de la velocidad deconducción de los nervios periféricos. Otrosestudios han sugerido que el descenso de factoresneurotróficos pueden tener un importantepapel en el desarrollo de la neuropatía.La afectación del sistema nervioso autónomopuede llevar a una hipoperfusión por elmantenimiento de fístulas arteriovenosas através de la microcirculación, y ello a pesar deun aporte arterial normal. Además es conocidoque los reflejos nociceptivos contribuyen adesarrollar la respuesta inflamatoria (neuro-
12 ■ PIE DIABÉTICOEs la complicación más frecuente de laneuropatía diabética. Se trata de úlceras queaparecen sobre puntos de presión, generalmentea nivel plantar en la cabeza de losmetatarsianos, pero que pueden aparecertambién en la punta o dorso de los dedos, espaciosinterdigitales o el talón. Suelen tener uncomponente de hiperqueratosis periulceroso.Se acompañan de diverso grado de exudación,según la infección sobreañadida. Habitualmenteson indoloras y se acompañan de pérdidade sensibilidad. Se debe realizar diagnósticodiferencial con la úlcera neuroisquémica, en laque no hay hiperqueratosis periulcerosa, sondolorosas y se asocian signos de isquemia cotrofismo),estando estos reflejos atenuados enpacientes diabéticos. Otra consecuencia de laneuropatía autónoma es la disminución enla secreción cutánea, volviéndose la piel másseca y susceptible al desarrollo de lesiones.La neuropatía motora contribuye a la atrofiade los músculos intrínsecos del pie, predominandoentonces el tono de la musculaturaflexora, con deformidades que crean puntosde presión en las cabezas de los metatarsianosy en el dorso y la punta de los dedos.La neuropatía sensitiva es la principal causade lesiones, ya que los pacientes son incapacesde detectar estímulos dolorosos y respondera ellos, lo que lleva al desarrollo deúlceras, necrosis y pérdida de tejido sin que elpaciente sea consciente de ello.La afectación de las articulaciones del pie yel tobillo por la neuropatía es lo que se conocecomo artropatía de Charcot; en casos desevera neuropatía sensorial se pierden los estímulospropioceptivos llevando a sobreestiramientosde las estructuras ligamentosascausando deformaciones y subluxaciones quepueden progresar a fracturas osteocondralescontinuas entrando en un círculo vicioso depérdida de la arquitectura normal del pie.IsquemiaEl componente isquémico del pie diabéticoes consecuencia directa de la macroangiopatía,expresada en forma de enfermedad arterialperiférica (EAP). La EAP es una de las manifestacionesclínicas de los procesos aterotrombóticos,junto a la cardiopatía isquémica y a la enfermedadcerebrovascular. La diabetes mellituses un factor de riesgo independiente con granpeso en el desarrollo de la EAP.La aterosclerosis en los pacientes diabéticoses anatomopatológicamente igual que enlos pacientes no diabéticos. Las diferencias estribanen que su aparición es más temprana,su extensión más difusa (a menudo bilateral) yuna afectación preferente por el sector de losvasos tibiales, dándose casos de permeabilidadcompleta del sector aortoilíaco y femoropoplíteojunto a lesiones totalmente oclusivas anivel infragenicular.El déficit de aporte sanguíneo al pie setraduce en una mayor dificultad para la cicatrizaciónde las lesiones producidas por laneuropatía, así como en una menor capacidadde defensa frente a la infección.InfecciónEl riesgo de infección observado en el piediabético se debe a la pérdida de continuidadde la envoltura cutánea del pie propiciada porla neuropatía que hace que se produzcan muchasmás lesiones y a la isquemia que retrasasu cicatrización. Esta pérdida de continuidadsupone una puerta de entrada para los microorganismos.El estado de hiperglucemia altera la respuestainmunológica aumentando la susceptibilidada la infección. Además la defensa frentea la infección demanda un incremento delmetabolismo, que apenas se puede dar cuandocoexiste una situación de isquemia.MANIFESTACIONES CLÍNICASLa presentación clínica del pie diabético esmuy variada, pudiéndose clasificar en distintossíndromes que pueden coexistir simultáneamenteen el mismo paciente.Úlcera neuropática:Mal perforante plantar
GENERALIDADES SOBRE EL PIE DIABÉTICO ■ 13una fractura de un pie artropático cursa conuna severa reacción inflamatoria.Úlcera neuroisquémicaÚlcera diabética.Se presentan de manera más frecuente anivel del primer dedo, en la superficie medialde la cabeza del primer metatarsiano, en lacabeza lateral del quinto metatarsiano y en eltalón. Al contrario de las neuropáticas, sonmuy dolorosas, no hay tejido de granulación nilesión hiperqueratósica y existen signos deisquemia de la extremidad, como ausencia depulsos y disminución del flujo sanguíneo. Secorresponden con el estadío IV de Leriche-Fountain de la isquemia crónica de los miembros,también denominado isquemia crítica.Necrosis digitalNecrosis del borde del pie.mo la ausencia de pulsos distales. Puede serla puerta de entrada de una complicacióninfecciosa, como una osteomielitis.Pie artropático o artropatía de CharcotEs consecuencia directa de la neuropatíasensitiva que conduce a microtraumatismosque pasan desapercibidos; la neuroartropatíaautonómica es causa de hiperemia, hecho quehace que aumente la actividad osteoclásticacon resorción y atrofia de la estructura ósea.La fase precoz cursa con eritema, aumento dela temperatura cutánea y edema. Radiológicamentese observan deformidades como luxacióntarsometatarsiana y subluxación plantardel tarso. Muchas veces se trata de un procesosilente que pasa desapercibido hasta la apariciónde severas deformidades. Otras vecesConsiste en la necrosis o gangrena, asociadao no a infección, de uno o varios dedos delpie. Puede ser debida a la macroangiopatía o ainfección. Si está causada por arteriopatía periféricacursa clínicamente como una úlceraneuroisquémica, con dolor que disminuye conla extremidad en declive, ausencia de pulsosdistales y signos de isquemia crónica. Si existenpulsos distales, la causa suele ser la infecciónpor gérmenes liberadores de toxinasnecrotizantes (generalmente S. Aureus) queproducen trombosis de las arterias digitales,que se sigue de gangrena del dedo al ser lacirculación a este nivel de tipo terminal.Mal perforante plantar.
14 ■ PIE DIABÉTICOCelulitis y linfangitisSon consecuencia de la existencia de unaúlcera que se infecta propagándose la infecciónpor los linfáticos subdérmicos y el tejidocelular subcutáneo, aunque pueden presentarsesin lesión aparente en la piel. La linfangitisse caracteriza por el desarrollo de lineas eritematosasque ascienden por el dorso del piey la pierna. Este eritema se debe diferenciardel rubor isquémico o eritromelia declive, desapareciendoesta última con la elevación dela extremidad, lo que no ocurre con el eritemade la linfangitis. La celulitis se presentacomo una zona de tejido celular subcutáneoindurado y con signos inflamatorios, generalmenteen los alrededores de la úlcera; sin embargoen presencia de este tipo de signosinflamatorios se debe descartar también unapresentación aguda de artropatía de Charcot.Linfangitis y celulitis suelen ser infeccionesmonomicrobianas producidas por gram positivos.Pueden cursar con adenopatías inguinalese incluso con afectación sistémica, asociandofiebre y leucocitosis; en casos extremospueden llegar a ser causa de shock séptico.Infección necrotizantede tejidos blandosSe produce cuando la infección sobrepasael nivel subcutáneo e involucra espacios subfasciales,tendones y sus vainas tendinosas, tejidomuscular, etc. Son lesiones muy graves; anivel local suponen una seria amenaza a la viabilidaddel miembro, dado su alto poder necrotizante;a nivel sistémico pueden cursarcon una infección generalizada, descompensaciónmetabólica de la diabetes y amenazar lavida del paciente. Es frecuente la formación deabscesos en los espacios plantares y dorsales,así como la progresión de la infección a travésde las vainas tendinosas. Casi siempre se asociana linfangitis y celulitis. Suelen ser polimicrobianasy a menudo están implicados gérmenesanaerobios. La combinación de variosagentes bacterianos de forma sinérgica es loque da a esta entidad su poder destructivo enforma de gangrena húmeda.OsteomielitisCualquier lesión ulcerosa en un diabéticopuede cursar con osteomielitis del hueso subyacente,aunque muchas veces sea un procesosilente por la inhibición de la respuesta inflamatoria.La presencia de hueso en una úlceraes un signo casi de certeza de presencia deosteomielitis. Se debe realizar diagnóstico diferencialcon la artropatía de Charcot, aunquea veces es muy difícil distinguir ambos procesosa pesar del empleo de complejas pruebascomplementarias. Es característica la osteomielitisde la cabeza de los metatarsianossecundaria a la progresión de la infección através de una úlcera neuropática plantar.PLANTEAMIENTO DIAGNÓSTICOExploración físicaEn el diagnóstico del pie diabético es precisauna cuidadosa exploración física. Sedeben inspeccionar la presencia de deformidadesy alteraciones de la arquitectura sugerentesde una artropatía de Charcot. La presenciade hiperqueratosis indica las zonassometidas a excesiva presión. La palpación enbusca de masas o fluctuaciones nos indica lapresencia de una posible colección purulenta.La presencia de zonas eritematosas se debeevaluar, ya que pueden corresponder a unacelulitis/linfangitis, a una artropatía aguda o alrubor en declive de una isquemia severa. Tambiénhay que registrar la presencia de fiebreque nos puede poner sobre la pista de un procesoinfeccioso.Analítica de sangreSu principal utilidad es la valoración metabólicadel control glucémico. Muchas veces elpie diabético es la primera manifestación de unadiabetes desconocida. En presencia de una infecciónsevera es frecuente el estado de hiperglucemiareactivo, pudiendo llegar a ser causade descompensaciones graves como el comacetoacidótico o el hiperosmolar. Una cifra ele-
GENERALIDADES SOBRE EL PIE DIABÉTICO ■ 15vada de leucocitos es sugestiva de infección,aunque es muy frecuente que por la inhibiciónde la respuesta inflamatoria una infección gravepueda cursar sin leucocitosis ni fiebre.Exploración de úlcerasEspecial relevancia tiene la exploracióncuidadosa de las úlceras. La inspección visualnos puede indicar si predomina el componenteneuropático o el neuroisquémico. Se debedesbridar toda zona desvitalizada, ya que bajouna úlcera con buen aspecto puede esconderseuna infección seria. Se debe utilizar unasonda metálica estéril para evaluar la profundidadde la lesión; la exposición de estructurasóseas en el fondo de una úlcera conlleva laexistencia de osteomielitis con un valor predictivopositivo del 89%.MicrobiologíaDebe tomarse un cultivo de toda úlceracon signos de infección, ya que aunque se inicieun tratamiento empírico, nos informará dela especie/especies implicadas y de las resistenciasantibióticas que nos permitirán cambiarla pauta por una más apropiada. La tomase debe realizar del fondo de la úlcera, ya queen la superficie existe colonización bacterianaque no se corresponde con el agente que estácausando la infección.Linfangitis y celulitis suelen ser infeccionesmonomicrobianas generalmente producidaspor estafilococos gram positivos; sin embargoen infecciones severas de tejidos blando suelecrecer una flora polimicrobiana formada poraerobios gram positivos y gram negativos yanaerobios.Pruebas de imagenUna radiografía de pie en proyecciones anteroposteriory oblicua es la prueba de imagenbásica. La osteoartropatía de Charcot semuestra radiológicamente con alteración dela estructura ósea normal, destrucción articulary zonas de osteitis. También es útil paralocalizar cuerpos extraños, gas sugerente deun proceso infeccioso y osteolisis sugerentede osteomielitis.Sin embargo los hallazgos radiológicos deosteomielitis no suelen aparecer hasta las doso tres semanas y muchas veces no es posiblediferenciarlos de los hallazgos de la artropatía.En esos casos se debe valorar la realización deuna Resonancia Nuclear Magnética, que aunquemucho más costosa presenta una sensibilidady especificidad mucho más elevada.La gammagrafía con tecnecio 99 tiene unaalta sensibilidad en la detección de osteomielitis,pero es poco específica, por lo que su usose restringe al seguimiento evolutivo del procesoinfeccioso. La gammagrafía con leucocitosmarcados presenta más especificidad.Valoración de la neuropatíaLa existencia de disestesias, parestesias ohiperestesias son sugestivas de afectaciónneuropática y se presentan con anterioridad ala artropatía y a las complicaciones infecciosas.Se puede realizar una valoración mediantediversas pruebas instrumentales.Los tests de sensibilidad mediante el usode diapasón valoran la afectación de la sensibilidadvibratoria y cuando se halla afectaciónsevera es predictiva del riesgo de ulceracióncon una sensibilidad del 80% y una especificidaddel 60%.Los monofilamentos de Semmes-Weinsteinson un método de despistaje rápido deneuropatía sensitiva. Exploran la sensibilidad ala presión fina cutánea. Este test posee unasensibilidad del 98% y una especificidad del80%. En caso de no percepción, se ha estimadoun riesgo 10 veces mayor de desarrollo deulceraciones y 17 veces de amputación.La asimetría o ausencia de los reflejosaquíleos son indicadores de la sensibilidadpropioceptiva, aunque a partir de cierta edadpueden estar abolidos aun sin existir neuropatía.Otras técnicas como estudios de conducciónnerviosa para estudiar el alcance de laneuropatía y pedobarografía para valorar laszonas de mayor presión en la planta del pie,pueden tener su utilidad en ciertos caos.
16 ■ PIE DIABÉTICOValoración vascularEn todo paciente con pie diabético se deberealizar una exploración vascular para valorarel componente isquémico, y evaluar lanecesidad de revascularización para lograr lacicatrización de las lesiones.La palpación de los pulsos a nivel femoral,popliteo, tibial posterior y pedio es básica. Laexistencia de pulsos a nivel distal indica unaprogresión directa del flujo sanguíneo sinoclusiones ni estenosis significativas a travésdel eje arterial. La desaparición del pulso femoralindica patología del sector aortoilíaco,la ausencia de pulso popliteo con femoralconservado es sugerente de obstrucción femoropopliteay la ausencia de pulsos distalescon presencia del femoral y popliteo indicalesiones de los troncos tibiales, patrón muycaracterístico de la arteriopatía diabética.Se debe evaluar el flujo arterial mediantesonda doppler, que aporta información cualitativay cuantitativa. La aplicación de pruebasde diagnóstico no invasivo como el índice tobillo-brazomediante sonda doppler presentadificultades en diabéticos; en estos pacienteses frecuente el fenómeno de calcinosis arterial,que hace que los troncos tibiales sean rígidosy no se puedan colapsar con un manguitode presión, o colapsen con presiones muyaltas que no se corresponden con la presiónde perfusión real. Así los valores suelen estarartificialmente elevados y hay que tenerlo encuenta a la hora de interpretarlos.Si se plantea la necesidad de revascularizaciónse debe proceder a realizar pruebas deimagen del sistema arterial; el patrón oro siguesiendo la arteriografía con sustracción digitalcon contraste iodado pero otras pruebasútiles y con gran rentabilidad diagnóstica sonla angiorresonancia, el angio-TC y el ecodopplerarterial.PLANTEAMIENTO TERAPÉUTICOPrevenciónLo más importante para un paciente diabéticoes prevenir la aparición de la úlcera.Esto se consigue mediante un control metabólicocorrecto, profilaxis y tratamiento de laneuropatía y una especial vigilancia y protecciónde los pies, mediante normas de actuaciónbásicas como la higiene cuidadosa, mantenersiempre el pie limpio y seco, inspeccióndiaria, empleo de calzado y calcetines adecuados,no andar descalzos, vigilancia de los callosy de las uñas y consultar con su médico siempreque lo necesite. En los pacientes en losque ya han aparecido complicaciones en unode los pies cobran aún mayor importancia estasrecomendaciones, precisando protecciónadicional el pie contralateral.Tratamiento de las complicacionesderivadas de la neuropatíaLa úlcera neuropática sin componentevascular ni infeccioso importante cicatriza enel 90% de los casos. La descarga postural paraevitar el apoyo sobre la úlcera, el desbridamientode las zonas desvitalizadas, la resecciónde las zonas hiperqueratósicas periulcerosasy el tratamiento tópico (limpieza consuero fisiológico, uso de agentes desbridanteso antibióticos según la evolución) son las medidasnecesarias para lograr la formación detejido de granulación y posterior epitelizaciónde la lesión.En el tratamiento de la artropatía de Charcotel objetivo es proteger la extremidad de laprogresión de las deformidades y prevenirlasen la extremidad contralateral. El primer pasoconsiste en un periodo prolongado sin apoyarel pie afectado o disminuyendo el peso que seejerce sobre él. Para conseguirlo puede ser necesarioun reposo inicial y posteriormente eluso de ayudas al apoyo (muletas, bastones) asícomo un calzado ortopédico de descarga apropiado.En casos extremos puede ser necesariala corrección quirúrgica de las deformidadesmediante técnicas de cirugía ortopédica.Tratamiento de las complicacionesinfecciosasLas linfangitis y celulitis no severas y depresentación aguda con escasa lesión cutánea
GENERALIDADES SOBRE EL PIE DIABÉTICO ■ 17suelen ser infecciones monomicrobianas producidaspor cocos gram positivos; su tratamientoconsiste en reposo de la extremidad yantibioterapia sistémica en regimen ambulatorio.Una cefalosporina de 1ª generación o unapenicilina isoxazólica durante dos semanas esuna pauta adecuada.Las infecciones graves con afectación departes blandas, abscesos, necrosis y osteomielitisrequieren ingreso hospitalario. Se debedrenar toda colección purulenta con desbridamientode todas las zonas desvitalizadas.Los tendones y sus vainas tendinosas se extirparánsi están afectados. Las zonas de osteomielitistambién deben ser retiradas. Elcontrol de la infección requiere una posturaagresiva dado su alto poder necrotizante ymuchas veces será necesaria la realización deamputaciones menores. Se debe dejar abiertala amputación, envolviéndola en gasas consuero fisiológico y con recambio de la curados o tres veces al día; esta medida favorece eldrenaje de los exudados purulentos. En ocasiones,cuando la infección se ha extendidotanto que hace inviable la recuperación delpie, se plantea directamente la realización deuna amputación mayor, bien sea infrarrotulianao supracondílea.El tratamiento antibiótico en caso deinfecciones graves no tiene por objetivo la curaciónde la infección, ya que por si sólo sintratamiento quirúrgico no es efectivo. Su finalidades coadyuvante evitando la propagaciónde la infección hacia zonas no afectadas. Laspautas empleadas deben ser más largas, conun mínimo de tres semanas y un máximo detres meses. La vía de administración inicial serála intravenosa, pasando a vía oral cuando lainfección esté controlada. Se debe cubrir unamplio espectro de microorganismos, ya quela presencia de una flora polimicrobiana compuestapor aerobios gram positivos y gramnegativos y anaerobios es lo habitual. La realizaciónde cultivos y antibiogramas periódicoses necesaria para detectar resistencias antibióticas,gérmenes poco habituales o cambiosen la flora responsable de la infección, modificandoel tratamiento empírico aplicado antesde obtener los cultivos por otro más apropia-do. La antibioterapia tópica no tiene ningúnvalor en este contexto. Los aminiglucósidoshan de evitarse por su mala difusión e inactivaciónen zonas necrosadas y con acúmulo depus, así como por su posible toxicidad renalen pacientes cuya diabetes ya constituye depor sí un riesgo de nefropatía.Las pautas adecuadas incluyen amoxicilina-clavulánico,cefalosporinas de 2.ª y 3.ªgeneración (cefotaxima, ceftazidima) o fluoroquinolonas(ciprofloxacino, ofloxacino eincluso levofloxacino) junto a algun anaerobicida(metronidazol o clindamicina). La utilizaciónen monoterapia de fármacos degran espectro como el imipenen o la piperacilina-tazobactamtambién posee granefectividad.Tratamiento de la isquemia subyacenteLos pacientes diabéticos con signos deisquemia pero que permanecen asintomáticosy sin complicaciones no precisan tratamientoquirúrgico. En todo paciente con pie diabéticocomplicado la existencia de isquemia empeorael pronóstico al empeorar la cicatrizaciónde las heridas y aumentar el riesgo de progresiónde la infección. Particularmente elaporte sanguíneo necesario para la cicatrizaciónde una amputación menor, la curación deuna úlcera neuroisquémica o el tratamientode una infección grave subyacente debe sermás elevado. Por ello en estos casos siemprese debe valorar el tratamiento de la isquemiamediante procedimientos de revascularización.Una cuidadosa selección de pacientes esprecisa para el éxito del procedimiento, yaque pacientes encamados, inmovilizados, conmal estado general y con escasa esperanza devida no se beneficiarán de una intervención derevascularización y será para ellos más adecuadala amputación.El tratamiento de la isquemia en pacientesdiabéticos supone una serie de complicacionesañadidas por la particular distribución dela aterosclerosis en los sectores más distales.Así el porcentaje de pacientes en los quetécnicamente es posible la intervención es
18 ■ PIE DIABÉTICOmenor que en pacientes no diabéticos conenfermedad arterial periférica.En estos pacientes cobran vital importancialas técnicas de revascularización de lostroncos distales tibiales, que desarrolladas enlos últimos veinte años han supuesto unaimportante reducción en el número deamputaciones mayores. Junto a las técnicasquirúrgicas clásicas de derivación, se abrenpaso nuevas técnicas endovasculares que vanampliando el espectro de posibilidades detratamiento.BIBLIOGRAFÍAAmerican Diabetes Association. Peripheral arterial disease inpeople with diabetes. Diabetes Care 2003; 26: 3333-3341Marinel.lo Roura J, Blanes Mompó I, Escudero Rodríguez JR,Ibáñez Esquembre V, Rodríguez Olay J. Tratado de piediabético. Pensa Esteve. 1999.Pomposelli FB jr, Domenig C. Diabetic Foot Problems. In: HalletJW jr, Mills JL, Earnshaw JJ, Reekers JA, editors.Comprehensive Vascular and Endovascular Surgery. Mosby;2004 p. 177-188.Seabrook GR, Towne JB. Management of foot lesions in thediabetic patient. In: Rutherford RB, editor. Vascular Surgery5th ed. Philadelphia: Saunders; 2000 p 1093-1101.
Diabetic AngiopathyRUY FERNANDES E FERNANDES, LUÍS MENDES PEDRO, LUÍS SILVESTRE, ANA EVANGELISTAAND JOSÉ FERNANDES E FERNANDESServiço de Cirurgia Vascular. Hospital de Santa Maria. Faculdade de Medicina da Universidade de Lisboa.Instituto Cardiovascular de Lisboa. Lisboa. PortugalINTRODUCTIONDiabetes Mellitus (DM) is a known risk factorfor peripheral arterial disease. This associationwas first recognized in 19th century in patientswithout overt signs of atheroscleroticdisease and small wounds that showed rapidprogression for gangrene and need for majoramputation. In those days a detailed urine analysiswas defended as mandatory(1,2). The prevalenceof DM is 2 to 5% in European countriesand increases with age, reaching 6-18% in patientsolder than 70 years (2) (3,4).The risk for peripheral artery (PAD) diseaseis bigger in diabetic patients, being estimatedto be fivefold higher than in non-diabeticpatients(5). 6-10% of these patients willdevelop trophic lesions (3). It is also knownthat DM-related PAD presents at youngerages, shows accelerated progression andworse outcomes(6). 45% of non-traumaticlower limb amputations are performed in diabeticpatients and the amputation risk in thesepatients is fifteen-fold higher for age-matchedcontrol groups (6,7). The excessive risk inthese patients seems to be attributed not onlyto the higher prevalence of PAD but alsoto the increased rate of infections, which arefrequently serious and progressive.It is also known that PAD is present in upto 50% of patients with diabetic foot ulcer andis an independent risk factor for amputation(8).A substantial number of individualswith a foot ulcer will therefore have PAD,ranging from relatively mild disease with limitedeffect on wound healing to severe limb ischemiawith delayed wound healing and a highrisk of amputation. In addition, wound healingcan be further disturbed by a complex interplayof several other factors such as poorglycemic control, microvascular dysfunction,impaired collateral formation, abnormal mechanicalstress on the ulcer and co-morbidities.(9)The effect of PAD on wound healing inpatients with diabetes and a foot ulcer willtherefore relate in part to its severity andextent and also to these other factors.In conclusion, diabetic foot problems andtheir complications are a medical and economicchallenge to the health care systemand require an aggressive multidisciplinaryapproach to achieve limb salvage.PERIPHERAL ARTERY DISEASEAlthough the clinical presentation andoutcome of PAD differ in diabetic and non-diabeticpatients, from a pathological perspectivethere are not significant differences. Themain characteristics that influence course ofthe disease and its treatment can be summarizedin the following aspects:–Macroangiopathy.–Microangiopathy.–Neuropathy.–Infection and imunological changes.MacroangiopathyThe pattern of disease distribution in peoplewith DM related PAD differs distinctlyfrom those people with PAD resulting fromother risk factors (10,11):
20 ■ PIE DIABÉTICO1. Extensive calcification of the arterial wall.2. Predominant involvement of tibio-peronealvessels (posterior tibial, anterior tibial andperoneal arteries).3. Less involvement of of aorto-iliac sectorbut with typical involvement of the externaland common femoral arteries.4. Sparing of foot arteries: frequently the pedalartery, the plantar arch and its branchesare patent often with segmental stenosis5. Frequent involvement of the hipogastric andprofunda femoris arteries that can presentwith diffuse disease, compromising importantcollateral pathways. The latter can be affecteduntil its distal segment, compromising outflowtargets in proximal revascularization.MicroangiopathyThe classical concept of occlusive microangiopathyas the hallmark of Diabetes relatedPAD, first described by Goldenberg(12),was not clearly demonstrated in recent studies(3).In histological and hemodynamic studiesno significant occlusions at the arteriolarlevel were noted. However other pathologicalchanges of the microcirculation were identifiedthat can explain the increased incidenceof trophic lesions and the aggressive course ofPAD in diabetic patients:1. Thickening of the basal lamina: this alterationinduces changes to blood vesselpermeability, reduces nutrient supply andmetabolite clearance to the arterial walland facilitates leucocyte migration and arterialwall inflammation. Apparently oxygendelivery is not affected.2. Endothelial cell disfunction: Severalmechanisms like hyperglycemia, free fattyacid production and insulin resistance contributeto endothelial cell dysfunction. Anend result of these mechanisms is a significantlyreduce bioavailability of nitric oxide,which in turn induce derangements in theregulation of blood flow and increase the localinflammatory state of the vascular wall.NeuropathyDiabetic polyneuropathy is one of commonestcomplications of DM. Its character-ized by distal motor-sensory and autonomicinvolvement of the lower and upper limbs(“stocking and glove distribution”). It’s causedby progressive demielinization of the peripheralnerves induced by hyperglycemia.The simultaneous presence of sensoryloss, motor deficits and autonomic deregulationcontribute to the development of mechanicaland postural changes of the foot(9).These changes, when combined with hyposthesiacan explain the appearance of hyperpressurelesions in foot locations associatedwith weight-bearing.Infection and immunologicalimpairmentInfections in diabetic patients can be rapidlyprogressive, inducing extensive destructionof soft tissues. Frequently small wounds in adiabetic foot lead to infection with extensivecellulitis, gangrene and fulminant sepsis thatrequire emergent treatment (13). Minor infectionscan rapidly degenerate in gangrene oftoe and involvement of the forefoot withproximal progression mainly in the tendinoussheaths and causing extensive soft tissue infection,osteomyelitis, abscess formation, skinnecrosis and ascending lymphangytis (fig. 1).Anaerobic infections are very commonand may be responsible for extensive necrotizitingfasciitis extending proximally.Figure 1. Diabetic foot infection with necrosis ofthe hallux and extensive soft tissue infection anddestruction.
DIABETIC ANGIOPATHY ■ 21Several factors seem to be responsible forthe serious implications of infection in DM:– Impaired immunological response (14): diabe -tic persons have diminished activity of leucocytesand some aspects of cell-mediatedimmunity. Glycation of antibodies compromisethe humoral response and in diabeticketoacidosis the protective effect of lacticacid is also impaired.– Polymicrobial infections (15): most diabeticfoot infections are caused by skin flora andGram-positive cocci, specially in the settingof a acute infection. Microbiological studiesshown that most of these infections arepolymicrobial, with Gram-positive bacteriae(S. aureus, coagulase-negative staphylococciand streptococci) isolated in 90% of specimens,Gram-negative bacteriae (enterococci)in 50% and anaerobes in 50-70%. Fungalinfections are also very frequent in the diabeticfoot and can promote skin disruptionand increase the risk for bacterial infection.CLINICAL PRESENTATIONClinical EvaluationClinical evaluation of a diabetic patient withPAD should comprise the following aspects:1. General evaluation of the patient, includingglycemic control, repercussion of DM in target-organs(retinopathy; nephropathy) andpresence of other cardiovascular risk factors.2. Evaluation of possible coronary diseaseand carotid bifurcation disease.3. Foot lesion characterization (neurophatic/pressurevs ischemic lesions), includingpresence and severity of infection.4. Evaluation of arterial circulation of thelower limbs.Due to the multifactorial etiology of tro -phic lesions in diabetic patients (arterial occlusivedisease, microcirculation abnormalities,neuropathy and infection) it is particularly importantto determine the relative contribute ofischemia. The absence of pulses, cutaneouspallor with limb elevation and persistence ofnecrosis after adequate treatment of infectionare all suggestive of significant arterial occlusivedisease. In some cases, due to neuropathy, restpain may be absent, enabling the silent progressionof the ischemic process and complementarynon-invasive testing is therefore essentialto correctly evaluate these patients. Arterialocclusive disease should always be actively investigatedin cases of diabetic foot, regardlessthe presence of other possible etiologies likeneuropathy or infection.After a complete evaluation it is useful toclassify each patient according to an establishedclassification to standardize clinicalinformation, prognostic implications and helpto select the best treatment for each case.ClassificationThe classifications of Fontaine and Rutherfordare clinical classifications, the former beingfrequently used in most european countries andthe latter in anglo-saxonic countries. (Table 1).FontaineRutherfordStage Clinical Grade Category ClinicalI Asymptomatic 0 0 AsymptomaticIIa Mild claudication I 1 Mild claudicationIIb Moderate to severe claudication I 2 Moderate claudicationI 3 Severe claudicationIII Ischemic rest pain II 4 Ischemic rest painIV Ulceration or gangrene III 5 Minor tissue lossIII 6 Major tissue lossTable 1. Fontaine’s and Rutherford classifications for peripheral artery disease.
22 ■ PIE DIABÉTICOBoth these clinical classifications havebeen criticized for being based on a subjectiveclinical evaluation and for including in eachstage a variety of clinical situations with differentprognostic implications and a wide rangeof therapeutic possibilities.In 1989 a European panel of vascular specialistsassembled in Berlin issued a consensusdocument about the concept of critical limbischemia (CLI)(16), defined as:It was based also on the observation thatpatients with rest pain and ankle pressure >50 mmHg use to require a reduced number ofmajor limb amputations as compared withthose with lower ankle pressure. This newconcept combines the classic clinical aspectswith the objective evaluation of the distal arterialpressures. Due to high rate of calcificationof the infra-geniculate arteries in DM itwas also recommended that toe pressureshould be used systematically in diabeticpatients.• Rest pain and/or ischemic skin lesions (stagesIII and IV of the Fontaine’s classification; gradeII and III of Rutherford’s), associated to:• Ankle pressure < 50mmHg or toe pressure< 30 mmHg).The Trans-Atlantic Inter-Society ConsensusDocument on Management of PeripheralArterial Disease (TASC) published in2000(17) and further revised in 2007 (TASCII)(18), considered the clinical evaluation,prognosis and decision-making for PAD patientsin two subgroups of intermittent claudicationand chronic CLI respectively, thus emphasizingthe importance of correctly identifythe subgroup of patients with CLI.DIAGNOSTIC STUDIESFoot X-rayA plain radiogram of a diabetic foot allowsthe identification of:• Osteoarticular deformities.• Arterial calcifications.• Signs of osteitis.and it should be carried out in all patients withcomplains of a diabetic foot.Vascular LaboratoryThe non-invasive evaluation performed ona Vascular Laboratory allows to appreciate thearterial circulation of the lower limbs, from theabdominal aorta to the pedal arteries. Determinationof ankle-brachial index (ABI), Dopplerultrasonography and exercise testing are sufficientto identify the presence of occlusive diseaseand localize the segment involved. Thereforethese studies are adequate for screeningand should be performed in all diabetic patientswith clinically suspected PAD or peripheralpulses changes. To determine the anatomic locationsof hemodynamic significant lesions, co -lor-guided duplex is currently the modality ofchoice in the Vascular Laboratory. Segmentalpressure determinations with plethysmographyand transcutaneous oxygen tension measurementsare complementary methods nowadaysseldom performed.The evaluation of a diabetic patient in theVascular Laboratory(19) raises problems inperforming the tests (extensive ulcers withdressings, intolerance to cuff compression) andrelated with the accuracy of methods used (extensivearterial calcification). It also poses specificchallenges in obtaining information regardingthe etiology of rest pain (ischemic versusneuropathic/infection), determining indicationfor revascularization, predicting the healingsuccess of trophic lesions and evaluating theoptimal level for amputation.Doppler UltrasonographyDoppler ultrasound provides a method todetect blood flow and analyze velocity waveforms(spectral analysis) at different levels ofthe lower limb arterial tree. Normal lowerlimbs are high resistance territories at restand peripheral arteries have a triphasic orbiphasic flow characterized by a brisk upstrokeof forward flow at systole, followed bya brief reverse flow during diastole (reflectionof the flow wave from the periphery) and asmall forward component at late diastole.
DIABETIC ANGIOPATHY ■ 23Arterial obstruction hemodynamic significantat rest triggers a distal vasodilation as compensatormechanism, lowering the hemodynamicresistance and allowing continuous forwardflow during diastole. The waveform becomesmonophasic and its spectrum is wider reflec -ting turbulent flow. At the level of a significantstenosis marked increase of flow velocity andturbulence may be noted and distally to theobstruction the waveform is dampened.Segmental arterial pressureSegmental arterial pressures are measuredwith cuffs placed in the upper thigh, above-knee,below-knee, ankle and toes and a Doppler deviceis used to detect flow. This technique is anindirect method of locating disease and presentsseveral pitfalls: adequate size cuffs for eachpatient are required, has low accuracy in casesof multi-segmental disease and is a time-consumingexam. It doesn’t provide more informationthan a clinical assessment of arterial pulsescombined with ABI index and has been largelyreplaced color-guided duplex.Ankle-brachial index (ABI)Determination of ABI is the simplestmethod to determine the presence of arterialocclusive disease and is widely used. The higherankle pressure (dorsalis pedis or posterior ti -bial) is divided by the higher of the two brachialpressures. In the absence of occlusive diseasethe ABI is equal or slightly superior to 1. Arte rialcalcification makes cuff compression difficult oreven impossible and ABI may be falsely high inpatients with heavily calcified infra-geniculatearteries, as seen in diabetic and end-stage renaldisease patients. It is essential to combine clinicalassessment, Doppler waveform analysis andpressure measurements to recognize inaccurateABI determination. Alternative methods toovercome this problem include quantification oftoe pressure and detection of flow with photoplethysmography.ABI decreases as the severity and extentof occlusive disease increase. It is generallyhigher than 0.5 in single-level disease and lowerin multi-level disease; generally patientswith claudication have an ABI between 0.5 an0.9, patients with rest pain below 0.4 andpatients with gangrene below 0.3. In diabeticpatients the ABI is particularly useful to detectpatients with asymptomatic occlusive diseaseto confirm the presence of occlusive arteriallesions and to identify patients with high riskfor ulceration and gangrene(20). ABI is also apotent predictor of cardiovascular risk.Color-flow duplex scanAs mentioned above, color-guided duplexscan combines direct visualization and morphologicalcharacterization of the arteries using B-mode imaging with functional evaluation of arterialblood flow based on Doppler waveformanalysis. The simultaneous combination of thesetechniques allows accurate evaluations of thehemodynamic relevance of each lesion encounteredand, using of modern equipments withhigh resolution imaging, its possible to obtain detailedmapping of occlusive disease from the aortato the pedal arteries. It can quantify thedegree of stenosis, differentiate stenosis fromocclusion and determine its extension. It also permitsthe identification of concomitant aneurysmaldisease. Duplex Scan is noninvasive and cost-effective,doesn’t require the use of nephrotoxiccontrast and is, therefore, suitable for serialexamination. It is also the preferred diagnosticstudy for surveillance of vascular interventions(endovascular and surgical procedures) (fig. 2).Figure 2. Surveillance duplex scan of afemoro-posterior tibial bypass.
24 ■ PIE DIABÉTICOAngiographyConventional contrast intra-arterial subtractionangiography is the most commonlyused imaging modality for planning a vascularintervention. It allows a detailed analysis ofthe complete arterial tree with characterizationof the arterial obstructions encountered.It is not influenced by arterial calcification andthus overcoming a limitation Duplex Scan andpermits a detailed visualization of the tibioperonealand foot circulation. Howeverangiography is associated with several complications,including access site complications,serious reaction to the contrast medium, contrast-inducedrenal function impairment and a0.16% risk of mortality.Mag<strong>net</strong>ic Resonance AngiographyGadolinium-enhanced Mag<strong>net</strong>ic Resonanceangiography (MRA) is being increasinglyused because it can provide detailed imagingof the arterial tree without the need of an arterialpuncture or the use of standard contrastagents. Several studies have shown thatMRA can be non inferior to angiography in theidentification of suitable arteries for revascularization,including pedal arteries, and is notinfluenced by the presence of calcification. Itseems, however, to overestimate the degreeand the extension of stenosis.Although gadolinium is mildly nephrotoxicit can adversely affect renal function in patientswith prior renal impairment. Recentlythere have been several reports of nephrogenicinduced systemic fibrosis related togadolinium administration to patients with severelycompromised renal function.Computed Tomographic AngiographyWith development of the recent multi-slicedetectors CT angiography is being increasinglyused to evaluate peripheral occlusive disease. Itallows a quick acquisition of images, minimizingissues related to patient noncompliance, anddelivers three-dimensional reconstruction ofthe arterial tree. Wall calcification frequently impairsthe determination of artery patency onreconstructions, requiring careful evaluation ofindividual axial slices and limiting its ability tostudy distal arteries of the limb.CTA also involves the administration ofhigh volume of iodine contrast that can inducerenal deterioration, thus limiting further itsapplication in diabetic patients.Imaging strategy for revascularizationIn patients with impaired renal function, asdiabetic patients often are, the risks of contrastinduced renal failure and of nephrogenic systemicfibrosis are not negligible and pose achallenge for the vascular specialist. Althoughconventional angiography still remains themodality of choice for planning of vascular intervention,duplex imaging can provide enoughinformation to plan a revascularization procedure,specially if the pattern of disease seems tobe adequate for endovascular intervention. Inthese cases, angiographic confirmation of thelesions observed can be accomplished duringthe endovascular intervention.Nevertheless, in our experience, angiographystill has a major role when pattern diseaseevaluated clinically and by duplex suggests theneed for surgical revascularization. MRA hasbeen increasingly used as a mapping imagingmodality in numerous centers and may gain amore prominent role in the future.TREATMENTAll diabetic patients with PAD should receiveoptimal risk factor management, adequateglycemic control and aggressive treatmentof foot infections (3,8). The most difficultquestion to answer on these patients managementis whether revascularization is warranted,for a certain lesion, in a certain patient.Some patients with minor distal gangrene orsmall ulcer and moderate occlusive disease canbe treated with small amputations, antibioticsand wound care measures, whereas patientswith severely ischemic limbs and extensivelesions will require a vascular intervention.
DIABETIC ANGIOPATHY ■ 25Glycemic controlIn the initial approach of a patient with adiabetic foot ulcer aggressive metabolic controlis often necessary. Infection can causediabetes decompensation requiring intensivemonitorization and commonly, optimalgycemic control can only be achieved aftersurgical débridement and institution of broadspectrumantibiotic therapy.Treatment of infectionPatients with limb-threatening infectionsrequire immediate hospitalization, immobilization,and intravenous antibiotics. Culturesfrom the depths of the ulcer should be sent;wound swabs are unreliable and should not beperformed. Empiric broad-spectrum antibiotictherapy should be initiated to cover thepolymicrobial infections, including anaerobicgerms usually seen in diabetic patients. Empiricantibiotic regimens are dictated by institutionalpreferences, local resistance patterns,availability, and cost. Early detection of infectionis of paramount importance and sophisticatedimaging of the foot through MRI or CTScan may be required to confirm earlychanges such as fluid collections, abcesses,erosion of soft tissues and of bone structures,which are missed on plain X Rays of the foot(21).Patients with abscess formation or necrotizingfasciitis must undergo prompt incision,drainage, and full débridement, including partialopen toe, ray, or forefoot amputation. Tendonsheaths should be probed as proximallyas possible and excised if infected. These proceduresmust be promptly performed in patientswith active infections before any vascularintervention and should not be delayed byany imaging investigation for revascularizationplanning.RevascularizationRevascularization should be consideredfor all patients with significant occlusive diseaseand diabetic foot ulcers. Recent studieshave shown that diabetic patients with CLIcould benefit from revascularization, regardlessthe technique used, with significantimprovements in limb salvage and survivalrates (4,7).The choice of a revascularization proceduredepends on the severity of the limb ischemia,the general condition, surgical risk assessmentand life-expectancy of the patient,anatomic location and distribution of arteriallesions and availability of venous conduit(22).The conjugation of these factors allow a tailoredapproach for each patient, that can includesurgical revascularization, endovascular,hybrid procedures or, in the severely ill andimmobilized patient with extensive arterial lesions,primary amputation. Based on extensivereview of studies, TASC introduced a classificationsystem that stratifies the anatomic patternof lesions in four groups according to thebest method of revascularization, whereasgroups A and B favor endovascular interventionand C and D open surgery.Open Surgery: Open surgery procedures,like bypass or endarterectomy, havebeen the classic revascularization approachfor CLI. The same surgical principles used forrevascularization in non diabetic patientsare applied for diabetic patients (23). Althoughthe anatomical pattern of arterial diseasefrequently involves crural vessels and performanceof ultradistal bypasses (to pedalarte ries) has been associated with excellentoutcome (24) (Fig. 3), the concomitant presenceof occlusive and calcified plaques in thecommon femoral artery requires conventionalendarterectomy(25) which may act as theentry gate to proximal and distal endovascularprocedures .Success of a distal bypass procedure hasfew requirements: adequate inflow, suitableconduit availability and appropriate outflow.DM-related PAD typically spares the aorto-iliacterritory, although multilevel disease iscommon, specially when multiple risk factorsare present. In the latter cases a combinedproximal and infra-inguinal revascularizationmay be necessary to provide adequate flow
26 ■ PIE DIABÉTICOfor healing of extensive, non-demarcated footulcerations. Concerning the adequacy of theconduit, the great saphenous vein is the mostused (fig. 4) and it provides the best long-termpatency and limb salvage rates (26).Figure 4. Control angiogram of a femoro-poplitealbelow-knee bypass.Other vein grafts, like small saphenousvein, spliced veins, upper limb veins and syntheticconduits like PTFE are alternatives withsignificantly worse results. Performance oftechnical adjuvants as the Miller or St.Mary’scuff to improve patency of synthetic grafts inthe absence of a suitable vein has been describedand seems associated with better limbsalvage rates (fig. 5).salvation rates close to 90% at one year andaround 75% at 5 yrs follow-up (4, 22). Howevera close surveillance program and aggressivere-intervention policy should be implementedto ensure clinical success (27).Endovascular Surgery: many authors nowconsider percutaneous transluminal angioplasty,with or without stenting to be the first lineapproach for CLI because clinical results aresimilar to open surgery and it potentially offersadvantages such as minimal access trauma, lowinfection rates and shorter hospitalization (7,28-29). New advances in the technology of endovasculardevices expanded even further thepossibilities of endovascular intervention. Dedicatedguidewires, catheters and sheaths tochronic total occlusions, lower profile ofballoons and better designed stents, drug-elutingballoons and stents, stentgrafts, etc openedthe possibility of successful treatment of calcifiedarteries and extensive occlusions, frequentlyobserved in diabetic patients, achievingacceptable patency rates compared to openbypass. Endovascular interventions can also betailored to each case, allowing revascularizationof targeted tibial and pedal arteries thatprovide flow to specific regions of the foot(angiossome theory) thus providing optimalflow for healing specific lesions (28, 30).Figure 5. A Miller’s cuff.The distal artery to act as receptor of abypass should be selected preferably in relationto its integrity and ability to provide directflow to the pedal arch or, in alternative,the one with a better collateralization <strong>net</strong>workto the foot.Primary patency rates for open surgeryin diabetic patients, although reduced in comparisonto nondiabetics, can provide limbFigure 6. Angioplasty of an extensive occlusion ofthe tibio-peroneal trunk.
DIABETIC ANGIOPATHY ■ 27Primary patency rates of endovascular procedureare generally significantly lower than abypass with vein, but with frequent re-interventions,assisted and secondary patency rates canbe similar to open surgery (31) (fig. 6).One significant advantage is the absence ofsurgical dissection which can be more hazardousin the presence of septic foot lesionsand contribute to the spreading of infection.Hybrid procedures: in cases of complexocclusive disease with multilevel involvement,extensive disease of the femoral bifurcationor long occlusions of the distal popliteal andcrural arteries, a combination of reconstructiveopen surgery and endovascular techniquescan be a less invasive and more appropriatestrategy. The combination of the twotechniques can be employed for improvementof iliac inflow for femoro-femoral crossoveror femoro-popliteal bypass;femoral bifurcation reconstruction forproximal and/or distal endovascular procedures;endovascular treatment of SFA stenosisto allow shorter distal bypass and managementof failing grafts. (Fig. 7).Regardless the modality chosen, limb salvagerates and overall survival are higher in diabeticpatients submitted to revascularization,when compared to medically treated cohorts.All procedures, open or endovascular, mayhave limited durability and a surveillance programwith aggressive re-intervention is crucialto maintain sustained clinical success. Therefore,conventional surgery and endovascularprocedures should be regarded as complementarytechniques that can be used duringthe lifespan of a diabetic patient.SympathectomyIn the last decades, lumbar sympathectomywas extensively performed in CLI patients,but nowadays has very limited indications forthe treatment of PAD.In diabetic patients autonomic neuropathyis frequent, further limiting the scope of thistechnique in diabetic patients.Adjuntive modalities in wound careNumerous adjunctive modalities exist forwound care, such as topical growth factors,synthetic skin grafts, hyperbaric oxygen therapyand negative pressure wound therapy.These techniques will be further explainedelsewhere in this book.AMPUTATIONAND REHABILITATIONThe last alternative remains amputation,that can be performed as a primary procedureor for failures of revascularization. Amputationof toes, ray amputations and evenforefoot amputations leave the patients with afunctional foot, allowing ambulation. Preser -vation of the knee joint should always beattempted, because adaptation to a prostheticlimb is much easier. Above-knee amputationsshould be reserved to critically ill or bedriddenpatients with limited perspective of ambulationin the future.Figure 7. A patient with rest pain of the right lowerlimb and multilevel disease, treated by femoral endarterectomy,angioplasty with stent of a stenosis ofthe common iliac artery and angioplasty with stentof a superficial femoral artery occlusion.PREVENTIONPrimary prevention should be the firstte<strong>net</strong> of managing the diabetic foot, but sec-
28 ■ PIE DIABÉTICOondary prevention with meticulous ulcer caremay be a more realistic goal. Primary preventioninvolves aggressive glycemic control (goalhemoglobin A1C
DIABETIC ANGIOPATHY ■ 2924. Fernandes e Fernandes J, Silva Nunes J, Damião A, Cunha eSá D, Mendes Pedro L, Freire J, et al. Revascularizaçãopediosa e plantar na Diabetes. Último recurso para a preservaçãodos membros inferiores. Revista Portuguesa deClínica e Terapêutica. 1991st ed. 4(13):135–143.25. Dosluoglu HH, Lall P, Cherr GS, Harris LM, Dryjski ML. Roleof simple and complex hybrid revascularization proceduresfor symptomatic lower extremity occlusive disease. J VascSurg. 2010 Jun. 1;51(6):1425–1435.e1.26. Veith FJ, Gupta SK, Ascer E, White-Flores S, Samson RH,Scher LA, et al. Six-year prospective multicenter randomizedcomparison of autologous saphenous vein and expandedpolytetrafluoroethylene grafts in infrainguinal arterialreconstructions. J Vasc Surg. 1986 Jan.;3(1):104–114.27. Dalsing M, Cikrit D, Lalka S. Femorodistal vein grafts: the utilityof graft surveillance criteria. Journal of vascular… 1995.28. Kudo T, Chandra FA, Kwun W-H, Haas BT, Ahn SS. Changingpattern of surgical revascularization for critical limb ischemiaover 12 years: Endovascular vs open bypass surgery.Journal of Vascular Surgery. 2006 Aug.;44(2):304–313.29. Beard JD. Which is the best revascularization for criticallimb ischemia: Endovascular or open surgery? J Vasc Surg.2008 Dec. 1;48(6 Suppl):11S–16S.30. Iida O, Soga Y, Hirano K, Kawasaki D, Suzuki K, Miyashita Y,et al. Long-term results of direct and indirect endovascularrevascularization based on the angiosome concept inpatients with critical limb ischemia presenting with isolatedbelow-the-knee lesions. J Vasc Surg. Elsevier Inc.; 2012 Feb.1;55(2):363–370.e5.31. Bradbury AW, Adam DJ, Bell J, Forbes JF, Fowkes FGR,Gillespie I, et al. Bypass versus Angioplasty in SevereIschaemia of the Leg (BASIL) trial: An intention-to-treatanalysis of amputation-free and overall survival in patientsrandomized to a bypass surgery-first or a balloon angioplasty-firstrevascularization strategy. J Vasc Surg. 2010 May1;51(5 Suppl):5S–17S.
Diagnóstico de la arteriopatía diabéticay pie diabéticoMARÍA ISABEL DEL BLANCO, JOSÉ MANUEL ORTEGA, MARÍA JESÚS GONZÁLEZ-FUEYO YRAFAEL FERNÁNDEZ-SAMOSServicio de Angiología y Cirugía Vascular. Hospital de León. León. España.INTRODUCCIÓNEl Consenso de pié diabético, de la SociedadEspañola de Angiología y Cirugía Vascular,en su primera RECOMENDACIÓN, define laentidad denominada pie diabético como: «laalteración de base neuropática, inducidapor la hiperglicemia, en la que con o sincoexistencia de isquemia, se produce,previo desencadenante traumático, lalesión y/o ulceración a nivel del pie» (1).Datos de interés:Según la Organización Mundial de la Salud(OMS), la prevalencia de la diabetes mellitus(DM) es del 2.1% de la población (4% tipo I y96% tipo II). Además se estima que un 45% delas personas diabéticas están sin diagnosticar(1). En España la prevalencia de la DM es del2,8-3,9% de la población (10% tipo I, 90% tipoII). La prevalencia de la isquemia de extremidadesinferiores es del 8.4% en la DM tipo I ydel 23.1% en la DM tipo II. La claudicación intermitentees aproximadamente el doble defrecuente en los pacientes diabéticos que enlos no diabéticos (2).La American Diabetes association recomiendanHemoglobina glicosilada
32 ■ PIE DIABÉTICOLa diabetes se asocia a neuropatía periféricay a una reducción de la resistencia ainfecciones que dan lugar a mayor riesgo deulceras e infecciones en el pie (2).4. Exploración osteo-articular:Anormalidades mecánicas. Deformidades,contracturas, evaluación de la forma de caminar(1, 3).Se utiliza una manguito de presión adecuado(anchura 40% del perímetro de la extremidaden su punto medio o ser un 20% mayordel diámetro de la extremidad en el punto demedición), colocado por encima de los maléolos.Igualmente se emplea una sonda dopplercontinuo de 5-10 MHz. (Figura 1).EXPLORACIÓN VASCULAR:1. Palpación de los pulsos periféricos:La exploración vascular periférica requiereuna palpación de los pulsos de las arteriasfemoral, poplítea, pedia dorsal o tibial anteriory tibial posterior. La arteria tibial posterior sepalpa en el maléolo medial y la pedia en eldorso del pie (3).La presencia de pulsos pedios palpablestiene un valor predictivo negativo de más del90% (2).2. Índice tobillo brazo (ITB):La prueba de detección sistemática primariano invasiva para EAP es el ITB (2).El consenso de la American DiabetesAssociation recomienda un examen de detecciónde la EAP mediante ITB cada 5 años enpacientes con diabetes (3).La presión sistólica no disminuye entreaorta y arterias terminales, por lo tanto lapresión registrada en el tobillo será 10-15mmHg superior a la registrada en la arteriahumeral.La disminución absoluta de la presiónsistólica en el tobillo es un buen indicador deafectación oclusiva arterial en los MMII (5).Material y método: Se coloca al pacienteen decúbito supino, se registra la presiónsistólica en ambos brazos y se utiliza la más alta,así mismo se registra la presión en ambosMMII, tanto en la arteria pedia como en latibial, posterior seleccionando la superior delas dos.Figura 1. Realización del índice tobillo brazo.El ITB será el cociente entre la presión sistólicamáxima en el tobillo y la presión sistólicaen el brazo.Interpretación de los resultados: Eldiagnóstico de EAP se establecerá con valoresde 0.9 o inferiores. Tabla I.ITB >1,3 NO COMPRESIBLEITB 1,1-1,3 NORMALITB O,91-0,99 VALORES LÍMITEITB O,41-0,90 ISQUEMIA LEVE/MODERADAITB < 0,40 ISQUEMIA GRAVETabla I. Interpretación de índice tobillo brazo (ITB) 5Un ITB de 0.9 tiene una sensibilidad paradescartar una enfermedad arterial periféricadel 95% y una especificidad para identificarsujetos sanos entre el 90-100% (5).3. Pruebas de esfuerzoEn condiciones normales la respuestafisiológica al ejercicio es la taquicardia y aumentode la presión de perfusión y el flujo seincrementa en la extremidad. En presencia depatología se produce una caída de la presióndistal a la estenosis u obstrucción (5).Indicaciones: Cuando las presiones segmentariasy el registro de pulso volumen sonnormales o medianamente anormales((ITB>0.8 pero
DIAGNÓSTICO DE LA ARTERIOPATÍA DIABÉTICA Y PIE DIABÉTICO ■ 33El índice tobillo brazo post ejercicio es unpoderoso predictor independiente de mortalidadpor todas las causas y proporciona unaestratificación de riesgo adicional más allá delíndice tobillo brazo en reposo (6).Material y método: Se realiza una determinacióndel ITB en reposo. Posteriormente seinvita al paciente a realizar el ejercicio. Se empleauna cinta rodante a una velocidad constantede 3,2 Km/h y con una inclinación de 12%.El ejercicio se interrumpe cuando el pacientecomience a notar molestias (dolor EEII, disnea,dolor torácico, etc.) o bien después de 5 minutosde ejercicio. Realizaremos una medicióndel ITB 1 minuto después de parar y cada minutohasta la normalización de las presiones (5).Interpretación del índice tobillo brazopostejercicio: Un descenso de la presiónde un 15-20% respecto de la inicial y unITB
34 ■ PIE DIABÉTICOsolas tiene una exactitud del 85%. Esto aumentaal 95% cuando se emplean juntas (5, 7).El uso conjunto de la presión sistólica segmentariay del registro de pulso volumen garantizaque los pacientes con diabetes que tienenuna calcificación arterial que produce una falsaelevación de la presión segmentaria, sean identificadoscon facilidad y evaluados correctamentemediante el registro de pulso volumen (5, 7).6. Indices dedos del pie brazoIndicado en pacientes diabéticos y pacientescon enfermedad vasoespástica.Material y método: paciente colocadoen decúbito supino. Se coloca la sonda pletismográficaen el primer o segundo dedo delpie. Utilizamos un manguito 1,2 veces la anchuradel dedo colocado proximal a la sondaen el dedo.Interpretación de los resultados: losvalores normales del índice dedo/brazo son>0,65. Si la presión digital es
DIAGNÓSTICO DE LA ARTERIOPATÍA DIABÉTICA Y PIE DIABÉTICO ■ 35Grado estenosis Modo B y B-color Onda doppler VSM RatioSin lesión Normal Trifásica
36 ■ PIE DIABÉTICOCoste (euros) Sensibilidad EspecificidadARTERIGRAFIA 523-1223 REFERENCIA REFERENCIAANGIORESONANCIA 429-514 92%-99% 97%ANGIOTAC 163-203 89-99% 83-97%ECODOPPLER 37-43 80-98% 88-99%Tabla III. Tabla donde aparece el coste de las distintas exploraciones y sufiabilidad (8,9,10,11).4. AngioTACFigura 4.Angioresonanciamagnética donde seaprecia una obstruccióniliofemoral bilateral.Ventajas: Detecta la enfermedad y su extensiónanatómica, detecta estenosis significativas,aporta información de la pared arterial,se realiza rápidamente (10, 11).Limitaciones: contrastes iodados, exposicióna radiación, presencia de calcio, artefactospor stent.Sensibilidad del 95% para detectar estenosis>50%u oclusiones y una especificidad del96%. Se describe que existe un 8% de sobreestimaciónde la estenosis y un 15% de casosque se subestima (10, 11). (Figura 5)Figura 5. AngioTAC donde se aprecia permeabilidadde los ejes arteriales.graves, 0.16% mortalidad, disecciones, ateroembolismos,insuficiencia renal, complicacionesdel lugar de punción (10, 11).Se recomienda el uso dela sustracción digitalen la realización de los estudios dado queaumenta la resolución de la exploración y disminuyela necesidad de contraste. (Figura 6).Por último en la Tabla III aparecen los costesque generan distintas técnicas diagnósticasde imagen.5. AngiografíaVentajas: aporta detallada información dela anatomía arterial, considerada patrón de referencia.Limitaciones: 0,1% reacciones gravesal medio de contraste, 0.7% complicacionesFigura 6. Imagen arteriográfico de arteria poplítea ytroncos distales en paciente diabético, donde se apreciauna afectación importante de troncos distales.
DIAGNÓSTICO DE LA ARTERIOPATÍA DIABÉTICA Y PIE DIABÉTICO ■ 37BIBLIOGRAFÍA1. Marinelo J, Blanes JI, Escudero JR, Ibañez V, Rodríguez J.Consenso sobre pie diabético. Angiología 1997(5): 193-230.2. Norgren I, Hiatt WR, Dormandy JA, Nehler MR, Harris KA,Fowkes FG: Inter-society consensus for the management ofperipheral arterial disease. (TASCII). Eur J Vasc EndovascSurg. 2007; 33: S1-S75.3. Frykberg RG, Zgonis T, Amstrong DG, Driver VR, Giurini JM,Kravitz SR, Landsman AS; Lavery LA, Moore JC, SchumberthJM, Wukich DK, Andersen C, Vanore JV. Diabetic foot disorders:a clinical practice guideline (2006 revision). The journalof foot and ankle Surgery 2006, 45(5): S1-S66.4. Nathan D M, Buse J B, Davidson Mb, Ferrannin I, Holman Rr,Sherwin R, Zinman B. Medical management of hyperglycemiain Type 2 diabetes: A consensus algorithm for the initiation andadjustment of therapy. A consensus statement of theAmerican Diabetes Association and the European Associationfor the Study of Diabetes. Diabetes Care 32: 193–203.5. March JR, Fontcuberta JM, Benito L, Mestre FX, Vila R. Guíabásica para el estudio no invasivo de la isquemia crónica demiembros inferiores. Angiología 2009; 61(supl 1): S75-S92.6. Sheikh M, Bhatt D, Li J, Lin S, Bartholomew JR. Usefulness ofpostexercise ankle-brachial index to predict all-cause mortality.Am J Cardiol 2011; 107: 778-782.7. Gerhard-Herman M, Gardin J, Jaff M, Mohler E, Roman M,Naqvi T. Guidelines for noninvasive vascular laboratory testing:a report from the American Society of Echocardiographyand the society for vascular medicine and biology. Vasc Med2006; 11: 183-200.8. Collins R, Burch J, Cranny G, Aguiar-Ibañez R, Craig D,Wright K, Berry E, Gough M, Kleijnen J, Westwood M.Duplex ultrasonography, mag<strong>net</strong>ic resonance angiographyand computed tomography angiography for diagnosis andassessment of sintomatic, lower limb peripheral arterialdisease: systematic review. BMJ 2007; 334 (7606): 1257-66.9. Heijenbrock-Kal MH, Kock M, Hunink M. Lower extremityarterial disease: multidetector CT angiography- Meta-análisis.Radiology2007; 245: 433-439.10. Gutiérrez Baz M, de Benito Fernández L, Criado Galán F,Puras Mallagray E. Diagnóstico y valoración funcional de lospacientes en la cirugía Endovascular de las arterias distalesdel miembro inferior. En: Cirugía endovascular de las arteriasdistales de las extremidades inferiores. Carlos VaqueroEditor. Valladolid .57-66. 2009.11. Salmerón Febres LM, Al-Raires Bolaños B, Blanes MompoJL, Collado Bueno G, Cuenca Manteca J, FernándezGonzález S, Linares Palomino JP, López Espada C, MartínezGámez J, Serrano Hernando J. Guía de actuación en técnicasy procedimientos endovasculares del sector infrainguinal.Angiología 2011; 63(3): 119-142.12. Kock M, Adriaensen M, Pattynama PMT et al. DSA versusmulti-detectro row CT angiography in peripheral arterialdisease: Randomized controlled trial. Radiology 2005; 237:727-737.13. Ouwendijk R, de Vries M, Pattynama PMT et al. Imagingperipheral arterial disease: a randomized controlled trialcomparing contrast-enhanced MR angiography and multidetectorrow CT angyigraphy. Radiology 2005; 236: 1094-1103.
Manifestaciones clínicas en la infeccióndel pie diabéticoLUIS MIGUEL URIEN Y MILAGROS BORREGOServicio de Cirugía General y A D. Complejo Hospitalario de Ávila. Ávila. España.INTRODUCCIÓNSe define el pie diabético como una alteraciónclínica de base neuropática inducida porla hiperglucemia mantenida, en la que con osin coexistencia de isquemia y previo desencadenantetraumático, se produce lesión y/oulceración del pie (1).La evaluación inicial ante toda heridasobre el pie del paciente diabético debe sersistemática, valorando tanto la situaciónvascular y neuropática como la existencia deosteomielitis y/o artropatía asociadas (2).Es importante valorar aspectos talescomo: tamaño, profundidad, márgenes, base ylocalización anatómica de la herida (la mayoriade las veces se extiende mas de lo que seaprecia en un primer examen), además de larepercusión general que pueda ocasionar.Tambien hay que anotar si existen olor y exudado.Deben tomarse cultivos del fondo de la úlcerao del exudado por aspiración, ya queotros tipos de muestras se han visto «insuficientes»para el diagnóstico (3).Debemos recordar que la infecciónno es la causa de la herida sino su complicación.EL PIE DIABÉTICO INFECTADOLa infección se define como una invasióntisular con multiplicación de micro-organismosque causan daño a los tejidos con o sinrespuesta inflamatoria del organismo. En el casodel pie diabético, la infección suele ser casisiempre secundaria a una herida cutánea. Eldiagnóstico es más clínico que microbiológico,ya que la herida está colonizada por la floracutánea habitual del paciente o por especiesbacterianas y hongos provenientes del medioambiente(4). La presencia de bacterias en unaherida no significa que esté infectada, debepor lo tanto distinguirse entre: colonizaciónbacteriana e infección.La colonización bacteriana (5). Es un fenómenofisiológico que se desarrolla sobre todala piel del paciente está compuesta de bacteriasaerobias y anaerobias poco virulentas (6-8), pero puede estar modificada en caso dediabetes, apareciendo gérmenes más virulentoscomo Staphylococcus aureus MR, Streptococcuspyogenes, Pseudomona y otros. Lapresencia de la flora colonizante, lejos de serperjudicial, podría acelerar la cicatrización dela herida (9).La evolución hacia la infección se debe amúltiples factores ligados a la bacteria y a suhuésped (tamaño, localización y profundidadde la herida, estado general e inmunológicodel paciente, especie bacteriana y grado de virulencia)(5). Los pacientes diabéticos estánmas expuestos que la población general a lasinfecciones y en particular a las localizadas anivel del pie (10-13). Entre un 15-25% de losdiabéticos desarrollarán a lo largo de su vidauna úlcera en el pie (14, 15) y de un 40 a un80% de estas úlceras se infectarán. (16).En la infección del pie diabético, el mecanismofisiopatológico es aún objeto de controversias.Para algunos autores, la frecuencia delas infecciones en el paciente diabético estaríanen relación con un déficit de los mecanis-
40 ■ PIE DIABÉTICOmos celulares de defensa, potenciados por lahiperglucemia, capaz de alterar las funcionesde los leucocitos (fagocitosis, adherencia, bactericida,quimiotactismo) (17-22). Para otros,la hiperglucemia favorece los fenómenos deapoptosis (23) siendo el origen de perturbacioneshemorreológicas responsables de trastornosde la vascularización distal (24).Las infecciones serán superficiales cuandoafecten a las capas de tejidos por encima dela aponeurosis superficial, mientras que, lasprofundas lo hacen a esa misma aponeurosis, losmúsculos o las estructuras osteoarticulares (25).El diagnóstico de infección presenta al menosdos de los siguientes signos: edema, induración,eritema perilesional, aumento de lasensibilidad local, dolor, calor local o presenciade pus (4, 26).Los signos clínicos de la infección puedenestar atenuados en el paciente diabético portadorde una neuropatía (27), un pie de Charcoten fase aguda (28) o en caso de isquemia (29,30). Signos como un tejido friable, necróticoprofundo o un olor nauseabundo, son datos afavor de una infección (31). La aparición de dolores un signo de gravedad (evidencia C-II).La gravedad de la infección será juzgadasegún la Clasificación del Consenso Internacionalsobre el pie diabético del InternationalWorking Group on the Diabetic Foot 2003.(Esquema I) (26)ESQUEMA IGRADO 1. Sin síntomas, ni signos de infección.GRADO 2. Afectación cutánea (sin afectación delos tejidos subcutáneos, ni sistémicos) con al menosdos de los siguientes signos:• Calor local.• Eritema > 0,2-2 cm alrededor de la úlcera.• Dolor.• Tumefacción local o induración.• Exudado purulento (secreción espesa, opaca,blanquecina o sanguinolenta).Las demás causas de reacción inflamatoria de la pielno deben ser tenidas en cuenta, como por ejemplo:traumatismos, gota, pie de Charcot agudo, fracturas,trombosis, estasis venoso, y otras.GRADO 3.• Eritema > 2 cm. unido a uno de los signos descritosanteriormente.• Infección de las estructuras debajo de la piel ydel tejido celular subcutáneo, como un abscesoprofundo, una linfangitis, una osteítis, una artritisséptica o una fascitis.No debe haber respuesta inflamatoria sistémica.GRADO 4. Infección local con la presencia designos sistémicos manifestados por al menos dosde las características siguientes:• Temperatura > de 38 ºC ó < 36 ºC• Frecuencia cardiaca > 90 lpm• Frecuencia respiratoria > 20 rpm• PCO 2< 32mmHg• Leucocitos > 12000 ó < 4000/mm 3• 10% de formas leucocitarias inmadurasIII. FORMAS CLÍNICAS INFECCIOSASDEL PIE DIABÉTICOa) La dermohipodermitis bacteriana se definecomo la afectación de la hipodermis. Eltermino celulitis no debe ser utilizado eneste contexto (25). La sintomatología secaracteriza por signos locales dominadospor enrojecimiento, inicialmente perilesional,pero que puede propagarse y constituiruna amplia placa inflamatoria, acompañadade edema, dolor y calor local. Lafiebre, la linfangitis y las adenopatías satélitesestán a veces ausentes en el pacientediabético (29).b) Las colecciones purulentas pueden presentarsebajo la forma de abscesos (coleccióncircunscrita) o de flemones (colecciónno circunscrita) en las partes blandasdel pie o de la pierna, a veces clínicamentedifícil de evaluar, necesitando la confirmaciónmediante exámenes de imagen.c) Fascitis necrotizante. Los signos locales estándominados por la necrosis cutánea yla coloración rápidamente violácea de lostejidos. Generalmente no hay ni pus niabscesos. La crepitación de los tejidos a lapalpación es inconstante pero evocadoradel desarrollo del clostridium spp., el empeoramientorápido del estado general y
MANIFESTACIONES CLÍNICAS EN LA INFECCIÓN DEL PIE DIABÉTICO ■ 41la extensión súbita de las lesiones, son lossignos de alarma. La existencia de unaneuropatía y /o una arteriopatía agravanel pronóstico. (32)d) La gangrena húmeda, se define por la presenciade tejidos necróticos negruzcos.Está caracterizada por la rápida evoluciónde las lesiones con secreción grisácea deolor nauseabundo, que produce un rápidoempeoramiento del estado general conprogresión a sepsis, desequilibrio metabólicoe insuficiencia renal (32).e) Osteoartritis infecciosa.- Ciertos parámetrosbiológicos inflamatorios pueden sugeriruna afectacion osteoarticular, peroesta alteración es muy inconstante y pocoespecífica (30, 33, 34-36).e) La artropatía de Charcot tiene una etiologíaneurógena que evoluciona en variasetapas cronológicas (37-40). Se define comouna afectación indolora de una o variasarticulaciones del pie, que conducen aluxaciones articulares y fracturas patológicasresponsables de una destrucciónmás o menos importante de la arquitecturadel pie.e) En la artropatía aguda de Charcot (37-39,41, 42) aparece repentinamente un nódulopseudo-inflamatorio, asociado a edema,eritema y calor local con una diferenciade temperatura significativa entre los dospies (42). La aparición de dolor sobre unpie neuropático puede significar la presenciade infección. Los síntomas generalesy las alteraciones analíticas suelenestar ausentes. La asociación de un pieagudo de Charcot y de una osteítis esposible.e) La afectación osteoarticular subyacentedebe considerarse en los siguientes casos:resistencia al tratamiento, recidiva dela infección de la herida, sobre todo siasienta cerca de una prominencia ósea,evolución desfavorable después de unmanejo óptimo y de una vascularizaciónarterial satisfactoria (43). Las artritis sépticasaisladas son raras.f) Osteitis/osteomielitis. La infección ósea esfrecuente en el diabético, se presenta en el30 al 80% de los casos según la gravedadde la infección (16). La infección se producepor contigüidad a partir de una herida,el origen hematógeno es excepcional en eldiabético. (4, 44-45). Cuando la infeccióninicialmente afecta a la cortical hablamosde osteítis, y cuando progresa hacia la medularosteomielitis. Tanto una como la otratienen una traducción clínica similar en elpie diabético. La localización mas frecuentees a nivel de los dedos del pie y del calcáneo(46).f) Los signos clínicos de una osteítis/osteomielitispueden demostrarse por: la palpaciónósea, por medio de una sonda metálicaestéril, introducida a través de la úlcera,aunque su valor pronóstico negativo no loelimina (47) y por la aparición de un fragmentoóseo o la movilidad anormal deun dedo con aspecto edematoso y coneritema (48).CLASIFICACIÓN CLÍNICADEL PIE DIABÉTICO INFECTADOEl interés de las clasificaciones de las lesionesdel pie diabético radica en que permiteninstaurar protocolos terapéuticosadecuados y establecer el pronóstico de laslesiones.Una de las primeras clasificaciones propuestasfue la de Williams en 1974 que utilizabala temperatura del pie afectado paracategorizar las lesiones necróticas: neuropáticasen el caliente, neuroisquémicas en el templadoe isquémicas en el frío (49).En 1981 la clasificación de Meggit-Wagnerde 5 grados está basada primariamenteen tres factores: profundidad de las ulceras, elgrado de infección y el grado de gangrena. Losgrados 1 al 3 son predominantemente neuropáticos,mientras que los grados 4 y 5 sonpredominantemente isquémicos. Sin embargo,esto no significa que los grados 1 y 3 nosean isquémicos o que los grados 4 y 5 notengan un componente neuropático. Enmuchos casos ambos componentes estánpresentes (50).
42 ■ PIE DIABÉTICOClasificación de Meggit-Wagner del pie diabético.En 1988 Coleman (51) divide el pie diabéticoen cuatro categorias numeradas del 0 al 3que incluye riesgo y gestión. (Esquema II).Figura 1. Lesiones superficiales.ESQUEMA IIGrupo Manifestaciones clínicas RecomendacionesGrupo 0 Sensibilidad normal. Visitas clínicas anuales.No hay úlceras plantares ni deformidades Educación del paciente y selecciónen los pies.de un calzado apropiado.Grupo 1 Neuropatía, sin historia de úlceras plantares Visitas clínicas dos veces al año.y sin deformidades en el pie.Modificaciones del calzado con plantillasblandas y educación del paciente.Grupo 2 Neuropatía, sin historia de úlceras Visitas clínicas cada 3-4 meses.y con deformidades en el pie.Prescripción de calzado adecuadoy educación del paciente.Grupo 3 Neuropatía, historia de úlceras en los pies Visita clínica cada 1-2 meses.y presentan evidencias de angiopatía. Calzado adecuado y educacióndel paciente.En 1991 Gibbson define tres grados de ulceraciones:leve, moderado y grave. El criteriode valoración esta basado en la profundidadde la ulceración y en el grado de la infección(52). Este sistema no tiene en cuenta la etiologíaprimaria de la lesión.También en 1991 Frykberg y Coleman,describen un sistema de clasificación de la úlceraque considera los factores de riesgo, asícomo etiologías especificas en el pie diabético.Fryberg identifica al paciente en riesgo basándoseen la presencia de neuropatía, isquemia,deformidad del pie, o cualquier combinaciónde estos factores. El sistema de Fryberg seFiguras 2. Dermohipodermitis bacteriana.
MANIFESTACIONES CLÍNICAS EN LA INFECCIÓN DEL PIE DIABÉTICO ■ 43Figuras 3 y 4. Fascitis necrotizante.describe como un sistema de clasificación deriesgo basado en 5 grados (53).Posteriormente otras clasificaciones comola de la Universidad de Texas (54-56), deLypsky (44) y la PEDIS (perfusión, extensión,destrucción tisular-profundidad, infeccióny sensibilidad)(26) están destinadas a valorarde forma individualizada la profundidad de laherida, el grado toxicidad sistémica, la terapéuticay otras.Los sistemas de clasificación anterioresdescriben factores de riesgo y estrategias detratamiento preventivo; sin embargo, no indicanespecíficamente como tratar las ulceraciones.Una clasificación ideal de las heridas deberíareunir varios objetivos (57): grado de severidady evaluación del pronóstico (cicatrizacióny riesgo de amputación mayor) quepermita una gestión normalizada de cada unade las mismas.La etiología subyacente y los factores deriesgo asociados son críticos para valorar lasúlceras en el pie diabético, para proponer untratamiento adecuado y para evaluar el pronóstico.De este modo recomiendan un sistemade clasificación combinado que tenga encuenta la etiología de la úlcera, los factores deriesgo, los esquemas de tratamiento y el pronóstico(26, 32, 58-60, 61-69).Las etiologías primarias y los factores deriesgo incluyen neuropatía periférica diabética,enfermedad vascular periférica, deformidaddel pie e historia de úlceras. Las opcionesde gestión clínica incluyen la educación delpaciente, modificaciones en el calzado, evaluaciónneurológica, evaluación vascular y tratamiento,cura de heridas y modificaciones en lacarga del peso en el pie.El sistema propuesto utiliza 6 grados deulceración, entre el 0 y el 5, basado en la clasificaciónde Wagner. La valoración de la úlceraestá subdividida según el grado de isquemia:Grado 0: la integridad de la piel estáintacta. La sensibilidad es normal y existe deformidaden el pie, con o sin neuropatía. Estospacientes no suelen tener una historia de ulceración.El tratamiento está dirigido a educaral paciente, uso de calzado apropiado y consultavascular cuando corresponda. En pacientescon deformidades en el pie, la cirugíacorrectora del pie puede recomendarse paraeliminar áreas de presión anormal. El pronósticode estos pacientes es bueno o excelente.Grado 1: se divide en dos categorías:– Grado 1A: heridas superficiales sin infección.Estos pacientes pueden tener un historialde ulceración plantar, pérdida de sensibilidady pueden o no presentar deformidadesen el pie.– Grado 1B: los mismos que para el grado 1Apero con un componente isquémico.
44 ■ PIE DIABÉTICOFigura 5. Necrosis del talón por osteomielitis delcalcáneo.La gestión de estos pacientes es similar ala de grado 0 con el añadido de desbridamientoapropiado de heridas y cuidado localde las mismas. Se logra modificar la carga depeso mediante sandalias curativas, plantillasde contacto total y modificaciones en el calzado.Las consultas vasculares son especialmenteimportantes en lesiones grado 1B. Serealizan doppler, oxígeno transcutáneo yarteriogramas, y se puede plantear una revascularizaciónarterial como garantía. Elpronóstico para los pacientes 1A es bueno,mientras que para los 1B es bueno o regular.Grado 2: se divide en dos categorías:– Grado 2A: implica ulceraciones hasta el nivelde tendón, hueso, ligamento y cápsulade la articulación con inflamación. No haysensibilidad. Estos pacientes presentan generalmenteuna historia de ulceracionesprevias en el pie, sin embargo, no es infrecuenteencontrar lesiones grado 2 comouna presentación primaria.– Grado 2B: presenta los mismos criteriosque el 2A con el añadido de un problemavascular significativo.Figura 6. Después de tratamiento del paciente dela fig. 5.La gestión de las lesiones de grado 2 essimilar al descrito anteriormente para elgrado 1 con el añadido de una posible hospitalización(a elección) para desbridamientode heridas profundas de todos lostejidos necróticos o inviables. Pueden realizarseextirpaciones de hueso con el objetivode obtener un adecuado cierre de lostejidos blandos. Pueden realizarse radiografíaspara descartar osteomielitis. De nuevo,la consulta vascular es obligada en las ulceraciones2B. El pronóstico para el grado 2Aes bueno, mientras que para el grado 2B esvariable.Grado 3: se divide en dos categorías.Figura 7. Necrosis + osteomielitis.– Grado 3A: presenta ulceraciones profundascon abscesos u osteomielitis. Estospacientes sufren una celulitis significativa
y toxicidad sistémica. Normalmente, estospacientes tienen un historial de ulceracionesprevias y neuropatía. Las deformidadesen el pie son comunes.– Grado 3B: son similares a las 3A con elañadido de una significativa enfermedadvascular.MANIFESTACIONES CLÍNICAS EN LA INFECCIÓN DEL PIE DIABÉTICO ■ 45El plan de gestión de las lesiones de grado3 es similar al de grado 2 con un ingresoinmediato en el hospital para antibióticos intravenososy la apropiada incisión y drenaje.El pronóstico para el grado 3A es regular;para el 3B es variable.Figura 8. Evolución del paciente 8.Grado 4: presentan gangrena de los dedoso la planta del pie con o sin celulitis significativao toxicidad sistémica. Estos pacientessuelen presentar ulceraciones profundascon el hueso expuesto. En la mayoría de loscasos estos pacientes sufren una enfermedadvascular periférica significativa; no sepercibe sensibilidad. En la mayoría de las lesionesgrado 4 con enfermedad vascular severano se notarán deformidades en el pie. Elprimer movimiento de gestión será la consultaen Angiología y Cirugía Vascular. La viabilidadde los tejidos se determinará segúnel éxito de los procesos de revascularizaciónarterial. El pronóstico para estos pacienteses regular-malo.Grado 5: presenta gangrena en todo elpie. De nuevo, la gestión de estos pacientespasa por la consulta de vascular y la re vascularizaciónarterial si es posible. Muchosde estos pacientes requieren la amputaciónmenor o mayor de la extremidad inferior.En cada grado, la evaluación apropiadade laboratorio, valoración de la enfermedadinfecciosa, interpretación radiográfica yvaloración vascular deben llevarse a cabocomo garantía. Los sistemas de clasificaciónde las úlceras están diseñados para facilitarprotocolos apropiados de tratamiento y handemostrado que mejoran los resultados(70).Figura 9. Resultado después de tratamiento PacienteFig. 7.Figura 10. Gangrena húmeda.
46 ■ PIE DIABÉTICOBIBLIOGRAFÍA1. Marinel-lo J, Blanes JI, Escudero JR, et al. Consenso de laSEACV sobre pie diabético. Angiología 1997; 5: 193-230.2. Fryberg RG, Armstrong DG, Giurini J et al. Diabetic footdisorders: A clinical practice guideline. J Foot Ankle Surg2000; 39: S1-S60.3. Lipsky BA. Medical treatment of diabetic foot infections.Clin Infect Dis 39 (Suppl 2): S104-S114, 2004.4. Lipsky BA, Berendt AR, Embil J, De Lalla F. Diagnosing andTreating diabetic foot infections. Diabetes Metb Res Rev2004; 20: S56-64.5. Bowler PG, Duerden BI, Armstrong DG. Wound microbiologyand associated approaches to wound Management.Clin Microbiol Rev 2001; 14: 244-69.6. Karchmer AW, Gibbons GW. Foot infections in diabetes:evaluations and Management. Curr Clin Top Infect Dis1994; 14: 1-22.7. Gerding DN. Foot infections in diabetic patients: the role ofanaerobes. Clin Infect Dis 1995; 20: S283-8.8. Diamantopoulos EJ, Haritos D, Yfandi G, et al. Managementand outcome of severe diabetic foot infections. Exp ClinEndocrinol Diabetes 1998; 106: 346-52.9. Dow G, Browne A, Sibbald RG. Infection in chronic wounds:controversies in diagnosis and treatment. Ostomy WoundManage 1999; 45: 23–40.10. Senior C. Assessment of infection in diabetic foot ulcers. JWound Care 2000; 9: 313–7.11. Robson MC, Mannari RJ, Smith PD, Payne WG. Maintenanceof wound bacterial balance. Am J Surg 1999; 178: 399–402.12. Boyko EJ, Lipsky BA. Infection and diabetes. In Diabetes inAmerica, 2nd edition, NIH Publication No 95-1468. 1995:485–499.13. Shah B, Hux J. Quantifying the risk of infectious diseases forpeople with dia- Bet es. Diabetes Care 2003; 26: 510–3.14. Mayfield JA, Reiber GE, Sanders LJ, Janisse D, Pogach LM.Preventive foot care in people with diabetes. DiabetesCare 1998;21:2161–77.15. Boulton AJM, Vileikyte L, Ragnarson-Tennvall G, Apelqvist J.The global burden of diabetic foot disease. Lancet 2005;336: 1719–24.16. Lipsky BA. Infectious problems in diabetic patients. In: Levinand O’Neal’s The Diabetic Foot (6th ed). Bowker JH,Pfeifer MA, eds. St Louis: Mosby. 2001: 467–80.17. Sato N, Shimizu H, Suwa K, Shimomura Y, Kobayashi I, MoriM. MPO activity and generation of active O2 species in leukocytesfrom poorly controlled diabetic patients. DiabetesCare 1992; 15: 1050–2. classification in relation to the finaloutcome. Wounds 2002; 14: 16–25.18. Marhoffer W, Stein M, Maeser E, Federlin K. Impairment ofpolymorphonu- clear leukocyte function and metaboliccontrol of diabetes. Diabetes Care 1992; 15: 256–60.19. Gallacher SJ, Thomson G, Fraser DW, Fisher BM, GemmellCG, MacCuish AC. Neutrophil bactericidal function in diabetesmellitus: evidence for association with blood glucosecontrol. Diabet Med 1995; 12: 916–20.20. Alexiewicz JM, Kumar D, Smogorzewski H, Klin M, MassryMG. Polymor- phonuclear leucocytes in non-insulin-dependentdiabetes mellitus: abnorma- lities in metabolism andfunction. Ann Intern Med 199 5; 123: 919–24. Clin InfectDis 2004; 39: S83–6.21. Delamaire M, Maugendre D, Moreno M, Le Goff MC, AllanicH, Ge<strong>net</strong>et B. Impaired leucocyte functions in diabeticpatients. Diabet Med 1997; 14: 29–34.tes: a controlled trial.Diabet Med 1996; 13: 156–9.22. Muchová J, Liptáková A, Országhová Z, et al. Antioxydantsystem in poly- morphonuclear leucocytes of type 2 diabetesmellitus. Diabet Med 1999; 16: 74–8.23. Rai NK, Suryabhan, Ansari M, Kumar M, Shukla VK, TripathiK. Effect of glycaemic control on apoptosis in diabeticwounds. J Wound Care 2005; 14: 277–81.24. Vigilance JE, Reid HL. Glycaemic control influences peripheralblood flow and haemorheological variables in patientswith diabetes mellitus. Clin He- morheol Microcirc 2005;33: 337–46.25. Conférence de consensus. Érysipèle et fasciite nécrosante.Med Mal Infect 2000; 30: 241–5.26. International Working Group on the Diabetic Foot.International consensus on the diabetic foot (CD-ROM).2003. In: International Diabetes Foundation; Brussels.http://www.iwgdf.org.27. Edmonds M. Infection in the neuroischemic foot. Int J LowExtrem Wounds 2005; 4: 145–53.28. Berendt T, Lipsky BA. Is bone infected or not?Differentiating neuro-os- teoarthropathy from osteomyelitisin the diabetic foot. Curr Diab Rep 2004; 4: 424–9.29. Eneroth M, Apelqvist J, Stenstrom A. Clinical characteristicsand out- come in 223 diabetic patients with deep footinfections. Foot Ankle Int 1997; 18: 716–22.30. Eneroth M, Larsson J, Apelqvist J. Deep foot infections inpatients with diabetes and foot ulcer: an entity with differentcharacteristics, treatments, and prognosis. J DiabetesComplications 1999; 13: 254–63.31. Cavanagh PR, Lipsky BA, Bradbury AW, Batek G. Treatmentfor diabetic foot ulcers. Lancet 2005; 366: 1725–35.32. Bernard, l , Lavigne, JP et al. Recommandations pour la practiqueChinique. Prise en charge du pied diabétique infecté.Medicine et maledies infectieuses. 2007; 37: 26-50.33. Armstrong DG, Lavery LA, Sariaya M, Ashry H. Leukocytosisis a poor indicatorof acute osteomyelitis of the foot in diabetesmellitus. J Foot Ankle Surg 1996; 35: 280–3.34. Newman LG, Waller J, Palestro C, et al. Unsuspected osteomyelitisin diabetic foot ulcers: diagnosis and monitoringby leukocyte scanning with indium 111 oxyquinoline. JAMA1991; 266: 1246–51.35. Lavery LA, Armstrong DG, Quebedeaux TL, Walker SC.Puncture wounds: normal laboratory values in the face ofsevere infection in diabetics and non- diabetics. Am J Med1996; 101: 521–5.36. Kaleta JL, Fleischli JW, Reilly CH. The diagnosis of osteomyelitisin diabetes using erythrocyte sedimentation rate: apilot study. J Am Podiatr Assoc 2001; 91: 445–50.37. Sanders LJ, Frykberg RG. Charcot neuroarthropathy of thefoot. In: Levine and O’Neal’s The Diabetic Foot (6th ed).Bowker JH, Pfeifer MA, eds. Saint Louis: Mosby. 2001: 439–66.38. Perrennou D, Aboukrat P, Richard JL. Ostéoarthropathienerveuse du pied diabétique. In: Le pied diabétique. RichardJ-L, Vannereau D, eds. Paris: Editions MF. 2002: 183–207.
MANIFESTACIONES CLÍNICAS EN LA INFECCIÓN DEL PIE DIABÉTICO ■ 4739. Hartemann-Heurtier A, Ha Van G, Grimaldi A. The Charcotfoot. Lancet 2002; 360: 1776–9.40. Rajbhandari SM, Jenkins RC, Davies C, Tesfaye S. Charcotneuroarthropa- thy in diabetes mellitus. Diabetologia 2002;45: 1085–96.41. Armstrong DG, Todd WF, Lavery LA, Harkless LB, BushmanTR. The natural history of acute Charcot’s arthropathy in adiabetic foot specialty clinic. J Am Podiatr Med Assoc 1997;87: 272–8.42. Armstrong DG, Lavery LA. Acute Charcot’s arthropathy ofthe foot and ankle. Phys Ther 1998; 78: 74–80.43. Lipsky BA. Osteomyelitis of the foot in diabetic patients.Clin Infect Dis 1997; 25: 1318–26.44. Lipsky BA, Berendt AR, Deery HG, Embil JM, Karchmer AW,LeFrock JL, Lew DP, Mader JT, Norden C, Tan JS. Diagnosisand treatment of diabetic foot infections. Clin Infect Dis2004; 39: 885–910.45. Jeffcoate WJ, Lipsky BA. Controversies in diagnosing andmanaging osteo- myelitis of the foot in diabetes. Clin InfectDis 2004; 39: S115–22.46. Ciampolini J, Harding KG. Pathophysiology of chronic bacterialosteomyelitis. Why do antibiotics fail so often?Postgrad Med 2000; 76: 479–83.47. Grayson ML, Gibbons GW, Balogh K, Levin E, KarchmerAW. Probing to bone in infected pedal ulcers: a clinical signof underlying osteomyelitis in diabetic patients. JAMA1995;273: 721–3.48. Rajbhandari SM, Sutton M, Davies C, Tesfaye SS, Ward JD.«Saussage toe»: a reliable sign of underlying osteomyelitis.Diabet Med 2000; 17: 74–7.49. Williams DT, Hilton JR, Harding KG. Diagnosing foot infectionin diabetes. Clin Infect Dis 2004; 39: S83–6.50. Wagner FW. The dysvascular foot: a system for diagnosisand treatment. Foot Ankle 1981; 2: 64-7.51. Coleman W. Footwear in a magement programo f injuryprevention. In: The diabetic foot. 4th Edition. St Louis: C.V.Mosby 1988; 9: 101-8.52. Gibbons GE, Ellopoulos GM. Infection of the diabetic foot.In. Management of diabetic foot problems. Philadelphia: WBSaunders, 1984; 97-102.53. Frykberg RG. Diabetic foot ulcerations. In The high risk footin diabetes mellitas. Edinburggh: Churchill Livingstone,1991; 185-6.54. Jeffcoate WJ, Macfarlane RM, Flechter EM. The descriptionand classification of diabetic foot lesions. Diabet Med 1993;10: 676–9.55. Lavery LA, Armstrong DG, Harkless LB. Classification ofdiabetic foot wounds. J Foot Ankle Surg 1996; 35: 528–31.56. Armstrong DG, Lavery LA, Harkless LB. Validation of a diabeticwound classification system. The contribution ofdepth, infection, and ischemia to risk of amputation.Diabetes Care 1998; 21: 855–9.57. Oyibo SO, Jude EB, Tarawneh I, Nguyen HC, Harkless LB,Boulton AJ. A comparison of two diabetic foot ulcer classificationsystems: the Wagner and the University of Texaswound classification systems. Diabetes Care 2001; 24: 84–8.58. Benhamou AC, Dadon M, Emmerich J, et al. Artériopathiedes membres inférieurschez le diabétique. Diabetes Metab1997; 23: 541–8.59. ANAES. Echographie-Doppler dans l’artériopathieoblitérante des membres inférieurs. 2002: 1–144.http://www.anaes.fr.60. Orchard TJ, Strandness Jr., E. Assessment of peripheral vasculardisease in diabetes. Report and recommandations ofan international workshop sponsored by the AmericanDiabetes Association and the American Heart Association.18-20 September, 1992, New Orleans, Louisiana.Circulation 1993; 88: 819–28.61. VALMI. Collège des enseignants de médecine vasculaire.Conduite à tenir devant une artériopathie des membresinférieurs chez le diabétique. Paris, 2004.62. Boursier V, Priollet P. Explorations vasculaires non invasiveschez le diabétique. Paris, 2005.63. Got I. Sur la nécessité d’une approche multidisciplinaire dupied diabétique. J Mal Vasc 2001; 26: 130–4.64. Hartemann-Heurtier A, Ha Van G, Danan JP, et al. Outcomeof severe diabetic foot ulcers after standardised managementin a specialised unit. Diabetes Metab 2002; 28:477–84.65. Sumpio BE, Aruny J, Blume PA. The multidisciplinary approachto limb salvage. Acta Chir Belg 2004; 104: 647–53.66. Vileikyte L. Diabetic foot ulcers: a quality of life issue.Diabetes Metab Res Rev 2001; 17: 246–9.67. Sumpio BE. Foot ulcers. N Engl J Med 2000; 343: 787–93.68. Gottrup F. Management of the diabetic foot: surgical andorganisational aspects. Horm Metab Res 2005; 37: 69–75.69. Apelqvist J, Larsson J. What is the most effective way toreduce incidence of amputation in the diabetic foot?Diabetes Metab Res Rev 2000; 16: S75– 83.70. Calhoun JH,Cantrell J, Cobos J. Treatment of diabetic footinfections: Wagner classification,therapy, and outcome.Foot Ankle 1988; 9: 101–8.
Úlcera NeuropáticaSERGIO BENITES*, NEFTALÍ RODRÍGUEZ NEFTALÍ** Y JUAN RODRÍGUEZ***Servicio de Angiología y Cirugía Vascular del Hospital Español de México.**Servicio de Angiología y Cirugía Vascular del C.M.N. «20 de Noviembre» I.S.S.S.T.E. MéxicoINTRODUCCIÓNLas úlceras neuropáticas constituyen unaseria complicación de la diabetes mellitus(DM). Es conocido que un 15% de la poblacióncon esta entidad metabólica van a desarrollaruna úlcera en las extremidades inferiores.La enfermedad neuropática de los miembrosinferiores se va a desarrollar como resultadodel daño en las estructuras nerviosas. Enlos casos de las úlceras en los pies diabéticos,además de los cambios metabólicos propiosde la diabetes, se van a sumar alteraciones enlas arterias periféricas, produciendo isquemiaque va a exacerbar la neuropatía. Consecuentemente,la deficiente perfusión sanguínea, lasusceptibilidad a la infección, la propia neuropatía,las alteraciones bioquímicas y el traumarepetido en los pies, o una combinación deestos factores, harán que la curación de estetipo de úlceras continúen siendo un gran reto.Las úlceras que se presentan en los diabéticostambién son conocidas como neurotróficas,tróficas, perforantes o malperforantes.EPIDEMIOLOGÍADe acuerdo a la FID (Federación Internacionalde Diabetes), según el último reportedel 2011, en el mundo existen cerca de 285millones de diabéticos, y se espera que alcancelos 400 millones en el 2030. La prevalenciade esta enfermedad en los Estados Unidos estápresente en el 6.3% de su población, es decir18.2 millones de personas que la padeceny se estima que alrededor de 5.2 millones dehabitantes no han sido diagnosticados (1). EnEuropa, se contabilizan 52.8 millones de diabéticos,y que probablemente 19 millones vivensin saberlo. En países de América Latina laprevalencia es cercana a las estadísticas previamenteseñaladas, por ejemplo en México elporcentaje de diabéticos oscila alrededor del10.5%, es decir 10.5 millones de habitantes yaproximadamente el 30% de la población desconoceque la padece.La diabetes mellitus constituye la principalcausa de amputaciones no traumáticas, 50-75%.La frecuencia de amputaciones en pacientescon DM es 15 a 28 veces mayor que en individuosque no la tienen (2, 3). En los Estados Unidosentre el 15 al 20% de los diabéticos se vana ver afectados por problemas en los pies y soncausantes del 20% de todas las hospitalizacionesy de más de 50,000 amputaciones de las extremidadesinferiores en un año (4). Por otro lado,se sabe que más del 50% de los diabéticos quefueron sometidos a amputaciones mayores, vana requerir de una nueva amputación en la extremidadcontralateral, durante los primeroscuatro años posteriores a la primera pérdida dela extremidad (5).El costo en el cuidado de las ulceracioneses significativamente alto y va en incrementocuando se requiere de una amputación. Ramseyy colaboradores, estiman que el costo quese atribuye a esta patología es de $27,987USD durante los primeros 2 años del diagnóstico(6), mientras que Harrington et-al, utilizandola base de datos del Medicare (programade asistencia médica para ancianos),encontró que sólo el 31% de las úlceras sanabandurante las primeras 20 semanas de tratamientoy estimaron un costo anual de$15,300 USD (7).
50 ■ PIE DIABÉTICOPATOGENESISEl origen y desarrollo de una úlcera neuropáticatiene múltiples componentes. Engeneral, ellas incluyen una combinación deinsuficiencia arterial de las extremidades inferiores,neuropatía diabética, problemas estructuralesdel pie, y trauma local (8). En unestudio realizado por Reiber y colaboradores,identificó que los componentes antes mencionadosestaban presentes en el 63% de los pacientes;así mismo, demostró que alrededordel 20% de los pacientes con úlceras neuropáticastenían mala circulación, el 50% van a tenerneuropatía periférica y una tercera partede ellos llegaron a presentar ambas alteraciones(9). En otro estudio Boulton evidencióque la neuropatía periférica estaba presenteen el 90% de los casos, la cual habitualmentese presenta en la diabetes mellitus después de10 años de evolución (10).Otras causas de menor frecuencia que tambiénse han descrito en la patogénesis de las úlcerasneuropáticas son la presencia de edema,callosidades e infección. A pesar que la infecciónestá comúnmente asociada con las amputacionesen pacientes diabéticos, no es consideradoun factor determinante hasta en un 60% en eldesarrollo de úlceras neuropáticas (11).NeuropatíaLa neuropatía diabética está involucradaen la mayoría de las ulceras neuropáticas. Laincidencia de ésta en pacientes con DM, estárelacionada con la duración de la misma y elcontrol glicémico. Diversos estudios han demostradoque los pacientes con un adecuadocontrol de su glicemia, tienen una mejor velocidadde conducción nerviosa, así como disminuciónde retinopatía y nefropatía.La etiología exacta de la neuropatía periféricano se conoce, pero se sabe que es el resultadode eventos metabólicos que incluyenel metabolismo de la glucosa, el sorbitol y lafructuosa, una disminución del mio-inositol(necesario para la conducción nerviosa), e isquemiaa nivel del nervio debido a una afec-ción de la vasa nervosum (12). El mecanismoestructural predominante que se ve afectadopor estos componentes metabólicos es el microvascular.Bajo condiciones normales las comunicacionesentre arteriolas y vénulas a niveldel pie están cerradas, y el flujo sanguíneo es através de los capilares nutrientes de la piel. Enpresencia de DM, existe una disminución en lainnervación simpática de estas comunicacionesentre arteriolas y vénulas, provocandouna gran dilatación de las arteriolas, abriendolas comunicaciones, con lo cual disminuye elflujo que se dirige hacia los capilares de la piel,provocando una disminución en su temperaturay en la presión transcutánea de oxígeno(13).Existen 3 tipos de neuropatía: 1) Sensorial(que controla la sensibilidad), 2) la denerviosmotores (que controlan la musculatura), y 3)autonómica (que controla la función como lasudoración, el flujo vascular y la frecuenciacardiaca). Todos estos tipos de neuropatía seven afectados en los pacientes con DM.Si bien la diabetes mellitus es la principalcausa de neuropatía, hay que recordar queexisten otras que pueden provocarla: la uremia,el síndrome de inmunodeficiencia adquirida(SIDA), deficiencias nutricionales, compresiónnerviosa, trauma, fracturas, tumores,exposiciones a radiación ó frío, ciertas medicinas,lupus eritematoso sistémico y artritisreumatoide (14).Anormalidades músculoesqueléticasLas deformidades del pie en los pacientescon DM y neuropatía periférica son muy comunesy se caracterizan por la presencia deáreas de alta presión (figura 1). Estas deformidadesademás se van a asociar con una disminuciónde la grasa a nivel de las cabezas metatarsianas.Las ulceraciones se van a desarrollara partir de un estrés repetitivo, en las zonasde mayor presión sobre dichas prominenciasóseas (15). Las áreas sobre los dedos, en lapunta de los mismos y debajo de las cabezasmetatarsianas son las más vulnerables a ulceracióne infección.
ÚLCERA NEUROPÁTICA ■ 51Fig 1. <strong>Úlceras</strong> neuropáticas en zonas de alta presión, correspondientes a las cabezas metatarsianas.La presencia de una callosidad puede incrementarla presión en el pie hasta en un30% más, y debido a la ausencia o disminuciónde una respuesta protectora secundaria a laneuropatía, fácilmente se puede desarrollaruna úlcera neuropática. Del mismo modo, lasúlceras que aparecen, pueden empeorar progresivamente.Las principales malformaciones que se vana presentar en los pacientes con DM son: laarticulación del tobillo equino, que se caracterizapor una franca limitación a la dorsiflexióndel pie, con lo cual se va a incrementarla presión en la planta del pie. Esta deformaciónse va a presentar en el 10.3% de los casos(16). Otra malformación comúnmente observada,es el llamado pie de Charcot, tambiénconocido como neuroartropatía de Charcot.Lavery y colaboradores encontraron una incidenciaanual de artropatía de Charcot en 11.7por 1000 entre no hispanos blancos con diabetes.La duración de la enfermedad tambiénes importante, y se observa que el 80% de lospacientes con pie de Charcot tiene más dediez años con DM (17).El mecanismo preciso en el desarrollo delpie de Charcot no se conoce. Existen diferentesteorías que tratan de explicar su etiología.A pesar de la idea frecuente, que la mayoría delas extremidades de los diabéticos son isquémicas,existe una evidencia que muchospacientes con neuropatía diabética tienen unincremento en el flujo sanguíneo y que semantiene acumulado en los pies. Esta condicióntiene correlación directa con la disminuciónde la densidad ósea que se observa en laartropatía de Charcot.El Dr. Eichenholz en 1966, dividió la progresiónde la enfermedad de Charcot en tresetapas: desarrollo, coalescencia y reconstrucción.La etapa de desarrollo es la etapa aguda dedestrucción, que se caracteriza por ruptura ydislocación de las articulaciones, edema, subluxación,formación de fragmentos de huesoy cartílago, fracturas intraarticulares y fragmentaciónósea. Este periodo generalmenteinicia posterior a un trauma menor, pero seagrava con la deambulación continua. La etapade coalescencia se caracteriza por disminucióndel edema, absorción de los fragmentosóseos y cartílago, así como curación de lasfracturas. La fase final es la reconstrucciónósea con remodelación y fusión de los segmentoslargos de huesos, con lo que se limitala movilidad de la articulación de manera importante.Debido a todos estos cambios, laszonas de presión son mayores en los pacientescon artropatía de Charcot, condición queincrementa hasta 4 veces el riesgo a desarrollaruna úlcera (18).En otra observación, hay tres estudios quehan evaluado si la presencia de úlcera neuropáticay pie de Charcot, tienen algún impactodirecto sobre la mortalidad de los pacientes.Cuando son comparados entre si, no seencontró diferencia significativa (19-21). Sin
52 ■ PIE DIABÉTICOembargo, en la actualidad existe evidencia deque la presencia de una úlcera neuropática, seasocia con un incremento hasta del 50% en lamortalidad a cinco años (22, 23).Insuficiencia circulatoriaLos pacientes diabéticos van a tener afecciónen la macro y microcirculación. La característicade enfermedad arterial periférica queva a afectarse, son los vasos de mediano calibre(macrocirculación), principalmente a nivelde la trifurcación de la arteria poplítea. Sinembargo, esta puede extenderse e involucrarlos vasos del pie.Los pacientes con neuropatías van a tenerafección del reflejo axonal nervioso, por loque van a presentar vasodilatación en respuestaa un estímulo doloroso. Esta vasodilataciónanormal puede, paradójicamente, provocarisquemia funcional (microcirculación).La presencia de enfermedad arterial periféricaes elevada, principalmente en lospacientes con DM tipo II. En un estudio queinvolucró 5229 pacientes diabéticos recientementediagnosticados, se encontró que el21.1% de ellos tenían un índice tobillo brazomenor a 0.9, mientras que el 7.3% eran claudicadores(24).Además de los cambios arteriales clásicosde la arterioesclerosis, con el desarrollo de lasplacas asociadas con la calcificación intimal, laenfermedad arterial en los diabéticos nosmuestran un patrón característico de calcificaciónde la capa media arterial.EVALUACIÓN DEL PACIENTECON ÚLCERA NEUROPÁTICALa evaluación del paciente inicia con la elaboraciónde una historia clínica completa.Se debe identificar correctamente todos losfactores de riesgo. Lavery y colaboradores,demostraron que el riesgo de ulceración seincrementa drásticamente de acuerdo al númeroy al tipo de factor de riesgo asociadocon un paciente diabético. Ellos encontraronque el incremento del riesgo era de 1.7 en unapersona con neuropatía periférica, 12.1 si ademásde ésta, presentaba alguna deformidad delpie, y hasta 36.4 si a estas dos se sumaba el antecedentede una amputación previa (25).En la tabla I se enumeran los diferentesfactores de riesgo que comúnmente se asociancon el desarrollo de una ulceración. Aparentementetienen un origen multifactorial,sin embargo, existen muchos otros factoresde riesgo que el médico necesita tomar encuenta.Por consiguiente, es importante unificarcriterios para poder establecer el riesgo queva a tener cada paciente. El Grupo de TrabajoInternacional en Pie Diabético, recomienda elsiguiente sistema de clasificación (26):Grupo 0. Paciente diabético sin factores deriesgo.Grupo 1. Incluye a pacientes con DM y neuropatía.Grupo 2. Incluye pacientes DM, neuropatía,Enf. Vascular y/o deformidad del pie.Grupo 3. Pacientes con historia de ulceraciónó amputaciones previas.Tabla IFactores de riesgo en el desarrollode una úlcera en DM• Ausencia de sensibilidad protectorra debido aneuropatía diabética.• Insuficiencia vascular.• Deformidad estructural o presencia de callosidad.• Neuropatía autonómica que causa disminuciónde sudoración y resequedad.• Movilidad articular limitada.• Larga duración de la diabetes.• Historia de tabaquismo prolongado.• Mal control glucémico.• Obesidad.• Disminución de la visión.• Historia de úlcera o amputación previa.• Sexo masculino.• Edad avanzada.• Raza étnica asociada con alta incidencia deDM (ej. Americano).• Calzado inadecuado.
ÚLCERA NEUROPÁTICA ■ 53Uno de los principales aspectos a evaluares la pérdida de la sensibilidad en el pie. Sepuede realizar fácilmente mediante el uso deel mono filamento de Semes-Weinstein (SW-ME) ó mediante el método de vibración. Laprueba con el SWME es una prueba no invasiva,de bajo costo, rápida y fácil de efectuar, queconsiste en la aplicación del monofilamentosobre el pie, durante un segundo. El pacientetiene la instrucción de decir «si», cada vez queél sienta el monofilamento en el pie. Basadosen la literatura, el método óptimo para realizarla prueba es con el monofilamento 5.07 /10 gr sobre la base del primer dedo y las cabezasmetatarsianas del 3er y 5to dedos. Fig. 2.El paciente que no sea capaz de detectar enalgún punto, debe de ser considerado en riesgopara maximizar su sensibilidad. Esta pruebase encuentra estandarizada y tiene una sensibilidaddel 90% (27).Fig 2. Zonas recomendadas de exploración con elmonofilamento de Semmes-Weinstein.Otro de los aspectos importantes a evaluares la presencia de dolor neuropático. Éstecomúnmente se describe como «quemante»,«ardoroso», «punzante» o como «piquetescon agujas». Hay que considerar que laactividad física puede exacerbar o aliviar estasituación.La pérdida de la función motora tambiénva a afectar a los músculos intrínsecos del pie,lo que conlleva a cambios estructurales delmismo con el paso del tiempo. Se han descritodiferentes tipos de malformaciones en lospies, desde el pie cavo (aquellos que presentanun arco plantar amplio), dedos en «forma demartillo», hallux valgus, cabezas metatarsianasprominentes, hasta el pie de Charcot.La evaluación del estado vascular se puedever dificultada debida a la coexistencia decalcificación arterial y enfermedad arterialperiférica en los pacientes con DM. Ante la ausenciade pulsos palpables, existen diferentesalternativas para su seguimiento, iniciando conla realización de un ultrasonido Doppler paradeterminar el tipo de señal encontrada (trifásica,bifásica ó monofásica), medición de presionessegmentarias, presión en los dedos,presión transcutánea de oxígeno (tcPO2) conlo cual se evalúa la microcirculación (28). ElDr. Zimmy y colaboradores en el año 2001,demostró que los pacientes con diabetesy neuropatía tienen significativamente mayortcPO2 cuando se encuentran de pie, comparadocon los pacientes solamente diabéticos,lo cual demostró la afectación en la microcirculación(29).La temperatura del pie también debe serexaminada, ya que una diferencia entre ambasextremidades podría indicarnos la presenciade infección o fractura. Sin embargo, algunosautores han determinado que ésta, es un bajoindicador del estado vascular o de la neuropatía,incluso como predictor de futuras complicaciones.La única asociación significativa quese encuentra en la temperatura, es en presenciadel pie de Charcot (17).Los síntomas y signos que se puedenencontrar ante la presencia de alteracionescirculatorias en estos pacientes son: edema,cambios en la piel (afección en uñas, pérdida
54 ■ PIE DIABÉTICOdel vello, resequedad), ausencia de pulso, cambiosde coloración ó temperatura, y palidez dela extremidad con la elevación de la misma,conocido como signo de Buerguer.La formación de callosidad en los pies esuna respuesta protectora natural hacia elestrés repetitivo. Esto se caracteriza por elengrosamiento hiperqueratósico de la piel. Sinembargo, el problema con ello es que la acumulaciónde callo puede incrementar la presión25% a 30% más, lo que resulta en laformación de una úlcera por debajo de estacallosidad, dificultando su detección. La presenciade hemorragia dentro de una callosidad,es considerada el principal indicador deulceración. En ocasiones, la presencia de estacallosidad puede provocar dolor por irritaciónde las terminaciones nerviosas superficiales.Basados en la duración y en la cantidadde presión que se aplique sobre el mismo, seva a desarrollar una ulceración.También es importante evaluar el tipo decalzado que se está utilizando, así como la mediciónde la presión plantar al momento de ladeambulación. Un método sencillo para ellose consigue con el uso del tapete de Harris,sobre la cual se van a dejar las impresiones delpie, identificando las zonas de mayor presión,las cuales son las de mayor riesgo.EVALUACIÓN DE LA ÚLCERANEUROPÁTICALa descripción de la úlcera neuropáticaes necesaria y útil para el seguimiento de lamisma durante su tratamiento. Las localizacionesy causas habituales de estas, están listadasen la tabla II. Las úlceras que se asocian a neuropatíapueden presentarse como una laceración,perforación o una ampolla con un borderedondeado u oblongo. La base de la úlcerapuede ser necrótica, rosada ó pálida, conbordes suaves bien definidos.Además, se debe clasificar a la úlcera puesen base a ello, se determinará qué tipo detratamiento es el adecuado, y se estimará laevolución que podría tener la misma. Existendiversos sistemas de clasificación descritos enla literatura, la más utilizada es la Clasificaciónde Wagner que divide a las ulceraciones en 6grados en base a la profundidad de la lesión ya la presencia de osteomielitis o gangrena(30). Debido a que esta clasificación no incluíala presencia de infección, isquemia o neuropatía,la Sociedad WONC en el año 2004 decidiórealizar una modificación al sistema deWagner incluyendo éstos aspectos (31).Otro sistema de Clasificación conocido,que es ampliamente utilizado fue el elaboradopor la Universidad de Texas, el cual utiliza unaestructura principal de 4 grados de profundidad,asociados con isquemia, infección, ambaso sin presencia de ninguna (32). De acuerdocon el Dr. Oyibo y colaboradores, estesistema es considerado superior al realizadopor Wagner como un mejor predictor para laevolución del paciente (33).Tabla IILocalizaciones Comunes y Causashabituales de las <strong>Úlceras</strong> NeuropáticasDedos/InterfalángicasCabezamatatarsianaInterdigitalSitios de uniónDorsode los dedosDedos (distal)Medio pie(dorsal o plantar)TalonesLimitada flexión de laarticulación interfalángica.Alta presión, limitada flexiónarticular.Aumento de la humedad, calzadoestrecho, deformidad del pie.Calzado estrecho, deformidaddel pie.Dedos en «martillo» o en«garra», calzado estrecho.Mala circulación, trauma,calzado estrecho.Deformidad de Charcot,trauma externo.Presión constante.De Sociedad WONC: Guías para el manejo de heridas enpacientes con enfermedad neuropática de las extremidadesinferiores. Glenview IL, 2004.Finalmente, es necesario establecer si unaúlcera está infectada o no. La presencia de infeccióndifícilmente se asocia con ulceración, a pesarde que es conocido que las personas condiabetes tienen una mayor predisposición a esta
ÚLCERA NEUROPÁTICA ■ 55complicación. Sin embargo, las ulceraciones infectadasen pacientes diabéticos son menos sintomáticasque en los no diabéticos, en muchasocasiones, el único hallazgo clínico que presentanes hiperglicemia. La presencia de una probableinfección debe ser detectada durante el exameninicial, y la realización de un cultivo posterior a ladesbridación es lo más recomendable.Una vez establecida la presencia de infección,se va a clasificar a las úlceras en dos grupos:aquellas que ponen en riesgo a la extremidady, por lo tanto, requieren de tratamientoquirúrgico inmediato y las que no presentan esteriesgo, de acuerdo a las características queestas presenten (Tabla III), que incluyen: celulitisalrededor de la lesión mayor a 2 cm, abscesoprofundo, osteomielitis y/o gangrena. La osteomielitises el factor determinante para realizarla desbridación quirúrgica inmediata. Diversosreportes en la literatura mundial, la encuentranhasta en el 60% de los pacientes (34, 35).Tabla IIISignos de riesgo de la extremidaden Infecciones de Pie DiabéticoNo compromisode ExtremidadCelulitis que rodeala lesión menorA 2 cm.No signos de toxicidadsistémica.No absceso profundo,Compromisode ExtremidadCelulitis alrededorde la lesión.Mayor a 2 cm.Absceso profundo.Osteomielitiso gangrena.MANEJO DE LAS ÚLCERASNEUROPÁTICASEl nivel de experiencia y conocimientorequeridos para el manejo de las úlceras neuropáticasse encuentra en una dinámica constante.Debido a la naturaleza compleja de lasmismas, así como a las numerosas y diferentesco-morbilidades que se pueden presentar enlos pacientes con diabetes, es necesario formarun equipo multidisciplinario para su manejo,el cual debe estar conformado por: un cirujanovascular, un cirujano ortopédico, infectólogo,endocrinólogo, personal certificado enel manejo de heridas, un ortesista, y en algunospaíses existe la especialidad de la podiatría(técnicos especialistas en patologías delpie). Hay diferentes reportes que demuestranuna reducción en el número de amputacionesentre el 50% y el 80%, cuando se cuenta coneficientes equipos multidisciplinarios (36, 37).Los beneficios en el apoyo de este equipomultidisciplinario son tanto para los pacientescomo para los integrantes del mismo. Dentrode los beneficios para los primeros destacan:la reducción en el tiempo de abordaje e intervenciónpara mejorar el estado circulatorio, lareducción en el tiempo de curación, en el iniciode una terapia antibiótica y en una mejorcalidad de vida, aunado con el desarrollo de unprograma de prevención. Los beneficios paralos médicos son: la posibilidad de formar ycoordinar un equipo de especialistas en el manejode pacientes con co-morbilidades complejas,el incremento en el número de pacientesreferidos a los que se puede ayudar, laidentificación como una Institución académicalíder y el poder contar con una infraestructuracapaz de desarrollar estudios clínicos, cadavez con mayor rigor científico.Una vez formado el equipo multidisciplinario,se debe realizar un adecuado controlglucémico, tratar las afecciones presentes, haciendohincapié en la necesidad de emplear ono antibióticos y posteriormente, se procedea prevenir y disminuir las zonas de alta presiónen la extremidad mediante el uso de apósitoshidrocelulares, retiro del tejido hiperqueratósicoque rodea característicamente a la lesión.En todo este proceso, se debe realizar ademásun adecuado control del dolor, para lo cualexisten diferentes alternativas.En la actualidad, no existe una terapia quecontrarreste el daño de la microvasculaturaque es la causante de la neuropatía, sin embargoexisten estudios clínicos que demuestranen sus resultados preliminares, que con eluso de Prostaglandinas aumenta significativamenteel flujo sanguíneo en las extremidadesinferiores, con lo que se mejoran los síntomasconsiderablemente.
56 ■ PIE DIABÉTICOEn el manejo de la úlcera, se siguen losmismos procedimientos que el tratamientode heridas en general: 1) tratamiento agresivoy extenso de la infección, 2) establecer siexisten datos de insuficiencia arterial y si esnecesario realizar algún procedimiento derivativoo reparación endovascular, 3) liberartodo tipo de presión sobre la úlcera, y 4) mejorarlas condiciones de la herida mediantedesbridaciones, uso de apósitos hidrocelulareso diferentes productos especializadospara el manejo avanzado de heridas, que encada vez tienen mayor diversidad y calidad(38). Figura 3.A B CD E FG H IFig. 3. Secuencia del tratamiento en caso de úlcera neuropática infectada (A), desbridación y amputaciónpor compromiso óseo (B, C, D), aplicación de apósitos hidrocelulares (E), granulación (G) y cicatrización(H,I).
ÚLCERA NEUROPÁTICA ■ 57La desbridación de la úlcera y de las callosidadesson un proceso integral en el manejo delas úlceras neuropáticas. Los beneficios queel médico busca incluyen el remover el tejidodesvitalizado, atacar las bacterias, estimular losfactores de crecimiento, remover el tejido proliferativono migratorio. Estos métodos de desbridaciónhan cambiado con el paso del tiempo,la quirúrgica se realiza tantas veces sea necesario,dependiendo de la formación de nuevo tejidonecrótico; también tenemos la opción derealizar la desbridación de manera enzimáticacon el uso de hidrogeles, apósitos hidrocelulares,etc. Existen ocasiones específicas en las queva a ser necesario realizar primero un procedimientode revascularización arterial, ya sea pormedio de una derivación quirúrgica o «by-pass»o, mediante el uso de terapia endovascular, paraposteriormente realizar la desbridación quirúrgicaó amputación menor. Figura 4.ABCFig. 4. Derivación distal con vena (A), Terapia endovascular a nivel dorsal y de vasostibiales (B), Evolución de Úlcera isquémica infectada, posterior a revascularizacióny adecuada granulación del lecho quirúrgico (C).
58 ■ PIE DIABÉTICOEn un estudio realizado por la doctoraArora y colaboradores, cuyo propósito eraevaluar el efecto de una revascularización exitosasobre la microcirculación, se demostróque el efecto fue favorable; sin embargo, estamejora en la microcirculación no alcanzabalos mismos niveles observados en los pacientesno diabéticos; por lo tanto, los pacientescon neuropatía diabética están en riesgo dedesarrollar una nueva ulceración ó en ocasiones,se va a ver alterado el proceso de cicatrizacióna pesar de haberse restablecido el flujoen las arterias de mediano a mayor calibre(39). Por tal motivo, existen otros autores quejustifican el uso de heparinas de bajo pesomolecular en estos pacientes, quienes aparentementepresentan una mejor evolución (40).En otros casos, todas las úlceras con celulitisextensa y/o osteomielitis, deberán serdesbridadas y manejadas con antibióticos parenterales.Los pacientes con úlceras que clínicamenteno muestran aspectos de infección,no deberían recibir terapia antibiótica.No hay evidencia que demuestre el uso dealgún tipo de apósito sea superior a otro para eltratamiento de las úlceras. En la actualidad existenmúltiples opciones que podemos utilizar enforma local. El incremento en la resistencia bacterianaa los antibióticos, ha originado que losclínicos cambien su opinión acerca de su uso enforma tópica. Existe una baja aceptación encuanto al uso de antibióticos tópicos en el casode úlceras neuropáticas infectadas, debido a quese puede crear resistencia bacteriana.Cuando nos enfrentamos a una úlcera queno muestra datos de mejoría después de ochosemanas, será necesario una reevaluación deltratamiento para asegurarse si es o no el adecuadoy deberá considerarse la toma de unabiopsia para descartar un proceso maligno. Si labiopsia es negativa y el tratamiento efectivo, laprincipal razón de esta falla en la cicatrizaciónserá la negatividad del ambiente celular, lo cuales una característica de las úlceras crónicas. Enesta circunstancia, se debe considerar el usode auxiliares de cicatrización (regenerador dela matriz celular, terapias de presión negativa,estimuladoras de angiogénesis, inhibidores deproteasas, etc.) para cambiar el medio celular ysea más factible la cicatrización.En términos generales, los factores que vana predecir que una úlcera vaya a sanar o no seránsu tamaño, su tiempo de evolución y el gradoque tenga la misma. Para establecer el gradode una úlcera neuropática utilizamos la siguientela tabla: (Tabla IV).Tabla IVEscala del Gradode una Úlcera Neuropática1. Engrosamiento parcial con involucro sólo dela dermis y epidermis.2. Engrosamiento completo y afección de tejidosubcutáneo.3. Grado 2 + exposición de tendones,ligamentos y articulación.4. Grado 3 + absceso y/o osteomielitis.5. Grado 3 + tejido necrótico.6. Grado 3 + gangrena del tejido alrededor.PREVENCIÓNLa prevención de las lesiones cutáneas enlos pacientes diabéticos es el objetivo principalpara evitar una amputación, así como parallevar una buena evolución de la morbi-mortalidad.La EDUCACIÓN es la base para laprevención de esta patología, la cual debe serrelevante, simple, completa y útil para que elpaciente conserve su funcionalidad. Es necesarioque los pacientes sepan cuándo deben deacudir con el médico (si se presenta algúncambio de coloración, tumefacción, herida ócuando el autocuidado no pueda llevarse acabo). Existen autores quienes que proponenademás de la educación, ésta se combine conuna terapia de comportamiento (41).En una revisión bibliográfica con temas dela prevención para la formación de úlcera neuropática,se encontraron 13 estudios aleatorizadosen los que se destaca a la auto mediciónde la temperatura del pie como el métodomás sencillo y eficaz para evitar la formaciónde una úlcera (42).Ya hemos mencionado anteriormente laimportancia de formar un grupo multidiscipli-
ÚLCERA NEUROPÁTICA ■ 59nario, con diferentes especialistas, por lo quetambién debe ser incluido en el proceso de laprevención. El Dr. Sumpio y colaboradoresenumeraran cuales serían los requerimientosmínimos para contar con un adecuado centrode atención de los pacientes (43). Señala ochoposibilidades, que se enumeran:1) Posibilidad para realizar un estudio hemodinámicoy anatómico vascular con revascularizaciónen caso necesario.2) Posibilidad para realizar una evaluaciónbiomecánica y podiátrica con intervenciónquirúrgica en caso necesario.3) Posibilidad para realizar una evaluaciónneurológica periférica.4) Posibilidad para realizar una evaluación dela úlcera, categorización y clasificación.5) Posibilidad para realizar una desbridacióno incisión quirúrgica.6) Posibilidad para iniciar y modificar la terapiaantibiótica en base a cultivos.7) Posibilidad para realizar un adecuado seguimientoy evaluación del riesgo para desarrollaruna úlcera.8) Posibilidad de reducir el riesgo de una nuevaulceración e infección mediante mecanismosprotectores.Finalmente, se insiste en el establecimientode un programa de auto-revisión cotidianade los pies, con la identificación de problemas(cambios de coloración, tumefacción,heridas, callosidades, dolor o falta de sensibilidad),la utilización de un calzado adecuado,liberar las zonas de presión, higiene diaria,mantener la piel bien hidratada, cuidadode las uñas y llevar un adecuado control glicémicoson los principios básicos para unaadecuada prevención.CONCLUSIONESLa diabetes mellitus ha presentado un granincremento en el último decenio. Del mismomodo, existe un considerable progreso tantoen la investigación, desarrollo de consensos,así como en las técnicas del tratamiento delpie diabético con los adelantos en el manejoavanzado de heridas. Sin embargo, hay todavíamucho por aprender en el campo del piediabético y sus complicaciones.Existen numerosas publicaciones donde sedemuestra que la formación de un equipomultidisciplinario, bien organizado, más la divulgacióny mejor conocimiento, puede marcarla diferencia en los resultados, evolución ycalidad de vida de los pacientes.Uno de los principales retos lo constituyela re-ulceración, la cual se presenta hasta en el60% de los pacientes que ya han presentadouna úlcera. Así, aunque existen nuevas terapiaspara mejorar la curación de una úlcera, nuevasmodalidades de diagnóstico y mejores técnicasquirúrgicas para su resolución, los compromisoseconómicos y psicológicos de unare-ulceración en el pie del diabético conti núansiendo un factor importante. El uso de un calzadoterapéutico puede jugar un papelimportante en esta estrategia, sin embargo elprogreso hacia la biomecánica del pie, la evidenciade sus resultados y prescripciones aúnson muy escasas.El uso de guías para el manejo, sólo definenun plan estratégico basado en los hallazgos,pero la provisión de una infraestructura quepermita la implementación de estas, todavía esinsuficiente.Existen nuevos retos, «lagunas» en nuestrosconocimientos y se requiere de una mayorpráctica en algunas áreas, tales como en elmanejo avanzado de heridas. Sin embargo, motivadospor el progreso y por los retos a losque nos enfrentamos, esperamos continuarprogresando en este tratamiento.BIBLIOGRAFÍA1. American Diabetes Associations (ADA): Economic costs ofdiabetes in U.S. in 2002, Diabetes Care 2003; 26(12): 917.2. Reiber GE. The epidemiology of diabetic foot problem.Diabetic Medicine 1998; 13: S6-S18.3. Most RS, Sinnock P: The epidemiology of lower extremityamputations in diabetic individuals. Diabetes Care 1983; 6:87-91.4. Krentz AJ, Acheson P, Basu A, Kilvert A, Wright AD, NattrassM: Morbidity and mortality associated with diabetic footdisease: a 12-month prospective survey of hospital admissionsin a single U.K. centre. Foot 1997; 7: 144-147.
60 ■ PIE DIABÉTICO5. Ebskov B, Josephsen P: Incidence of reamputation and deathafter gangrene of the lower extremity. Prosthet OrthoticsInt 1980; 4: 77-80.6. Ramsey SD, Newton K, Blough D, McCulloch DK, SandhuN, Reiber GE, Wagner EH: Incidence, outcomes, and cost offoot ulcers in patients with diabetes. Diabetes Care 1999;22: 382-387.7. Harrintong C et-al. A cost analysis of diabetic lower-extremityulcers. Diabetes Care 2000; 23: 1333.8. Margolis D, Hoffstad O, Allen-Taylor L, Berlin J. DiabeticNeuropathic Foot Ulcer. Diabetes Care 2002; 25: 1835-1839.9. Reiber GE et-al. Causal pathways for incident lower-extremityulcers in patients with diabetes from two settings.Diabetes Care 1999; 22(1): 157.10. Boulton A et-al. The diabetic foot: of neuropathic aetiology?Diabetes Care 1999; 15: 557.11. Pecoraro R, Reiber G. Classification of wounds in diabeticamputees. Wounds 1990; 2: 65-69.12. Levin M. Management of diabetic foot: preventing amputation.South Med J 2002; 95(1): 10.13. Driver V, Landowski M, Madsen J. Neuropathic wounds: Thediabetic wound. En Bryan R & Nix D: Acute & ChronicWounds. Current Management Options. Ed 3th. St. Louis,2007, Mosby.14. Boulton A. The Pathway to Ulceration: Aetiopathogenesis. InBoulton A, Cavanagh P and Rayman G: The Foot inDiabetes. 4th ed, England 2007. Wiley.15. Levin M. Pathogenesis and general management of footlesions. In Bowker J, Pfeiffer M: Levin And O`Neal´s TheDiabetic Foot. 6th ed, St. Louis, 2001. Mosby.16. Caselli A, et-al. The forefoot-to-rearfoot plantar pressureratio is increased in severe diabetic neuropathy and canpredict foot ulceration. Diabetes Care 2002; 25: 1006.17. Lavery L. et-al. Diabetic foot syndrome: evaluating the prevalenceof foot pathology in Mexican Americans and nonHispanic whites from a diabetes disease managementcohort. Diabetes Care 2003; 26(5): 1435.18. Jeffcoate W, Harding K. Diabetic Foot Ulcers. Lancet 2003;(361): 1545.19. Armstrong D, Todd W, Lavery W, Karkless L, Bushman T. Thenatural history of acute Charcot`s arthropathy in a diabeticfoot speciality clinic. Diabet Med 1997; 14: 357-363.20. Fabrin J, Larsen K, Holstein P. Long-term follow-up in diabeticCharcot feet with spontaneous onset. Diabetes Care2000; 23: 796-800.21. Van Baal J, Game F, Hubbard R, Jeffcoate W. Mortality associatedwith acute Charcot foot and neuropathic foot ulcer.Diabetes Care 2010; 33: 1086-1089.22. Moulik P, Mtonga R, Gil G. Amputation and mortality innew-onset diabetic foot ulcers stratified by aetiology.Diabetes Care 2003; 26: 494.23. Robins J, Strauss G, Aron D, Long J, Kuba J, Kaplan Y.Mortality rates ans diabetic foot ulcers: is it time to communicatemortality risk to patients with diabetic foot ulceration?J Am Podiatr Med Assoc 2008; 98: 489-493.24. Faglia E, et-al. Screening for peripheral arterial disease bymeans of the ankle-brachial index in newly diagnosed type2 diabetic patients. Diabet Med 2005; 22: 1310-4.25. Lavery L et-al. Practical criteria for screening patients athigh risk for diabetic foot ulceration. Arch Intern Med1998; 158(2): 157.26. Apelqvist J et-al. International consensus on the diabeticfoot. En: The Interrnational Working Group on the diabeticfoot. Amsterdam, Netherlands 1999.27. Feng Y, Schlosser F, Sumpio B. The Semmes Weisteins monofilamentexamination as screeenig tool for diabetic peripheralneuropathy. J vasc Surg 2009; 50: 675-82.28. Bowering G, et-al. Diabetic foot ulcers, pathophisiology,assessment and therapy. Can Fam Physician 2001; 47: 1007-1009.29. Zimmy S, et-al. Early detection of microcirculatory impairmentin diabetic patients with foot at risk. Diabetes Care2001; 24, 1810-1813.30. Wagner F. The dysvascular foot: a system for diagnosis andtreatment. Foot Ankle 1981; 2:64.31. WONC Society: Guidelines for management of wounds inpatients with lower-extremity neuropathic disease,WONC Clinical Practice Guideline Series 3, Glenview IL,2004.32. Lavery L, Amstrong D, Harkles L. Classification of diabeticfoot wounds. J Foot Ankle surg 1996; 35: 528.33. Oyibo S, et-al. A comparison of two diabetic foot ulcer classificationsystems the Wagner and the University of Texaswound classification systems. Diabetes Care 2001; 24: 84.34. Eneroth M, Apelqvist J, Stenstrom A. Clinical characteristicsand outcome in 223 diabetic patients with deep foot infections.Foot Ankl Int 1997; 18(11): 716.35. Lipsky B. Osteomyelitis of the foot in diabetic patients ClinInfect Dis 1997; 25: 1318.36. Edmonds M, Blundell M, Morris M, Thomas E, Cotton L,Watkins, Improved survival of the diabetic foot: the role ofa specialized foot clinic. Q J Med 1986; 60: 763-771.37. Meltzer D, et-al. Decreasing amputation rates in patientswith diabetes mellitus. An outcome study. JAPMA 2002;92(8): 425.38. Frykberg R, et-al. An evidence based approach to diabeticfoot infections. Am J Surg 2003; 186: 44S.39. Arora S, Pomposelli F, LoGerfo F, Veves A. Cutaneous microcirculationin the neuropathic diabetic foot improves significantlybut not completely after successful lower extremityrevascularization. J Vasc Surg 2002; 35: 501-505.40. Kalani M, Apelqvist J, Blomback M, Brismar K, Eliasson B,Eriksson J, et-al. Effect of Dalteparin on healing of chronicfoot ulcers in diabetic patients with peripheral arterialocclusive disease. Diabetes Care 2003; 26: 2575-2580.41. Roter D, et-al. Effectiveness of interventions to improvepatient complicance: a meta-analysis. Med Care 1998; 36:1138-1141.42. Arad Y, Fonseca V, Peters A, Vinik A. Beyond the monofilamentfor the insensate diabetic foot. A systematic reviewof randomized trials to prevent the occurrence of plantarfoot ulcers in patients with diabetes. Diabetes Care 2011;34: 1041-1046.43. Sumpio B, Armstrong D, Lavery L, Andros G. The role ofinterdisciplinary team approach in the management of diabeticfoot. J Vasc Surg 2010; 51: 1504-1506.
Manejo y cuidados de la Úlcera diabéticaBORJA MERINO, LOURDES DEL RÍO, VICTORIA GASTAMBIDE, SANTIAGO CARRERA,MARÍA ANTONIA IBÁÑEZ, JOSÉ ANTONIO BRIZUELA, VICENTE GUTIÉRREZ,MIGUEL MARTÍN PEDROSA, ENRIQUE SAN NORBERTO, NOELIA CENIZO,JOSÉ ANTONIO GONZÁLEZ FAJARDO, CARLOS VAQUEROServicio de Angiología y Cirugía Vascular. Hospital Clínico Universitario de Valladolid. EspañaCONCEPTOS Y EPIDEMIOLOGÍASe define el Pie Diabético, como unaalteración clínica de base etiopatogénica neuropáticae inducida por la hiperglucemia mantenidaen la que, con o sin coexistencia deisquemia y previo desencadenante traumático,produce lesión y/o ulceración del pie. (SEACVConsenso sobre Pie Diabético1997) (1).La prevalencia de la Diabetes Mellitus esdel 6%, aunque se estima que está infradiagnosticada,existiendo un porcentaje similar depacientes que no son diagnosticados. Ademáses la séptima causa de muerte directa en lospaíses desarrollados, sin tener en cuenta supapel en la mortalidad cardiovascular (2).Las complicaciones de la diabetes son deetiopatogenia vascular o metabólica. La úlceraen el pie diabético es una de las complicacionesmás frecuentes en las extremidades inferioresde los diabéticos, calculándose que enal menos un 15% de los diabéticos estaránpresentes (3). Su incidencia general anual esdel 2-3% (7% en aquellos pacientes con neuropatíaperiférica), y su prevalencia oscila entreel 2 y 10% (4). Se estima que alrededor del85% de los diabéticos que sufren amputacionespreviamente han padecido una úlcera.La prevalencia estimada de neuropatía periférica,factor de riesgo prevalente para el desarrollode úlcera, oscila entre el 30 y el 70%.Aproximadamente el 70-100% de las úlceraspresentan signos de neuropatía periférica. Laprevalencia de enfermedad vascular periféricaen diabéticos se ha calculado que oscila del10-20% (Consenso Internacional sobre PieDiabético 2001) (5).Analizando los datos aportados en esteapartado, se deduce la necesidad de la identificaciónde los pacientes diabéticos para realizarun correcto control metabólico de losmismos, así como un cuidado idóneo y minuciosomanejo de su pie.FACTORES DE RIESGOPARA LA APARICIÓNDE LA ÚLCERA DIABÉTICASiempre que nos encontremos ante un pacientediabético, deberemos identificar la presenciade alguno de los siguientes factores deriesgo para el desarrollo de úlcera diabética. Elespecial cuidado en estos pacientes será vitalpara evitar la progresión de las úlceras a lesionesde mayor gravedad que pudieran conllevara una infección y una consecuente amputacióndel pie. Así, los grupos de riesgo deulceración diabética serían (6,7):– Antecedentes de ulceración previa.– Neuropatía periférica: presencia desíntomas y signos de alteración de losnervios periféricos típica en pacientesdiabéticos.– Isquemia arterial crónica: la arteriopatíade los diabéticos es una arteriopatíadistal, siendo característica la calcinosisarterial.– Retinopatía diabética.
62 ■ PIE DIABÉTICO– Deformidades óseas: alteraciones estructuralesdel pie como la presencia dededo de martillo, dedos en garra, halluxvalgus, cabezas metatarsianas prominentes,situación de neuroartropatía, amputacionesu otra cirugía del pie.– Antecedentes de exceso de alcohol.– Aislamiento social: que conlleva un seguimientoinapropiado del paciente.– Ancianos de más de 70 años, con patologíaasociada y mal control terapéutico.CLÍNICA DEL PIE DIABÉTICOEn base a la etiopatogenia, y según el Consensode la Sociedad Española de Angiología yCirugía Vascular sobre Pie Diabético (1) puedenestablecerse las siguientes formas o gradosclínicos:– ÚLCERA NEUROPÁTICA, caracterizadapor úlcera en la zona de presión o deformidaddel pie, existiendo tres localizacionesprevalentes y características: primer y quintometatarsiano en sus zonas acras; y calcáneoen su extremo posterior. Son ulceracionesde forma redondeada, callosidad periulcerosae indoloras. La perfusión arterial escorrecta, con existencia de pulsos tibiales.– ÚLCERA NEURO-ISQUÉMICA, caracterizadapor necrosis inicialmente seca y habitualmentede localización laterodigital, quesuele progresar de forma rápida a húmeday supurativa si existe infección sobreañadida.Generalmente los pulsos tibiales estánabolidos y existe una neuropatía previaasociada.– PIE DIABÉTICO INFECTADO, de la queclínicamente es posible distinguir a su veztres formas, que pueden cursar de formasucesiva, pero también simultánea: celulitissuperficial, infección necrotizante y osteomielitis.• Celulitis Superficial: en un 95% causadapor un único germen patógeno gram positivo,(generalmente estafilococo aureus oestreptococo). Puede ser autolimitadao evolucionar a formas más extensas.• Infección necrotizante: afecta a tejidosblandos y es polimicrobiana. Cuandose forman abscesos, el proceso puede extendersea los compartimentos plantares.• Osteomielitis: de localización preferenteen primero, segundo y quinto dedo,que suele cursar de forma sintomática,aunque a veces los síntomas pueden faltar,siendo a veces difícil el diagnóstico diferencialcon formas no sépticas. En estesentido, la exteriorización ósea en la basede una ulceración tiene un valor predictivodel 90%.– ARTROPATÍA NEUROPÁTICA, caracterizadapor fracturas espontáneas que sonasintomáticas. Radiológicamente se objetivareacción perióstica y osteolisis. En sufase más avanzada o final da lugar a unaartropatía global o de Charcot, que sedefine por la existencia de la subluxaciónplantar del tarso y la pérdida de la con -cavidad medial del pie causada por eldesplazamiento de la articulación calcá -neoastragalina, asociada o no a la luxacióntarsometatarsal.ÚLCERA NEURO-ISQUÉMICADesarrollaremos a continuación las característicasde las úlceras diabéticas neuroisquémicas(8):– Son dolorosas.– Pulsos ausentes.– Presencia de márgenes irregulares.– Habitualmente localizadas en los dedos.– Callosidades ausentes o infrecuentes.– Hallazgos sensoriales variables.– Flujo sanguíneo disminuido.– Venas colapsadas.– Pie frío.– Aspecto pálido y cianótico.– No deformidades óseas.En la Tabla 1, se establece el diagnósticodiferencial entre úlceras neuropáticas y neuroisquémicas.
MANEJO Y CUIDADOS DE LA ÚLCERA DIABÉTICA ■ 63Tabla IDiagnóstico diferencial entre úlceraneuroisquémica y neuropáticaÚlcera neuropática. Úlcera neuroisquémica.Indolora.Dolorosa.Pulso normales. Pulsos ausentes.Aspeco en sacabocados. Márgenes irregulares.Localizada en la planta Habitualmente localidelpie.zada en los dedos.Presencia de callosidades. Callosidades ausenteso infrecuentes.Pérdida de sensibilidad, Hallazgos sensorialesreflejos y sentido variables.vibratorio.Flujo sanguíneo Flujo sanguíneoaumentado (shunts disminuido.arteriovenosos)Venas dilatadas. Venas colapsadas.Pie seco, caliente. Pie frío.Aspecto rojizo. Aspecto pálido,cianótico.Deformidades óseas. No deformidadesóseas.GRADACIÓN CLÍNICAEN LAS ÚLCERAS DIABÉTICASLas úlceras diabéticas también han sidoclasificadas por Wagner según su severidad:(gravedad, profundidad de la úlcera, grado deinfección y gangrena) (Tabla 2).Grado 0. Pie clínicamente normal, pero quedebido a neuropatía o deformidadesóseas se considera «pie deriesgo».Grado 1. Úlcera superficial que no afecta atejido celular subcutáneo.Grado 2. Úlcera profunda no complicada, queafecta a tendón, hueso o cápsula, perocon ausencia de osteomielitis.Grado 3. Úlcera complicada con manifestacionesinfecciosas (osteomielitis,absceso).Grado 4. Gangrena necrotizante limitada(digital, antepie, talón).Grado 5. Gangrena extensa.Tabla 2Gradación clínica de las úlceras diabéticas(Wagner)GRADO Lesión Características0. Ninguna, pie Callos gruesos,de riesgo. cabezas metatarsianasprominentes, dedos engarra, deformidadesóseas.1. <strong>Úlceras</strong> superficiales. Destrucción total delespesor de la piel.2. <strong>Úlceras</strong> profundas. Pe<strong>net</strong>ra en la piel, grasa,ligamentos pero sinafectar hueso, infectada.3. <strong>Úlceras</strong> profundas Extensa, profunda,más absceso. secreción y mal olor.4. Gangrena limitada. Necrosis de parte delpie.5. Gangrena extensa. Todo el pie afectado,efectos sistémicos.DIAGNÓSTICODE LA ÚLCERA DIABÉTICAEl diagnóstico de la úlcera diabética sebasa en 3 apartados fundamentales:a) Anamnesis: debiendo englobar los siguientesepígrafes:a) – General: antecedentes personales yfamiliares del paciente, tipo de diabetes,duración, etc.a) – Úlcera: se debe preguntar al paciente sies la primera vez que le ocurre o ha presentadoúlceras en otras ocasiones, larespuesta terapéutica previa, presencia ono de dolor, etc.a) – Control de glucemias: glucemias previas,pauta de insulina empleada, etc.a) – Otros: comorbilidad y patologías asociadas,tratamiento habitual, dieta, etc.b) Exploración Física: abordando los siguientesapartados, con el fin de diferenciarfundamentalmente:b) – Úlcera: valorando la presencia o no deexudado, profundidad, morfología de los
64 ■ PIE DIABÉTICObordes con el fin de delimitar el tipo deúlcera en función de sus características.b) – Neurológico: valorando la sensibilidad anivel del pie, uso del Monofilamento deSemmes-Weinstein para detectar la pérdidade la sensibilidad protectora.b) – Vascular: determinar la presencia o node pulsos distales en el paciente diabéticoasí como la realización del Índice tobillo/brazocon el fin de descartar elcomponente isquémico de la úlceradiabética.b) – Artropático.c) Pruebas complementariasc) – Pruebas de Laboratorio (sistemático ybioquímica): deben realizarse de formarutinaria, con determinación del perfilmetabólico y valorando la función renal.c) – Radiología de pie: tiene su relevancia enestadios avanzados con el fin de descartarosteomielitis.c) – RNM: validez en el diagnóstico de infecciónde tejidos blandos y/o osteomielitisen el pie.c) – Otros: Microbiología (cultivo de exudados).TRATAMIENTO DE LA ÚLCERADIABÉTICALa recomendación número XIV del Consensode la Sociedad Española de Angiología yCirugía Vascular sobre Pie Diabético (1) establece,con un nivel de evidencia tipo 1 que «lacorrección metabólica, el control de los factoresde riesgo y el reposo funcional de la zonaafectada constituyen las medidas básicas esencialesen el tratamiento del pie diabético».Así, y en consecuencia, el tratamiento de laúlcera diabética debe ser multidisciplinar,constituido por un equipo en el que tengancabida médicos de atención primaria, angiólogosy cirujanos vasculares, personal de enfermería,podólogos y rehabilitadores. Se trata deuna cadena asistencial en la que cada eslabónes imprescindible.Es fundamental concienciar al paciente deque en cuanto note una úlcera, busque atenciónprofesional de inmediato. Las úlceras enlos pies de pacientes con diabetes se debentratar por varias razones tales como, reducirel riesgo de infección y amputación, mejorar lafuncionalidad y la calidad de vida y reducir elcoste de la atención médica.El principal objetivo del tratamiento de lasúlceras en el pie es lograr la cicatrización tanpronto como sea posible. Cuanto más rápidasea la cicatrización, menor será la probabilidadde infección.Así, podemos decir que las bases para realizarun tratamiento adecuado de la úlcera delpie diabético son:– Evitar la infección: siendo de vital importanciaevitar la evolución a mal perforanteplantar o gangrena. Para ello, es clave mantenerla úlcera limpia y vendada.– Quitar presión a la zona, lo que se conocecomo «descarga»: es preciso para lograr unacicatrización óptima. Se deben «descargar» lasúlceras, en particular las de las plantas de lospies, pidiendo a los pacientes que usen calzadoespecial, un aparato ortopédico, escayolasespecializadas, o una silla de ruedas o muletas.Estos dispositivos reducirán la presión y lairritación en la zona de la úlcera, acelerando elproceso de cicatrización.– Desbridamiento de piel y tejidos que esténnecróticos y dificulten el proceso de cicatrización.– Aplicación de apósitos a la úlcera, limpiándoladiariamente. Para un tratamiento óptimo,deberían aplicarse gasas con suero fisiológicosobre la úlcera recambiándolas cada 6 horas.– Control de la glucemia y patología asociadaa la diabetes.– Oxigenoterapia hiperbárica: aumenta lasdefensas inmunológicas, activa la insulinaendógena, estimula la cicatrización y disminuyela hipoxia tisular, siendo una alternativaóptima en los pacientes con úlcera diabética,con efectos terapéuticos duraderos.Su elevado coste y baja disponibilidad en loshospitales limitan su empleo generalizado.– Revascularización: en el caso de aquellas úlcerasque presenten un componente isquémico,empleándose técnicas quirúrgicasconvencionales o técnicas endovasculares.
MANEJO Y CUIDADOS DE LA ÚLCERA DIABÉTICA ■ 65PREVENCIÓN DE LA APARICIÓNDE ÚLCERAS EN EL PIE DIABÉTICOSegún el Consenso de la Sociedad Españolade Angiología y Cirugía Vascular sobre PieDiabético (1), se establecen como recomendacionespara la prevención:1. Inspección diaria del pie para detectarlesiones ampollosas, hemorragias, maceracioneso escoriaciones interdigitales. Sedeberá utilizar un espejo para la inspecciónde planta y talón.2. Antes de proceder a calzar el zapato, inspeccionarcon la mano su interior paradetectar resaltes, costuras con rebordes,o cuerpos extraños, que deberán sereliminados.3. El Calzado idóneo es aquel que cumplecuatro principios básicos:-Absorción de la carga mediante plantillaselásticas.-Ampliación de la carga por distribuciónde la presión en mayor área.-Modificación de las zonas de apoyo conflictivas.-Aportación de amplia superficie.Por ello debe ser extraprofundo y ancho,se asociará a plantillas blandas para distribuirla presión y si existe deformidades seasociarán a ortesis rígidas para disminuiry distribuir las presiones anormales.4. Las zapatillas de deporte con estas característicasson las más adecuadas para lospaseos.5. Cambiar los calcetines y los zapatos dosveces al día.6. No caminar nunca sin calzado. Utilizarzapatillas amplias en lugares como playasy piscinas.7. No utilizar nunca agua caliente o almohadillaseléctricas para calentar los pies.8. No autoeliminar callosidades, acudir alpodólogo.9. No apurar el corte de las uñas, sino hacerlode forma recta y limarlas suavemente.10. Lavar los pies con agua y jabón durantecinco minutos. Proceder a un buen aclaradoy exhaustivo secado sobretodo entrelos dedos.11. Antes de utilizar agua caliente en la higienede los pies, medir la temperatura delagua con el codo.12. Aplicar crema hidratante después del baño.13. Notificar a su enfermera o médico lasanomalías en su pie aunque estas seanindoloras.BIBLIOGRAFÍA1. Marinel-lo J, Blanes JI, Escudero JR, Ibáñez V, Rodríguez J;Consenso de la Sociedad Española de Angiología y CirugíaVascular sobre Pie Diabético Angiología.1997; 49:193-230.2. Centers for Disease Control. Diabetes. A serious healthproblem. In A. Glance 2000. Atlanta: Centers for DiseaseControl and Prevention; 2000.3. Frykberg RG, Habershaw GM, Chrzan JS. Epidemiology ofthe diabetic foot: ulcerations and amputations. In Veves A,ed. Contemporary endocrinology: clinical managementof diabetic neuropathy. Totowa, NJ: Humana Press; 1998.p. 273.4. Abbott CA,Vileikyte L,Williamson S, Carrington AL,Boulton AJM. Multicenter study of the incidence and predictiverisk factors for diabetic neuropathic foot ulceration.Diabetes Care 1998; 21: 1071-5.5. International Working Group on the Diabetic Foot.International Consensus on the Diabetic Foot. TheNetherlands, 1999.6. Grupo de Trabajo sobre <strong>Úlceras</strong> Vasculares de la A.E.E.V.Consenso sobre úlceras vasculares y pie diabético de laAsociación Española de Enfermería Vascular (A.E.E.V.).Asociación Española de Enfermería Vascular 2004.7. Rodríguez JA, MD, FACS, Phoenix A Z. Manejo de las ulcerasen el pie diabético. The Cardiovascular MultimediaInformation Network. Febrero de 2007.8. Asociación Española de Cirujanos (AEC), SociedadEspañola de Angiología y Cirugía Vascular (SEACV),Sociedad Española de Medicina Interna (SEMI), SociedadEspañola de Quimioterapia (SEQ). Documento de consensosobre el tratamiento antimicrobiano de las infeccionesen el pie diabético. Angiología 2008; 60: 83-101.
Curas del pie diabéticoEVA M.ª MARTÍN, ALEJANDRO DELGADO, ÁNGEL DUATO Y JOSÉ MIGUEL AZCONAServicio de Angiología y Cirugía Vascular. Hospital Clínico Lozano Blesa. Zaragoza. EspañaEl pie diabético presenta lesiones crónicas,tórpidas, de origen etiopatogénico diverso(neuropatía, isquemia, infección, alteracionesóseas), casi siempre mixto, que dificultansu tratamiento y prolongan su evolución.Es prioritario reconocer todos estos factorese identificarlos para actuar sobre elloscuando sea necesario, para que las curas localestengan éxito. La valoración continua porparte de su médico, junto con el personal deenfermería, que habitualmente realiza lascuras locales, es fundamental para evitar elfracaso terapeútico, que abocará en la amputaciónmenor o mayor del pie diabético.La localización, extensión, profundidad,existencia de celulitis o flemones, osteítis, esdecir, el grado de afectación clínica será el factorprincipal a la hora de elección de los diferentestratamientos a realizar, variando éstosen función de la respuesta terapeútica obtenidaen cada momento.En los grados clínicos de menor afectación(I y II de Wagner) el tratamiento local sepodrá realizar de forma ambulatoria, mientrasque en los estadíos más severos (III y IV) elpaciente precisará ingreso hospitalario, tantopor el tipo de tratamiento local como sistémico.En el grado I, úlcera superficial, se recomiendareposo absoluto del pie lesionado,limpieza diaria, la utilización de diversos apósitos,o de factores de crecimiento o productoscon colágeno, como se comentará posteriormente.En el grado II, úlcera profunda, se recomiendadesbridamiento quirúrgico asociadoal desbridamiento enzimático o autolítico.Ante signos de infección asociar apósitos conplata. Si no evoluciona satisfactoriamente, aso-ciar antibióticos por vía sistémica tras muestrade cultivo y antibiograma.En los grados III y IV, el paciente debe deser hospitalizado, para realizar desbridamientoquirúrgico y/o amputación menor o drenajede absceso, tratamiento antibiótico sistémico,y evaluación de tratamiento revascularizador.El tratamiento local de la úlcera tienecomo objetivo principal: eliminar el tejidonecrótico, controlar la carga bacteriana, controldel exudado y facilitar el crecimiento deltejido sano. (1-5)LIMPIEZALa limpieza de las heridas es una fase quetiene una gran importancia, aunque frecuentementeno se le da y se realiza de una maneramecánica.Una correcta limpieza va a tener una relacióndirecta con la optimización de las condicionesnecesarias para la cicatrización y asíFig 1. Limpieza de la lesión con suero fisiológico.
68 ■ PIE DIABÉTICOdisminuir el peligro de infección, ya que con lalimpieza, se retiran microorganismos y materialnecrótico presentes en el lecho.Existen una serie de recomendacionespara la limpieza de úlceras:• Se deberá limpiar al principio del tratamientoy durante cada cambio de apósito.• Utilizar la mínima fuerza mecánica, ejerciendola presión suficiente para facilitar el arrastrede detritus, sin causar trauma en el lecho.• Se debe utilizar solución salina isotónica atemperatura ambiente, realizando el secadoposterior con la mínima fuerza para no dañarel nuevo tejido.• No limpiar las heridas con productos limpiadoreso agentes antisépticos, como por ejemplo:povidona yodada, yodóforos, solucionesde hipoclorito sódico, peroxido de hidrógenoy ácido acético, por su reconocida toxicidad yagresividad con los granulocitos, monocitos,fibroblastos y tejido de granulación.DESBRIDAMIENTO (6,7)Se hará si existe necrosis o esfacelos yaque son: caldo de cultivo para infecciones, inicianuna respuesta inflamatoria y retrasan lacuración al representar una barrera mecánicapara el tejido de granulación.El tipo de desbridamiento se decide enfunción del tipo, calidad, profundidad y locali-Fig. 2. Material básico para el desbridamiento quirúrgico.zación del tejido necrótico, así como del estadogeneral del paciente, pero es un pasoimprescindible para tener aspiraciones a lacuración de este tipo de lesiones crónicas.Existen diferentes tipos de desbridamiento,que en muchas ocasiones pueden combinarsepara hacer más eficaz y rápido el proceso:– QUIRÚRGICOS: Constituye el métodomás rápido para eliminar áreas de escarassecas, gruesas, extensas, adheridas a planosprofundos o de tejido necrótico húmedo. Enosteomielitis y fascitis plantar puede ser elmétodo indicado de entrada.Se realiza en una sola sesión por un cirujano,en quirófano, bajo alguna técnica anestésicao de sedación, con pinzas y bisturí o tijera.Su coste es elevado, pero su rapidez puedecompensar este inconveniente.Dentro de este apartado podemos incluirel Desbridamiento Cortante, reservando esteconcepto al procedimiento que normalmenterealiza el personal de enfermería a pie decama, retirando el tejido desvitalizado, conmaterial estéril, pinzas y bisturí o tijera, extremandolas medidas de asepsia, puesto que seproduce una fase de especial proliferaciónbacteriana.Está indicado ante tejido necrótico nomuy extenso, zonas hiperqueratósicas típicascomo en el mal perforante plantar, lesionessecas o con exudado abundante maloliente.Habrá que preveer los posibles riesgos dedolor, hemorragia, que se pueden solventaraplicando previamente algún anestésico localy la utilización de hemostáticos locales. Serecomienda una formación específica querequiere de conocimientos, habilidades, actitudesy destreza por parte del personal quelo realice.– MECÁNICOS: Es el menos utilizado, yaque es traumático y poco selectivo, y en ocasionespuede arrastrar tejido sano.Se basa en la eliminación de tejido desvitalizado,mediante fuerzas físicas, utilizando laabrasión mecánica, incluyendo el uso de apósitoshúmedos-secos, hidroterapia o el uso dedextranómeros (Debrisan®).
CURAS DEL PIE DIABÉTICO ■ 69Fig. 4. Instrumental básico para el desbridamientocortante.Su poder de absorción es más lento que elde los hidrocoloides, por lo que suelen requerirvarias aplicaciones para obtener un desbridamientoeficaz.Indicada en úlceras superficiales, que nopresenten signos de infección o previo al desbridamientoquirúrgico.Fig. 3. Desbridamiento quirúrgico con amputaciónabierta del 1.º dedo del pie.– ENZIMÁTICOS: Se realiza mediante laaplicación tópica de enzimas (proteolíticos,fibrinolíticos) que inducen la hidrólisis del tejidonecrótico superficial.No suelen ser muy eficaces para eliminarescaras muy endurecidas o grandes cantidadesde material necrosado de capas profundas.Fig. 5. Desbridamiento cortante con cucharilla yresultado.
70 ■ PIE DIABÉTICOLas curas se deben realizar al menos cada24 horas, limpiando la herida previamente consuero fisiológico.Pueden causar irritación de la piel perilesionaly no deben utilizarse durante la fase degranulación.Las enzimas más utilizadas en la actualidadson las siguientes:Colagenasa (Iruxol®)El principio activo es una colagenasa clostridiopeptidasaA específica, obtenida del cultivodel Clostridium histolyticum, y que noafecta a las células intactas o tejidos.Promueve y protege la formación denuevo colágeno.Actúa en condiciones fisiológicas de temperaturay pH neutro, y su acción puede inhibirsepor diversas sustancias (cloruro de benzalconio,nitrato de plata).En tratamientos prolongados puede obser -varse sensibilización.Estreptodornasa y EstreptoquinasaSon enzimas obtenidos de cultivos deestreptococos hemolíticos.La estreptodornasa licúa las nucleoproteínasde las células muertas y la estreptoquinasaactiva el plasminógeno en plasmita.Tripsina y QuimotripsinaSe obtienen a partir del páncreas demamíferos.Reducen la inflamación de tejidos blandosy el edema asociado a heridas quirúrgicas ytraumáticas.DesoxirribonucleasaFragmenta el ADN, por lo que hace quelos exudados sean menos adherentes.FibrinolisinaDegrada la fibrina y otras proteínas plasmáticasa subproductos solubles no reabsorbibles,sin actuar sobre el colágeno.Puede inducir algunas reacciones alérgicas.Hidrogeles combinados (Intrasite® gel)Se trata de un polímero de carboximetilcelulosa,que favorece la autolisis celular ehidrata.Arrastra esfacelos y bacterias, siendo sumecanismo muy lento.Fig. 6. Cura de úlcera con colagenasa (Iruxol®) encapa fina.UrokinasaSe ha mostrado muy eficaz como fibrinolíticoen el tratamiento de las trombosisarteriales y venosas de distintas localizaciones,así como en el manejo de la organizaciónfibrosa de trasudados en cavidadescerradas.Se ha utilizando tradicionalmente en basea su capacidad activadora del plasminógeno ypor tanto con finalidad fibrinolítica.Existen otras acciones ligadas a su mecanismode acción:– Acción proliferativa.– Acción antiinfecciosa: disminuye la dura-
CURAS DEL PIE DIABÉTICO ■ 71– AUTOLÍTICOS: Consiste en aplicar unapósito oclusivo que al crear un ambientehúmedo y anóxico favorece la eliminacióndel material necrótico por la actuación deenzimas, macrófagos y neutrófilos.Indolora y atraumática, con una acciónmás lenta, pero la cura en ambiente húmedoa demostrado mayor efectividad clínica y rentabilidadque la cura tradicional.Existen numerosos apósitos para la realizaciónde la cura húmeda, debiendo de elegirel más apropiado en cada caso, según la localizacióny tipo de lesión, lo que indica quetodavía no existe el apósito ideal para estetipo de lesiones.Fig.7. Úlcera tras amputación transmetatarsiana.Cura con carboximetilcelulosa+plata (Aquacel®Plata) y apósito de poliuretano (Tegaderm®).ción de la infección de la herida quirúrgica,consiguiendo una conversión bacteriológicatemprana.– Acción pro-angiogénica: existe en diversosestudios una granulación acelerada de lasheridas no infectadas y un claro estimulode la angiogénesis.Alginatos: (Algisite®, Algosteril®, SeasorbSoft®, Sorbsan®, Solbalgón®, Tegagen®).Derivados de las algas naturales, son polisacáridosnaturales formados de la asociaciónde los ácidos gulurónico y manurónico. Labase es una fibra de alginato cálcico. Absorbenexudado o líquido seroso y reaccionan químicamentecon él para formar un gel hidrófilo.Crean un ambiente húmedo y caliente enel lecho de la herida, aportándole condicionesideales para que se produzca el proceso decicatrización.Indicados en heridas de moderada-altaexudación, algunos autores también refierensu utilidad en heridas infectadas y heridas conmal olor. Debido a su gran capacidad deabsorción algunos apósitos hidrocoloides yalgún hidrogel incorporan este producto paracomplementar sus propiedades.Los alginatos cálcicos son productos noantigénicos, hemostáticos y bioabsorbiblesque presentan una cierta actividad antibacteriana.Poliuretanos: Laminares-Espumas(Tegaderm®, Bioclusive®, Epiview®,Hidrofilm®, Op-site®, Mepilex®):Lámina o película plástica fina de poliuretanoadhesivo. Son flexibles, lavables e impermeablesa bacterias, pero no absorben exudado.Son generalmente transparentes y semioclusivos.
72 ■ PIE DIABÉTICObasadas en la carboximetilcelulosa u otrospolisacáridos y proteínas (pectina, gelatina,poli-isobutileno).Pueden ser apósitos semipermeables(impermeables a los gases) u oclusivos(impermeables a los gases y líquidos).Las sustancias hidrocoloides junto con elexudado de la lesión crean un gel que mantieneun ambiente húmedo que favorece lacicatrización y protege de la infección.Mejoran la epitelización y favorecen laproliferación de nuevos vasos sanguíneos enel tejido de granulación.A diferencia de los anteriores, no estárecomendado en lesiones infectadas.Sus indicaciones son úlceras sin signos deinfección y con ligera a moderada exudación.Ocasionalmente pueden producir reaccionesalérgicas.Fig. 8. Mal perforante plantar. Cura con lámina depoliuretano (Mepilex®).Crean un ambiente húmedo en la heridaque estimula la regeneración tisular y acelerala curación.Se utilizan en úlceras relativamente superficiales,con exudado mínimo o nulo y tambiénpara prevención de las mismas.Si se comparan con los hidrocoloides,algunas espumas son más absorbentes y causanmenos escapes, siendo su manipulaciónmás fácil, si bien, su efecto cicatrizante esmenor que el de los hidrocoloides.Hidrocoloides: (Alione®, Algoplaque®,Aquacel®, Askina Ulcuflex®, Askina Sorb®,Biofilm®, Comfeel Plus Extra Absorbente®,Comfeel Plus Transparente®, Hidrocoll®,Physiotulle®, Sureskin®, Varihesive GelControl®, Versiva®, Urgotul®):Existe una gran variedad de apósitoshidrocoloides con diferentes composicionesHidrogeles: (Askina Gel®, Purilón Gel®,Varihesive Hidrogel®, Nugel®, Geliperm®,Hydrosorb®, Intrasite®, Norm-Gel®, Hyper-Gel®):Existen dos tipos: los hidrogeles amorfos ylos apósitos en láminas.Su composición es fundamentalmenteagua más sistemas microcristalinos de polisacáridosy polímeros sintéticos muy absorbentes.Los hidrogeles están diseñados para eldesbridamiento de tejido necrosado y conesfacelos, logrando una serie de condicionespara una cicatrización eficaz de las heridas,sobre todo los amorfos.Sin ser oclusivos, hidratan y alivian eldolor. Precisan de un apósito secundario defijación.También esta destinado para heridas enfase de granulación y epitelización.Hidrofibras: (Aquacel®)Es un producto hecho de fibras de carboximetilcelulosa.Comparte acciones de los hidrocoloides ylos alginatos, por lo que le confiere una granabsorción.No es impermeable y requiere un apósitosecundario.
CURAS DEL PIE DIABÉTICO ■ 73Apósitos de Plata: (Actisorb®,Melgisorb Ag®, Mepilex Ag®, ComfeelPlata®, Aquacel Ag®, Biatain Ag®, Acticoat®,Arglaes®, Avance®, Katomed®, Katoxyn®,Conteet®) (8).Atendiendo a su mecanismo de acción sepueden dividir:– Liberadores de plata: liberan gradual y sostenidamentela plata iónica durante unperiodo de tiempo (minimizando la posibilidadde riesgo citotóxico sistémico).– No liberadores de plata: en los que el exudadoes absorbido por el apósito (no hayriesgo citotóxico).Son antibacterianos, no crean resistencias,no son tóxicos frente a los fibroblastos, acortanla fase inflamatoria favoreciendo la curacióny disminuyen el olor.Están indicados en lesiones colonizadascríticamente o en lesiones infectadas.El apósito debe de estar en contactodirecto con la herida, retirando previamenteel tejido seco necrótico y requieren un apósitosecundario.Generalmente se asocian con otros apósitosautolíticos y también con los apósitos decarbón activado en las lesiones malolientes.PREVENCIÓN Y TRATAMIENTODE LAS INFECCIONESEn un gran porcentaje de úlceras, existecolonización bacteriana, casi siempre polimicrobiana,que precisará tratamiento antibióticosistémico, como se trata en otro capítulo.Una limpieza adecuada y un correcto desbridamientoimpiden que ésta progrese a infecciónclínica, aunque si la lesión no evolucionafavorablemente y tras descartar la presencia deosteomielitis o celulitis, puede iniciarse un tratamientocon un antibiótico tópico. (9,10)– Antibióticos Tópicos (bacitracina, sulfadiazinaargéntica, neomicina, polimixinaB...):Pueden favorecer la aparición de resistencias,sobre todo cruzadas con antibióticossistémicos, sobreinfecciones (infeccionespor gérmenes resistentes) o reacciones desensibilidad retardada.No pe<strong>net</strong>ran en el lecho de la herida y sóloson útiles para tratar la infección superficiallocal. Aunque su utilización no ha mostradoofrecer ventajas clínicas, algunas guías recomiendan2 semanas de tratamiento conantibióticos tópicos en lesiones que nocicatrizan, o que continúan exudando despuésde 2-4 semanas de cuidados tópicoscon apósitos adecuados.– Antisépticos Tópicos (peróxido dehidrógeno, hipocloritos, ácido acético, ...):Uso controvertido debido a su acción citotóxica,ya que además de inhibir los fibroblastosbacterianos inactivan el crecimientode la célula sana, por lo cual muchos deellos están en desuso por este motivo, obien: por tener propiedades irritantes(alcohol), por lesionar el tejido de granulación(hipoclorito sódico) o porque enmascaranla lesión (violeta de genciana).Pueden utilizarse en lesiones que van a sersometidas a desbridamiento cortante, porla posibilidad de bacteriemia transitoriadurante el procedimiento. El gluconato declorhexidina al 0,05-1% es el antisépticomejor tolerado y eficaz.GRANULACIÓNY EPITELIZACIÓNUna vez que la úlcera está limpia, desbridaday desinfectada, debe mantenerse unambiente húmedo adecuado para favorecer elproceso de granulación y cicatrización.Habitualmente, uno de los métodos másempleados consiste en la aplicación de apósitossimples (secos o impregnados), apósitossemiimpermeables de poliuretano o hidrocoloides,dependiendo del tipo de lesión.Otras Terapias:Cura con Factores de Crecimiento (11-13)Son pequeños fragmentos proteicos biológicamenteactivos que pertenecen al grupo
74 ■ PIE DIABÉTICOde las citoquinas y que son producidos ysegregados ante un estímulo específico. Seencuentran en mayor proporción en las plaquetas.Estimulan la llegada y activación deneutrófilos y macrófagos a la úlcera, así comola neoangiogénesis.Se puede preparar mediante centrifugaciónde pequeñas cantidades de sangre autólogadel paciente, consiguiendo un plasma conuna concentración rica en plaquetas, próximaal 95%. Tiene el inconveniente de depender deun laboratorio hematológico próximo y de suconservación.Existen preparados comerciales como elBecaplermin (Regranex® gel), Factor deCrecimiento Derivado de las Plaquetas deorigen Recombinante Humano (rh PDGF-BB), que está producido por tecnología deDNA recombinante, mediante la inserciónde un gen para la cadena B del derivadoplaquetario de la levadura Saccharomicescerevisiae.La aplicación de los Factores deCrecimiento, debe efectuarse sobre úlcerascon unas condiciones adecuadas de cara a laacción de los mismos: limpias de fibrina yesfacelos y libres de sobreinfección.Cura con Terapia de Presión Negativa(V.A.C.: Vacuum Assisted Closure) (14-17)Es un sistema de cicatrización no invasivoy activo que utiliza una presión negativa localizaday controlada para estimular la curaciónde heridas agudas y crónicas.Su mecanismo de acción se basa en:– Reducción del edema local.– Estimula el flujo sanguíneo.– Favorece la formación de tejido de granulación.– Reducción de la colonización bacteriana.– Creación de un ambiente húmedo para lacicatrización.– Mejora la migración epitelial.– Aplica presión negativa para tensar uniformementeuna herida.Fig. 9. Úlcera extensa de talón. Cura con Terapiade Presión Negativa V.A.C.CONCLUSIONESEl método más eficaz para tratar las lesionesdel pie diabético es prevenirlas, minimizandoen lo posible los factores de riesgo, instaurandouna serie de medidas posturales,extremando la limpieza y eliminando las condicionesque favorecen su aparición.El tratamiento local de las lesiones del piediabético a de contemplar al paciente en sutotalidad y el entorno de cuidados en cada caso,sin olvidar el enfoque multidisciplinar de cirujanovascular, endocrinólogo, traumatólogo, cirujanoplástico, podólogo y médico de atención primaria,como posible coordinador de todos ellosen la mayoría de las ocasiones. (18,19)BIBLIOGRAFÍA1. Frykberg RG, Zgonis T, Armstrong DG et al. Diabetic footdisorders: a clinical practice guideline (2006 revisions):Journal of Foot and Ankle Surgery 2006; 45 (Suppl): 1-66.
CURAS DEL PIE DIABÉTICO ■ 752. Rodríguez-Olay J, Ibañez-Esquembre V, López-Palencia J. Elpie diabético: Diagnóstico y tratamiento. En: Vaquero F. ed.Tratado de las enfermedades vasculares. Barcelona: Vigueraed; 2006: 1241-51.3. Carpintero LA. Pie diabético. En: El pie diabético. Ed. Juntade Castilla y León. Valladolid; 1995: 121-32.4. Kalish J, Hamdan A. Management of diabetic foot problems.J Vasc Surg 2010; 51: 476-486.5. Fernández-Alonso L. Tratamiento del pie diabético. Analesde Cirugía Cardiaca y Vascular 2003; 9: 50-4.6. Cornell RS, Meyr AJ, Steinberg JS, Attinger CE. Dèbridementof the noninfected wound. J Vasc Surg 2010; 52(12S): 31S-36S.7. Guía Clínica: Prevención y tratamiento de las lesiones porpresión. Subcomisión de lesiones por presión del HospitalClínico Universitario Lozano Blesa. Zaragoza 2009. GuíaSalud Nº 446.8. Shu-Fen Lo, Chee-Jen Chang, Wen-Yu Hu, Mark Hayter, Yu-Ting Chang. The effectiveness of silver-releasing dressingsin the management of non-healing chronic wounds: a metaanalysis.Journal of Clinical Nursing 2009; (18) 5: 716-28.9. Candel FJ, Alramadan M, Matesanz M. Infection in diabeticfoot ulcers. Eur J Inter Med 2003; 14: 341-3.10. White RJ, Cooper R, Kingsley A. Wound colonization andinfection: the role of topical antimicrobials. BJN 2001; 10(9): 563-78.11. Wu SC, Marston W, Armstrong DG. Wound care: The roleof advanced wound healing technologies. J Vasc Surg 2010;52(12S): 59S-66S.12. Marti-Mestre FX. Factores de crecimiento y úlceras vasculares.Angiología 2005; 57: 335-43.13. DiGiovanni CW, Petricek JM. The evolution of rhPDGF-BBIn muskuloskeletal repair and its role in foot and anklefusión surgery. Foot Ankle Clin 2010; 15: 621-40.14. Lázaro-Martinez JL, March JR, Torres de Castro OG, SegoviaT, Guadalix G. eds. Guía de tratamiento del pie diabéticocon terapia de presión negativa. Madrid: Ed. CorporativasS.L.; 2007.15. Vikatmaa P, Juutilainen V, Kuukasjarvi P, Malmivaara A.Negative pressure wound therapy: a systematic review oneffectiveness and safety. Eur J Vasc Endovasc Surg 2008; 36:438-48.16. Armstrong DG, Lavery LA. Diabetic Foot StudyConsortium. Negative pressure wound therapy after partialdiabetic foot amputation: a multicentre, randomizedcontrolled trial. Lancet 2005; 366: 1704-10.17. Blume PA, Walters J, Payne W, Ayala J, Lantis J. Comparisonof negative pressure wound therapy using vacuum-assistedclosure with advanced moist wound therapy in the treatmentof diabetic foot ulcers: a multicenter randomizedcontrolled trial. Diabetes Care 2008; 31:631-6.18. Cheer K, Shearman C, Jude EB. Managing complications ofthe diabetic foot. BMJ 2009; 339:1304-7.19. Rogers LC, Andros G, Caporusso J, Harkless LB, Mills JL,Armstrong DG. Toe and flow: Essential components andstructure of the amputation prevention team. J Vasc Surg2010; 52(12S): 23S-27S.
Anestesia y pie diabéticoJUAN CARLOS ÁLVAREZ-LÓPEZServicio de Anestesia y Reanimación. Hospital Clínico Universitario de Valladolid. Valladolid. EspañaINTRODUCCIÓNLas lesiones producidas por la diabetesen el llamado «pie diabético» suponen parael paciente que lo padece una importantefuente de sufrimiento, incapacidad, disminuciónde la calidad de vida y un riesgo de laperdida de parte o de la totalidad del miembroafecto. Consecuentemente al aumentode la morbilidad, aparece un incremento dela mortalidad y de los costes socio-sanitarios.En España, la incidencia de amputacionesno traumáticas es de 46,1 por 100.000en diabéticos, siendo en población no diabéticadel 1,6.Los pacientes con diabetes mellitus, puedendesarrollar una enfermedad arterialperiférica (con mayor incidencia en el segmentoinfrapoplíteo) y una microangiopatíaque condicionan una insuficiencia vascular yque en la mayor parte de los casos se traduceen lesiones tróficas que pueden evolucionarhacia la pérdida de parte o de la totalidadde la extremidad afecta. Además de laslesiones producidas por la patología vascular,los diabéticos pueden desarrollar una neuropatía(pérdida de la función autonómica, sensitivay motora de los nervios periféricos)que condiciona la pérdida de la sensibilidadprotectora, atrofia muscular, deformidadesóseas, alteraciones biomecánicas del pie, elfracaso de los mecanismos de regulación dela sudoración que determinan la formaciónde hiperqueratosis, callos y ulceración y quepueden conducir a la amputación de parte ola totalidad de la extremidad. La neuropatíaperiférica reduce y finalmente suprime lasensación dolorosa y así muchas lesiones delpie pasan inadvertidas y el paciente acude almédico cuando están más complicados, loque explica la elevada tasa de amputaciones.La combinación de la neuropatía sensorial yla isquemia tiene efecto directo adversosobre los mecanismos de defensa del pacientediabético, haciéndoles más vulnerables alas infecciones del pie. La infección en losdiabéticos es una de las causas principales dedescompensación metabólica.El paciente diabético presenta alteraciónde múltiples órganos y sistemas entre lasque destacan las que afectan al sistema renal,cardiovascular u ocular. El pie diabético esuna de las consecuencias que sobre el sistemanervioso autónomo (polineuropatía) y elvascular (micro y macroangiopatía) produceun estado hiperglicémico mantenido. El tratamientodel pie diabético precisa la realizaciónde múltiples acciones terapéuticas queconllevan un importante dolor (curas, desbridamientos,amputaciones…) y que requierendiferentes técnicas anestésicas o analgésicaspara poderlas realizar. El empleo de losbloqueos de los nervios periféricos de laextremidad inferior para el tratamiento quirúrgicodel pie diabético, por su eficacia, sencillez,baja incidencia de efectos adversos y laescasa repercusión hemodinámica, puede serla técnica de elección para el tratamientoquirúrgico de este tipo de pacientes.RECUERDO ANATÓMICOLa inervación del miembro inferior estáasegurada conjuntamente por el plexo lumbary el plexo sacro. (Figs. 1 y 2)
78 ■ PIE DIABÉTICOFigura 1. Anatomía del plexo lumbosacro.Plexo lumbarEl plexo lumbar está formado por la convergenciade las raíces anteriores de los cuatroprimeros nervios espinales lumbares.Recibe habitualmente las fibras del 12º nerviotorácico y emite hacia el plexo sacro unarama que nace del 4º nervio lumbar. El conjuntodel plexo está situado en el interiordel músculo psoas mayor en un compartimentoaponeurótico único. En la parte altadel compartimento se originan directamenteramas terminales: nervio iliohipogástrico eilioinguinal (L1), nervio genitocrural (L1 yL2), ramas musculares para el cuadrado lumbar(T12-L4), psoas mayor (L2-L4) y psoasmenor (L1). Más lateral y distalmente, losnervios espinales L1 a L4 se dividen enramas anteriores y posteriores. Las fibras delas ramas posteriores se reorganizan y sefusionan para constituir el nervio cutáneolateral del muslo o femorocutáneo (L1-L2) yel nervio crural (L1 a L3). Las ramas anterioresconvergen para formar el nervio obturador(L2-L4).Plexo sacroEstá constituido por la unión de las ramasanteriores del último nervio espinal lumbar(L5) con los tres primeros nervios espinalessacros (S1 a S3), a los cuales se agregan doscontingentes de fibras provenientes respectivamentede las raíces anteriores del 4º nerviolumbar y del 4º nervio sacro. El contingenteprocedente de L4 alcanza la rama anterior deL5 en la proximidad de su salida del conduc-Figura 2. Distribución cutánea del plexo lumbosacro.to espinal, para constituir el tronco lumbosacro.Las ramas anteriores de los otros nerviossacros alcanzan el plexo justo por encima dela gran escotadura ciática, bajo la forma dedos láminas nerviosas. La lámina inferior, plexiformey delgada, se continúa directamentepor el nervio pudendo. La lámina superior seprolonga por el nervio ciático que deja la pelvisa ese nivel. El nervio ciático es el más grandede los nervios del organismo. En realidadestá constituido por dos nervios distintosrodeados por una vaina única, el nervio peroneocomún y el nervio tibial. Estos dos nerviosdescienden dentro de la vaina hasta eltercio inferior del muslo donde a nivel de lafosa poplítea, se dividen en las dos ramas terminales.Inervación del pieToda la inervación del pie viene recogidapor cinco ramas terminales, cuatro de ellasramas distales del plexo sacro (sural, tibialposterior, peroneo superficial y peroneo profundo),y una única rama del plexo lumbar, elnervio safeno interno (Tabla I).
ANESTESIA Y PIE DIABÉTICO ■ 79NervioCiáticoFemoralTabla I. Inervación del pie.Ramas terminalesN. tibialN. peroneo profundoN. peroneo superficialN. suralN. safenoNervio safeno. Tras salir del canal de losaductores, alcanza la rodilla por su bordeinterno (bajo el músculo sartorio). Discurresuperficialmente por la parte interna de lapierna, en íntima relación con la vena safenainterna y se divide en dos ramas al llegar a laaltura del maléolo interno. Recoge la sensibilidadde la zona cutánea interna del pie, queen ocasiones llega hasta la articulación metatarsofalángica del primer dedo.Nervio sural. Desciende pegado a lavena safena externa, por detrás del maléoloexterno del tobillo. Al sobrepasar la línea deflexión de la rodilla se incorpora al n. ciáticopoplíteo interno o tibial (mas frecuente), n.ciático poplíteo externo o peroneo común oincluso a ambos. Recoge la sensibilidad de unapequeña zona cutánea de la parte externa dela planta del pie.Nervio tibial. Atraviesa verticalmente elrombo poplíteo, pasando por debajo del arcotendinoso del soleo. Desciende todo su trayectoa través de la pierna junta los vasostibiales posteriores en el interior del compartimentoposterior de la pierna. Antes de llegaral maléolo interno de la pierna da sus ramascalcáneas y conforme desciende, a la altura delmaleolo los N. plantar interno y externo, querecogen la sensibilidad de la parte posterior,medial e interna de la planta del pie y lechoungueal.N. ciático poplíteo externo o peroneocomún. Se dirige oblicuamente hacia lacara externa del hueco poplíteo, y rodea lacabeza del peroné dividiéndose en el n. peroneosuperficial y peroneo profundo.N. peroneo superficial. Discurre superficialmentepor el borde antero-externo de lapierna tras atravesar la fascia superficial ysituarse por encima del retináculo extensor. Anivel del dorso del pie se divide en dos ramas,el nervio cutáneo dorsal medial y el cutáneo dorsalintermedio. Recoge la sensibilidad de prácticamentela totalidad del dorso del pie.N. peroneo profundo. Se introduce enel interior del compartimento anterior de lapierna inervando a toda su musculatura, asícomo a los extensores cortos. Realiza todosu trayecto pegado a la arteria pedia. Emiteramas motoras para la musculatura extensoraintrínseca del pie. Se dirige hacia la primeracomisura y da sus dos ramas digitales dorsalespara recoger la inervación de unapequeña zona cutánea entre el primer ysegundo dedo, y gran parte de la articulacióntarsiana y metatarsofalángica del 2º, 3º y 4ºdedos.La inervación sensitiva de los dedos delpie viene recogida por dos nervios digitalesdorsales procedentes del nervio peroneosuperficial y dos nervios digitales plantaresoriginados en los nervios plantar interno yexterno. Esta distribución es constante conexcepción de los nervios digitales externosplantar y dorsal del primer dedo y los internosplantar y dorsal del segundo que procedendel nervio peroneo profundo.ANESTESIA PARA LA CIRUGÍADEL PIE DIABÉTICOLos cuidados quirúrgicos del pie diabéticoincluye múltiples opciones tales como la cirugíaelectiva de técnicas para tratar deformidadesdolorosas o realizar amputaciones, cirugíaprofiláctica en la que se realizan procedimientosencaminados a reducir el riesgo de ulceración,cirugía curativa para ayudar a cicatrizarúlceras o heridas, o aquella cirugía de emergenciaque se realiza para limitar la progresiónde una infección o isquemia.Uno de los problemas más frecuentes delpie diabético son las úlceras. La mayoría de las
80 ■ PIE DIABÉTICOúlceras del pie diabético son predominantementeneuropáticas, se ubican en el antepie ysuelen tener un tamaño pequeño (1,5 cm 2 ). Apesar de su tamaño inicial poco preocupante,con un manejo adecuado, la cicatrización sealcanza sólo en el 60 a 80% de los pacientes.En el 15% de las úlceras es necesaria unaamputación menor o mayor del pie y el 4% delos pacientes muere a consecuencia de lainfección generalizada iniciada en la úlcera.Todos estos tratamientos, que suelen serdolorosos, pueden ser realizados con el concursode una anestesia general (inhalatoria,intravenosa ó ambas) o bien con diferentestipos de anestesia locorregional (a. epidural, a.intradural, bloqueos nerviosos de plexos operiféricos) (tabla II). De estas opciones anestésicas,los bloqueos periféricos (en especialel bloqueo de tobillo), ofrecen la ventaja deser sencillos y rápidos de realizar y de no produciralteraciones hemodinámicas significativas.Requieren un conocimiento anatómicopreciso de la zona, destreza para su realizacióny en algunas circunstancias pueden serrealizados por los propios cirujanos.Amputación /curas Técnica anestésicaInterfalángicaBloqueo digitalTransmetatarsiana Bl. peroneo común1-2-3 dedo + tibialTransmetatarsiana Bl. peroneoincluyendo 4-5 dedo común+tibial+ suralMediotarsiana (Chopart) Bl. tobilloTarsometatarsiana Bl. ciático poplíteo(Lisfranc)+ safenoAmputación infracondilea Bl. femoral+ ciático subglúteoEn aquellos casos de infección o edema de pieo tobillo, realizar bloqueo poplíteoTabla II. Técnicas anestésicas empleadas para lacirugía del pie.Bloqueo del tobilloEs una buena técnica anestésica para lacirugía del pie, que produce un mínimo bloqueomotor y una analgesia postoperatoriaque puede ser de 10-12 h. Tiene el inconve-niente de que para su realización precisamosrealizar 5 pinchazos, por lo que es muyimportante realizar una adecuada sedación alos pacientes. En este tipo de bloqueos, no esaconsejable utilizar soluciones anestésicasque contengan adrenalina.MaterialAgujas: Para la realización de los bloqueos,debemos emplear agujas finas de tipo «insulina»G-25 (0,5 x 16 mm), excepto para el tibialposterior que emplearemos una aguja de tipo«intramuscular» G-21 (0,8 x 40 mm), o las deneuroestimulación de 50 mm.Neuroestimulador: Solo útil para el bloqueodel n. tibial posterior.Ecógrafo: Prescindible en el bloqueo detobillo. Puede ser útil para el bloqueo del n.tibial posterior.Anestésicos locales: Mepivacaína 1%, bupivacaína0,25%, ropivacaína 0,2%, lidocaína 1%.Se recomienda no utilizar vasoconstrictores.Volumen anestésico: 10 ml para el bloqueodel tibial posterior y 5 ml para el resto de losbloqueos. No sobrepasar los 40-50 ml (límitede dosis tóxica).Bloqueo del nervio tibial posteriorEs una de las dos ramas terminales del N.tibial. Proporciona inervación para las estructurasprofundas (huesos, músculos y articulaciones)del aspecto plantar del pie así como lainervación sensitiva de toda la planta del pie.La arteria tibial posterior a nivel del maléolointerno del tobillo es la mejor referencia anatómicapara su bloqueo, situándose el nervio,en la mayor parte de las ocasiones posteriora ésta. En este tipo de bloqueo es en el únicoque tiene cabida la ecografía y/o la neuroestimulación,con la que se obtiene una respuestamotora de flexión plantar e inversión delpie.TécnicaPuede realizarse con el paciente en decúbitosupino o prono.
ANESTESIA Y PIE DIABÉTICO ■ 81Puntos de referencia: maléolo interno, tendónde Aquiles y arteria tibial posterior.Abordaje lateral: Decúbito supino, pie enrotación externa. Puncionar por detrás delmaléolo interno, posterior al pulso de la a.tibial posterior.Abordaje posterior: Decúbito prono.Punción medial al tendón de Aquiles, dirigiéndosehacia el periostio tibial.Volumen: 5-10 ml.2. Bloqueo del nervio peroneoprofundoEs la rama medial del N. peroneo común.A nivel de la articulación del tobillo se sitúaanterior a la arteria dorsal del pie. Inervaestructuras profundas (hueso, músculo y ar -ticulaciones) del aspecto dorsal del pie, e inervaciónsensitiva del borde lateral del primerdedo y el borde medial del segundo dedo.3. Bloqueo del nervio peroneosuperficialEs la rama lateral del N. peroneo común.En el tercio distal de la pierna, en el parteanterior, se hace subcutáneo, y a nivel delmaléolo medial se divide en ramas terminalesque inervan el dorso del pie y los dedos.TécnicaDecúbito supino y pierna en rotacióninterna.Referencias: Maleolo externo y bordeanterior de la tibia.Abordaje 2 cm por encima de la línea trazadaentre maléolo externo y la cara anteriorde la tibia. Realizar un rodete subcutáneo entoda ella.Volumen: 5-7 ml.TécnicaDecúbito supino.Referencias: arteria pedia y línea intermaleolar.Abordaje tobillo: 2 cm por encima de lalínea intermaleolar, lateral al tendón delextensor del 1º dedo, punción perpendiculara la piel hasta contactar con la tibia.Abordaje en el dorso del pie: por fuera deltendón extensor del 1º dedo, junto al latidode la arteria pedia.Volumen: 3-5 ml.
82 ■ PIE DIABÉTICO4. Bloqueo del nervio suralEs un nervio sensitivo formado por ramasde los n. tibial y peroneo común. Se hace subcutáneoen la parte distal de la pierna, y dainervación sensitiva a la parte lateral del tobilloy pie. A nivel de la articulación del tobillopasa por detrás y debajo del maléolo lateral.TécnicaPosición decúbito supino.Referencias: Maleolo externo, línea intermaleolary tendón de Aquiles.Realizar infiltración subcutánea entremaléolo externo y tendón de Aquiles.Volumen: 5 ml.5. Bloqueo del nervio safenoEs la rama terminal del n. femoral. Se hacesubcutáneo en la cara interna de la rodilla,continúa paralelo a la vena safena interna porla cara medial de la pierna hasta el tobillo,pasando por delante del maléolo medial.Suple de inervación sensitiva a la parte internade la pierna, tobillo y pie.TécnicaDecúbito supino, con la pierna en rotaciónexterna.Referencias: Maléolo interno y borde tibialanterior.Realizar una infiltración subcutánea, 2-3cm por encima de la línea entre el maléolointerno y el borde tibial anterior.Volumen: 5 mlBIBLIOGRAFÍA1. Bridenbaugh PO, Wedel DJ. The lower extremity: somaticblockade. En Cousins MJ, Bridenbaugh PO, editors. Neuralblockade in clinical anesthesia and management of pain. 3rded. Philadelphia, PA: Lippincott-Raven Publishers. 1998 pp:373-394.2. Hadzic A, Vloka JD. Anesthesia for ankle and foot surgery.Tech Reg Anesth Pain Manag. 1999; 3 (2): 113-1193. Monkowski DP, Egidi HR. Ankle block. Tech Reg Anesth PainManag.2006; 10 (4): 183-188.4. Enneking FK, Chan V, Greger J, Hadzic A, Lang SA, HorlockerTT. Lower-extre-mity peripheral nerve blockade: Essentialsof our current understanding. Reg Anesth Pain Med.2005;30 (1): 4–35.5. Singelyn FJ. Single-injection applications for foot and anklesurgery. Best Pract Res Clin Anaesthesiol.2002; 16: 247-2546. Chin KJ, Wong, NW, Macfarlane AJ, Chan VW. Ultrasoundguidedversus anato-mic landmark-guided ankle blocks. A6-year retrospective review. Reg Anesth Pain Med. 1011;36(6): 611-618.7. Kocum A, Turkoz A, Bozdogan N, Caliskan E, Eker EH, ArslanG. Femoral and sciatic nerve block with 0.25% bupivacainefor surgical management of diabetic foot syndrome: ananesthetic technique for high-risk patients with diabeticnephropathy.J Clin Anesth. 1010;22 (5): 363-6.8. Foote J, Freeman R, Morgan S, Jarvis A. Surgeon administeredregional blocks for day case forefoot surgery. FootAnkle Surg. 2012 18 (2): 141-3.
Open Surgery for Revascularizationof the Diabetic FoodFRANCESCO SPINELLI, FRANCESCO STILO, MICHELE LA SPADA AND DAVID BARILLÀUnit of Vascular Surgery, Department of Cardiovascular and Thoracic Sciences, University of Messina, ItalyCritical Limb Ischemia (CLI) is caused byperipheral arterial obstructive disease and isassociated with a high risk of limb loss in theabsence of revascularization. The indicationfor the treatment is based on clinical status ofpatient, lesion morphology, surgical risk, ASAclassification, life expectancy, and surgicalexperience of the centre. For the overwhelmingmajority of patients with CLI (Rutherford4-5-6) (1-3), revascularization represents thebest option. The superficial femoral andpopliteal arteries are more often affected inpatients with diabetes than is the aortoiliacsegment, so when claudication is present, it isusually experienced in the calf. Diabeticpatients with foot ulcers and gangrene areoften found to have a strong popliteal pulseand absent pedal pulse. This finding is due to ahighly prevalent pattern of predominantly tibialartery occlusive disease in diabetics. Inmost cases the peroneal artery is patent andit is the last of the three crural arteries toocclude. The primary pedal arch is almostalways incomplete, but in most cases at leasta segment of the plantar arch retains patency,if not continuity with the anterior and posteriorcirculation. Consequently, by-pass to asingle tibial or peroneal artery usually providesgood blood flow to the foot, so it portendsa high likelihood that the patient is asuitable candidate for revascularization (4).In this case of very poor run-off, bypass tothe «isolated segment» is the preferentialoption with a reasonable success rate (5-7).On the basis of actual recommendations, themorphological indications to bypass graft arerepresented principally by TASC D patients.This classification did not entail the clinicalstatus of the patients that also influences theresults and the time of healing (8).These general observations underscorethe importance of the preoperative flowchart.Firstly we have to decide which patientis indicated for EV and which one for bypassgraft. The improved resolution of dupleximaging has made this diagnostic modality thegold standard to define disease location (9).A significant advantage of this noninvasivemodality is that it yields both anatomic andblood flow information, providing an assessmentof the hemodynamic effect of arterialocclusive lesions. In some patients (redosurgery, young patients, clinical indication toEV as first-line treatment), standard arterio -graphy is still the «gold standard». The ultrasoundstudy should be preferentially performedby the same surgeon that will be theoperator. The leg should be preferentiallyexamined in hanging position to favor theidentification of very low flow in the distalvessels and to correctly measure the veinsalong their course.Since Kunlin’s first description of the successfuluse of autologous vein to bypassfemoro-popliteal arteriosclerosis obliterans(10-11), many studies have sought to determi<strong>net</strong>he best material and technique forrevascularization. Different materials havebeen used for infrainguinal bypass grafting,including autologous and homologous graftsfrom the saphenous vein or the human umbi -lical vein as well as synthetic graft materialssuch as polytetrafluoroethylene (PTFE) orpolyester (Dacron) grafts (12). There is nearuniversal agreement that autologous vein isthe best conduit for infrainguinal bypass at all
84 ■ PIE DIABÉTICOlevels (13-14). The greater saphenous vein(GSV) is the most readily available anddurable conduit. Assessment of vein availabilityand quality is critical and should be carriedout by duplex mapping, before embarking onthe operation (15). Considerable debate hassurrounded the selection of alternative conduitsin the case of absence of the greatersaphenous vein (16).GRAFT AND TECHNICAL CHOICESeveral alternatives have been reportedfor infrainguinal grafts:• In situ autologous GSV;• Reversed autologous saphenous vein;• Other veins;• Varicose veins;• PTFE;• Dacron;• Heparin Bonded PTFE;• Peculiar technical artifices;• Allograft and Xenograft;• Composite grafts;• Combined Endovascular approach.GREATER SAPHENOUS VEINAn adequate ipsilateral greater saphenousvein, when available, is the best material forarterial reconstruction (14). In the largestAmerican series (17) of above the knee (AK)(31%) and below the knee (BK) (69%) bypasswas reported a cumulative patency rate of91% at 1 year, 81% at 5 years, and 70% at 10years. The in-situ technique was used in 75%of cases with a 90% of limb salvage at 10years. Also a European randomized prospectivestudy, with 75% of BK and 97% of CLIpatients, reported at 10 years a 41.7% primarypatency, a secondary patency of 64.8%, anda limb salvage of 73.5% (6).The in-situ technique was firstly used byMay e Rob in 1960s, then for several years itwas dismissed because of the technical pro -blems related to the valves disruption, untilLeather improved the method of the veinvalvulotomy (18). The advantages of thismethod are:• Caliper of the conduit decreasing progressively,thus improving hemodynamicand congruency of the anastomosis;• Preservation of adventitial vascularization;• Absence of wall trauma, which canoccur in the ex-situ technique.An alternative use is represented by thenon-reversed technique. This method consistsin the excision of the best available segmentof vein, valvulotomy and anastomosis (19). Theadvantage should be the use of the best segmentof the vein, the possibility to perform adifferent way functional to the necessity, andto perform the proximal anastomosis at differentlevel.This technique presented an increase riskof lesion of the collateral veins (20).In all this techniques it is fundamental toavoid skin necrosis secondary to an inappropriatepreparation and sampling of the vein.The echo-duplex mapping of the vein is consideredto be mandatory.OTHER VEINSWhen an adequate length of GSV is notavailable, different autologous materials canbe used, as lesser saphenous vein (LSV),cephalic and basilic arm veins, and remnantsof the GSV.The incidence of the absence of an adequateipsilateral GSV has been reported to beas high as 40 to 45%. The absence or the nonoptimalquality of this conduit is due to previoustreatment of varicose veins, its use in aprevious bypass (e.g., coronary bypass), aninsufficient diameter, or the presence of varicosedilatation.The lesser saphenous vein may representthe best alternative, with cumulative patencyrate and limb salvage similar to the GSV (21).Although harvesting the LSV may requireplacement of the patient in the prone positionwith subsequent repositioning to the supineposition for performance of the bypass (22),
OPEN SURGERY FOR REVASCULARIZATION OF THE DIABETIC FOOD ■ 85the use of the LSV for lower extremity revascularizationwithout repositioning has beenreported (23). In our experience, we reported65% primary patency at 2 years, in case offirst revascularization.Despite inferior patency rates comparedto GSV, arm vein conduits are generally consideredusable. Lepantalo et al. (24) in a recentseries retrospectively reviewed 290 consecutiveinfrainguinal bypasses for CLI using arm aveins (130) or prosthetic graft (160) inabsence of adequate GSV. The patency ratesat 3 years were significantly better in the armvein group for the infrapopliteal revascularization.Pomposelli et al. (25) also compared theeffectiveness of all-autogenous arm veinbypass grafts (506 bypasses) with that of prostheticgrafts (234). The 1-year primary patencyrates for BK femoro-popliteal grafts were92.9% ± 5.1% (arm vein) and 83.4% ± 8.0%(prosthetic); the 3-year rates were 72.8% ±10.1% (arm vein) and 55.5% ± 12.1% (prosthetic)(P .05). The 1-year limb salvage ratesfor BK femoro-popliteal grafts were 100%(arm vein) and 91.3% ± 7.0% (prosthetic); the3-year rates were 94.7% ± 7.3% (arm vein)and 75.3% ± 14.6% (prosthetic) (P = NS).These experiences showed that arm veinsare an excellent alternative of the GSV, comparedwith prosthetic graftsA particular concern for the arm veins arethe fragility and difficulty in handling duringthe preparation. In addition, frequently, multiplesegments may be necessary to attain sufficientconduit length to perform a bypassgraft. These concerns have led several Authorsto promote the use of prosthetic grafts forarterial reconstruction.VARICOSE VEINSWe stress the use of non-optimal veingraft material to avoid prosthetic bypass,which produces bad results in terms of patencyand limb salvage. The midterm incidence offocal stenosis due to intimal hyperplasia is 20to 35%.Varicose dilation may involve an isolatedsegment or the entire vein. The basilic vein isusually thinly walled and has a large diameter;therefore, is typically prone to developaneurysm or other graft problems at a rate ofup to 55%. These situations are usually a contraindicationto autologous vein grafting dueto the increased formation of intimal hyperplasiaand dilatation which could lead toaneurism formation and thrombus apposition.Attention to this problem is crucial inyounger patients undergoing vein bypass graft.Young people have a long life expectancy, andtheir arterialized veins frequently undergoprogressive dilatation.The external sheath acts to contain thegraft, prevents turbulent blood flow, and significantlyimproves long-term patency ratescompared to unsupported grafts.Polyester external mesh is a valid methodto perform bypass with autologous material,as ectatic or varicose veins.In our experience we used external meshto prevent the dilatation of bypass in pre -sence of an ectatic or varicose autologousmaterial (26).A multifilament polyester mesh was utilizedin 21 patients (7.3%) of 289 patientstreated in the same interval of time. It was anopen, porous prosthesis with a honeycomblikestructure allowing the intraoperativeexternal scaffolding of autologous veins. Thechoice of external mesh was based on themean diameter evaluated at echo-scan.Only the suboptimal dilated tract of veinswas covered in an attempt to maintain in-situbypass whenever possible. The external meshwas fixed with some points at the anastomosisto avoid curling of the coating and possibleformation of stenosis.Primary, assisted patency, and amputationfreesurvival rates at 24 months were 57.1 %(SE ± 3.9), 81% (SE ± 3.2), and 85.7% (SE ±2.8), respectively, comparable to those of previousstudies of infrainguinal revascularizationin patients with no vein varicosities.Although the polyester mesh can beprone to infections, especially when used inCLI patients with extensive gangrene, we did
86 ■ PIE DIABÉTICOnot observe infections related to the externalmesh and to the vein graft, although somepatients already had wound infections. Ourresults demonstrated that the use of externalpolyester scaffolding for varicose or dilatedvein grafts was safe.VEIN VS. PTFEA classic randomized trial published in1986 demonstrated the superiority of veingrafts in BK revascularization, whereas the AKfemoro-popliteal PTFE bypass graft wasequivalent to the saphenous vein bypass graftfor 18 months and was not significantly inferiorthereafter (27).Klinkert et al (28) performed a systematicreview of studies comparing the patency ofsaphenous vein and PTFE as bypass materialin the AK femoro-popliteal position. Whenonly RCTs were considered, venous bypasseswere superior to PTFE bypasses at all intervalsstudied. The pooled primary graft patencyof saphenous vein and PTFE were 82.6%and 74.6% at 2 years and 76.4% and 56.1% at5 years, respectively.On the basis of these findings it has beenargued that an AK graft should be initially preferred,whenever possible, to spare the saphenousvein for a future bypass to a BK arteryin the same limb. However, this vein-sparingapproach has been unrewarding, but itremains in frequent use (29).Pereira et al. (30) estimated the long-termoutcomes after femoro-popliteal bypasses forclaudication or critical ischemia in a metaanalysisof the studies published from 1986through 2004, and confirmed that the GCVperforms better than PTFE and should beused whenever possible.The differences in results between thesetwo materials appeared to be correlated tothe clinical status of the patients.The thrombosis secondary to the use ofPTFE presented major complications, with asignificant increase of urgent redo and a lowrate of limb salvage (56% vs. 81% for veinbypass, P.019) (31). Moreover, the occlusion ofprosthetic AK in the claudicant frequentlycaused a worsening of the clinical statusdetermining a limb ischemia.PTFE VS. DACRONThe results of RCTs of Dacron vs. PTFEgrafts for femoro-popliteal bypass grafting arecontroversial.In a recent study (32) has been provided acontemporary and comprehensive summationof midterm patency rates of Dacron or PTFEgrafts in femoro-popliteal bypass grafting basedon a meta-analysis consisting only of rando -mized controlled trials. The pooled cumulativeprimary patency of Dacron and PTFE graftswas, respectively, 60.2% and 53.8% at 3 years,and 49.2% and 38.4% at 5 years. The conclusionwas that either Dacron or PTFE grafts can beused in femoro-popliteal bypass grafting withsimilar midterm primary patency.Poor prognostic indicators of graft survivalwere CLI, BK distal anastomosis, andgrafts with a smaller diameter (6 mm).Therefore the real issue remains whetherDacron or PTFE grafts should be used whenthe autologous saphenous vein is unavailable.HEPARIN-BONDED EPTFERecently, a new bioactive PTFE graft withcovalent endpoint attachment of heparin,enabling maintenance of functional heparinbioactivity, has been developed, and its effectivenessin terms of improvement of earlygraft patency has been demonstrated in anexperimental study.This material provided a primary patencynot significantly different from the saphenousvein and good long-term results, especiallyencouraging in the BK position (33).A minor platelet deposition after implantationand a reduced thromobogenicity mayhave promoted short- and long-term graftpatency. In addition, sustained heparin activitymay have mitigated the development of intimalhyperplasia.
OPEN SURGERY FOR REVASCULARIZATION OF THE DIABETIC FOOD ■ 87Pulli et al. (33) in a multicenter registryreported midterm results of infrainguinalbypasses performed in 425 patients presentingwith CLI (56% of a BK bypass and 24% ofa AK bypass). Cumulative estimated 36-monthprimary patency, secondary patency, limb salvage,and survival rates were respectively61%, 70%, 83%, and 83%. The factors associatedwith poorer limb salvage rates were thepresence of ischemic ulcers or gangrene (P.004), and the presence of only one patent tibialvessel (P < .001).Overall, these results, though not obtainedin a randomized controlled trial, provide solidadditional evidence that heparin-bonded ePTFEgrafts represent an important new option inthe treatment of peripheral arterial disease.PECULIAR TECHNICAL ARTIFICESAritifices for distal anastomosisFailure of PTFE bypass grafts to the BKlevel is thought to be a result of neointimalhyperplasia at the distal anastomosis. O<strong>net</strong>heory to account for these processes is acompliance mismatch between the prostheticmaterial and the native artery.Several adjunctive techniques have beendesigned to improve the patency rates ofprosthetic bypass grafts. These techniquesinclude the construction of a vein patch orcuff at the distal anastomosis to preventocclusion by intimal hyperplasia, and the crea -tion of a distal arteriovenous fistula (AVF) toincrease graft blood flow in high outflowresistance systems (34).A randomized prospective study with theuse of a distal anastomosis interposition veincuff, reported 2-year cumulative patency ratesof 62% for femoro-infrapopliteal grafts (35).At the BK site, this was reflected in 24-month difference in limb salvage rates of 84%vs. 62%, respectively (P .08), with a statisticallysignificant advantage when PTFE bypass graftswere anastomosed to the BK popliteal artery.Distaflo PTFE is an alternative PTFE prosthesisthat mimics a vein cuff.Pan<strong>net</strong>on et al. (36) in a multicenter randomizedprospective trial compared theresults of this pre-cuffed PTFE graft to a veincuffed graft. Bypass was a redo procedure in53% and was performed at the infrapoplitealvessels in 79%. At 1 and 2 years, primarypatency was 52% and 49% for the precuffedgroup and 62% and 44% for the vein cuffedgroup, respectively (P .53). Then the Authorsconcluded that this precuffed graft is a reasonablealternative conduit in place of thevein cuff.Vein interposition AVF proposed by Ascerhas represented an alternative method combiningsome of the aforementioned principles(37). This technique matches the use of aPTFE graft with a distal AVF and vein interpositionat the distal anastomosis, resulting incontinued prograde flow in the target arterydistal to the fistula. By this method the Authorreported a primary patency at 3 years of 65%,and 78% of limb salvage, respectively.In this series the distal arterial targetswere frequently the tibial vessels, and thistechnique was frequently used as redo procedure.We reported a similar experience with3-year cumulative patency rates of 62% and alimb salvage of 66%, respectively (38).Another possible artifice to improve theflow of distal anastomosis was described bySogaro et al. (39) that confectioned an adjunctivearteriovenous fistula by pantaloon technique.Secondary cumulative patency at 57months was 57.3% with a 61.5% limb salvagerate.Artifices for the passage of the graftSeveral aspects influence the patency of adistal bypass grafts. The passage of the graftsshould be performed far from cutaneous scar,in a deep position, eliminating structures thatcould compress the graft.The more frequent target of a distal revascularizationfor the treatment of extensivetissue loss or gangrene is represented by thedorsalis pedis artery. Approaching this arterythe extensor digitorum longus tendon shouldbe partially resect to avoid the external com-
88 ■ PIE DIABÉTICOpression of a venous bypass (total resectionshould be performed in case of completeantefoot gangrene). The passage of the graftshould be preferentially performed throughthe interosseus membrane opening a largedoor on this membrane and mobilizing a longtract of the distal arterialized vein. Also theflexor digitorum longus tendon and thesoleus aponeurosis should be resect to avoidthe compression of the vein before the passagethrough the interosseus membrane.Artifices for clampingActually, the use of ordinary clamps canresult in arterial damage, especially in endstage renal disease (ESRD) patients affectedby critical limb ischemia (CLI).The majority of patients with advancedperipheral arterial disease had a very diseaseddistal arterial <strong>net</strong>work with heavily calcifiedarteries, poor run-off, and relevant comorbidities.Consequently, bypasses were moredistal and technically demanding if comparedto the standard CLI patients.Principally in patients with end stage renaldisease the distal arteries are not compressibledue to extensive wall calcification.For several years, by performing distalanastomosis, we have been putting a clamponly on the proximal part of the target vesseland we have been applying, as Ysa et al (40), anintravenous cannula in order to occlude thedistal end of the arteriotomy in tibial andplantar vessels (41).We connected the cannula by a 20-cmlong plastic tube to a 30-mL syringe filled withheparinated (.20%) saline. The length of thetube has been useful to not hinder the suturingmaneuvers. The whole system allowed aregular flushing with heparinated saline intothe distal runoff, preventing thrombosis of thelumen in cases of poor retrograde bleeding.The size of cannulas varied according to thelumen of the artery.Despite the caliber adaptation, in few casesit was not possible to move the cannula forwardinto the artery. In these situations, wechoose to clamp the artery only proximally toFig. 1. No clamping technique for distal anastomosisat the dorsalis pedis artery.the arteriotomy and not to clamp it distally(Fig.1). In order to minimize blood loss, wepositioned the patient in an extremeTrendelenburg position, and we clamped thedistal artery by gentle external digital compression,flushing the anastomosis area bypouring saline that flowed away with the bloodthanks to the upraised position of the limb.This artifice critically improves the techniquereducing the arterial trauma in calcifiedand diseased arteries.ALLOGRAFT AND XENOGRAFTTransplantation of a vascular allograft is anattractive alternative in patients with nosuitable autologous vein.The ideal vascular allograft should have ahigh graft patency rate, a low graft disintegrationrate, should be available off the shelf indifferent diameters and lengths, and be able tobe stored for long periods.Fahner et al. (42) in a systematic reviewevaluated the results of clinical studies inwhich vascular allograft were used in themanagement of patients needing an infrainguinalbypass operation for a total of 3837allograft found. The patency and then the limbloss were directly correlated to type ofpreservation. One-year cumulative primarypatency rates were 13% to 79% for cryopreservation,63% to 80% for cold storage, and
OPEN SURGERY FOR REVASCULARIZATION OF THE DIABETIC FOOD ■ 8940% to 91% for glutaraldehyde. The rate ofmajor limb loss was 20% to 58% for cryopreservation,10% to 69% for cold storage, and0% to 65% for glutaraldehyde, and the percentageof graft disintegration was 2% to 6%for cryopreservation, 4% to 15% for coldstorage, and 0% to 11% for glutaraldehyde.Regarding the use of Xenograft, there wereonly few experience reported with poor results.Tolva et al. (43) reported a two centre experiencewith a depopulated ureteric xenograftfor femoro-popliteal revascularization in 12 patientswith CLI. They observed 10 of 12 patientswith the graft explanted due to aneurysmal enlargement,and only one graft was still patent at5 years. Probably this material could be useful toassist the patency of autologous bypass, withthe substitution of brief segment, and in case ofreplacement in an infected field.COMPOSITE GRAFTSPatients with a failed PTFE grafts oftenrequired a repeat bypass with a compositegraft to salvage the lower extremity. After multiplegraft failures, the long-term outcome of afurther bypass has been only minimally satisfactorywith other autogenous veins or syntheticprostheses (44). Composite grafts maybe a better option, as graft patency and limbsalvage appear to be better with a compositionof vein and PTFE for popliteal and infrapoplitealbypasses. Composite grafts have been used for42% of bypasses after multiple bypass failures,but these had the highest early primary graftfailure rates. Patency rates for these grafts havebeen reported to be 65% at 1 and 2 years afterfemoro-tibial bypasses, and at 5 years they haveranged from 28% to 53% (45).Bastounis et al. (46) reported cumulative5-year secondary patency of 75% for compositegrafts and 82% for saphenous-veingrafts (P .05). The primaryand secondary patency and limb salvage ratesfor compared PTFE grafts were 24%, 31% and40%, respectively.Composite grafts of PTFE achieve longtermpreservation of ischemic limbs inpatients with poor run-off and insufficientautogenous vein for a long graft directed tothe tibial vessels.OPERATIVE PLANNINGBefore operation, the surgeon first mustdefine the inflow source. If unanticipated arterialdisease is identified or vein quality andlength are worse than anticipated once theoperation is under way, the inflow site hemodynamicsuitability should be assessed byintraoperative Doppler CW.Although inflow artery selection is generallystraightforward, outflow site selectionrequires greater judgment. The general principleof infrainguinal reconstruction is to bypassall hemodynamically significant disease and toinsert the bypass into the distal limb arterythat has at least one continuous runoff arteryto the foot. In general, the most proximal segmentof tibial or peroneal artery that is continuouswith the foot should be chosen as theoutflow site. Thus, a patent anterior tibial orposterior tibial artery in direct continuitywith the foot and pedal arch would be chosenover the peroneal artery as an outflow site ifsuitable vein length is available. Most authorshave found no adverse effects on graft patencyor limb salvage for peroneal bypasses comparedwith tibial or pedal bypasses (47-48),but some others authors have made a strongcase for pedal bypass, particularly in diabeticpatients with tissue loss. The importance ofrestoring a pedal pulse and maximizing forefootreperfusion was emphasized in thesecases. Generally is preferred dorsal pedal orparamalleolar posterior tibial-plantar arteryinsertion sites for short bypasses originatingfrom the popliteal artery in diabetic patientswith tissue loss (49-50), even when bypassmust originate in the groin, is preferred dorsalpedal or paramalleolar posterior tibialplantararteries as outflow, splicing a vein ifrequired to obtain sufficient length, if tissueloss is present.
90 ■ PIE DIABÉTICOCOMBINED ENDOVASCOLARAPPROACHThe optimal management of CLI patientswith multilevel diseases often requires a combinationof endovascular and opens surgicaltechniques (51).The combined approach can be used toincrease the availability of both inflow andoutflow vessels.Interesting results have been obtained onthe run in vessels, with a patency rate from 58to 100%, contrary to run off vessels, asreported by Dougherty et al. (52).Late graft occlusions were attributable tofailure of the endovascular procedure, theproblems being the intrinsic patency ofendovascularly treated lesions.An appropriate follow-up protocol with aprompt reintervention whenever feasible wasnecessary.ACTUAL INDICATIONS FOR BYPASSGRAFTING IN THE ENDOVASCULARERAPTA is frequently used as first choice due torelated low morbidity and mortality rates, reservingOS for failures.Technological advances and maturation ofendovascular skills have allowed percutaneoustreatment of SFA occlusive disease to flourish,and many lesions previously felt amenable onlyto open surgical bypass may now be success -fully managed percutaneously.In this era of increased utilization of endovascularprocedures, the TASC II consensusstill recommends surgical bypass in complexand extensive femoro-popliteal arterial disease.TASC group provided guidelines on the basisonly of morphological indications. The clinicalfeatures have not been considered, even ifdifferent results in terms of patency, overallsurvival, and limb salvage have been reportedto be influenced by the clinical status of thelimb. Moreover these classifications have notbeen followed in the clinical practice, as EVtreatment has been frequently abused forTASC D patients.CLI patients with rest pain or tissue lossfrequently presented TASC D patterns, withlong occlusion. Such lesions were associatedwith a higher risk of EV failure and worseningof the initial runoff score. Ihnat et al. (53) advisednot to attempt EV treatment in patientswith TASC D lesions, with poor tibial arteryrunoff, or with extensive tissue loss.In patients with advanced CLI after one ormore EV failed procedures the distal arterieswere unsuitable for anastomosis because of recentthrombosis, dissection or lack of run-off.In our Department, for this reason, we reservedsurgical revascularization to patientswith serious tissue loss and long arterial occlusions.Our first indications to the treatment hasbeen stated following the clinical presentationsof the diseases, as TASC D lesions were a contraindicationto EV in case of advanced clinicallesions such as tissue loss and gangrene.On the contrary, in case of rest pain weconsidered EV treatment even for TASC D lesionsat the femoro-popliteal level.Therefore a correct approach to the treatmentof CLI is to look at it from three sides:technical issues of revascularization, footwound healing issues, and comorbidity (54).The BASIL Trial was the only RCT up tonow that compared EV and OS in the treatmentof CLI, and failed to demonstrate the superiorityof one method over the other (55).We believe that the Basil trial has the greatlimit to consider, in the surgical arm, preferentiallythe femoro-popliteal bypass: an operationusually ineffective in advanced CLI patients withtissue loss.Reduced amputation-free survival and increasedall-cause mortality were found in theendovascular treatment group after 2 years.For those patients who survived 2 years,however, the randomization to surgery was associatedwith a significant increase in overallsurvival of about 7 months and a trend towardincreased amputation free survival of about 6months during the subsequent mean follow-upof about 3 years.However, vein performed significantly betterthan prosthetic bypass in terms of amputationfree survival.
The data also suggestedthat most patients would havebeen better served by an attemptat EV rather than prostheticbypass if no suitable veinwas available as a conduit.Patients who underwentbypass surgery after failed EVfared significantly worse thanthose who underwent bypassas their first treatment, as previoushad concluded Inhat (53)and our group (56).Therefore BASIL Investigatorsrecommended choosing the type of revascularizationson the basis of patient’s life expectancybecause EV are unlikely to reap thelonger-term benefits of surgery but is significantlyless expensive and morbid in the shortterm.Many patients who could not undergo avein bypass would probably have been betterserved by a first attempt at EV than by prostheticbypass. Surgeons should make everyeffort to use vein material.The fact that a failed EV attempt per se reducesthe chance of success of a subsequentsurgical revascularization should be borne inmind when considering treatment strategies.This means that the problem has not beensolved and raises the question whether the useof EV was strictly indicated in all CLI patients.PERSONAL EXPERIENCEAiming to contribute to clarify the role ofEV treatment vs. OS repair, we reviewed ourexperience with both forms of treatment in thelast five years. From January 2005 to August2010, 687 patients (451 male 65.6%, 236 female34.4%), average age 73.23 years, underwent OSor EV in response to severe CLI.Comorbidities were: diabetes 67%, hypertension78%, smoking 64%, COPD 57%, coronaryartery diseases 49%, hyperlipidemia 39%,cerebrovascular diseases 27%, renal failure 21%.We performed in these patients 802 di -fferent procedures: 213 EV proceduresOPEN SURGERY FOR REVASCULARIZATION OF THE DIABETIC FOOD ■ 91Table IClinical presentationsClinical presentations Bypass grafts EV Hybrid or% % Combined %Foot finger or ante foogangre<strong>net</strong> 31% 2.5% 5.0%Hind foot gangrene 7% 1.0% 2.5%Ulcers 5% 3.0% 11.0%Rest pain 3% 7.0% 6.0%Severe claudicatio – 13.0% 3.0%Total 46% 26.5% 27.5%(26.5%), 369 bypass graft (46%), and 220hybrid or combined procedures (27.5%). In115 patients (16.7%) the procedures werebilateral.Patients with extensive tissue loss or gangrene(Rutherford 6) and with longer arterialocclusions were first considered for surgicaltreatment. Patients with failed EV in case ofrelevant rest pain or non healing ulcers weresecondarily addressed to surgical treatment.Details regarding clinical presentationswere reported in Tab I.Surgical revascularization included pre -ferentially femoro-tibial or plantar and popliteo-plantarbypasses with autologous mate rialin 91% of cases and PTFE in 9%, details werereported in Tab II.In presence of important gangrene or tissueloss and TASC D multilevel occlusions,our preference was reserved to tibial or pedalTable IIType of material used for bypassType of material %In situ saphenous vein 59Translocated saphenous vein 8Reversed saphenous vein 6Composite vein 8Lesser saphenous vein 7Arm veins 2Homograft 1PTFE and composite 9
92 ■ PIE DIABÉTICOrevascularization with extreme use of allautogenous material (Figs. 2-4).Fig. 2. Vein bypass graft with distal anastomosis atthe plantar artery.Fig. 4. Vein bypass graft with distal anastomosis atthe dorsalis pedis artery.In-hospital overall survival and amputation-freesurvival were, respectively, 96% vs.93%. Mean follow-up was 25.35 months.Only 8 patients (1%) were lost at follow-up.Primary assisted patency @1 year werefor surgical group 87% vs.72% for surgicalgroup after failure of previous EV (P > .25),respectively, and amputation free survivalwere respectively 79% vs. 69% (P > .1) (TabIII).Two hundred and ni<strong>net</strong>y-five assistanceprocedures (37%) were performed to maintainpatency: 112 (14%) surgical proceduresand 183 EV procedures (23%).Overall survival and amputation-free survivalwere 84% vs.76%, 69% vs.56%, 61% vs.46% @ 1, 3 and 5 years, respectively (Tab IV).Table IIIAmputation-free survival of CLI patientsFig. 3. Arteriography of a femoro-plantar bypass.In absence of sufficient venous material, afemoro-popliteal EV attempts and then popliteo-tibialbypass for multilevel diseases representedour preference.There were 41% of redo procedures thathad to be performed on patients previouslyunsuccessfully treated by different surgicaland non surgical centers.
OPEN SURGERY FOR REVASCULARIZATION OF THE DIABETIC FOOD ■ 93Table IVPrimary assisted patency in the surgicalgroup and in surgical group after failure of EVDISCUSSION AND CONCLUSIONMultilevel arterial disease is best treatedby surgical bypass according to TASC recommendations.The ideal material for AK revascularizationsis synthetic, as it has given results similarto the autologous saphenous vein.Numerous reports have confirmed thelong-term superiority in patency of vein oversynthetic conduit, however, many physicianscontinue to use synthetic grafts in the AK positionto preserve venous conduit for a futuredistal revascularization.The choice of conduit was left to the discretionof the operating surgeon and is eitherePTFE or Dacron.The ideal material for BK revascularizationsis autologous saphenous vein, which hasbeen demonstrated to provide significantlybetter results than prosthetic grafts. When autologousveins are not suitable, the most commonlyused synthetic material is ePTFE associatedin particular situations to technical artificesfor distal anastomosis.Moreover, a significantly higher percentageof early graft thromboses and amputationswere recorded in patients undergoing redoprocedures and in patients with preoperativepoor runoff status. These findings support theneed for continuing to use autologous mate -rials in these subgroups of patients. The widespreaduse of venous material significantly in-fluenced the patency and the limb salvagerates,The EV appears to be a viable option forprimary SFA, particularly when vein is notavailable, if the patient is a poor candidate forconventional bypass, and in case of rest painor severe claudication.But in severe CLI patients, PTA has shownpoor long-term patency.TASC classifications needed to be correlatedto the clinical features to pone the correctindication to the treatment.Distal reconstructive arterial surgery,rather than becoming obsolete, has evolvedtoward more ambitious targets, pushing itslimits and being more distal, more extremeand more demanding for the treatment of tissueloss and gangrene.REFERENCES1. Rutherford RB, Baker JD, Ernst C, Johnston KW, Porter JM,Ahn S et al. Recommended standards for reports dealingwith lower extremity ischemia: Revised version. J Vasc Surg1997; 26:517-538.2. Kalra M, Gloviczki P, Bower TC, Pan<strong>net</strong>on JM, Harmsen WS,Jenkins GD et al. Limb salvage after successful pedal bypassgrafting is associated with improved long-term survival. JVasc Surg 2001; 33:6-16.3. Nguyen LL, Mo<strong>net</strong>a GL, Conte MS, Bandyk DF, Clowes AW,Seely BL. PREVENT III Investigators. Prospective multicenterstudy of quality of life before and after lower extremityvein bypass in 1404 patients with critical limb ischemia. JVasc Surg 2006; 44: 977-984.4. F Spinelli, G De Caridi, M La Spada et al.. By-pass on malleolarand pedal arteries. In A Stella, M Gargiulo: Arteriopatia diabeticaperiferica. Ed. Minerva Medica Torino 2009, pag 109-114.5. Andros G, Harris RW, Salles-Cunha SX, et al: Bypass graftsto the ankle and foot. J Vasc Surg 1988; 7:785-794.6. Belkin M, Welch HJ, Mackey WC, O’Donnell Jr TF: Clinicaland hemodynamic results of bypass to isolated tibial arterysegments for ischemic ulceration of the foot. Am JSurg 1992; 164:281-284.7. Faglia E, Dalla Paola L, Clerici G, et al: Peripheral angioplastyas the first-choice revascularization procedure in diabeticpatients with critical limb ischemia: prospective study of993 consecutive patients hospitalized and followed between1999 and 2003. Eur J Vasc Endovasc Surg 2005; 29:620-627.8. F Spinelli, F Stilo, M La Spada et al.. Results of femoro-distalbypass according to clinical conditions and prostheticmaterials. In C Pratesi, R Pulli: Up-date in ChirurgiaVascolare. Ed. Minerva Medica Torino 2007: 248-253.
94 ■ PIE DIABÉTICO9. F Spinelli, F Stilo, G De Caridi et al.. In G. Coppi: Diagnosticaavanzata e accessi vascolari. Ed. Minerva Medica Torino2011, pag 409-417.10. Kunlin J: Le traitement de l’arterite obliterante par le greffeveineuse. Arch Mal Coeur Vaiss 1949; 42:371-372.11. Testart J: Jean Kunlin (1904-1991). Ann VascSurg 1995; 9(Suppl):S1-S6.12. Roll S, Müller-Nordhorn J, Keil T et al. Dacron vs. PTFE asbypass materials in peripheral vascular surgery systematicreview and meta-analysis. BMC Surg 2008;8:22.13. Donaldson MC, Whittemore AD, Mannick JA: Further experiencewith an all-autogenous tissue policy for infrainguinalreconstruction. J Vasc Surg 1993; 18:41-48.14. Taylor Jr LM, Edwards JM, Porter JM: Present status ofreversed vein bypass grafting: five-year results of a modernseries. J Vasc Surg 1990; 11:193-205.15. Bagi P, Schroeder T, Sillesen H, Lorentzen JE: Real time B-mode mapping of the greater saphenous vein. Eur J VascSurg 1989; 3:103-105.16. F Spinelli, F Stilo, F Benedetto et al.. Femoro-poplitealbypass for CLI. In Goëau-Brissonière, Ricco, Koskas:Vascular and Endovascular Surgery 2010. Critical LimbIschemia in 2010. Ed. GMSanté. Paris 2010, pag 26-36.17. Shah DM, Darling RC 3rd, Chang BB, et al. Long-termresults of in-situ saphenous vein bypass. Analysis of 2058cases. Ann Surg 1995;222:438-448.18. Leather RP, Shah DM, Chang BB et al. Resurrection of thein situ saphenous vein bypass, 1 000 cases later. Ann Surg1988;208:435-42.19. Belkin M, Knox J, Donaldson MC et al. Infrainguinal arterialreconstruction with nonreversed greater saphenous vein. JVasc Surg 1996;24:957-62.20. Batson RC, Sottiurai VS. Nonreversed and in situ vein grafts.Clinical and experimental observations. Ann Surg1985;201:771-9.21. Chang BB, Paty PS, Shah DM et al. The lesser saphenousvein: an underappreciated source of autogenous vein. J VascSurg. 1992;15:152-157.22. Londrey GL, Bosher LP, Brown PW et al. Infrainguinalreconstruction with arm vein, lesser saphenous vein andremnants of greater saphenous vein: a report of 257 cases.J Vasc Surg 1994;20:451-7.23. Spinelli F, Mirenda F, Mandolfino T et al. The lesser saphenousvein (LSV) for distal revascularizations for lowerlimbs salvage. J Vasc Endovasc Surg. 2001; 8:97-110.24. Arvela E, Söderström M, Albäck A et al. Arm vein conduit vsprosthetic graft in infrainguinal revascularization for criticalleg ischemia. J Vasc Surg 2010;52:616-23.25. Faries PL, LoGerfo FW, Arora S et al. A comparative studyof alternative conduits for lower extremity revascularization:Allautogenous conduit versus prosthetic grafts. J VascSurg 2000;32:1080-90.26. G. Carella, F Stilo, F Benedetto et al.. Femoro-distal bypasswith varicose veins covered by prosthetic mesh. J Surg Res2011. In press.27. Veith FJ, Gupta SK, Ascer E et al. Six-year prospective multicenterrandomized comparison of autologous saphenousvein and expanded polytetrafluoroethylene grafts ininfrainguinal arterial reconstructions. J Vasc Surg1986;3:104-14.28. Klinkert P, Post PN, Breslau PJ, van Bockel JH. Saphenousvein versus PTFE for above-knee femoropopliteal bypass. Areview of the literature. Eur J Vasc Endovasc Surg2004;27:357-62.29. Berglund J, Björck M, Elfström J. SWEDVASC Femoro-poplitealStudy Group. Long-term results of above knee femoro-poplitealbypass depend on indication for surgery andgraft-material. Eur J Vasc Endovasc Surg 2005;29:412-8.30. Pereira CE, Albers M, Romiti M et al. Meta-analysis of femoropoplitealbypass grafts for lower extremity arterial insufficiency.J Vasc Surg 2006;44:510-7.31. Jackson MR, Belott TP, Dickason T et al. The consequencesof a failed femoropopliteal bypass grafting: comparison ofsaphenous vein and PTFE grafts. J Vasc Surg. 2000;32:498-505.32. Takagi H, Goto S, Matsui M et al. A contemporary metaanalysisof Dacron versus polytetrafluoroethylene graftsfor femoropopliteal bypass grafting. J Vasc Surg2010;52:232-6.33. Pulli R, Dorigo W, Castelli P et al. on behalf of the PropatenItalian Registry Group. Midterm results from a multicenterregistry on the treatment of infrainguinal critical limbischemia using a heparin-bonded ePTFE graft. J Vasc Surg2010;51:1167-77.34. Dardik H, Berry SM, Dardik A et al. Infrapopliteal prostheticgraft patency by use of the distal adjunctive arteriovenousfistula. J Vasc Surg 1991;13:685-90.35. Stonebridge PA, Prescott RJ, Ruckley CV. Randomized trialcomparing infrainguinal polytetrafluoroethylene bypassgrafting with and without vein interposition cuff at the distalanastomosis. J Vasc Surg 1997;26:543-50.36. Pan<strong>net</strong>on JM, Hollier LH, Hofer JM. Multicenter randomizedprospective trial comparing a pre-cuffed polytetrafluoroethylenegraft to a vein cuffed polytetrafluoroethylene graftfor infragenicular arterial bypass. Ann Vasc Surg.2004;18:199-206.37. Ascer E, Gennaro M Pollina RM et al. Complementary distalarteriovenous fistula and deep vein interposition: a fiveyearexperience with a new technique to improve infrapoplitealprosthetic bypass patency. J Vasc Surg 1996;24:134-43.38. Spinelli F, Mandolfino T, D’Alfonso M et al. Distal revascularisationof lower limbs using prosthetic bypass and venousinterposition fistula following the Ascer procedure. J VascEndovasc Surg 2001; 4: 285-289.39. Sogaro F, Galeazzi E, Amroch D et al. Pantaloon vein grafttechnique in tibial revascularization with arteriovenous fistulafor limb salvage. Cardiovasc Surg. 1996;4:377-80.40. Ysa A, Bustabad MR, Arruabarrena A et al. Easy alternativesto difficult clamping of distal vessels of the leg. J Vasc Surg2008;47:1091-3.41. Spinelli F, Stilo F. Regarding: «Easy alternatives to difficultclamping of distal vessels of the leg». J Vasc Surg.2008;48:1641-1642.42. Fahner PJ, Mirza M, van Gulik T et al. Systematic review ofpreservation methods and clinical outcome of infrainguinalvascular allografts. J Vasc Surg 2006;44:518-24.43. Tolva V, Bertoni GB, Trimarchi S et al. Unreliability of depopulatedbovine ureteric xenograft for infra inguinal bypass
OPEN SURGERY FOR REVASCULARIZATION OF THE DIABETIC FOOD ■ 95surgery: mid-term results from two vascular centres. Eur JVasc Endovasc Surg. 2007;33:214-6.44. De Frang RD, Edwards JiM, Mo<strong>net</strong>a GL et al. Repeat legbypass after multiple prior bypass failures. J Vasc Surg1994;19:268-77.45. Quiniones WJ, Colhurn MD, Ahn SS et al. Very distal bypassfor salvage of the severely ischemic extremity. Am J Surg1993;166:117-23.46. Bastounis E, Georgopoulos S, Maltezos C et al. PTFE–veinComposite Grafts for Critical Limb Ischaemia: a ValuableAlternative to All-autogenous Infrageniculate Recons -tructions. Eur J Vasc Endovsc Surg. 1999; 18:127-32.47. Elliott BM, Robison JG, Brothers TE, Cross MA: Limitationsof peroneal artery bypass grafting for limb salvage. J VascSurg 1993; 18:881-888.48. Pomposelli Jr FB, Jepsen SJ, Gibbons GW, et al: Efficacy ofthe dorsal pedal bypass for limb salvage in diabetic patients:short-term observations. J Vasc Surg 1990; 11:745-751.49. Mills JL, Gahtan V, Fujitani RM, et al: The utility and durabilityof vein bypass grafts originating from the popliteal arteryfor limb salvage. Am J Surg 1994; 168:646-650.50. Shah DM, Darling 3rd RC, Chang BB, et al: Is long veinbypass from groin to ankle a durable procedure? An analysisof a ten-year experience. J Vasc Surg 1992; 15:402-407.51. London NJM. Surgical Intervention for Lower ExtremityArterial Occlusive Disease: Femoropopliteal and TibialInterventions. Comprehensive Vascular and EndovascularSurgery (second Edition). Edited by: John Hallett Jr. Mosby.Elsevier. 2009:192-214.52. Dougherty MJ, Young LP, Calligaro KD. One hundredtwenty-five concomitant endovascular and open proceduresfor lower extremity arterial disease. J Vasc Surg.2003;37:316-22.53. Ihnat DM, Duong ST, Taylor ZC et al.. Contemporary outcomesafter superficial femoral artery angioplasty andstenting. The influence of TASC classification and runoffscore. J Vasc Surg. 2008;47:967-974.54. Hynes N, Mahendran B, Manning B et al. The influence ofsubintimal angioplasty on level of amputation and limb salvagerates in lower limb critical ischemia: a 15 year experience.Eur J Vasc Endovasc Surg. 2005;30:291-299.55. Bradbury AW on behalf of the BASIL trial Investigators andParticipants. Bypass versus Angioplasty in Severe Ischaemiaof the Leg (BASIL) trial in perspective. J Vasc Surg2010;51:1S-4S.56. F Spinelli, F Stilo, F Benedetto et al.. Early and 1-year resultsof infrainguinal Bypass after failure of endovascular therapy.Int Angiol 2011;30:156-63.
Tratamiento endovascular de las arteriasdistales del miembro inferiorCARLOS VAQUERO, ENRIQUE SAN NORBERTO, MIGUEL MARTÍN-PEDROSA,JOSÉ ANTONIO BRIZUELA, JOSÉ ANTONIO GONZÁLEZ-FAJARDO Y BORJA MERINOServicio de Angiología y Cirugía Vascular. Hospital Clínico Universitario de Valladolid. Valladolid. EspañaINTRODUCCIÓNLa oclusión de las arterias de los miembrosinferiores, ya sea por diferentes causasaterosclerosis, diabetes o tromboangeitis obliteranteu otras causas mas infrecuentes, puedenproducir variadas repercusiones isquémicassiendo la más grave la gangrena (1). Lasoclusiones se pueden producir a diferentesniveles ya sean proximales a nivel de los ejesiliacos, intermedias a nivel femoral o en lasarterias distales (2). Distintos procedimientosse han propuesto para realizar la revascularizaciónde los miembros siendo algunos revascularizadoresy otros derivativos con diferentesresultados hasta el momento actual (3). Laangioplastia es una técnica revascularizadora,repetitiva, mínimamente invasiva y que hamostrado su eficacia en sectores proximalesdel árbol arterial (4). A nivel distal, la revascularizaciónarterial en el momento actual esfactible con el desarrollo de nuevas técnicasde abordaje intraluminal de los vasos, desarrollosde balones de pequeño perfil y diámetroy gran longitud (5).La determinación del mejor método derevascularización para el tratamiento de laenfermedad arterial periférica se basa en elbalance entre el riesgo de una intervenciónespecífica y el grado y la durabilidad de lamejoría clínica que se espera derivada de ella(6). Los resultados de la revascularizacióndependen de la extensión de la enfermedaden el árbol arterial (inflow, outflow y diámetroy longitud del segmento enfermo), el grado deenfermedad sistémica (comorbilidades queafectan a la esperanza de vida e influyen en lapermeabilidad de la técnica de revascularización)y del tipo de procedimiento llevado acabo. La información de los grandes ensayosclínicos deben ser consideradas en el contextode la situación individual del paciente (7,8).En los últimos años se ha constatado unnotable incremento del uso de la terapiaendovascular para el tratamiento de la enfermedadoclusiva infrainguinal (9). El incrementofavorable del riesgo/beneficio, secundario alos bajos porcentajes de morbilidad y mortalidadasociados a las intervenciones percutáneas,en comparación con la revascularizaciónquirúrgica abierta, es uno de los factores másimportantes (10,11).La angioplastia transluminal percutánea(ATP) se realiza generalmente bajo anestesialocal con un sedación intravenosa mínima ycon una corta estancia hospitalaria. El fallorenal agudo inducido por contraste es la complicaciónmás frecuente, a pesar que su incidenciaglobal ha caído por debajo del 6%, conel desarrollo de agentes hipo e iso-osmolares,aunque puede incrementar su tasa de apariciónen pacientes con insuficiencia renal previay diabetes. Otras complicaciones descritasson las derivadas del sitio de punción, predominantementepseudoaneurismas y fístulasarteriovenosas, que alcanzan menos del 1% ycomplicaciones tromboembólicas o infecciosas(12,13).Continúa constituyendo fuente de debate elcoste de estos procedimientos (7). Aquellosque creen que la terapia endovascular estásobre utilizada consideran que los costes realesestán infraestimados, debido a la pobre durabilidadasociada y la mayor necesidad de procedi-
98 ■ PIE DIABÉTICOmientos adicionales. Uno de los hallazgossecundarios del estudio BASIL (Bypass versusAngioplasty in Severe Ischemia of the Leg), encontrabaun mayor coste a un año para la revascularizaciónquirúrgica que para la ATP (14).Los autores presentan en este estudio, losresultados personales con la aplicación de latécnica de angioplastia a nivel de las arteriasdistales de la pierna y el pie.MATERIAL Y MÉTODOSSe incluyen en el estudio un total de 239pacientes afectos de patología arterial oclusivalocalizada en las arterias distales de los miembrosinferiores, tronco tibio-peróneo, tibialanterior, pedia, tibial posterior y arteria perónea,tratando 278 lesiones. La mayoría de lospacientes (78.4%) fueron varones y la edadmedia 71.9 años. Todos los enfermos se encontrabanen un estadio clínico de claudicacióninvalidante, dolor de reposo o lesiones tróficasdistales que justificaban la indicación terapéutica,estando incluidos el 12.1 % en el estadio Ide Leriche-Fontaine, el 29.7 % en el II y el58.1% en el III. Como procesos patológicostodos los pacientes eran portadores de aterosclerosis(47.2%), diabetes (49.3%) o tromboangeitisobliterante 3.3 %), presentandoalgunos de ellos varios procesos concomitantes(18.2%). Los enfermos fueron estudiadosclínicamente y clasificados según los estadíosde Fontaine. Se les realizó un estudio de imagenprevio a la revascularización y durante elprocedimiento quirúrgico se realizó una angiografíaprevia al tratamiento que se efectuó concontrol fluoroscopio y control con esta técnicaposterior al tratamiento. El seguimiento serealizó desde el punto de visto clínico, valorandola presencia de pulsos o evolución de laslesiones y la realización del índice tobillo brazo,tras la medición de presiones segmentarias ydesde el punto de vista ultrasonográficomediante exploración Eco-doppler. Los controlesevolutivos del proceso se realizaron almes, a los tres meses, seis meses y al año. Losdatos cuantificables fueron tratados desde elpunto de vista estadístico fundamentalmenteconstatando los valores medios, desviaciónstandard y proporciones sin realizar valoracionescomparativas, al ser un estudio descriptivo.RESULTADOSLos resultados mostraron las característicasclínicas de los pacientes estudiados en loque se refiere a la edad, sexo, estadío clínico yotros perfiles de los enfermos valoradosComo factores de riesgo destacaron lahipertensión (53.9%), la dislipemia (4.7%) y eltabaquismo (20.5%), no estando exentos depadecer otro tipo de padecimientos concomitantes(64.4%). En un 9.6 % se había realizadoun procedimiento de angioplastia previay en el 12.1% operaciones derivativas tipo bypass.Tabla ICaracterísticas clínicas y demográficasde los pacientes con enfermedad vascularperiféricaPacientes 239Miembros 278Edad (años) 71.9Sexo74.8% varonesIndicaciónEstadio I Leriche-Fontaine 0%Estadio II Leriche-Fontaine 12.1%Estadio III Leriche-Fontaine 29.7%Estadio IV Leriche-Fontaine 58.1%Diagnóstico enfermedad arterialAterosclerosis 47.2%Tromboangeitis obliterante 3.3%Angiopatía diabética 49.3%Factores de riesgoHipertensión 53.9%Diabetes 52.3%Dislipemia 34.7%Hábito tabáquico 20.5%Enfermedades asociadas 64.4%Angioplastia previa 9.6%Bypass previo 12.1%Otras intervenciones vasculares 7.9%Tabla I. Características de los pacientes
TRATAMIENTO ENDOVASCULAR DE LAS ARTERIAS DISTALES DEL MIEMBRO INFERIOR ■ 99Solo en el 4.6 % se ubicaron a nivel de lasarterias distales, presentando los pacienteslesiones en distintos sectores de forma asociada,siendo la femoral superficial la arteriaque de forma simultánea presentó mayor incidenciade lesiones concomitantes (21.9 y22.6%). Las lesiones desde el punto de vistade clasificación TASC estuvieron distribuidasde forma proporcional en los distintos grupos.La longitud media de las lesiones tratadasfue de más de 10 cm (13.1±6.3) y el diámetromedio de los vasos distales tratados alrededorde 3 mm (3.1±1.2). Predominó comoarteria distal afectada la tibial anterior quepresentó patología y se trató en 149 casos,seguida de la arteria perónea (139). Tabla IICaracterísticas arteriales de los pacientesafectados de arteriopatía crónicaobstructivaLocalización de la oclusiónDistales y Iliaca común y externa 8.9 %Distales, Iliaca externa y femoralsuperficial 13.6%Distales y femoral superficial 21.9%Distales y Femoral superficialy poplítea 22.6%Femoral superficial y arteriascrurales 11.5%Arterias distales y poplítea 14.7%Arterias distales 6.4%TASC A II 17%TASC B II 18%TASC C II 34%TASC D II 31%Longitud media de las lesiones 13.1±6.3Diámetro de los vasos distales 3.1±1.2Calcificación 67.6%Vasos distales tratadosTronco tibio-peróneo 69Arteria tibial anterior 149Arteria tibial posterior 77Arteria perónea 139Arteria pédia 21Arco plantar 16Tabla II. Características de los vasos tratados.El procedimiento más frecuente realizadofue la angioplastia que se efectuó en 329 casosy de forma testimonial la implantación de unstent. En un 24.8% se fracasó en el intento decanalización del vaso y en un 14.2% no se logrórealizar la angioplastia. En el 73% de losprocedimientos la técnica fue de punción y deforma ipsilateral en un 67% de los casos. Serealizaron otro tipo de intervenciones complementarias,predominando la angioplastia desectores proximales en un 24.1% junto contécnicas de cirugía abierta como fue la profundoplastiay by-pass proximales como procedimientoshíbridos. Tabla IIIProcedimientos realizadosAngioplastia 329Implantación stent 7Media de balones utilizados 2Media de inflados de balón 3Tiempo medio de inflado balón 2.9 minFracaso permeabilización vaso 24.8%Fracaso técnico angioplastia 14.2%AbordajePunción 73%Disección arterial 27%Ipsilateral 67%Contralateral 33%Cierre acceso abordaje arterialSutura arterial 27%Cierre percutáneo 53%Compresión 20 %Tipo AnestesiaLocal 17%Regional 68 %General 15%Intervenciones complementariasBy-pass proximales 19 (6.8%)Angioplastia proximalesStent proximales67 (24.1%)34 (12.2 %)Endarterectomía 16 (5.7%)Profundoplastia 37 (13.3%)Trombectomía 6 (2.1%)Amputación menor (digitales) 26 (9.35%)Amputación menor (pie) 20 (7.9%)Tabla III. Tipo de procedimientos practicados enlos enfermos.
100 ■ PIE DIABÉTICOLa perforación de la arteria tratada fue lacomplicación técnica que mayor presentaciónse constató, constituyendo el 7.5 % delos casos, seguida de la embolización distal.Tabla IVComplicaciones de los procedimientos deangioplastiaTrombosis 3.50%Rotura arteria acceso 2.70%Perforación arteria tratada 7.50%Embolización distal 6.80%Hematoma inguinal 1.30%Amputación mayor 8.63%Tabla IV. Complicaciones de los procedimientostras los procedimientos de angioplastia.Como resultados del procedimiento, enun 75.8% de los casos, se valoró como éxitotécnico y en un 70.5 % como éxito clínico.Se logró el salvamento de la extre midadal año en un 62.5% de los casos, resultandola permeabilidad primaria el 66.7% de loscasos y la secundaria el 59.8% de los casos.Tabla VSe evidenciaron causas de muerte nodirectamente relacionada con el procedimiento,como la cardiaca, la pulmonar, insuficienciarenal y otras causas siendo desconocida laetiología de este evento en el 10.4% de losenfermos. Se perdió su seguimiento en el17.1% de los pacientesLos pacientes tratados fueron anticoaguladosdurante el procedimiento, mediante ladosificación de heparina sódica a dosis de 1mg/Kg peso, con lavados de los sistemas deacceso con suero heparinizado. Después delprocedimiento se les instauró pauta de dobleantiagregación mediante la aplicación de clopidogrel(75 mg) y aspirina (300 mg), a excepciónde los considerados con riesgo trombóticoque s eles mantuvo durante 3 días con laadministración de heparina de bajo pesomolecular para continuar con la doble antiagregación.Resultados del procedimiento endovascularÉxito técnico 75.8%Éxito clínico 70.5%Salvamento extremidad al año 62.5%Reintervenciones 8.2%Permeabilidad primaria 66.7%Permeabilidad secundaria 59.8%Fallecimiento pacienteCardiaca 2.9%Insuficiencia respiratoria 2.1%Insuficiencia renal 1.6%Accidente vascular cerebral 1.2%Tumor 0.8%Embolismo pulmonar 0.8%Otras causas 7.9%Desconocido 10.4%Pérdida seguimiento 17.1%Tabla V. Resultados a nivel local y general de lospacientes tratados.DISCUSIÓNLa enfermedad aterosclerótica de las arteriasdistales puede encontrarse en combinacióncon otros territorios proximales o comoenfermedad predominante en este territoriopor debajo de la rodilla. Existe una clara asociacióncon la diabetes mellitus (13) en comparacióncon otros factores de riesgo que serelacionan con diferentes territorios arteriales,como son el hábito tabáquico, los nivelesde plasminógeno o el volumen corpuscularmedio eritrocitario elevado. Al ser la diabetesuna enfermedad endémica con un crecimientoanual aproximado al 2.5%, el tratamientode la enfermedad distal de extremidades inferioresestá adquiriendo un papel importanteen nuestra práctica clínica diaria.Los pacientes con enfermedad ateroscleróticaconfinada a las arterias infrapoplíteassuelen permanecer asintomáticos gracias auna red colateral excelente que se desarrollaentre las arterias tibiales. Una arteria tibialpermeable es habitualmente suficiente paramantener al paciente libre de síntomas isquémicos.Cuando esos pacientes presentan
TRATAMIENTO ENDOVASCULAR DE LAS ARTERIAS DISTALES DEL MIEMBRO INFERIOR ■ 101Figura 1. Tratamiento mediante angioplastia de sector infragenicular. Lesión TASC tipo B (a). Angioplastiamediante balón Amphirion 3 x 80 mm. (Invatec, Innovative Technologies) (b). Control arteriográfico (c).isquemia crítica de la extremidad, habitualmenteposeen una severa y extensa enfermedadde tres vasos y sólo el 20-30% sufren unalesión focal con un buen run-off. Los pacientessuelen ser de edad avanzada y con comorbilidadsevera, como la diabetes y la isquemiacoronaria, las cuales incrementan el riesgoquirúrgico. La cirugía de derivación fémorodistaly pedal es técnicamente demandante yse asocia con una mortalidad perioperatoriaentre el 1.8 y el 6% (15,16).Las opciones quirúrgicas para la revascularizaciónde la enfermedad oclusiva de las arteriasdistales de las extremidades inferioresincluyen el bypass autógeno o sintético, laendarterectomía o procedimientos híbridos.Por su parte, las técnicas endovasculares descritasen este sector son la angioplastia conbalón, stent, láser o dispositivos de extracciónde placa (2).Las bajas tasas de complicaciones de laangioplastia distal han llevado a varios autoresa indicar su empleo en pacientes con claudicaciónintermitente en grado IIb de Fontainepara el tratamiento de estenosis. Para oclusiones,sin embargo, la claudicación no es consideradauna indicación apropiada por un potencialporcentaje de complicación elevado.La diabetes llega a aparecer en el 63-91%de los pacientes sometidos a tratamientoendovascular distal por isquemia crítica. Lamayoría tiene afectados los tres vasos, son unaarteriopatía distal severa, pero suele existir unareconstitución de algún vaso hacia el pie. Lospacientes con enfermedad renal terminal pareceser el grupo más difícil de tratar al tenerenfermedades ateroscleróticas muy difusas,con participación de vasos distales y pedios ycalcificaciones arteriales más intensas.La lesión distal ideal sería focal y con unbuen drenaje distal. Las estenosis parecenposeer una tasa de resultados técnicos satisfactoriosmejor que las oclusiones. Estas condicionesideales sólo están presentes enmenos del 30% de los pacientes con isquemiacrítica, y si existe, suele verse en uno o dos delos vasos. La recuperación del flujo en línearecta hacia el pie al menos en un vaso despuésde la angioplastia es necesaria para eléxito clínico. La dilatación de una lesión pro-
102 ■ PIE DIABÉTICOximal cuando la arteria distal está gravementeafectada no ofrecerá un beneficio clínicoduradero. Varty et al. (21), han publicado salvamentosde extremidad a un año del 77% enpacientes con isquemia crítica de extremidadtras PTA infrainguinal. En pacientes con anatomíasfavorables, la tasa de salvamento a 2años es superior al 80%. No obstante se hanobtenido mejores resultados tras tratamientoendovascular en pacientes con enfermedadinfragenicular a varios niveles que aquelloscon enfermedad a un único nivel, quizás porposeer una aterosclerosis local más exacerbada(23).Algunos estudios publicados sobre tratamientoendovascular del sector infrapopliteorealizan la terapia exclusiva en arterias tibiales(23,24), no tratando la arteria peronea.Extrapolando los conocimientos de la cirugíaabierta, la revascularización de la arteria peroneaincluso en su tercio distal, alcanza los mismosresultados de permeabilidad y salvamentode extremidad que cualquier otra arteriacrural (25).La distribución típica de la enfermedadarteriosclerótica en los pacientes con isquemiacrítica de extremidad incluye múltiplesestenosis y oclusiones en el árbol arterialdesde la arteria femoral a la arcada plantar(17). Sin embargo, en el 25% de los pacientescon isquemia crítica, las lesiones están confinadasal territorio infrapoplíteo (26), siendoestos pacientes predominantemente diabéticosy se caracterizan por enfermedad másextensiva con vasos crurales más calcificados(27). Los tratamientos quirúrgicos abiertoscomo la amputación y el bypass han predominadodurante décadas. Las tasas de éxito sonmuy variables, debido principalmente a laselección de los pacientes.Como los bypass distales a cualquiera delas arterias tibiales o a la arteria peronea songeneralmente complejos, dificultosos y conuna incidencia significativa de oclusión tempranay con una morbimortalidad operatoriaconsiderable, estas intervenciones no deberíangeneralizarse para tratar pacientes conclaudicación intermitente, y deberían serreservados para la isquemia crítica de extremidadesinferiores. La mortalidad perioperatoriatras un bypass fémoro-distal varía entreel 0 y el 18%, pero largas series actuales la hancifrado en menor a 3% (28,29). Recons -trucciones fémorodistales con vena safenainterna obtienen una permeabilidad primariaa 5 años entre el 60 y 70%, secundaria entreel 70 y 80% y un salvamiento de extremidadentre 75 y el 85% (30,31).El tratamiento quirúrgico tradicional paraestos pacientes es el bypass o la amputaciónprimaria. Los pacientes con revascularizaciónexitosa logran una mayor supervivencia y unamayor calidad de vida en comparación con lospacientes que han sufrido amputación (32). Lacalidad de vida de los pacientes tras un bypassfémoro-distal continúa constituyendo un factorinfraestimado de los resultados a largoplazo. El éxito técnico no garantiza el bienestardel paciente. Solamente el 68% de lospacientes mantienen la habilidad de vida independienteque poseía preoperatoriamente ysólo el 14% permanecen libres de síntomas ocomplicaciones o no requieren reoperaciones(33).Por lo tanto, la restauración de aportesanguíneo al pie debería intentarse siempreque fuera posible en todos los pacientes.Existen casos en que la PTA es la única opciónreal de revascularización en pacientes conisquemia crítica (34).Incluso si la amputación no puede ser evitada,el tratamiento endovascular infrapoplíteopuede permitir un amputación menor enpacientes en los que en otro caso hubierannecesitado una amputación mayor.Los beneficios reconocidos de la terapiapercutánea infrainguinal distal son la disminucióndel tiempo operatorio, típicamentemenor a 2 horas, mientras que las técnicasquirúrgicas abiertas alcanzan una duraciónmedia de 4 horas (13); la menor estancia hospitalaria(35); el menor tiempo de recuperacióndel paciente; la preservación de la venasafena para una potencial futura intervencióncardiaca o vascular periférica (19); y el hechoque la repetición de la PTA en comparacióndel tratamiento quirúrgico abierto en casosde reestenosis resulta mucho más sencillo
TRATAMIENTO ENDOVASCULAR DE LAS ARTERIAS DISTALES DEL MIEMBRO INFERIOR ■ 103(36). Por todas estas razones, existe la creenciacada vez más extendida de considerar altratamiento endovascular la primera opciónterapéutica para la isquemia crítica de extremidady reservar la revascularización quirúrgicapara aquellos en que el tratamientoendovascular hubiera fallado.El pasado año Giles et al. (22) publicaronuna serie de 176 pacientes consecutivossometidos a angioplastias infrapoplíteas.Demostraron cómo el éxito técnico inicial, asícomo la reestenosis y el salvamento de extremidaddepende del grado de clasificaciónTASC de la lesión tratada y de la idoneidad delas lesiones para la realización de un posiblebypass. Concluyeron cómo los resultados dela angioplastia infrapoplítea en pacientes conisquemia crítica de extremidad hacen que estatécnica sea apropiada para pacientes que nosean óptimos candidatos para bypass o inclusocomo técnica de primera línea de tratamientoen pacientes candidatos a bypass ylesiones TASC A, B ó C.Los avances tecnológicos y el incrementode las técnicas endovasculares han originadouna tendencia en el tratamiento de la enfermedadvascular oclusiva periférica hacia abordajesmenos quirúrgicos y más percutáneos.El papel adecuado de la cirugía y de la terapiaendovascular en la claudicación intermitentecontinúa siendo una controversia. Existe lacreencia cada vez más extendida, que elbypass infragenicular es apropiado únicamentepara un subgrupo cuidadosamente seleccionadode pacientes con síntomas de claudicación.En ciertos pacientes con criterios anatómicosfavorables estaría indicada la terapiaendovascular en pacientes claudicantes conenfermedad oclusiva tibioperonea.La doctrina tradicional había establecidodurante varios años que la reconstrucciónquirúrgica a nivel tibioperoneo para el tratamientode la claudicación era excesivamenteagresiva. La morbilidad potencial excedía a losbeneficios clínicos esperados, además la oclusióndel bypass distal podía convertir unasituación relativamente benigna como la claudicaciónen una situación ominosa de salvamentode extremidad.Durante las últimas décadas, las técnicasde reconstrucción quirúrgica distal infrainguinalhan mejorado sus resultados enpacientes con isquemia crítica de la extremidad,alcanzando bajas tasas de mortalidad ypermeabilidades a 5 años mayores al 80%(31,37). De tal forma, varios autores hanpublicado resultados favorables para la cirugíade revascularización en pacientes cuidadosamenteseleccionados con una claudicaciónlimitante y anatomía favorable.Los excelentes resultados de estos estudiosse explican por la alta selección de lospacientes intervenidos. De tal forma, la mayoríade los pacientes buenos candidatos paraun bypass fémoro-tibial manifiestan enfermedadtibioperonea o tibial proximal como unaextensión de una enfermedad concomitantede femoral superficial y/o poplítea y ademáscuentan con unos vasos de salida de la anastomosisdistal adecuados. Este hecho pone demanifiesto la gran importancia de la selecciónde los pacientes y el escaso número de ellosa los que se puede ofrecer esta opción terapeútica.Los resultados publicados para la angioplastiaa nivel tibioperoneo para el tratamientode la claudicación son limitados. No existeevidencia de nivel 1, mientras que se ha producidoun número creciente de estudiosbasados en series de instituciones, con unamezcla de situaciones clínicas con mayoría depacientes con isquemia crítica y un pequeñonúmero de sujetos con claudicación severa.Otros autores han combinado sus resultadosde revascularización endovascular fémoropoplíteacon los obtenidos en el territoriotibioperoneo.Dorros et al. (38) publicaron en 1998 lamayor experiencia publicada hasta la actualidadde angioplastia tibial con 312 pacientes,133 de ellos tratados por claudicación. Enéste subgrupo el éxito técnico ascendió al98%. El éxito inicial de tratamiento fue mejorpara claudicantes que para aquellos pacientescon isquemia crítica y para lesiones estenóticas(98%) que para oclusiones totales (86%).Es destacable cómo estos resultados fueronobtenidos en un tiempo donde la variedad y
104 ■ PIE DIABÉTICOlas propiedades de las guías, los catéteres y losbalones disponibles era significativamente máslimitado que el existente en la actualidad.La experiencia acumulada con el empleode stent para el tratamiento de la angioplastiasubóptima en claudicantes, se reduce a seriesde casos. Kickuth et al. (39) en 2007 publicansu experiencia con el empleo del stent Xpert(Abbott Vascular) en 16 pacientes con claudicacióny 16 con isquemia crítica. Ofrece unosresultados globales de permeabilidad a 6meses del 82% y una tasa de salvamento deextremidad del 100%.Mayoritariamente, los pacientes claudicantesincluidos en los estudios de terapia endovascularinfragenicular corresponden a gradoIII de Rutherford (38-40). No obstante, estemismo año se ha publicado la experiencia inicialcon un dispositivo de aterectomía orbitalen pacientes con lesiones distales, algunos deellos con clínica de claudicación en grado I deRutherford (41).La mayoría de los estudios realizadossobre el tratamiento endovascular del sectordistal se basan en el empleo de la angioplastiasimple. Existe también una experiencia cadavez mayor con el empleo de stent en la regióninfrapoplítea. En el 2005 dentro de las guías dela ACC/AHA para el tratamiento de lospacientes con enfermedad arterial periférica yrecomendaciones clase II del tratamientoendovascular de la claudicación, se otorgabaun nivel de evidencia C a la efectividad destents, aterectomía, cutting balloon, dispositivostérmicos y láser para el tratamiento de laslesiones infrapopliteas excepto para el salvamentode resultados subóptimos tras la dilatacióncon balón (42).Durante el pasado año el metaanálisis deRomiti et al. (43), publicó unos resultadospara la PTA infrainguinal de un éxito técnicoinmediato del 89%, y unos resultados a tresaños de permeabilidad primaria y secundariadel 48.6% y 62.9% respectivamente, salvamentode extremidad del 82.4% y una supervivenciadel paciente del 68.4%. Estos resultadosmuestran una peor permeabilidad que elbypass distal pero una tasa de salvamiento deextremidad equiparable.Los stents autoexpandibles han obtenidoresultados en series más limitadas de permeabilidada 2 años de 54.5% y salvamento deextremidad del 90.8% (Xpert stent, AbbotVascular) (44). Rand et al. (45), en 2006 publicabanuna mayor permeabilidad a 6 meses conel empleo de stent balón expandibles(Carbostents, Sorin Biomedica) que con PTAen una población de 51 pacientes y randomizacióntras haber atravesado la lesión con la guía.Las indicaciones para el empleo de stentautoexpandibles publicadas en la bibliografíaserían el resultado subóptimo tras angioplastia:estenosis residual >30% (12,14) o >50%(46), a pesar de inflado de balón repetido y/oprolongado, la disección o retroceso elásticotras PTA (22,46), trombo oclusivo resistente aintervención (39, 46)y lesiones estenóticaslargas u oclusiones, tipos TASC C y D (47).No obstante existe la posibilidad de utilizarotros dispositivos que se encuentran en elmercado, como son stent balón expandibles,stent bioabsorbibles, stent liberadores de fármacos(sirolimus), crioplastia, cutting balloon,aterectomía mecánica u orbital o láser. Todosellos cuentan con ventajas y desventajas teóricas,pero en ningún caso poseen unas indicacionesde uso establecidas y no existe ningúnestudio comparando sus resultados conla angioplastia o con la cirugía abiertaCONCLUSIONESLa afectación de arterias distales se presentapredominantemente en el momentoactual en el varón, pero apareciendo una progresivaincremento de la incidencia en el casode la mujer. La aterosclerosis y la diabetesméllitus se muestran como principal enfermedadbase de la patología oclusiva distal, mostrándosecon bastante frecuencia como procesosconcomitantes. Los trastornos tróficos,es decir el Estadio IV de Leriche-Fontaine justificanun gran porcentaje de intervencionesquirúrgicas revascularizadoras. Son los factoresde riesgo clásicos, como la hipertensión,diabetes y tabaquismo quien soporta estapatología. Se siguen presentando los procesos
TRATAMIENTO ENDOVASCULAR DE LAS ARTERIAS DISTALES DEL MIEMBRO INFERIOR ■ 105de afectación arterial como multisegmentaria,estando afectados varios sectores a la vez. Laangioplastia para procedimientos distales, es latécnica de elección, aunque a veces requiereactuaciones complementarias. La incidencia decomplicaciones de la técnica, se puede considerarbaja, optando en muchas ocasiones porla vía ipsilateral mediante punción directa delvaso. Los resultados a corto medio plazo, sepueden considerar aceptables, aunque noimpide que haya que realizar amputacionesmenores distales como gestos complementarios.Se puede considera la angioplastia de losvasos distales como una buena herramientarevascularizadora, que prolonga la viabilidadde los miembros afectados por situaciones deisquemia crítica o con gangrenas.BIBLIOGRAFÍA1. Lumsden AB, Davies MG, Peden EK. Medical and endovascularmanagement of critical limb ischemia. J EndovascTher. 2009;16(2 Suppl 2):II31-62 .2. Zeller T, Sixt S, Rastan A. New techniques for endovasculartreatment of peripheral artery disease with focus on chroniccritical limb ischemia. Vasa. 2009;38(1):3-12.3. Kudo T, Chandra FA, Kwun WH, Haas BT, Ahn SS. Changingpattern of surgical revascularization for critical limb ischemiaover 12 years: endovascular vs. open bypass surgery. JVasc Surg. 2006;44(2):304-13.4. Conte MS, Geraghty PJ, Bradbury AW, Hevelone ND, LipsitzSR, Mo<strong>net</strong>a GL, Nehler MR, Powell RJ, Sidawy AN.Suggested objective performance goals and clinical trialdesign for evaluating catheter-based treatment of criticallimb ischemia. J Vasc Surg. 2009;50(6):1462-73.5. Yan BP, Moran D, Hynes BG, Kiernan TJ, Yu CM. Advances inendovascular treatment of critical limb ischemia. Circ J.2011;75(4):756-65.6. Beard JD. Which is the best revascularization for criticallimb ischemia: Endovascular or open surgery? J Vasc Surg.2008;48(6 Suppl):11S-16S.7. Forbes JF, Adam DJ, Bell J, Fowkes FG, Gillespie I, Raab GM,Ruckley CV, Bradbury AW; BASIL trial Participants. Bypassversus Angioplasty in Severe Ischaemia of the Leg (BASIL)trial: Health-related quality of life outcomes, resource utilization,and cost-effectiveness analysis. J Vasc Surg.2010;51(5 Suppl):43S-51S.8. Bradbury AW, Adam DJ, Bell J, Forbes JF, Fowkes FG,Gillespie I, Ruckley CV, Raab GM; BASIL Trial Participants.Bypass versus Angioplasty in Severe Ischaemia of the Leg(BASIL) trial: A survival prediction model to facilitate clinicaldecision making. J Vasc Surg. 2010;51(5 Suppl):52S-68S9. Conte MS. Bypass versus Angioplasty in Severe Ischaemia ofthe Leg (BASIL) and the (hoped for) dawn of evidencebasedtreatment for advanced limb ischemia. J Vasc Surg.2010;51(5 Suppl):69S-75S.10. Bradbury AW, Adam DJ, Bell J, Forbes JF, Fowkes FG,Gillespie I, Ruckley CV, Raab GM; BASIL trial Participants.Bypass versus Angioplasty in Severe Ischaemia of the Leg(BASIL) trial: A description of the severity and extent ofdisease using the Bollinger angiogram scoring method andthe TransAtlantic Inter-Society Consensus II classification. JVasc Surg. 2010;51(5 Suppl):32S-42S.11. Conte MS. S Understanding objective performance goalsfor critical limb ischemia trials emin Vasc Surg.2010;23(3):129-37.12. Menard MT, Belkin M. Infrapopliteal intervention for the treatmentof the claudicant. Semin Vasc Surg 2007;20:42-53.13. Tsetis D, Belli AM. The role of infrapopliteal angioplasty. BrJ Radiol 2004;77:1007-15.14. Adam DJ, Beard JD, Cleveland T, Bell J, Bradbury AW, ForbesJF, et al, and BASIL trial participants. Bypass versus angioplastyin severe ischaemia of the leg (BASIL): multicentre,randomized controlled trial. Lancet 2005;366:1925-34.15. Abdelsalam H, Markose G, Bolia A. Revascularization strategiesin below the knee interventions. J Cardiovasc Surg(Torino) 2008;49:187-91.16. Zeller T, Sixt S, Rastan A. New Techniques for endovasculartreatment of peripheral artery disease with focus on chroniccritical limb ischemia. Vasa 2009;38:3-12.17. Dormandy JA, Rutherford RB. Management of peripheral arterialdisease (PAD). TASC Working Group. TransAtlantic Inter-Society Consensus (TASC). J Vasc Surg 2000;31:S1-S296.18. Norgren I, Hiatt WR, Dormandy JA, Nehler MR, Harris KA,Fowkes FG. Inter-society consensus for the management ofperipheral arterial disease. (TASC II). Eur J Vasc EndovascSurg 2007; 33: S1-S75.19. Isner JM, Rosenfield K. redefining the treatment of peripheralarterial disease. Role of percutaneous revascularization.Circulation 1993;88:1534-57.20. Faglia E, Clerici G, Clerissi J, Caminiti M. Quarantiello A,Curci V, et al. Angioplasty for diabetic patients with failingbypass graft or residual critical ischemia after bypass graft.Eur J Vasc Endovasc Surg 2008;36;331-8.21. Varty K, Bolia A, Naylor AR, Bell PR, London NJ.Infrapopliteal percutaneous transluminal angioplasty: a safeand successful procedure. Eur J Vasc Endovasc Surg1995;9:341-5.22. Giles KA, Pomposelli FB, Hamdan AD, Blattman SB,Panossian H, Schermerhorn ML. Infrapopliteal angioplastyfor critical limb ischemia: relation of TransAtlanticInterSociety Consensus class to outcome in 176 limbs. JVasc Surg 2008;48:128-36.23. Sadek M, Ellozy SH, Turnbull IC, Lookstein RA, Marin ML,Faries PL. Improved outcomes are associated with multilevelendovascular intervention involving the tibial vesselscompared with isolated tibial intervention. J Vasc Surg2009;49:638-44.24. Peregrin JH, Smírová S, Koznar B, Novotný J, Kovác J,Lastovicková J, et al. Self-expandable stent placement ininfrapopliteal arteries after unsuccessful angioplasty failure:one-year follow-up. Cardiovasc Intervent Radiol2008;31:860-4.
106 ■ PIE DIABÉTICO25. Ballotta E, Da Giau GD, Gruppo M, Mazzalai F, Martella B.Infrapopliteal arterial revascularization for critical limbischemia: Is the peroneal artery at the distal third suitableoutflow vessel? J Vasc surg 2008;47:952-9.26. Haimovici H. Patterns of arteriosclerotic lesions of thelower extremity. Arch Surg 1967;95:918-33.27. Fraser SCA, Al-Kutoubi MA, Wolfe JHN. Percutaneoustransluminal angioplasty of the infrapopliteal vessels: theevidence. Radiology 1996;200:33-43.28. Oderich GS, Pan<strong>net</strong>on JM, Yagubyan M, Bower TC, Hofer J,Noel AA, et al. Comparison of precuffed and vein-cuffedexpanded polytetrafluoroethylene grafts for infrageniculararterial reconstructions: a case-matched study. Ann VascSurg 2005;19:49-55.29. Ballotta E, Renon L, Toffano M, Piccoli A, Da Giau G. Patencyand limb salvage rater after distal revascularization tounclampable calcified outflow arteries. J Vasc Surg2004;39:539-46.30. Pomposelli FB, Kansal N, Hamdan AD, Belfield A, Sheahan M,Campbell DR, et al. A decade of experience with dorsalispedis artery bypass: analysis of outcome in more than 1000cases. J Vasc Surg 2003;37:307-15.31. Shah DM, Darling RC 3rd, Chang BB, Fitzgerald KM, Paty PS,Leather RP. Long-term results of in situ saphenous veinbypass. Analysis of 2058 cases. Ann Surg 1995;222:438-46.32. Klevsgard R, Risberg BO, Thomsen MB, Hallberg IR. A 1-yearfollow-up quality of life study after hemodynamically successfulor unsuccessful surgical revascularization of lowerlimb ischemia. J Vasc surg 2001;33:114-22.33. Nicoloff AD, Taylor LM, McLafferty RB, Mo<strong>net</strong>a GL, PorterJM. Patient recovery after infrainguinal bypass grafting forlimb salvage. J Vasc Surg 1998;27:256-66.34. Gray BH, Laird JR, Ansal GM, Shuck JW. Complex endovasculartreatment for critical limb ischemia in poor surgicalcandidates: a pilot study. J Endovasc Ther 2003;9:599-604.35. Holm J, Arfvidsson B, Jivegard L, Lundgren F, Lundholm K,Schersten T, et al. Chronic lower limb ischemia: a prospectiverandomised controlled study comparing the 1-yearresults of vascular surgery and percutaneous transluminalangioplasty (PTA). Eur J Vasc surg 1991;5:517-22.36. Soder HK, Manninen HI, Jaakkola P, Matsi P, Rasanen HT,Kaukanen E, et al. Prospective trial of infrapopliteal arteryballoon angioplasty for critical limb ischemia: angiographicand clinical results. J Vasc Interv Radiol 2000;11:1021-31.37. Belkin M, Knox J, Donaldson MC, Mannick JA, WhittemoreAD. Infrainguinal arterial reconstruction with nonreversedgreater saphenous vein. J Vasc Surg 1996;24:957-62.38. Dorros G, Jaff MR, Murphy KJ, Mathiak L. The acute outcomeof tibioperoneal vessel angioplasty in 417 cases withclaudication and critical limb ischemia. Cathet CardiovascDiagn 1998;45:251-6.39. Kickuth R, Keo HH, Triller J, Ludwig K, Do DD. Initial clinicalexperience with 4-F self-expanding XPERT stent systemfor infrapopliteal treatment of patients with severeclaudication and critical limb ischemia. J Vasc Interv Radiol2007;18:703-8.40. Stoner MC, deFreitas DJ, Phade SV, Parker FM, Bogey WM,Powell S. Mid-term results with laser atherectomy in thetreatment of infrainguinal occlusive disease. J Vasc Surg2007;46:289-95.41. Safian RD, Niazi K, Runyon JP, Dulas D, Weinstock B,Ramaiah V, et al. Orbital atherectomy for infrapopliteal disease:device concept and outcome data for the oasis trial.Caheter Cardiovasc Interv 2009;15:406-12.42. Hirsch AT, Haskal ZJ, Hertzer NR, Bakal CW, Creger MA,Halperin JL, et al. ACC/AHA 2005 practice guidelines forthe management of patients with peripheral arterial disease(lower extremity, renal, mesenteric, and abdominal aortic).Circulation 2006;21:e463-654.43. Romiti M, Albers M, Brochado-Neto FC, Durazzo AE,Pereira CA, De Luccia N. Meta-analysis of infrapoplitealangioplasty for chronic critical limb ischemia. J Vasc Surg2008;47:975-81.44. Bosiers M, Lioupis C, Deloose K, Verbist J, Peeters P. Two-yearoutcome after Xpert stent implantation for treating below theknee lesions in critical limb ischemia. Vascular 2009;17:1-8.45. Rand T, Basile A, Fleischmann D, Funovics D, GschwendtnerM, Haumer M, et al. PTA versus carbofilm-coated stents ininfrapopliteal arteries: pilot study. Cardiovasc IntervenRadiol 2006;29:29-38.46. Tepe G, Zeller T, Heller S, Wiskirchen J, Fischmann A,Coerper S, et al. Self-expanding nitinol stents for treatmentof infragenicular arteries following unsuccessful balloonangioplasty. Eur Radiol 2007;17:2088-95.47. Goshima KR, Mills JL, Hughes JD. A new look at outcomesafter infrainguinal bypass surgery: traditional reportingstandards systematically underestimate the expenditure ofeffort required to attain limb salvage. J Vasc Surg2004;39:330-5.
Tratamiento de la arteriopatía diabética,mediante la utilización de balónimpregnado de drogaENRIQUE SAN NORBERTO, BORJA MERINO, VICTORIA GASTAMBIDE, ISABEL ESTEVEZ,CARLOS VAQUEROServicio de Angiología y Cirugía Vascular. Hospital Clínico Universitario de Valladolid. Valladolid. España.INTRODUCCIÓNLa enfermedad arterial periférica es unapatología muy prevalente en nuestra sociedad,cuya clínica abarca desde la claudicaciónintermitente en las primeras etapas hasta eldolor de reposo y la gangrena en los casosmás graves. Los procedimientos endovascularesse han sumado durante los últimos veinteaños a los tratamientos farmacológicos y quirúrgicosabiertos de esta enfermedad. A pesardel éxito técnico inmediato, estas técnicasdeben luchar contra la restenosis y la oclusióndurante los años de seguimiento, lo queempeora sus resultados clínicos a medio ylargo plazo. No obstante, el tratamientoendovascular se ha convertido en la mayoríade las ocasiones en la opción terapéutica deprimera línea en la mayoría de las ocasiones.La liberación de fármacos localmente harevolucionado el tratamiento percutáneo delas arterias coronarias. A pesar de sus múltiplesformas de liberación, su principal avanceha sido la reducción de la restenosis tras laimplantación de stents liberadores de fármacos.Los mecanismos de la formación de laestenosis intrastent incluyen una inevitablelesión de la pared del vaso caracterizada poruna formación excesiva de tejido neointimal,llamada hiperplasia intimal, que consiste encélulas musculares lisas y matriz extracelular.El inhibir la proliferación de celular musculareslisas constituye una estrategia para evitarla formación de esta hiperplasia, y con ello deaumentar la permeabilidad de los procedimientosendovasculares.En este capítulo intentamos describir latécnica de la angioplastia con balón con fármacos(Fig. 1), en la arteriopatía de las extremidadesinferiores, así como comentar la evidenciacientífica que existe en la actualidadsobre su empleo.Figura 1. Balón liberador de fármacos, AdmirallIn.Pact (Invatec, Medtronic).BALÓN DE ANGIOPLASTIAY FÁRMACOSLos balones liberadores de fármacosconstituyen una técnica que combina la angioplastiacon balón (Fig. 2) y el efecto antiproliferativo,en el que durante un corto espaciode tiempo de contacto el fármaco debeabsorberse rápidamente por la íntima y susefectos deben ser duraderos (1).El fármaco de elección ha sido el paclitaxel.Es un antiproliferativo que induce una
108 ■ PIE DIABÉTICOFigura 2. Severa ateromatosis y trombosis de tercio distal de arteria tibial anterior y pedia tratada medianteangioplastia con balón liberador de fármaco InPact Amphirion (Invatec, medtronic).zación de balón liberador de fármacos enarterias de extremidades inferiores.Realizaron un modelo porcino de tratamientode restenosis intrastent. Los grupos experimentalesfueron dos, el grupo A, tratadosmediante balones impregnados en paclitaxel,recubiertos con una pequeña proporción deiopromide con acetona con una dosis depaclitaxel aproximadamente de 1.2 µg/mm2,el grupo B tratados con balones impregnadoscon paclitaxel, recubiertos con paclitaxeldisuelto en etilacetato, con una dosis de paclitaxelde aproximadamente 1.8 µg/mm2, elgrupo C tratados con balones convencionalesy 6.4 mg de paclitaxel disuelto en 370 mg/mlde iopromida empleado para la angiografíaselectiva pre y postprocedimiento, y grupo Do grupo control tratados con balones convencionalesy medio de contraste.Tras 30 días, la valoración de la estenosisse llevó a cabo mediante cuantificación arteriográfica,demostrando una reducción restenosisintrastent en los grupos de tratamientoen comparación con el grupo control. La inhibiciónde la proliferación neointimal másimpresionante se logró en el grupo B. En estegrupo el diámetro mínimo de la luz dentro delstent y de restenosis intrastent fue 3.3+0.5mm (p
TRATAMIENTO DE LA ARTERIOPATÍA DIABÉTICA, MEDIANTE LA UTILIZACIÓN DE BALÓN… ■ 109vos en cuanto restenosis intrastent respectoal grupo control.Este estudio demostró que la liberaciónlocal de paclitaxel, bien disuelto en el mediode contraste, bien impregnando el balón deangioplastia, reduce la restenosis intrastent,en un modelo de arteriopatía periférica porcina,de acuerdo con estudio clínicos y preclínicosen arterias coronarias. Sugiere un posiblepapel de los balones liberadores defármacos en el tratamiento de la restenosisintrastent en el territorio periférico (5).ESTUDIOS CLÍNICOSTres estudios clínicos han sido publicadossobre el tratamiento de la enfermedad arterialperiférica mediante balones liberadoresde fármaco (Tabla 1). El estudio THUNDER(Local Taxan with Short Exposure forReduction of Restenosis in Distal Arteries)(6), se trata de un estudio randomizado, ciegoy multicéntrico desarrollado en Alemania quecompara el empleo del balón Paccocath conbalones convencionales y con balones convencionalesa los que se añadió paclitaxel enel medio de contraste, con respecto a la eficaciay tolerancia en inhibir restenosis en elsector fémoro-poplíteo. Incluye un seguimientototal de 2 años y 154 pacientes con síntomasen clase 1 a 5 de Rutherford y estenosisu oclusiones de arteria femoral superficial opoplítea. La longitud media de lesiones tratadasfue 7.4 cm., siendo el 27% oclusiones totalesy además el 36% habían sido tratadas previamente.En seguimiento a 6, 12 y 24 meses,el tratamiento con el balón liberador de fármacose asoció con una reducción significativaen la pérdida tardía de la luz. Además elTabla 1Resumen de los estudios disponibles sobre la utilización de balón liberador de fármacos sobreel territorio fémoro-poplíteoTHUNDER FEMPAC LEVANT IAño 2008 2008 2010Pacientes 154 87 101Balón Paccocath Paccocath MoxyLongitud media 7.4 cm. 5.7 cm. –Trombosis 27% 16% –LLL (6 meses) mm. 0.4 (Vs 1.7*) 0.3 (Vs 0.8*) 0.45 (Vs. 1.19*)LLL: pérdida tardía de la luz (late lumen loss), * angioplastia con balón convencional.porcentaje de lesión diana revascularizada a 6,12 y 24 meses tras la intervención permanecíasiendo menor en el grupo de balón conpaclitaxel. No existió incremente en la apariciónde eventos trombóticos o embólicos enel grupo tratado con Paccocath.El estudio FEMPAC (Inhibition ofRestenosis in Femoropopliteal Arteries:Paclitaxel-Coated Versus Uncoated Balloon.Femoral Paclitaxel Randomized Pilot Trial) (7),incluyó 87 pacientes con estenosis u oclusionesdel sector fémoro-poplíteo, randomizadosa tratamiento mediante angioplastia conbalón convencional (42 pacientes) o conbalón Paccocath (45 pacientes). En el seguimientoa seis meses, los pacientes tratadoscon el balón Paccocath poseían una reducciónsignificativa de pérdida tardía de la luz. La diferenciaentre ambos grupos se mantuvodurante 18 y 24 meses tras la intervención.Además, los pacientes del grupo tratado conPaccocath mejoraban clínicamente, pero nomostraban mejoría en el índice tobillo/brazo.Comparado con el estudio THUNDER la pér-
110 ■ PIE DIABÉTICOdida tardía de luz fue menor en el grupo controlde este estudio. Sin embargo, el FEMPACconfirmaba los resultados del estudio THUN-DER, demostrando que exposiciones cortasde arterias arterioscleróticas a paclitaxelpodía ser suficientes para inhibir la restenosis.El estudio LEVANT I no ha sido publicadopor escrito, sino presentado por Scheinert en2010 en el congreso TCT (3). Incluía 101pacientes con lesiones fémoro-poplíteas primariasque habían sido predilatadas con balonespor debajo de su diámetro. Si la predilataciónera exitosa, los pacientes se randomizaban paraser tratados con el balón Moxy o un balón convencional,de diámetros concordantes con elvaso a tratar. A los pacientes con un resultadoinsuficiente tras la predilatación se les implantabaun stent y eran randomizados para una postdilatacióncon balón convencional o conMoxy.En el seguimiento a seis meses la pérdidatardía de la luz y la revascularización de la lesióndiana fueron significativamente menores en elgrupo tratado con el balón Moxy.Otros estudios que se están desarrollandoen la actualidad son el Advance 18 (Cook),Freeride (Eurocor), Levant II (Lutonix), Lixtrial (Biotronik), Inpact SFA I (Med -tronic/Invatec), PICCOLO o Inpact-Deep (3).El único estudio clínico disponible sobre elempleo de balones liberadores de fármaco enarterias infrapoplíteas es un registro prospectivode 107 pacientes tratados con In.Pact Deep(Medtronic Invatec), que fue presentado porSchmidt durante el EuroPCR en 2010. La longitudmedia de la lesión fue 175 + 89 mm.,60.5% de los pacientes poseían oclusionestotales y el resto 39.5% enfermedad estenótica.El seguimiento comprendía arteriografíatras 3 meses y exploración clínica a los 3, 6 y12 meses. Se disponía de seguimiento a los tresmeses de 93 pacientes, de los que en 71 deellos (81 lesiones) se disponía de control arteriográfico.Se observó mejoría clínica en el76.3% de los casos, mientras que el 22.4% permanecieronsin cambios y el 1.3% empeoraron.Tras 3 meses, el porcentaje de restenosis arterográficaera mayor del 50% en el 27% de laslesiones tratadas, con restenosis del segmentocompleto tratado del 11% (Van der Berg).La aplicación de los balones liberadores defármaco sobre los vasos infrapoplíteos poseemás limitaciones, comparada con el tratamientode lesiones fémoro-poplíteas (3). Laprimera de ellas es la pérdida significativa defármaco durante la navegación hasta la lesióna tratar, la cual, sin embargo, puede prevenirsemediante la predilatación del vaso con balonesconvencionales y/o con el empleo deintroductores largos o catéteres guía. Lasegunda es la posibilidad de una liberación delfármaco limitada hacia la pared del vaso motivadapor la calcificación de la misma. Tambiénpuede presentarse un cubrimiento incompletode la lesión por el fármaco, una retraccióntemprana o una disección del vaso tras el tratamiento.La combinación de este tipo de procedimientoscon otros dispositivos endovasculares,como aquellos eliminadores de placa, puedeconsiderarse el futuro del tratamiento endoluminalde las lesiones oclusivas de las extremidadesinferiores (1). Desde un punto de vistateórico, si disponemos de recursos técnicosque nos permitan eliminar la placa depositadaen la pared arterial (aterotomos) y ademásañadir fármacos de manera local que hagan queno se vuelva a restenosar el vaso a ese nivelpor aparición de hiperplasia intimal (balonesliberadores de fármacos), constituiría la estrategiaterapéutica de elección, en comparacióncon otras basadas en la implantación de materialesajenos al organismo (stents simples,recubiertos o liberadores de droga) o lesionesintimales más agresivas (cutting-balloon).CONCLUSIONESLos balones liberadores de fármaco hansupuesto un nuevo armamento en el arsenalde dispositivos endovascular que disponemosen la actualidad frente la enfermedad arterioscleróticaperiférica. La inexistencia deefectos secundarios y la ventaja de no precisarla implantación de materiales ajenos alorganismo hacen de estos procedimientosatractivos, especialmente en lesiones complejaso vasos distales.
TRATAMIENTO DE LA ARTERIOPATÍA DIABÉTICA, MEDIANTE LA UTILIZACIÓN DE BALÓN… ■ 111Sus principales ventajas de esta técnicason la ausencia de implantación de stent opolímero, y la rápida y homogénea liberaciónde altas concentraciones de fármaco a la totalidadde la superficie del vaso. No obstante, seprecisan más estudios clínicos que desarrollensus indicaciones y resultados a medio y largoplazo.BIBLIOGRAFÍA1. Manzi M, Cester G, Palena LM. Paclitaxel-coated balloonangioplasty for lower extremity revascularization: a newway to fight in-stent restenosis. J Cardiovasc Surg2010;51:567-71.2. Rowinsky EK, Donehower RC. Paclitaxel (taxol). N Engl JMed 1995;332:1004-14.3. Zeller T, Schmitmeier S, Tepe G, Rastan A. Drug-coatedballoons in the lower limb. J Cardiovasc Surg2011;52:235-43.4. Albrecht T, Speck U, Baier C, Wolf KJ, Böhm M, SchellerB. Reduction of stenosis due intimal hyperplasia afterstent supported angioplasty of peripheral arteries bylocal administration of paclitaxel in swine. Invest Radiol2007;42:579-85.5. Van Den Berg JC. Drug-eluting balloons in below-the-kneeapplications. A new technique for treating below-the-kneeocclusivedisease. Endovascular Today 2010;Sept:52-6.6. Tepe G, Zeller T, Albrecht T, Heller S, Schwarzwälder U,Beregi JP, et al. Local delivery of paclitaxel to inhibit restenosisduring angioplasty of the leg. N Engl J Med2008;358:689-99.7. Werk M, Langner S, Reinkensmeier B, Boettcher HF, Tepe G,Dietz U, et al. Inhibition of restenosis in femoropoplitealarteries: paclitaxel-coated versus uncoated balloon: femoralpaclitaxel randomized pilot trial. Circulation2008;118;1358-65.
Negative Pressure Wound Therapy in DiabeticFoot WoundsLUÍS SILVESTRE, ANA EVANGELISTA, RUY FERNANDES E FERNANDES, LUÍS MENDES PEDROAND JOSÉ FERNANDES E FERNANDES- Department of Vascular Surgery, Hospital de Santa Maria. Lisboa. Portugal- Instituto Cardiovascular de Lisboa, Lisboa, PortugalINTRODUCTIONFoot problems in diabetic patients remaina major public health issue and are the mostcommon cause of hospitalization. The lifetimerisk of foot lesions (ulcer/gangrene) in diabe -tic patients has been estimated in 15% to 25%(1) and >15% of these lesions will ultimatelylead to amputation (2). The response to treatmentof many diabetic ulcers is poor, what hasled to the development of different types ofinterventions aiming at improving healing.Recently, the International Working Group ofthe Diabetic Foot conducted a systematicreview concerning the interventions toimprove healing of these chronic ulcers (3)and concluded that Negative Pressure WoundTherapy (NPWT) as well as the hyperbaricoxygen therapy, were the only types of interventionswith published evidence to justify itsuse.The NPWT is a specific form of woundsuction within a sealed environment that iscreated by a negative pressure device with acollection container connected by a specializedtube to a porous foam which fills thewound (Figure 1). It was popularized byMorykwas and Argenta following their seminalstudies published in 1997 (4, 5) and hasbeen used since then, both as a primarytreatment of chronic and complex woundsand as an adjunct for temporary closure andwound bed preparation, preceding surgicalprocedures, such as skin grafts and flapsurgery.Figure 1. NPWT device applied to the foot wound.EFFECTS OF NEGATIVE PRESSUREWOUND THERAPYBasic research suggests several mechanismsof action of NPWT, such as mechanicalwound deformation, reduction of exudate andbacterial load, promotion of blood flow andgranulation tissue formation. However, thesemechanisms are not completely clear yet.Blood flowThe increase of blood flow seems to beproven whereas its mode of action remains
114 ■ PIE DIABÉTICOThe primary goal of treatment for theapplication of NPWT is to progress a woundtowards closure, either by secondary intentionor surgically. Secondary goals are thereduction of the amputation rate, to achievefaster wound bed preparation and to reducethe frequency of dressing changes.According to an expert panel consensus(18) NPWT must be considered as anadvanced wound care therapy for post-ope -rative University of Texas Grade 2 and 3 diaunclear.The first animal study by Morykwaset al. (5) described a maximal increase ofperfusion measured by laser Doppler using125 mmHg negative pressure lasting 5-7minutes, followed by a decrease to baseline.Wackenfors et al. (6) could find an area ofhypoperfusion close to the wound edges(< 1,5 cm), but increased perfusion slightlyaway from the wound border. Increased perfusionremained for 10 minutes, followed by afall to baseline and negative pressure higherthan 50 mmHg led to the enlargement of thearea of hypoperfusion. The author concludedthat lower negative pressures and intermittentmode are required to avoid ischemia.Chen et al. (7) observed an increase in bloodflow in wounds experimentally created in theears of white rabbits and subsequently treatedwith vacuum-assisted closure technology.Microscopic examination and image patternanalysis revealed that increased blood flowseemed to be the result of higher vasculardiameter, blood flow velocity, and blood vo -lume, as well as angiogenesis stimulation andendothelial proliferation. Z ch et al. (8) andKalmoz et al. (9) have also reportedincreased blood flow in diabetic foot ulcersand dermal burn injuries treated withNPWT, respectively.Barrier function and local woundenvironmentThe ability of NPWT to protect thewound depends on its physical ability to providean airtight barrier between the woundand the external environment as a result ofthe integral adhesive drape. This provides adual function; the drape maintains a moistwound environment, conducive to woundhealing, as well as providing a barrier to externalinsult (e.g., contamination by particulatesor microbes). Fleischmann et al. (2) (10, 11)found an effective protection in acute traumaticwounds treated with NPWT. Many referencesreport that NPWT can reduce oedema(4, 13) contributing to increase the bloodflow, although this observation is only basedon clinical observations.Granulation tissue formationand cell proliferationThe formation of granulation tissue is anessential step in wound healing process eitherby reducing wound size, allowing secondaryintention closure, or preparing the woundbed for surgical grafting.The significant increase of granulation tissueformation induced by NPWT was firstreported by Morykwas et al. (4, 13) in a swinemodel and confirmed by Fabian et al. (14) inan ischemic wound model in rabbits. Theanalysis, based on immunohistochemicalmethods of tissue biopsies taken from woundbase and edge before and after 5 days ofNPWT, found a 200% increase in endothelialcell proliferation (15). Another trial describeda significant increase of epithelialization ofsplit thickness skin graft donor sites treatedwith NPWT (16).Wound DeformationUpon application of negative pressure, thewound immediately contracts, reducing itssize (macrodeformation). Application of NPWTwound fillers in the wound bed causesmicrodeformations that are thought to contributeto granulation tissue formation and,thus, to reduce wound size (17).NEGATIVE PRESSURE WOUNDTHERAPY IN FOOT ULCERSDiabetic foot ulcers without ischemia
NEGATIVE PRESSURE WOUND THERAPY IN DIABETIC FOOT WOUNDS ■ 115betic feet without ischemia. A range of advantageswas demonstrated when comparedwith conventional therapy (saline gauzealone), and includes improvements in thespeed of granulation tissue formation,decrease in wound dimensions, time to healing,cost of treatment and rate of amputations.In general, an improved chance of fasterhealing with grade 1 diabetic foot ulcers isobserved with the application of NPWT,which may not be immediately warranted inthese wounds (19).Certain wound types may benefit moresignificantly from application of NPWT thanothers, as is the case of larger and olderwounds (more than one year in duration),which are less likely to achieve a positive outcomewith conventional therapy. When thesewounds are treated with NPWT, their ratesof healing are closer to the results obtainedwith the smaller and more recent wounds(20).With respect to the duration of NPWT,several publications favour wound closure bysecondary intention (21, 22) (Figure 2), sinceFigure 2. Wound resulting from amputation of the 3 first toes: 4 days after the surgery (A); 30 days aftersurgery and 25 after the beginning of NPWT (B); 5 months later, secondary intention healed wound (C).it has been shown to improve the rate of closureand reduce the time to healing. However,the use of NPWT until complete wound closure,which lasts for a relatively long period oftreatment, has an important impact on thepatient’s quality of life and overall cost of therapy.Therefore, NPWT can also be used as abridge to surgical grafting (23), increasing thespeed of granulation tissue formation until thewound becomes a good candidate to receive askin graft. This strategy may reduce the lengthof hospital stay and the cost of therapy.Ischemic foot ulcersMost published studies regarding diabeticfoot ulcers describe results following NPWTin adequately perfused limbs. However, it iswell recognized that diabetic patients typicallyhave tibial and peroneal arterial occlusivedisease and ischemia results from atheroscleroticmacrovascular disease besides themicrocirculatory dysfunction (24). The use ofNPWT on ischemic limb wounds is a highlyspecialized clinical scenario since in theabsence of adequate blood perfusion, normalwound healing process cannot proceed (25).Therefore, revascularization is undoubtedlythe best intervention to achieve limb salvagein patients with limb ischemia.After successful revascularization, NPWTmay be considered as an advanced woundcare therapy for lower limb ulcerations (18).In such cases, it has demonstrated to signifi-
116 ■ PIE DIABÉTICOcantly improve healing outcomes in both arte -rial ulcers (26, 27) and minor amputationstumps (28, 29). However, in up to 14% of patients,revascularization procedures are notrecommended for technical or clinical reasons(30), and even when such procedures can beperformed, they will fail in a significant proportionof cases (31). No<strong>net</strong>heless, it has beenshown that the majority of limbs with criticallimb ischemia not suitable for revascularisationcan be salvaged. In this situation, NPWT can beused with the goal of preventing amputationsince several studies have reported completehealing of wounds following NPWT in patientswith critical limb ischemia in the absence ofsuccessful revascularisation (32, 33).Infected ulcersInfection is a well-recognised barrier towound healing, which often requires systemicantibiotic therapy and surgical debridement ofinfected or necrotic tissue. NPWT should beused only as an adjunctive therapy to controlinfection and never as a substitute of suchmeasures. Despite reporting either no reductionor increasing in bacterial numbers, severalstudies identified a favourable response ofwounds to NPWT (34, 35) while othersreported even a higher rate of resolution ofclinically apparent infection in wounds treatedwith NPWT compared to alternative means(36). Such observations can be explained bythe beneficial effects of NPWT on woundhealing, which include control of oedema,increased perfusion, wound contraction andgranulation tissue formation.Wound fillers with active anti-microbialproperties like anti-microbial gauze may contributetowards infection control and silverfoam and anti-microbial WCL may, as well,have a similar effect.Contraindications to the useof Negative Pressure Wound TherapyAs previously mentioned, NPWT cannotbe considered a substitute for surgicaldebridement and its application is contraindicatedin wounds containing necrotic tissue(37). In case of infected wounds, regulatorybodies recommend careful considerationbefore NPWT is applied, and its use inuntreated osteomyelitis is contraindicated(37). The application of NPWT onto exposedorgans, exposed vasculature or anastomoticsites is also contra-indicated (18).TREATMENT VARIABLESFOR NEGATIVE PRESSUREWOUND THERAPYWound filler and wound contact layerThe wound filler is the material used to fillthe wound and is most commonly composedof polyurethane (PU) «black» foam andpolyvinyl alcohol (PVA) «white» foam orgauze. The wound filler can be directly appliedon the wound bed or used in conjunctionwith a wound contact layer (WCL) that is a thinlayer of material between the wound bed (andsometimes the surrounding skin) and theNPWT wound filler. Different wound fillersand WCL may determine a different tissueresponse to NPWT and that is why suchmaterials must be selected according to thetype of wound.No differences in the degree of blood flow(38) or wound contraction in small wounds(39, 40) have been observed with either foamor gauze, although PU foam results in morecontraction than gauze in large wounds (41). Interms of clinical outcomes, the rate of reductionof wound size (42) and the healing time(34) seem to be similar with both wound fillers.PU foam promotes rapid and thick granulationtissue formation (5, 43) whereas PVAfoam (5) and gauze (43) are thought to formthinner but more stable granulation tissue.Moreover, PU foam is responsible for a higherlevel of tissue ingrowth when comparedwith gauze (44). Removal of the foam alongwith the ingrown tissue causes tissue damageand bleeding, being painful for the patient(45). Therefore, gauze and possibly PVA foamshould be considered to reduce patient’s pain
NEGATIVE PRESSURE WOUND THERAPY IN DIABETIC FOOT WOUNDS ■ 117on dressings removal. Conversely, PU foam isrecommended when a rapid surface granulationresponse is desired, as is the case oflarge, deep, uniformly shaped wounds withfew contours or tunnels (46). Because of thelack of shape memory, gauze may contourbetter the surface of complex-shaped woundsand it is easier to apply than PU foam, whichrequires extensive pre-shaping and can bevery time consuming (46). PVA foam can alsobe used in these complex wounds since it hasmuch less shape memory than PU foam (47).The WCL is used with the purpose ofminimising tissue ingrowth into the woundfiller material and thereby protecting thewound bed from damage during the removalof wound filler and reducing de patient’s pain.It is recommended to use a non-adherentWCL when using a PU foam-based to bolstera skin graft. However, the use of a less adhe -rent filler such as gauze or PVA foam mayremove the need for additional WCL (37).Pressure levelUpon the adoption of commercial NPWT,a standard pressure setting of -125 mmHgbecame the accepted norm. In recent years,the need to modify the pressure settings for avariety of reasons suggested a benefit of arange of negative pressure levels between -40and -150 mmHg instead of a fixed value.Several in vivo studies suggest that pressuresfrom -40 to -80 mmHg are oftenenough to determine wound contraction andthat increasing pressure beyond this pointresulted in little additional contraction (39,40, 48). Other in vivo studies have also consistentlydemonstrated increased blood flow atpressures ranging from -50 to -175 mmHg(49-51).Microdeformation of the wound surfacewas also observed with pressures of -75 and-125 mmHg (40). The effect of varying levelsof pressure on formation of granulation tissuehas been evaluated in two animal studies (4,13) and one clinical study (52). The maximalgranulation tissue formation occurs in therange from -50 to -125 mmHg.The higher level of negative pressure isassociated to increased discomfort expe -rienced by the patient (49) and thereby lowernegative pressures may be considered toreduce pain.Avoidance of higher levels of negativepressure is also recommended in woundswith vascular compromise since NPWTreduces blood flow in immediate vicinity ofthe wound and this effect becomes more pronouncedwith increasing negative pressure(6, 43).On the other hand, when management ofhigh levels of exudate is a specific treatmentgoal, a higher level of negative pressure (withinthe therapeutic range of 50-150 mmHg)may be needed to adequately manage thewound fluid (54).Continuous or intermittent deliveryof pressureIntermittent delivery of pressure, whichinvolves cyclical release and reapplication ofpressure, in a typical pattern of 5 minutes onand 2 minutes off, has been shown to increasethe rate of granulation tissue formation (4,55) compared to continuous pressure.However, intermittent pressure delivery canexacerbate the pain that is experienced bythe patient at every cycle. Furthermore, duringthe off phase, exudate can accumulate andbreak the adhesive film seal. Borquist et al.(55) demonstrated that a «variable» therapyproviding smooth cycles of two different levelsof negative pressure is almost as effectiveas conventional intermittent pressure butpreferable to patients.Drainage conduitNegative pressure may be applied using anon-perforated drainage tube connected tothe top of the dressing or a perforateddrainage tube within the wound filler. Malmsjet al (56) reported that, for «wet» wounds,perforated drains inserted into the woundfiller transmitted negative pressure to thewound bed more efficiently than non-perfo-
118 ■ PIE DIABÉTICOrated drains on the surface, regardless thewound filler used (gauze or foam). Accordingto this observation, the choice of drainagetechnique may be particularly important inwounds with a large volume of exudate.NPWT IN THE TREATMENTOF LOWER LIMB ISCHEMICWOUNDS AT OUR DEPARTMENTWe have reviewed the results of the recentexperience using NPWT in the treatment oflower limb ischemic wounds at our department,which comprises 23 patients, including 22with the diagnosis of Diabetes Mellitus. Most ofthe patients (21) underwent endovascular orconventional limb revascularization beforeapplication of NPWT, according to the type andextension of vascular disease. The remaining 2patients had an anatomical pattern of diseaseconsidered not suitable for surgery.The lower extremity wounds included 11foot lesions resulting from toe amputation, 3after transmetatarsal amputation, 5 foot ulcersand 4 leg ulcers (Figure 3). All those woundswere selected to NPWT because of its largedimensions, depth and exudate production.The level of pressure ranged between -100 and -125 mmHg, the filling material usedwas the PU foam, due to its lower cost, anddressings were changed every 72 hours. Thetreatment with NPWT was discontinuedwhen all the wound bed was filled with granulationtissue or if there was no response ofthe wound to therapy. This treatment hasbeen applied for a mean of 22 days (6 to 40days).Most of the patients (19 patients: 82%)achieved a positive outcome with 10 woundsundergoing successful skin graft and 9 progressingto secondary intention healing. In theremaining 4 patients the wounds have wor -sening in spite of the NPWT, requiring abelow-knee amputation in 3 cases and anabove-knee amputation in the other one(Figure 4).Figure 4. Outcomes of NPWT in ischemic woundsat our department revision.CONCLUSIONFigure 3. Type of ischemic wounds undergoingNPWT at our department revision.NPWT has proven to be effective in thewound protection and improvement of healingprocess, allowing a faster surgical graftingor secondary intention closure. Theseimproved outcomes, compared to conventionaltherapy, contribute to improve patientcomfort and result in a significant reductionof costs. It is thereby a valuable tool that mustbe used to improve the care of foot lesions indiabetic patients and reduce the risk of associatedamputations.REFERENCES1. Singh N, Armstrong DG, Lipsky BA. Preventing foot ulcersin patients with diabetes. JAMA 2005;293:217-28.
NEGATIVE PRESSURE WOUND THERAPY IN DIABETIC FOOT WOUNDS ■ 1192. Ramsey SD, Newton K, Blough D, McCulloch DK, SandhuN, Reiber GE, Wagner EH. Incidence, outcomes, and cost offoot ulcers in patients with diabetes. Diabetes Care1999;22:382-7.3. Game FL, Hinchlife RJ, Apelqvist J, et al. A systematic reviewof interventions to enhance the healing of chronic ulcersof the foot in diabetes. Diabetes Metab Res Rev 2012;28(Suppl 1): 119-141.4. Morykwas MJ, Argenta LC, Shelton-Brown EI, et al. Vacuumassistedclosure: a new method for wound control and treatment:animal studies and basic foundation. Ann Plast Surg1997;38:553-62.5. Argenta LC, Morykwas MJ. Vacuum-assisted closure: a newmethod for wound control and treatment: clinical experience.Ann Plast Surg 1997;38:563-76.6. Wackenfors A, Sj gren J, Gustafsson R, et al. Effects ofvacuum assisted closure therapy on inguinal wound edgemicrovascular blood flow. Wound Repair Regen2004;12:600-6.7. Chen SZ, Li J, Li XY, Xu LS. Effects of vacuum-assisted closureon wound microcirculation: an experimental study.Asian J Surg. 2005; 28(3): 211–217.8. Zöch G. VAC-Therapie und Laser-induzierte Fluoreszenzvon Indozyaningrün (IC-VIEW) – eine Bestimmung derWundperfusion beim Diabetischen Fußsyndrom.Zentralblatt Chir 2004; 129(Suppl): 80–81.9. Kamolz LP, Andel H, HaslikW, et al. Use of subatmosphericpressure therapy to prevent burn wound progression inhuman: first experiences. Burns 2004; 30: 253–258.10. Fleischmann W, Kinzl L. Gewebeproliferation durchVakuumtherapie. Langenbecks Ann Chir 1995; 112(SupplII): 256–260.11. Fleischmann W, Strecker W, Bomelli M, Kinzl L.Vakuumversiegelung zur Behandlung desWeichteilschadens bei offenen Frakturen. Unfallchirurg1993; 96: 488–492.12. Morykwas MJ, Simpson J, Punger K, Argenta A, Kremers L,Argenta J. Vacuum-assisted closure: state of basic researchand physiologic foundation. Plast Reconstr Surg 2006;117(7 Suppl):121S–126S.13. Morykwas MJ, Faler BJ, Pearce DJ, et al. Effects of varyinglevels of subatmospheric pressure on the rate of granulationtissue formation in experimental wounds in swine.Ann Plast Surg 2001;47:547-51.14. Fabian TS, Kaufman HJ, Lett DE, et al. The evaluation of subatmosphericpressure and hyperbaric oxygen in ischemicfull-thickness wound healing. Am Surg 2000: 1136–1143.15. Walgenbach KJ, Starck JB. Induction of angiogenesis followingvacuum sealing. ZfW 2000; 13: 9–10.16. Genecov DG, Schneider AM, Morykwas MJ, et al. Pressuredressing increases the rate of skin graft donor site reepithelialization.Ann Plast Surg 1998; 40: 219–225.17. Saxena V, Hwang CW, Huang S. Vacuum-assisted closure:microdeformations of wounds and cell proliferation. PlastReconstr Surg 2004;114:1086-96.18. Vig S, Dowsett C, Berg L, et al. Evidence-based recommendationsfor the use of negative pressure wound therapy inchronic wounds: steps towards an international consensus.J Tissue Viability 2011 Mar;20 (Suppl 1):S1-18.19. Oyibo SO, Jude EB, Tarawneh I, Nguyen HC, Harkless LB,Boulton AJ. A comparison of two diabetic foot ulcer classificationsystems: the Wagner and the University of Texaswound classification systems. Diabetes Care 2001 Jan;24(1):84-8.20. Lavery LA, Boulton AJ, Niezgoda JA, Sheehan P. A comparisonof diabetic foot ulcer outcomes using negative pressurewound therapy versus historical standard of care. IntWound J 2007 Jun;4(2):103-13.21. Armstrong DG, Lavery LA, Diabetic Foot StudyConsortium. Negative pressure wound therapy after partialdiabetic foot amputation: a multicentre, randomizedcontrolled trial. Lancet 2005 Nov 12;366(9498):1704-10.22. Blume PA, Walters J, Payne W, Ayala J, Lantis J. Comparisonof negative pressure wound therapy using vacuum-assistedclosure with advanced moist wound therapy in the treatmentof diabetic foot ulcers: a multicenter randomizedcontrolled trial. Diabetes Care 2008 Apr;31(4):631-6.23. McCallon SK, Knight CA, Valiulus JP, Cunningham MW,McCulloch JM, Farinas LP. Vacuum-assisted closure versussaline-moistened gauze in the healing of postoperative diabeticfoot wounds. Ostomy Wound Manage 2000 Aug;46(8):28-32.24. LoGerfo FW, Coffman JD. Current concepts. Vascular andmicrovascular disease of the foot in diabetes. Implicationsfor foot care. N Engl J Med 1984;311:1615-9.25. Slovut DP, Sullivan TM. Critical limb ischemia: medical andsurgical management. Vasc Med 2008 Aug;13(3):281-91.26. Aust MC, Spies M, Guggenheim M, Gohritz A, Kall S,Rosenthal H, et al. Lower limb revascularisation precedingsurgical wound coverage e an interdisciplinary algorithmfor chronic wound closure. J Plast Reconstr Aesthet Surg2008 Aug;61(8):925-33.27. Lejay A, Creton O, Thaveau F, Bajcz C, Stephan D, Kretz JG,et al. Current clinical applications of vacuum-assisted closure(VAC) in vascular surgery. J Mal Vasc 2008 Dec;33(4,5):196-201.28. Rivolta N, Piffaretti G, Tozzi M, Lomazzi C, Maida S, Riva F,et al. Two-stage treatment for diabetic foot: surgical peripheralrevascularization and minor amputation in day-surgeryadmission. Int J Surg 2008;6(Suppl. 1):S75-7.29. Nishimura K, Kanaoka Y, Ishiguro S, Harada S, Shiraya S,Fujiwara Y, et al. Vacuum-assisted closure for bilateral severeischemic foot after revascularization: a case report. IntAngiol 2009 Aug;28(4):340-3.30. Marston WA, Davies SW, Armstrong B, et al. Natural historyof limbs with arterial insufficiency and chronic ulceration treatedwithout revascularization. J Vasc Surg 2006;44:108-14.31. Romiti M, Albers M, Brochado-Neto FC, Durazzo AE,Pereira CA, De Luccia N. Meta-analysis of infrapoplitealangioplasty for chronic critical limb ischemia. J Vasc Surg2008 May;47(5):975-81.32. Clare MP, Fitzgibbons TC, McMullen ST, Stice RC, Hayes DF,Henkel L. Experience with the vacuum assisted closurenegative pressure technique in the treatment of nonhealingdiabetic and dysvascular wounds. Foot Ankle Int 2002Oct;23(10):896-901.33. Horch RE, Dragu A, Lang W, Banwell P, Leffler M, Grimm A,et al. Coverage of exposed bones and joints in critically ill
120 ■ PIE DIABÉTICOpatients: lower extremity salvage with topical negativepressure therapy. J Cutan Med Surg 2008SepeOct;12(5):223e9.34. Hu KX, Zhang HW, Zhou F, et al. A comparative study of theclinical effects between two kinds of negative-pressurewound therapy. Zhonghua Shao Shang Za Zhi 2009;25:253-7.35. Weed T, Ratliff C, Drake DB. Quantifying bacterial bioburdenduring negative pressure wound therapy: does thewound VAC enhance bacterial clearance? Ann Plast Surg2004;52:276-9.36. Stannard JP, Volgas DA, Stewart R, et al. Negative pressurewound therapy after severe open fractures: a prospectiverandomized study. J Orthop Trauma 2009;23:552-7.37. Birke-Sorensen H, Malmsj M, Rome P, Hudson D, Krug E,Berg L, et al. Evidence-based recommendations for negativepressure wound therapy: Treatment variables (pressurelevels, wound filler and contact layer) - Steps towards aninternational consensus. J Plast Reconstr Aesthet Surg2011;64(Suppl. 1-16).38. Malmsj M, Ingemansson R, Martin R, et al. Wound edgemicrovascular blood flow: effects of negative pressurewound therapy using gauze or polyurethane foam. AnnPlast Surg 2009;63:676-81.39. Malmsj M, Ingemansson R, Martin R, et al. Negative-pressurewound therapy using gauze or open-cell polyurethanefoam: similar early effects on pressure transduction and tissuecontraction in an experimental porcine wound model.Wound Repair Regen 2009;17:200-5.40. Borgquist O, Gustafsson L, Ingemansson R, et al. Micro- andmacromechanical effects on the wound bed of negativepressure wound therapy using gauze and foam. Ann PlastSurg 2010 Jun;64(6):789-93.41. Malmsj M, Lindstedt S, Ingemansson R. Effects of foam orgauze on sternum wound contraction, distension and heartand lung damage during negative pressure wound therapyof porcine sternotomy wounds. Interact CardiovascThorac Surg; 2011; 12 (3): 349-354.42. Dorafshar A, Franczyk M, Lohman R, Gottlieb L. «AProspective Randomized Trial Comparing SubatmosphericWound Therapy with a Sealed Gauze Dressing and theStandard Vacuum Assisted Closure Device». In press, AnnPlast Surg. 2011 Jun 27. [Epub ahead of print].43. Malmsj M, Borgquist O. NPWT settings and dressing choicesmade easy. Wounds Int 2010;1(3).44. Sandnes DK, Sobel M, Flum DR. Survival after lower extremityamputation. J Am Coll Surg 2004;199:394.45. Franczyk M, Lohman RF, Agarwal JP, et al. The impact of topicallidocaine on pain level assessment during and aftervacuum-assisted closure dressing changes: a double-blind,prospective, randomized study. Plast Reconstr Surg2009;124:854-61.46. Jeffery SL. Advanced wound therapies in the management ofsevere military lower limb trauma: a new perspective.Eplasty 2009;21(9):e28.47. Gabriel A, Shores J, Bernstein B, et al. A clinical review ofinfected wound treatment with vacuum assistedClosure®(V.A.C. ®) therapy: experience and case series.Int Wound J 2009;6:1-25.48. Torbrand C, Ugander M, Engblom H, et al. Wound contractionand macro-deformation during negative pressure therapyof sternotomy wounds. J Cardiothorac Surg2010;30(5):75.49. Timmers MS, Le Cessie S, Banwell P, et al. The effects of varyingdegrees of pressure delivered by negative-pressurewound therapy on skin perfusion. Ann Plast Surg2005;55:665-71.50. Borgquist O, Ingemansson R, Malmsj M. Wound edgemicrovascular blood flow during negative-pressure woundtherapy: examining the effects of pressures from -10 to -175 mmHg. Plast Reconstr Surg 2010;125:502-9.51. Petzina R, Gustafsson L, Mokhtari A, et al. Effect of vacuumassisted closure on blood flow in the peristernal thoracicwall after internal mammary artery harvesting. Eur JCardiothorac Surg 2006;30:85-9.52. McCord SS, Naik-Mathuria BJ, Murphy KM, et al. Negativepressure therapy is effective to manage a variety of woundsin infants and children. Wound Repair Regen 2007;15: 296-301.53. Wackenfors A, Gustafsson R, Sj gren J, et al. Blood flow responsesin the peristernal thoracic wall during vacuum-assistedclosure therapy. Ann Thorac Surg 2005;79:1724-30.54. Borgquist O, Ingemansson R, Malmsj M. The influence oflow and high pressure levels during negative pressurewound therapy on wound contraction and fluid evacuation.Plast Reconstr Surg; 2011 Feb;127(2):551-9.55. Borgquist O, Ingemansson R, Malmsj M. The effect of intermittentand variable negative pressure wound therapy onwound edge microvascular blood flow. Ostomy WoundManage 2010;56:60-7.56. Malmsj M, Lindstedt S, Ingemansson R. Influence on pressuretransduction when using different drainage techniquesand wound fillers (foam and gauze) for negative pressurewound therapy. Int Wound J 2010;7:406-12.
The Role of Hyperbaric Oxygen Therapyin the Treatment of Diabetic Foot UlcersISABEL CÁSSIO*, NELSON OLIVEIRA*, LISA BORGES* AND LUÍS CABRAL**.*Department of Angiology and Vascular Surgery, Hospital do Divino Espírito Santo-Ponta Delgada,Azores, Portugal.**Hyperbaric and Subaquatic Medicine Unit, Hospital do Divino Espírito Santo-Ponta Delgada,Azores, Portugal.DEFINITIONHyperbaric oxygen therapy (HBOT) consistson breathing oxygen at a higher pressurethan the local atmospheric pressure (1).Although generic, this definition associatesthe two most important concepts of thistherapy. Oxygen can only be administered byinhalation in a pressurized hyperbaric chamber.Subsequently, not all therapies thatinvolve oxygen or pressure are consideredHBOT. This restrictive definition is necessarybecause, throughout history, this concept hasbeen disrespected, and the term HBOT hasbeen misused, occasionally in mercenary wayswith lack of clinical results. Such difficulty inunderstanding the scientific basis of this me -dical therapy unfortunately led to a troubleddevelopment of HBOT.HYSTORICAL PERSPECTIVEThe physiologic concepts that allow thesafe administration of pressurized oxygenwere developed in the beginning of the 17 thcentury. The first investigations in this areafocused more on pressure variation as a the -rapeutical agent rather than on oxygen admi -nistration. In 1662, the British cleric Henshawcrowned his investigation with a publicationwhere he states that chronic pathologies be -nefitted from low atmospheric pressures andacute pathologies from a higher atmosphericFigure 1. Multiplace hyperbaric chamber installedin our Institution-outer view.pressure (2). Even after the discovery of oxygenin 1774, for decades, only pressure variationeffects were taken into account, whenstudying some pathophysiological processes.With the industrial development in the19 th century, more precisely in 1870, duringthe construction of the Brooklyn bridge foundation,Paul Bert gave hyperbaric medicine abreakthrough by describing the decompressiondisease on the constructors working inside aircompressed«caissons» (2). The attention ofnaval armed forces was drawn by his investigation,allowing the development of the vast va -riety of underwater exploration devices availablenowadays (3). In 1879, the French SurgeonFontaine described the connection betweenatmospheric pressure elevation and theincrease of the blood-dissolved oxygen frac-
122 ■ PIE DIABÉTICOFigure 2. Multiplace hyperbaric chamber installedin our Institution-inner view.tion. His surgical successes led to the constructionof a portable hyperbaric chamber wherehe performed surgical interventions (2).This scientific peak in hyperbaric medicinecontributed paradoxically to the beginning ofits first decline. In 1921, Cunningham constructeda hyperbaric chamber with 20 metersof diameter, in Cleveland Ohio. Inside, privaterooms, a dining room, and a smoke room weredistributed in five floors. The project promoterpromised cure for diabetes, cancer, arterialhypertension and many other diseases. Afternine years of activity without credible scientificevidence, «Cunningham’s sanatorium» was shutdownand afterwards demolished (4).The potential fire and explosion hazardassociated to HBOT limited for years its‘ use.Several projects developed in the 1930’s werenot applied to clinical practice due to safetyissues in the administration of hyperbaricoxygen. After these technical limitations weresurpassed, many personalities dedicatedthemselves to HBOT but only Ito Boerema, anotable Professor of Surgery in the Universityof Amsterdam, Netherlands, possessed thegeniality that guaranteed him the epithet of«Father of Modern Hyperbaric Medicine». In1960, along with his collaborators, he pu -blished an article entitled «Life withoutblood» (5). This scientific publicationrelaunched credibility and investigation onHBOT. In this famous article, the authorsdescribed how three pigs were kept aliveafter replacing all circulating blood by plasma,under HBOT. This work marks the beginningof the evidence-based HBOT era and allowedProfessor Boerema to perform several cardiacsurgeries, like the correction of a greatvessel transposition, Fallot’s tetralogy and pulmonarystenosis in a hyperbaric operatingtheatre specially built for the purpose (2).Since the beginning of the 21 st century,the number of hyperbaric centers, scientificsocieties and published articles has grownlargely. Hyperbaric medicine is recognized as amedical subspecialty in several countries.Therapeutical indications have been extensivelyinvestigated and are explained by tenmain physiological principles.PHYSIOLOGICAL PRINCIPLES1. Plasma-dissoluted oxygen increase - In isobaricconditions, with an inspired fraction of oxygen(FiO 2) of 21%, if one excludes the oxygencontained in the erythrocytes, plasmacontains 0.3% of dissolved oxygen. This percentageincreases to 1.88% with a FiO 2of100%, which is equivalent to an arterialoxygen partial pressure (PaO 2) of673mmHg, at sea level pressure conditions.When pressure is elevated, the blood-dissolvedfraction of gas is increased. Erythrocyte-bindedoxygen remains unchanged asthese are already completely saturated. Inconsequence, at a pressure of 3 absoluteatmospheres (ATA), for example, plasmadissolvedoxygen will increase to 6%, andPaO 2would be 2 193 mmHg 6 .2. Reduction of gaseous bubbles and circulatoryobstruction-Boyle-Mariotte law states thatvolume varies inversely to pressure. Any
THE ROLE OF HYPERBARIC OXYGEN THERAPY IN THE TREATMENT OF DIABETIC FOOT ULCERS ■ 123closed-space contained gas, as a gas-bubblein our body, will reduce to half its originaldiameter in submitted to the double or theambient pressure.3. Angiogenic effects - High levels of circulatingoxygen have been demonstrated to increasethe production of growth factorsres ponsible for promoting neovascularization(7, 8). This effect is responsible for theretinopathy of prematurity that occurs inpremature neonates’ retina, in which theexcessive vascular proliferation is proportionalto the FiO 2used.4. Neocolagenization Potentiation-Fibro blasticactivation only occurs when a PaO 2diffe -rential above 30-40mmHg 9 is found. Pathologicprocesses that produce gradual andchronic tissue hypoxia respond to HBOTwith incremental tecidual regenerationwhen oxygen is administered in an intermi -ttent dose.5. Hypoxic tissue preservation-HBOT providesenough oxygen for tissues with an acutecompromise of blood flow (10). Theincrease of plasma-dissolved oxygen by 15-fold directly accounts for a 4-fold increasedoxygen diffusion distance, from the peripheralcapillaries (6). This additional tecidualoxygenation is only maintained during deHBOT session but may allow a sufficientperfusion time to solve definitively theproblem and thus tissue preservation.6. Phagocytic capacity activation of polymorphonuclearleucocytes (PMNL) – PMNLdependent phagocytosis and bacteriallysis rely upon oxygen availability. In vitroand in vivo studies have demonstratedincreased neutrophilic and macrophagicactivity under high pressure and/or oxygenconditions (11, 12).7. Bacteriostatic and bactericidal effect - Somesporulated anaerobic bacteria do notresist in hyperoxic environments. Also, asynergic action takes place between certainantibiotics and oxygen, such asaminoglycosides or tobramycin, expandingtheir effective life-half (13).8. Toxin inactivation - Alfa-toxin of Clostridiumperfringens, responsible for the developmentof septic shock and a rapid evolutionof clostridial myonecrosis (gaseousgangrene) is inactivated by HBOT (14).9. Vasoconstriction-HBOT induces a selectivevasoconstriction in hyperoxic vascularterritories as vasodilatation takes place inhypoxic areas. This is known as Robin-Hood effect. This beneficial phenomenonmay be applied in compartimental syndrometreatment, acute ischaemic limbpathologies or in skin grafts to reduceinterstitial oedema15. Published studieshave demonstrated a reduction of fluidneeds in patients with severe burns, ifsubmitted to a HBOT protocol15.10. Carboxihaemoglobin elimination-Haemoglobin(Hb) has a 240-fold greater affinity forcarbon monoxide (CO) than oxygen. MeanCO-Hb ligation time breathing non-enrichedair at sea level is 520 minutes. However,a single HBOT session under 3 ATAreduces this time to 23 minutes (10, 16).INDICATIONSUndersea and Hyperbaric Medical Society(UHMS) leads a criterious approval processon all HBOT indications. The list of indicationsfor HBOT published by the UHMS (17) isused by insurance companies in the UnitedStates for comparticipation and refundablepurposes. It is important to state that insur-Figure 3. A patient currently on HBOT in ourInstitution-initial presentation.
124 ■ PIE DIABÉTICOance companies only approve HBOT treatmentin the Diabetic Foot ulcers class III orgreater (Wagner classification).Table IEvidence-based indicationsfor hyperbaric treatmentArterial gaseous embolismCarbon monoxide (CO) poisoningClostridial myonecrosis (Gaseous gangrene)Crush-lesions, compartimental syndrome andacute traumatic ischaemic lesionsDecompression sickness (diving acident)Central retinal artery occlusionWound-healing optimization in chronic wounds(with arterial insuffiency)Severe anemiIntracranial abcessNecrotizing soft-tissue infectionsRefractory osteomyelitisRadiation induced lesions (soft tissue and bonenecrosis)Compromised grafts and flapsThermal burns (acute phase)Sudden neurossensorial idiopathic hearing lossIn the light of the ten physiological basicprinciples enumerated above, additionalHBOT utilizations may be hypothesized.Several multicenter randomized trials arecurrently taking place, which might add someindications to this list. Other reports exist indiverse pathologies where a beneficial rolehas been attributed to HBOT but cannot findexplanation in these same principles. Thesereports must be considered regarding theirlevel of the scientific evidence.CONTRAINDICATIONSThe only absolute counter indication forHBOT is a untreated pneumothorax (18).Several relative counter indications have beenreported (10), which require careful evaluationby the hyperbaric physician before initiatingtreatment.Table IIContraindicationsfor hyperbaric treatmentRegular medications: doxorubicin, cisplatin, disulfiramor mafenide acetateAcute superior respiratory infection (equalizationdifficulties)Pulmonary emphysemaPrevious thoracic surgeryPregnancy (unknown effects)Previously, HBOT was counter indicatedin patients with neoplasms because of thehigh risk of tumor expansion due to angiogeniceffect of the treatment. However, a synergiceffect has been reported betweenchemotherapy and increased tumor oxygenation,with improved clinical response to theoncologic treatment (19). This is still an experimentalfield and the patient should be awareof the risks.ADVERSE EFFECTSOxygen is toxic in excessive doses. As inwith any medication, potential side effectsmust be accounted when prescribing oxygentherapy, especially in a hyperbaric environment.Oxygen toxicity may appear in twoforms (10).The acute form, more visible, is also easierto resolve and is known as the Paul Berteffect. It is characterized by central nervoussystem toxicity at high PaO 2. The sessionassistant must be alert for the alert signs (vertigo,irritability, facial muscle tremors, dyspnoea,nausea or vomiting, blurred or tunneledvision) that usually precede a tonic-clonicseizure (10). Seizure treatment is based onadministrating atmospheric air. HBOT protocolsare programmed to avoid this kind oftoxicity.The chronic form, also known as theLorrain Smith (10) effect is more concerningbecause of the insidious and eventually irreversibleevolution it may assume. Pulmonary
THE ROLE OF HYPERBARIC OXYGEN THERAPY IN THE TREATMENT OF DIABETIC FOOT ULCERS ■ 125fibrosis is the hallmark of this entity, andresults from prolonged exposure to oxygen.This effect is avoided by respecting expositiontables that limit the number of hours of expositionaccording to the administered FiO 2.HYPERBARIC TREATMENT DOSAGEA hyperbaric chamber is defined as a pressurizablecontainer that has the capacity toaccommodate one or several individuals inorder to submit them to a medical treatment.Therefore, multiple types of chambers exist,from monoplace chambers (oxygen pressurized)to multiplace chambers (air pressurized)according to the number of patients they mayaccommodate. Any one of the alternatives hasadvantages and disadvantages, but securityand versatility lead to the increased numberof multiplace chambers.Treatment protocols take into accountthe toxic effect and exposition time to oxygenof the patient and the assistants. AllFigure 4. A patient currently on HBOT in ourInstitution-after 20 sessions.patients, independently of their pathology, aretreated according to the same table, excludingdiving accident patients who have a specifictreatment protocol. The United States ofAmerica Navy’s tables are the most commonlyused, and among these, the most appropriatefor non urgent indications is the US9 3 . Onthis protocol, patients are submitted daily to3 periods of 30 minutes breathing 100% oxygenat 2.4 ATA. The number of sessions variesaccording to the illness treated, but usuallymore than 20 and less than 80 are recommended.Oxygen is given by inhalation throughfacial masks or head tents after pressurizationof the chamber to the treatment depth.Modern hyperbaric chambers have air conditioningand entertainment systems in orderto offer the best possible comfort to patients.DIABETIC FOOT –A PUBLIC–HEALTH ISSUEMultiple etiopathogenic factors contributeto the development of diabetic foot ulcers,such as autonomic, motor and sensory neuropathy,peripheral microvascular andmacrovascular disease, structural foot deformities(Charcot arthropathy), abnormal footmechanics, which lead to increased load ofpressure, and predispose to foot trauma (20,21, 22). Diabetic ulcer-related complicationsare the most frequent cause of hospitaladmissions in the diabetic population (about25% of all admissions) (20, 21). They are estimatedto affect 15% of all diabetics in anymoment throughout their lives (21) and tohave a 5-year cumulative recurrence rate of66 to 70% (20, 22).Non-healing diabetic foot ulcers with over30 days of evolution are associated with apoor outcome as these are often complicatedwith infection, osteomyelitis, and gangrene,which in turn may lead to amputation.Diabetic ulcer-related complications accountalone for more than two thirds of all nontraumaticamputations (20) and 85% of all diabeticlower limb amputations are preceded by
126 ■ PIE DIABÉTICOan ulcer (23). Diabetic patients with footulcers have an increase of 2.4 times in theoverall mortality risk in comparison to thosewithout foot ulcers (21).Treatment and prevention of diabetic footulcers should be based on preventing progressionof neuropathy through rigorousmetabolic control, addressing peripheral arterialdisease in a precocious fase, appropriatewound dressing and thorough debridement,pressure relief, infection control and healtheducation in foot care and footwear (20, 22).PHYSIOLOGIC EFFECTSOF HIPERBARIC OXYGEN THERAPYWound-healing impairment in the diabeticfoot results from an imbalance between oxygensupply, due to diminished local blood flowcaused by micro and macrovascular arterialdisease, autonomic neuropathy, tissue oedema,compromised erythrocyte deformabilityand increased glycated haemoglobin with consequentabnormal oxygen delivery, but alsofrom an increased tissue oxygen demand. Inan infected ulcer, oxygen needs can be as highas 20 times of normal tissue demands (23).Both of these mechanisms result in a loweroxygen pressure in the tissue surrounding thewound, which results in compromised healing.Beneficial effects of HBOT with applicabilityin the Diabetic Foot setting are:Correction of tissue Hypoxia – HyperbaricOxygen Therapy (HBOT) corrects woundhypoxia by increasing the total blood content ofoxygen, principally the plasma dissolved fractionof Oxygen. Physiologic vasoconstriction occursin hyperoxic tissues directing blood to hypoxicareas, thus accounting for the redistribution ofoxygen to these tissues. These mechanisms areresponsible for the increase of transcutaneousoxygen pressure (TcPO 2) measured in the tissuesurrounding the wound. In normal, nonhypoxictissue, TcPO 2is approximately 40mmHg. Under HBOT, the partial pressure ofoxygen in the hypoxic wounds may increasefrom a basal 10-20 mmHg to 200 mmHg (24).In a prospective randomized trial, it wasdemonstrated that the TcPO 2measured in thetissue around the wound increased from 22 to454 mmHg, approximately, at the end of thefirst HBOT session (25).Hemorrheiologic effect – Red blood celldeformability is improved which also amelioratesmicrocirculation (24, 26, 27, 28).Oedema reduction-Vasoconstriction se -condary to the increase in arterial PaO 2decreases intracapillary pressure, leading toreduction of vasogenic tissue edema and interstitialpressure, which contribute to a better tissueoxygenation (20, 23, 24, 26, 27, 29).Wound healing-The increased O 2concentrationassociated with HBOT stimulates fibroblasticcellular division, collagen synthesis andextracellular transportation, and promotes inincrease in extracellular matrix protein production,increasing collagen deposition in the connectivetissue matrix. HBOT also increases theenzymatic activity of the lisin-oxydase that promotescrossed-linkage collagen molecules,therefore reinforcing the structural resistanceof the connective tissue matrix. This processwill indirectly promote angiogenesis and epithelizationof the wounds, by providing them anadequate collagen matrix for structural support(18, 20, 23-29).Angiogenesis – Oxygen (O 2) gradientsthroughout the ulcer resulting from HBOTpromote endothelial growth factor productionwhich in turn leads to capillary growththus stimulating directly angiogenesis (18, 20,23-29).Indirect antimicrobial effects– Increased leukocyte phagocytic activity-Neutrophil phagocytic capacity is null whenlocal O2 tension is less than 28 mmHg.Tissue O 2tension elevation has beneficialeffect on leukodiapedesis and alsoneutrophil phagocytic activity (18, 20, 21,23-29).– Reinforcement of leukocyte toxic effect onbacteria-Hyperoxia is responsible forincreasing superoxide radical productionby leucocytes, which has a bacterial lyticeffect inside phagossomes (18, 20, 21,23-29).
THE ROLE OF HYPERBARIC OXYGEN THERAPY IN THE TREATMENT OF DIABETIC FOOT ULCERS ■ 127– Synergic effects with antibiotics-The beneficialeffect of HBOT on neovascularization ofthe wounds, increasing tissue perfusion,leads to a larger local bioavailability ofantibiotics, prolonging their action and reinforcingtheir antimicrobial power (28).Direct antimicrobial effects– Bactericidal effect-Hyperoxia leads toincreased endobacterial oxygen radicalswhich in turn lead to abnormal protein synthesisand enzyme-chain inactivation, consequentlycausing bacterial membrane structuredisrupture. This process is more evidentin anaerobic microorganisms, such asClostridium, because of lack of anti-oxidativesystems to defend them from oxygen radical-inducedstress. Even before exerting thisbactericidal effect, HBOT already inhibits theproduction of toxins by those bacteria.HBOT also promotes aerobic bacteria lysisby supersaturating the existent anti-oxidativesystems with oxygen radicals, whichends in their neutralization (18, 24-29).– Bacteriostatic effect-HBOT leads to a nicotinamideadenine dinucleotide phosphateoxidase(NADPH) depletion, with consequentreduction of protein and nucleic acidsynthesis. This process is responsible insu -fficient bacterial supplies of adenosi<strong>net</strong>riphosphate resulting in lower bacterialproliferation (18, 24-29).EVIDENCED-BASED BENEFICIALEFFECTS OF HYPERBARIC OXYGENIN DIABETIC FOOT ULCERSImpact on ulcer healing and wound sizereduction – Most of the available studies whichincluded patients with nonhealing ulcers supporta favorable effect on the account ofHBOT (table IV). Although supported bymore recently published randomized studies,higher rates of wound reduction and healingrates (table IV) are found in non-randomizedstudies.Abidia et al (27) published the first doubleblinded,randomized controlled trial in 2003,with healing rates in the HBOT group of 63%compared to 28% in the control group at 6months of follow-up.Recently, Löndahl et al (30) in an also double-blinded,randomized controlled trialreported healing rates of 52% and 29%(P=.03) after a 1-year period in the HBOTand control group respectively. In this report,patients had undergone a thorough vascularassessment and were found to be poor candidatesfor revascularization. Limitations havebeen stressed, in particular, only 56% of eligiblecandidates were enrolled and only 57% ofthese completed the scheduled treatmentsessions (40), although 80% reached the 35 thsession. One may speculate upon what resultswould had been obtained, had more patientscompleted the scheduled program.Impact on long-term ulcer healing – A sustainedbeneficial effect has been consistentlydetailed in many reports, up until 3 years (30-34). Albuquerque e Sousa (34) published in2005 a retrospective study that included 96patients with diabetic foot ulcers. Amongexcluded patients were all patients whohealed their diabetic foot lesions during theprogrammed HBOT. Follow-up was continuedfor a median period of 45 months for theexperimental group (patients who had beentreated with HBOT but without full cicatrizationof their foot lesions) and of 55 monthsfor the control group. The author found that41.2% of HBOT patients healed their woundin comparison to 3.1% in the control group,difference that proved statistically significant(confidence interval of 95%). A metanalysis onthe behalf of The Cochrane Collaboration(35) was published in 2004, and concludedthat HBOT significantly reduced the risk ofmajor amputation and may improve thechance of healing, thus supporting applicationof this treatment in patients with diabetic footulcers.Impact on amputation rates – Amputationsare the last resource in the management ofdiabetic foot complications and althoughregarded as failure of the treatment of diabe -tic foot, 12% of all diabetic foot ulcers willprogress to amputation (36). Data published
128 ■ PIE DIABÉTICOhas supported a significant relative risk reductionfor major amputations in patients receivingHBOT but not for minor amputations(table IV).A lack of consistency in these evidencesallied to methodological issues of thosereports can be pointed out. Looking only tothe randomized controlled trials (RCT), wefind that Duzgun et al (37) found that HBOTwas associated to lower amputation rates (0%in the HBOT group versus 34% in the controlgroup), findings that are also in line with Fagliaet al (31). However, in the recently publishedRCT by Löndahl et al (30) and in the reportfrom Abidia et al (27) in 2003, this beneficialeffect was not supported.Absolute difference in Transcutaneous oxygentension-Several studies (27, 31, 38) demonstratesignificant differences of transcutaneousoxygen tension (TcPO 2) betweenpatients who underwent HBOT comparativelyto control groups. In the report publishedby Lin et al (38) a median TcPO2 of 35.8 and57.7 mmHg were found in the control and theexperimental groups.Impact on quality of life-Additionally toameliorating the healing process and thusavoiding amputation, HBOT has been repor -ted to have an important psychologicalimpact. Abidia et al (27) evaluated generalhealth and vitality domains in the Short-form36 questionnaire and found in improvementin well-being. Reduction in limitations due tophysical and emotional health and a progressin mental health summary score wereobserved by Londahl et al (39).IS TREATMENT WITH HYPERBARICOXYGEN COST-EFFECTIVE?Given the present global economic scenario,cost-effectiveness analysis is a crucial aspectin the discussion that has surroundedHBOT.The burden of diabetic ulcers has beenpointed out in several studies. A survey in theUnited States with 2 253 patients (40) estimateda cost of $13 179 per ulcer-relatedepisode, which increased to $27 721 in moresevere cases.HBOT is expensive, but costs are reimbursablethrough national health programs insome countries. A 30-session protocol maycost $9 000 (30). According to Ramsey et al(14), the overall economic impact due to anewly diagnosed foot ulcer in a 40 to 60 yearoldpatient was $27 987 in the first 2 yearsafter diagnosis. A foot amputation may costfrom $18 760 to more than $40 000 42,43,44 ,and if rehabilitation is accounted for, another$40 000 to $ 50 000 must be added (45).Guo et al (46) found that on a 1, 5 and 12-year perspective HBOT was cost-effective,accounting for an incremental cost of $27.310, $5.166 and $2.225 per additionalquality adjusted life year gained respectively.These calculations were based upon a hypotheticalcohort of 1000 sixty year-old patientsand HBOT was adjunctive to standard bestcare,however these «Best-care» costs werenot accounted for. Abidia et al (27) performeda limited analysis and calculated a saving of£2960 per patient based exclusively on areduction in the number of visits required forulcer dressing.The Australian Medical Services AdvisoryCommittee (47) based there analysis on the11% risk difference in amputations, and foundthat $11 142 (AU) would be saved per amputationavoided if rehabilitation cost wereincluded.Chuck et al (48) estimated HBOT wouldcost CND$40,695 after 12 years, in comparisonto CND$49,786 for standard care aloneper patient.The Medical Advisory Secreteriat (49)estimated that cost-avoidance per each amputationavoided was CND $53 800 with HBOT.In Ontario alone, and using Cochrane’s estimateof one third of amputations preventedwith HBOT, the cost-avoidance would beCND $5.8 million.All these assumptions in favor of HBOTmay not be flawless, since they are based uponclinical effects provided by studies with limi -ted power, thus affecting cost-effectivenessoutcomes.
THE ROLE OF HYPERBARIC OXYGEN THERAPY IN THE TREATMENT OF DIABETIC FOOT ULCERS ■ 129COST-EFFECTIVENESS-OURINSTITUITIONAL ANALYSISHyperbaric chamber were installed in theAutonomic Region of the Azores in order tosupport the touristic activity (recreation andprofessional diving). As diving accidents followa seasonal distribution well below the chamberscapacity, it was necessary to guaranteethe chamber maintenance and to keep theprofessional team proficient in chamber ope -ration. Therefore, the hyperbaric chamberswere installed in the hospitals, which allowedto start the regular hyperbaric medicine acti -vity. In our Institution, a multiplace chamberwas installed.In our unit, activity costs are monthlyaccounted, including expenses with staff, me -dication and consumables. In the analysisbelow, costs with infrastructure and equipmentwere not accounted for. In 2011, thecost per session, per patient was 33 €.Considering that the Portuguese nationalhealth system determines a refund value of62,30 € per patient, per session, the costeffectivenessanalysis finds that the chamber iseconomically sustainable. This analysis doesnot include the fees charged to recreationaland professional divers for underwater medicineconsultations.Tabla IIIHyperbaric oxygen treatment-related costsCosts Monthly mean 2011 Total 2011Consumables 326,78 € 3.921,46 €Oxygen 955,41 € 11.464,96 €Staff 3.683,33 € 44.200,00€Total 4.965,52 € 59.586,42 €PATIENT SELECTIONAND MONITORINGThe greatest benefit from HBOT isobserved in patients with hypoxic ulcerswhich have failed to heal with conventionaltreatment, and who have an intact or mildcompromise of arterial blood supply. Inthese, local infection, microangiopathy, autonomicneuropathy, oedema and decreasederythrocyte deformability are responsiblefor a synergic pathway leading do localhypoxia and ulceration (28).According to Centers for Medicare andMedicaid Services Guidelines, a patient musthave Diabetes and a Wagner 2 or higherwound of a lower limb resulting from diabetesthat has not responded to standardwound care to qualify for HBOT (50).Several methods may be employed toselect patients-invasive measurement of tissuepartial oxygen pressure, duplex ultrasonography,Doppler flowmetry, arteriography,mag<strong>net</strong>ic resonance imaging, positronemition tomography scan and near infraredreflectance spectroscopy (51) and do notpreclude a complete previous vascularassessment with revascularization if indica -ted and if feasible. If correctable arterialinsufficiency is not recognized, the patientwill not respond in a durable fashion toHBOT (52).However, transcutaneous oxygen pressureTcPO 2has been found to be predictivein determining which candidates may besuitable for HBOT. Many factors mayinterfere with the determination of TcPO 2(skin thickness, oedema, skin temperature,respiratory and cardiac condition, posi -tioning of the electrode) (53). Fife et al (54)found in a retrospective analysis of 1 144patients that an in-chamber TcPO 2cutoff of200 mmHg might be discriminating betweensuccess and failure of HBOT, and thatcombination of a sea-level air TcPO 2< 15mmHg and a TcPO 2< 400mmHg in thechamber predicted failure of HBOT with areliability of 75.8% and a positive predictivevalue of 73.3%. In general, HBOT is mostsuccessful when periwound TcPO 2is < 40mmHg in normobaric air, increases morethan 10 mmHg in normobaric 100% O 2andincreases more than 200mmHg underHBOT (54).
130 ■ PIE DIABÉTICOTable IVComparative analysis of published studies
THE ROLE OF HYPERBARIC OXYGEN THERAPY IN THE TREATMENT OF DIABETIC FOOT ULCERS ■ 131Table IV (Continuación)Comparative analysis of published studies*Jadad score: Trials are scored one point for each ‘randomization’, ‘randomization method described / adequate’, ‘double blinding’, ‘double-blinding described / adequate’,and ‘description of withdrawals / dropouts’. †Statistically significantAbbreviations: Atm – atmosphere; C – control group / controlled; CI – confidence interval; D – duration; E – experimental group; HBO – Hyperbaric oxygen; N– Number; NC – non-controlled; NRS – non-randomized, NS – not significant; PDGF – platelet-derived growth factor; PS- Prospective; R – randomized trial; RS – retrospective;RR – risk ratio; SC – standard care; T – trial; TcPO 2– Transcutaneous Oxygen Pressure; WMD – weighted mean difference, wk – weeks.
132 ■ PIE DIABÉTICOHYPERBARIC OXYGEN TREATMENT«DOSE» FOR DIABETIC FOOTULCERSMost trials applied 100% O 2under 2 to2.5 atmospheres of pressure on a daily basis(5 to 7 days a week) in 90-120 minute sessions(table IV). According to Fife et al (55),the greatest benefit of HBOT appears withthe first 15 treatments, and treatment is continuedfor at least 30 days if beneficial effectsare evident, at which time, according to theCenter for Medicare and Medicaid Services,healing must documented (52). However, thisperiod may be insufficient for heavy smokers(more than 10 pack-years) who will thereforerequire more prolonged HBOT (52).RECOMMENDATIONS FROMINTERNATIONAL ORGANIZATIONSThe American Diabetes Association supportedthe use of HBOT in patients with diabeticfoot ulcers refractory to standard treatment(56). The Australian Medicare Service Advisory(47), the Canadian Diabetes Association(57) have guidelines that endorse the use ofHBOT in these patients. The Consensus Re -commendations on Advancing the Standard ofCare for Treating Neuropathic Foot Ulcers inPatients with Diabetes has recommendedHBOT in persistently ischemic of infected diabeticfoot ulcers in addition to best standardtreatment (58).Application of HBOT in the treatment ofdia betic foot wounds is a Type 2 recommendationfrom the European Committee for HyperbaricMedicine (ECHM), emitted in the 7th EuropeanConsensus Conference on HyperbaricMedicine in Lille, in 2004 (18, 27, 29), which recommendationssupport:Application of HBOT as an adjunctive treatmentin patients with ischemic wounds withouta surgically treatable arterial lesion or as a complementafter vascular surgery, when the woundpersists unhealed.TcPO 2basal determination for HBOT indication.HBOT in the nondiabetic patient withchronic critical ischemia, if TcPO 2levels exceed50 mmHg under hyperbaric conditions (27).CONCLUSIONSDiabetic foot complications are a healthissue that warrant alternative options as outcomeremains be poor.Best care standards of diabetic footwounds include a multidisciplinary approachwith appropriate metabolic control, precisevascular assessment, directed infectious era -dication, extensive debridement of devitalizedtissue and rational dressing management.Maximal advantage may be obtained in nestingHBOT facilities within a multidisciplinary caresetting, thus providing an organized and multifacetedresponse to the diabetic patient andtheir foot complications. Also, an appropriatereferral to multidisciplinary wound careteams is essential in avoiding amputation.Underdeveloped knowledge of HBOT is aconcerning issue (66) warranting appropriateeducation of both physicians and patients.Updated evidences support that appropriatecandidates for HBOT are patients withWagner grade 3 or higher diabetic ulcerswhich have failed to heal under conventionaltreatment with an adequately perfused capi -llary bed in the wound area, with intact orrevascularized arterial inflow and thesepatients are best assessed by the TcPO 2response to a 100% oxygen challenge (57).HBOT is still under investigation but mayhave a beneficial role for some of thesepatients. More randomized controlled trials,including the ongoing prospective, doubleblindedrandomized controlled trial by O’Reillyet al (67) may further support HBOT and itsrole for these patients.BIBLIOGRAPHIC REFERENCES1. J. Kot, J. Desola, A. Gata Simão, R. Gough-Allen, R. Houman,J-L. Meliet, et al; A European Code of Good Practice for
THE ROLE OF HYPERBARIC OXYGEN THERAPY IN THE TREATMENT OF DIABETIC FOOT ULCERS ■ 133Hyperbaric Oxygen Therapy»; European Journal ofUnderwater and Hyperbaric Medicine (Volume 5,Supplement 1, December 2004).2. W.T. Workman, Gerhard F.K. Haux; History of HyperbaricChambers; Best Publishing Company; 1st edition (July2000).3. Defense Department - U.S. Navy - Naval Sea Systems;United States Navy Diving Manual, Revision 6.4. Editorial; The Cunningham tank treatment; JAMA1928;90(18):1494-1496.5. Boerema I, Meyne Ng, Brummelkamp Wk et al; Life withoutblood: a study of the influence of high atmospheric pressureand hypothermia on dilution of the blood; J CardiovascSurg 1960;1:133-146.6. Wattel F, Mathieu D; Oxygénothérapie hyperbare et réanimation.Ed Masson 1990. pg. 8-15.7. Marx RE, Ehler WJ, Tayapongsak P, Pierce LW; Relationshipof oxygen dose to angiogenesis induction in irradiated tissue;Am J Surg. 1990 Nov;160(5):519-24.8. Heng MC, Harker J, Csathy G, Marshall C, Brazier J,Sumampong S, Paterno Gomez E; Angiogenesis in necroticulcers treated with hyperbaric oxygen.Ostomy WoundManage. 2000 Sep;46(9):18-28, 30-2.9. Kindwall EP; Uses of hyperbaric oxygen therapy in the1990s; Cleve Clin J Med. 1992 Sep-Oct; 59(5):517-28.Review.10. Kindwall EP, Whelan HT; Hyperbaric Medicine Practice 2ndEd. Revised. Best Pub Comp 2002.11. Desola Ala J. Oxigenoterapia hiperbárica en patología infecciosa.Revisón y pusta al dia. Enfermedades Infecciosas1986; 4 (2); 84-88.12. Mader Jt, Brown Gl, Guckiuan Jc, Wells Ch, Reinarz Aj; Amechanism of the amelioration by hyperbaric oxygen ofexperimental staphylococcal osteomyelitis in rabbits; JInfect Dis 1980;142:915-922.13. Desola J; Bases y Fundamento terapeutico daOxigenoterapia Hiperbarica; JANO/Medicina 1260, 5-11 deJunho 1998;LIV.14. Kaye D; Effect of hyperbaric oxygen on Clostridia in vitroand in vivo; Proc Soc Exp Biol Med 1967;124:360-6.15. Kindwall EP, Gottlieb LJ, Larson DL.Hyperbaric oxygen therapyin plastic surgery: a review article; Plast Reconstr Surg.1991 Nov;88(5):898-908. Review.16. Weaver LK, Hopkins RO, Chan KJ et al; Hyperbaric Oxygenfor Acute Carbon Monoxide Poisoning; N Engl J Med2002;347(14):1057-67.17. Gesell LB; Hyperbaric Oxygen Therapy Indications 12thEdition; Undersea and Hyperbaric Medical Society.18. Tiago D.F. Fernandes et al; Medicina Hiperbárica, Acta MedPort. 2009; 22(4):323-33419. Ben<strong>net</strong>t M, Feldmeier J, Smee R, Milross C; Hyperbaric oxygenationfor tumour sensitisation to radiotherapy: a systematicreview of randomised controlled trials; Cancer TreatRev. 2008 Nov; 34(7):577-91. Epub 2008 Jul 21.20. Dang, C.N; Boulton, A.J.M; Changing perspectives in diabeticfoot ulcer management. Int J Low Extrem Wounds 2003; 2: 4.21. Heyneman; C.A; Lawless-Liday, C; Using hyperbaric oxygento treat diabetic foot ulcers: safety and effectiveness. CritCare Nurse; 2002; 22:52-60.22. Hunt, D; Clinical Evidence, Diabetes: foot ulcers and amputations.Clin Evid; 2009; 01:602.23. Andros G., Lavery L.A., Diabetic Foot Ulcers, Rutherford’sVascular Surgery7th edition, Cronenwett, J.L; Johnston,K.W; Cambria, R.P; et al; Philadelphia, Saunders Elsevier;2010, volume 2 1735-1746.24. Mathieu, D; Role of Hyperbaric Oxygen Therapy in theManagement of Lower Extremity Wounds. Int J LowExtrem Wounds; 2006, 5:233.25. Kessler L, Bilbault P, Ortega F, et al. Hyperbaric oxygenationaccelerates the healing rate of nonischemic chronic diabeticfoot ulcers: a prospective randomized study. DiabetesCare. 2003; 26 (8):2378-2382.26. Wattel, F; Mathieu,D; Coget J.-M; et al; Hyperbaric oxygentherapy in chronic vascular wound management; Angiology;1990;41:59.27. Abidia A, Laden G, Kuhan G, et al. The role of hyperbaricoxygen therapy in ischaemic diabetic lower extremityulcers: a double-blinded randomised-controlled trial. Eur JVasc Endovasc Surg. 2003; 25(6):513-518.28. Albuquerque e Sousa, J.G; Inalação de oxigénio em meiohiperbárico, fundamentos da sua utilização no tratamentodo pé diabético. Rev Port Cir Cardiotorac Vasc; 2002; vol.9; 22:35-43.29. Ong, M; Hyperbaric oxygen therapy in the management ofdiabetic lower limb wounds; Singapore Med J; 2008; 49(2):105.30. Löndahl M, Katzman P, Nilsson A, Hammarlund C.Hyperbaric oxygen therapy facilitates healing of chronicfoot ulcers in patients with diabetes. Diabetes Care. 2010;33(5):998-1003.31. Faglia E, Favales F, Aldeghi A, et al. Adjunctive systemic hyperbaricoxygen therapy in treatment of severe prevalentlyischemic diabetic foot ulcer. A randomized study. DiabetesCare. 1996; 19(12):1338-1343.32. Kaya, A; Aydin, F; Altay, T; et al; Can major amputation ratesbe decrease in diabetic foot ulcers with hyperbaric oxygentherapy? Int Orthop;2009; 33:441- 446.33. Chen C.E, Ko J.Y, Fong C.Y, et al; Treatment of diabetic footinfection with hyperbaric oxygen therapy. J Foot AnkleSurg. 2010 Jun;16(2):91-5.34. Albuquerque e Sousa, J.G; Avaliação a longo termo das úlcerasdiabéticas dos membros inferiores não cicatrizadas,após oxigenoterapia hiperbárica. Rev Port Cir CardiotoracVasc; 2005, 12(4): 227-237.35. Kranke,P; Ben<strong>net</strong>, M.H; Debus, S.E; et al; Hyperbaric oxygentherapy for chronic wounds (Review). The CochraneLibrary; 2009; issue 3.36. Urbancic-Rovan V, Slak M. Results of 16 months’ foot screeningin Ljubljana, Slovenia. Paper presented at 7th NationalMeeting on Diabetic Foot; 1998 May; Malvern, UK; 21:2161-77.37. Duzgun AP, Satir HZ, Ozozan O, Saylam B, Kulah B, CoskunF. Effect of hyperbaric oxygen therapy on healing of diabeticfoot ulcers. J Foot Ankle Surg. 2008; 47(6):515-519.38. Lin T.F; Chen S.B; Niu, K.C. The vascular effects of hyperbaricoxygen therapy in treatment of early diabetic foot.Undersea Hyperb Med. 2001; 28 (suppl):67.
134 ■ PIE DIABÉTICO39. Löndahl M, Landin-Olsson M, Katzman P. Complications -hyperbaric oxygen therapy improves health-related qualityof life in patients with diabetes and chronic foot ulcer.Diabet Med. 2011;28(2):186-190.40. Apelqvist J, Larsson J, Agardh CD. Long-term prognosis fordiabetic patients with foot ulcers. J Intern Med1993;233:485-91.41. Ramsey SD, Newton K, Blough D, et al. Incidence, outcomes,and cost of foot ulcers in patients with diabetes.Diabetes Care. 1999;22:382-387.42. Cianci P, Petrone G, Drager S, et al. Salvage of the problemwound and potential amputation with wound care andadjunctive hyperbaric oxygen therapy: an economic analysis.J Hyperb Med. 1988; 3:127-141.43. Tennvall GR, Apelqvist J, Eneroth M. Costs of deep footinfections in patients with diabetes mellitus.Pharmacoeconomics. 2000; 18: 225-238.44. Mackey WC, McCullough JL, Conlon TP, et al. The costs ofsurgery for limb- threatening ischemia. Surgery. 1986; 99:26-35.45. Cianci P. Adjunctive hyperbaric oxygen therapy in the treatmentof the diabetic foot. J Am Podiatr Med Assoc. 1994;84:448-455.46. Guo, S; Counte, M.A; Gillepsie, K.N; Cost-effectiveness ofadjunctive hyperbaric oxygen in the treatment of diabeticulcers. Int J Technol Assess Health Care; 2003; 19, 4: 731-737.47. Australian Medicare Services Advisory Committee (MSAC).Hyperbaric Oxygen Therapy. MSAC applications; 2000:1018-1020.http://www.msac.gov.au/inter<strong>net</strong>/msac/publishing.nsf/Content/app1018-1020-1.48. Chuck, A.W; Hailey, D; Jacobs, P; et al; Cost-effectivenessand budget impact of adjunctive hyperbaric oxygen therapyfor diabetic foot ulcers; Int J Technol Assess Health Care;2008; 24: 178-183.49. Medical Advisory Secretariat, Ministry of Health and Long-Term Care; Ontario Health Technology Series 2005; vol.5,nº11.50. Shuren J, Dei Cas R, Kucken L,Tillman K. Hyperbaric oxygentherapy (HBO) in the treatment of hypoxic wounds anddiabetic wounds of the lower extremities [decision memorandum].Centers for Medicare & Medicaid Services(CMS); August 30, 2002. CMS CAG-00060N.51. Tiaka, E. K; Papanas, N; Manolakis, C; et al; The role of hyperbaricoxygen in the treatment of diabetic foot ulcers;Angiology; DOI 10.1177/0003319711416804, publishedonline August 25th, 2011.52. Barnes, R.C. Point: Hiperbaric oxygen is beneficial for diabeticfoot wounds. Clin Infect Dis; 2006:43:188-92.53. Löndahl M, Katzman P, Hammarlund C, Nilsson A, Landin-Olsson M. Relationship between ulcer healing after hyperbaricoxygen therapy and transcutaneous oximetry, toe bloodpressure and ankle-brachial index in patients with diabetesand chronic foot ulcers. Diabetologia. 2011;54(1): 65-68.54. Fife, C.E; Buyukcakir, C; Otto, G.H; et al; The predictive valueof Transcutaneous oxygen tension measurement in diabeticlower extremity ulcers treated with hyperbaric oxygentherapy: a retrospective analysis of 1144 patients. WoundRepair Regen; 2002; Jul-Aug; 10 (4):198-207.55. Fife C.E; Buyukcakir C, Otto G, Sheffield P, Love T, WarrinerR 3rd. Factors influencing the outcome of lower-extremitydiabetic ulcers treated with hyperbaric oxygen therapy.Wound Repair Regen. 2007;15(3): 322-331.56. American Diabetes Association: consensus developmentconference on diabetic foot wound care (consensus statement).Diabetes Care. 1999;22(2): 1354-1360.57. Räkel A, Huot C, Ekoe´ JM. Canadian Diabetes AssociationTechnical Review: the diabetic foot and hyperbaric oxygentherapy. Can J Diabetes. 2006;30(2): 411-421.58. Snyder RJ, Kisner RS, Warriner RA III, Lavery LA, Hanft JR,Sheehan P. Consensus recommendations on advancing thestandard of care for treating neuropathic foot ulcers inpatients with diabetes. Ostomy Wound Manage.2010;56(suppl 4):S1-S24.59. Doctor N, Pandya S, Supe A. Hyperbaric oxygen therapy indiabetic foot. J Postgrad Med. 1992; 38(1):111-114.60. Baroni G, Porro T, Faglia E, et al. Hyperbaric oxygen in diabeticgangrene treatment. Diabetes Care. 1987; 10(1):81-8661. Oriani, G; Sala, C; Capagnoli, P; et al; Hyperbaric oxygen therapyin diabetic gangrene. J Hyperb Med 1990; 5 (2):171-175.62. Zamboni, W.A; Wong, H.P; Stephenson, L.L; et al; Evalutationof hyperbaric oxygen for diabetic wounds: a prospectivestudy.Undersea Hyperb Med. 1997; 24(3): 175-179.63. Kalani, M; Jörneskog, G; Naderi, N; et al; Hyperbaric oxygen(HBO) therapy in treatment of diabetic foot ulcers, Longtermfollow-up. J Diabetes Complications; 2002; 16:153-158.64. Cianci P, Petrone G, Green B. Adjunctive hyperbaric oxygenin the salvage of the diabetic foot. Undersea andHyperbaric Medical Society. Annual Scientific Meeting. SanDiego. 1991.65. Lyon, K.C; The case for evidence in wound care: investigatingadvanced treatment modalities in healing chronic diabeticlower extremity wounds. J Wound OstomyContinence Nurs. 2008 Nov-Dec; 35(6):585-90.66. Evans, A.W; Gill, R; Valiulis, A; et al; Hyperbaric oxygen therapyand diabetic foot ulcers. Knowledge and attitudes ofCanadian primary care physicians. Canadian FamilyPhysician 2010; 56:444-52.67. O’Reilly, D; Linden, R; Fedorko, L; et al; A prospective, double-blind,randomized, controlled clinical trial comparingstandard wound care with adjunctive hyperbaric oxygentherapy (HBOT) to standard wound care only for the treatmentof chronic, non-healing ulcers of the lower limb inpatients with diabetes mellitus: a study protocol. Trials;2011; 12:69.
Experiencia del programa de AtenciónIntegral a pacientes con pie diabéticoJORGE LUIS MORALES FLORAT, MARITZA VÁZQUEZ TORRES Y YOANKY GUTIÉRREZ POSTIGOHospital Provincial Dr. Roberto Rodríguez Fernández. Morón. Cuba.INTRODUCCIÓNLa diabetes se considera una pandemia enel mundo. En las Américas fue estimado en elaño 2000 un total de 35 millones de diabéticosy se espera un incremento a 64 millonesen el 2025 (1) asociado a un aumento de riesgode muerte prematura, esencialmente poruna mayor predisposición a desarrollar enfermedadescardiovasculares. Estos pacientestienen, además un mayor riesgo de padecerceguera, Insuficiencia renal y amputaciones demiembros inferiores (2,3). El síndrome de piediabético representa una de las complicacionescrónicas de mayor morbilidad y discapacidadde los pacientes diabéticos en la actualidad(4). Las altas tasas de amputaciones causanun importante grado de invalidez con unelevado costo económico y social. En Río deJaneiro, Brasil, la incidencia anual de amputacionesalcanza la cifra de 180 x 100 000 habitantes(5). La alta frecuencia con la que sepresenta esta complicación de la diabetes hasido reconocida a nivel mundial por su impactosobre el sistema de salud. El consenso de laSociedad Española de Angiología y CirugíaVascular estima que esta enfermedad se presentaentre el 8 y el 13% de los diabéticos (6),y el consenso sobre cuidados del pie diabéticode la Asociación Americana de Diabetesefectuada en Boston en 1999, estimo la prevalenciaen el 15% de los diabéticos (7). Variosinvestigadores del tema coinciden en la necesidadde establecer programas dirigidos a laeducación y prevención de las complicacionesde esta enfermedad (8, 12).El principal factor de riesgo no traumáticode amputaciones de miembros inferiores loconstituye la Diabetes Mellitus, se ha estimadoque en Cuba se les realiza a cerca de 1000 personascada año. Los problemas de cicatrizaciónde las heridas tienen una importancia clínicamáxima y su costo económico alcanza losmiles de millones de dólares (13). La úlcera delpie diabético (UPD) es una complicación de laDiabetes Mellitus, su incidencia anual es de un10% en todos los que presentan esta enfermedad,la cual se eleva entre 5 y 7,5% en los quepresentan neuropatía periférica, Se estima queel 15% de los Diabéticos desarrollan úlceras enalgún momento de su vida y que entre el 10 yel 30% de ellos progresan a la amputación. Seha reportado que aproximadamente el 60% delas amputaciones están precedidas por úlcerasinfectadas, a los 5 años de practicada unaamputación de los miembros inferiores, muerendel 50 al 60% de los pacientes (13,14).Uno de los padecimientos más comunesrelacionados con los problemas de la cicatrización,lo constituye esta enfermedad. Losdiabéticos están afectados por varios factoresque retardan este proceso: Las infecciones, laanemia, isquemia, neuropatía, hiperglucemiamantenida, quimiotaxis, pobre colagenización,aumento de las citoquinas (TNF, ILI, IL8,), disminucióndel factor de crecimiento derivadosde plaquetas, (PDGF), disminución del factorde crecimiento derivados de fibroblastos,arresto del ciclo celular, senectud celular anticipada,defecto de la angiogenesis y desorganizaciónde la matriz. Los pilares del tratamientode las heridas del pie diabético es elcuidado meticuloso, la terapia antimicrobianay las técnicas de revascularización, a menudoestos procederes son inefectivos, y finalmenteinevitable la amputación (15, 16).
136 ■ PIE DIABÉTICOEl receptor de EGF se ha identificadocomo diana de precursores de los productosavanzados de la glicocilazión, como el glioxal(GO) y el metilglioxal (MGO), en una formadependiente del tiempo y la dosis, que conducea la supresión de la autofosforilación delreceptor y de su subsiguiente activación. ElEGF estimula la proliferación de fibroblastos,queratinocitos y células endoteliales de vasos,lo cual contribuye a sus propiedades cicatrizantes(17). En estudios clínicos previos, en lafase I y II en pacientes con UPD, se a evidenciadoque la administración intralesional deHeberprot-P estimula la cicatrización, y comoresultado, la formación de un tejido de granulaciónútil en el lecho de las úlceras, que permiteel cierre por segunda intención omediante injerto de piel. Este efecto se asociaa una reducción del riesgo de amputación(16). Tales resultados fundamentan la necesidadde introducir la administración exógenade factores de crecimiento como una terapiainstrumental para mejorar y mantener el procesode la cicatrización en esta población.El riesgo de que un enfermo diabéticosufra una amputación menor o mayor en laextremidad inferior es muy elevado con respectoa la población no diabética (14).Numerosos estudios aseveran que la incidenciaacumulativa de amputaciones en la poblacióna la que se le diagnostica DM antes de los30 años y con una evolución de mas de diez,supera el 5% en la DM tipo I, y el 7% en la DMtipo II (15,16). Cuando un enfermo diabéticodesarrolla una úlcera en el pie, en principiotiene limitadas probabilidades de cicatrizarcon facilidad, mas de infectarse, que la infeccióndifunda y que, con relativa facilidad, conduzcaa la gangrena que finalmente supongauna amputación (17).Se han utilizados distintos modelos de tratamientosen las lesiones de PD, tanto preventivos,médicos y quirúrgicos, aunque aunhoy no han logrado reducir las mutilaciones,sobre todo en pacientes con úlcera grado IIIy IV, según clasificación de Wagner, úlcerasprofundas abscedadas y con osteomielitis, ygangrena delimitada de un dedo y del pie,Continua búsqueda alternativa que se aproxi-men a lograr este prepósito. El déficit particularmentesevero de EGF en la DM estimula yabre nuevos horizontes en lograr una mejorcalidad de vida. (18).La posibilidad de contar con un nuevoproducto cubano de Biotecnología elHeberprot-P, único en el mundo, desarrolladoen el Centro de Ingeniería Genética y biotecnología(CIGB) de Cuba, por tecnología deADN recombinante, al insertar en el genhumano de EGF en la Saccharomyces cerevisiae,facilitara que se aplique a la dosis de0,75mg en tres secciones por semana por víaintralesional, hasta lograr una granulación útilo cicatrización de la lesión, con un máximo de8 semana de tratamiento.MATERIAL Y MÉTODOEl estudio fue observacional, descriptivo,longitudinal y prospectivo para evaluar la respuestaterapéutica de los pacientes con UPDque fueron sometidos a tratamiento conHeberprot – P de 75mg, en el servicio deAngiología del Hospital General DocenteRoberto Rodríguez Fernández, Morón,Provincia de Ciego de Ávila.Muestra: 73 pacientes con el diagnósticode UPD grado 3 y 4, según clasificación deWagner.Criterios de inclusión: Úlcera grado 3 y 4de Wagner, mayor de 18 años, voluntariedaddel paciente con el consentimiento informado.Criterios de exclusión: Úlcera con un áreamenor de un centímetro cuadrado, coma diabético,cardiopatía isquemia descompensada,insuficiencia renal crónica con creatininas superiora 200 mmol/l, enfermedades malignas.El estudio fue observacional, descriptivo,longitudinal y prospectivo para evaluar la respuestaterapéutica de los pacientes con UPDque fueron sometidos a tratamiento conHeberprot – P de 75mg, en el servicio deAngiología del Hospital General DocenteRoberto Rodríguez Fernández, Morón,Provincia de Ciego de Ávila.Muestra: 73 pacientes con el diagnósticode UPD grado 3 y 4, según clasificación deWagner.
EXPERIENCIA DEL PROGRAMA DE ATENCIÓN INTEGRAL A PACIENTES CON PIE DIABÉTICO ■ 137Criterios de inclusión: Úlcera grado 3 y 4de Wagner, mayor de 18 años, voluntariedaddel paciente con el consentimiento informado.Criterios de exclusión: Úlcera con un áreamenor de un centímetro cuadrado, coma diabético,cardiopatía isquemia descompensada,insuficiencia renal crónica con creatininassuperior a 200 mmol/l, enfermedades malignas.Variables: <strong>Úlceras</strong> de pie diabético grado3y 4 de Wagner, evolución de las lesiones, clasificadasen satisfactorias y no satisfactorias.Satisfactorias: Los que no se le realizóamputación.mayor.No satisfactorias: Los que se le realizóamputación mayor, intervenciones quirúrgicas:Desbridamientos y amputaciones.Patrón vascular: Normal, distal de laspiernas y femoropopliteo.Heberprot- P: Es un producto liofilizado,estéril, de color blanco, libre de preservodiseñado para la administración intra y perilesional.Contiene factor de crecimiento epidérmicohumano recombinante, y se presentaen bulbos de 75 y 25mg, se diluye su contenidoen 5ml agua destilada, se cambia de aguja yse procede a su aplicación comenzando desdeel fondo de la lesión hacia la periferia, se cambiala aguja en cada puntura para evitar contaminaruna zona de la lesión con otra, seintroduce la acuja a una profundidad de uncentímetro y se instila de 0,5 a 1cc. ElHeberprot-P se administro según la evoluciónde la lesión y el tiempo que requirió cadapaciente hasta la granulación completa o cierrepor injerto.Se realizaron complementarios necesariospara este tipo de tratamiento (Glucemia, Cultivocon antibiograma, Rx del pie con vistasantero posterior y oblicua, Creatinina, Ultrasonidoabdominal, Tacto rectal, Rx de tórax,Eritrosedimentación, Electrocardiograma, índicede presiones y Hemoglobina glicosilada).Se tomo foto al comienzo y final del tratamientode la lesión.RESULTADOSEn la tabla I, podemos observar que lasúlceras de pie diabético grado III, según clasificaciónde Wagner se presentaron con mayorfrecuencia con 54 enfermos, para el 73,97%,seguida de las úlceras de pie diabético gradoIV, según clasificación de Wagner se presentaroncon menos frecuencia para el 26,02%.Tabla IClasificación del pie diabético segúnWagnerWagner Pacientes %III 54 73,97%IV 19 26,02%Total 73 100%Fuente: Datos tomados de historial clínico.En la tabla II, podemos observar que 67pacientes con úlcera de pie diabético evolucionaronde forma satisfactoria para el91,78%, seguido de 6 pacientes que evolucionaronde forma no satisfactoria representandoel 8,21%.Tabla IIEvolución de las lesionesSatisfactoria N.Satisfactoria Total67 91,78% 6 8,21% 73 100%Fuente: Datos tomados de historia clínica.En la tabla III, podemos observar que 67pacientes con úlcera de pie diabético se lerealizo desbridamiento de la lesión para un91,78%, y se realizaron 6 amputaciones mayoresrepresentando el 8,21%.Tabla IIIIntervenciones QuirúrgicasDesbridamiento Amputación67 91,78% 6 8,21% 73 100Fuente: Datos tomados de historia clínica.
138 ■ PIE DIABÉTICOEn la tabla IV, podemos observar que elpatrón vascular isquémico se presento conmayor frecuencia que el normal representandoel 84,92% de los pacientes (62) solo el15,06% presento un patrón normal (11).Tabla IVPatrón vascularPatrónN.º devascular pacientes %Normal 11 15,06%Distal,f.poplíteo 62 84,92%DISCUSIÓNLa clasificación fisiopatoloías diferenciaentre la úlcera neuropática y la isquémica,aunque frecuentemente hay una superposiciónde ambos parámetros, la mas aceptada esla de (Wagner) que valora tres parámetros, elgrado de infección, de isquemia, y profundidadde la úlcera (16). Teniendo en cuenta esta clasificación54 pacientes (73,97%) presentaronlesiones grado III, y19 pacientes (26,02%)grado IV.Estas fueron las dos formas clínicas depresentación incluidas para la selección delos pacientes que se les aplico Heberprot-P,este ultimo resultado se relaciono con elelevado componente isquémico del diabéticofactor predictivo en el desenlace fatal delmiembro, se trata de lesiones crónicas terminalesque por su complejidad clínico patológicaestablecen un pronostico muy sombríoubicados en los estadios III y IV deWagner que implican un riesgo de amputaciónmayor de un 90%.La meta del sistema de salud cubano serásiempre evitar, la ulceración, la amputación yla discapacidad de las personas afectadaspor DM, logrando un adecuado controlmetabólico. Sin embargo una vez establecidauna lesión en el pie, el tratamiento oportunodemanda una atención rápida y eficientepara mejorar su pronóstico e impedir la discapacidad(7) La introducción del productocubano Heberprot-P en el tratamiento de laúlcera del pie diabético ha sido un formidableavance en la reducción del índice deamputaciones de discapacidad en estas personas(7), en nuestro trabajo queda demostradoque el uso del Heberprot-P en lasúlceras del pie diabético reduce el númerode amputaciones, solo 6 pacientes de unamuestra de 73 fueron amputados (8,21%)logrando disminuir el índice de amputacióninferior al 10%, resultados similares peromas alentadores se obtuvieron en Venezueladonde esta insertado el programa de atenciónintegral al diabético., logrando disminuirel índice de amputación por debajo del4%.Es posible que estos resultados no seantan alentadores, pero los que a diario practicamosla atención medica a pacientes diabéticosindica que existe una alternativa detratamiento a las úlceras del pie diabéticoantes de plantearle una cirugía exerética, esdecir una amputación mayor, el 91,78% delos pacientes logro una granulación y cicatrizaciónde la lesión, este resultado constituyeun llamado a todo el personal médicorelacionado con esta patología ya que enestos momentos no existe otra terapéuticaque nos pueda conducir a estos resultados.El pie diabético es una complicación gravede la diabetes mellitus con un mal controlmetabólico habitual, su etiología es multifactorial,predominando en algunos casos lalesión vascular y en otros la neurológica, losfactores predisponentes (Macroangipatía,Microangiopatía y la neuropatía), los desencadenantes(factores extrínsecos y intrínsecos),y los agravantes que favorecen a lascomplicaciones impidiendo que la lesióncicatrice.Evidencias GráficasPaciente con úlcera de pie diabético gradoIII según Wagner, se le realizó desbridamientoy desteche de la lesión con exposición tendinosa,se aplica Heberprot-P al terminar elproceder.
EXPERIENCIA DEL PROGRAMA DE ATENCIÓN INTEGRAL A PACIENTES CON PIE DIABÉTICO ■ 139BIBLIOGRAFÍAFig. 1. Antes de aplicar el Heberprot-P.Se le aplicaron 16 dosis de 0,75mg tres vecespor semana hasta lograr tejido de granulaciónútil y cierre total de la lesión a los 60 días.No se le realizó ningún tipo de amputación.Fig. 2. Después de aplicado el Heberprot-P.ConclusionesEl heberprot-P, es una alternativa de tratamientopara las úlceras del pie diabético, capazde disminuir las tasa de amputaciones mayoresen los grados III, IV de Wagner, induce de formarápida y consistente el tejido de granulaciónútil incluso en las lesiones con patrón isquémico,los resultados de nuestro trabajo demostraronque de 73 pacientes diagnosticados conúlcera de pie diabético tratados con Heberprot-Pel 91,78% salvaron su extremidad y elresto disminuyo el numero de amputacionesmenores. El resultado final del trabajo fue buenopor que se logró incorporar los pacientes ala vida social y laboralmente activa.1. Barceló A, Rajpathak S, Incidence and prevalence of diabetesmellitus in the Americas. Rev pan Salud. 2001, 10 (5):300-7.2. La diabetes en las América, Boletín Epidemiología de laorganización panamericana de la salud. 2001, 22 (2): 1-3.3. Alleyne G. La diabetes: Una declaración para las América.Boletín of thepanamerican Health organization. 1996, 30(3) 261.4. Sell, Luveras JL, Domínguez cm. Guía practica para el diagnosticoy el tratamiento del síndrome del pie diabético.Rev. Cubana Endocrinal 2001, 1 (3): 188-7.5. Stanbovsky CR, Spichler D, Lessa L, Costa C Farti A, FranesLJ, E La parte R. Capture-recapture method to estímatelowerextremity amputación rates in Río de Janeiro. Rev.Panam salud publica 2001, 10 (5). 334-40.6. Marinello J, Blanes JL, Escudero V, Rodríguez J Consensosobre pie diabético. Angiología 1997, 49 (5): 193-231.7. American Diabetes Association. Consensus developmentconference on Diabetic foot Wound care. Diabetes care.1999, 22: 135-60.8. Suárez R, García R, Álvarez R, Edreira Conocimientos, destrezasy conductas ante el cuidado de los pies en un grupode amputados diabéticos.Rev cubana Endocrinal 2001, 12(2):93-104.9. Alcacer CA, Escobar B. Cuidados preventivos de los pies:Pacientes con diabetes tipo II. Rev. Med IMMSS 2001, 39(4): 311-7.10. Slovenkay MP, foot problems in diabetes. Med clin north am1998, (4): 949-71.11. Word A. Metz, addone EL, Edelman D, foot educationimproves Knomledge and satisfaction among patients athigh risk for diabetis.12. Houser D E, promotion of foot health m diabetes. ClinExcell nurs pract 1999, 3 (4): 210-3.13. Perich AP, Gonzales RM, Valdés E, Arsanz MC. Desarrollo dediabetes mellitus en pacientes con tolerancia a la glucosaalterada: Seguimiento de 18 años. Rev. Cubana Endocrinal2002; 13 (2).14. Berlanga J, Cibrian D, Guillen L,Freyre F, Albad JS, LopezSaura P, et al Methylglyoxal administration induces diabeteslike microvascular changes and perturbs the healing processof cutaneous wounds. Clin Sci (Lond) 2005; 109 (1):83-95.15. Zoulyanov L, Kirsner RS, A review of a bi layered livingcell treatment (Apligraft) in the treatment of venous legulcers and diabetic foot ulcers. Clin interv Aging 2007; 2(1): 93-8.16. Berlanga J, Parts P, Ramirez D, Gonzales R, Lopez Saura P,Aguiar J, et al prophylactic use of epidermal growth factorreduces ischemia / reperfusion intestinal damage. Am J pathology2002 Aug; 16 (2): 373-9.Steed DL, Clinical evaluation of recombinant human17. Steed DL. Clinical evaluation of recombinant human platelet-derivedgrowth factor for the treatment of fowerextremity ulcers. Plats Reconstr. Surg 2006, 117 (7 Supp):1435-95.
140 ■ PIE DIABÉTICO18. Mansbridge JN, Liu K, Pinney RE, Patch R, Ratcliffe A,Naughtan GK, Growth factors secreted by fibroblasts: rolein healing diabetic foot ulcers . Diabetes Obes Metab 1999;1: 265-79.19. Armstrong DG, livery LA, Diabetic foot ulcers: prevention,diagnosis and classification. Am Fam Phys 1998; 57: 1325-32, 1337-820. Boulton AJM, Befts RP, Franks CL, Newick PG, Word JD,Duckworth T, Abnor malities of foot pressure in early diabeticneuropathy. Diabet Med 1987; 4. 225-8.21. American Diabetes Association. Standard of medical Carefor patients with diabetes mellitus. Position statementsDiabetes Care 1998; 21: s23-s31.22. Takehara K. Grawith regulation of skin fibroblasts. JDermatol Sci 2000; 24(Suppl1): 570-7.23. Most BA, Scholtz GS, Interctions of cytokines, growth factorsand proteases in acute aand chronic wounds. WoundReparair Regeneral 1996; 4 (4): 411-20.24. Spencer S. Pressure relieving interventions for preventingand treating diabetic foot ulcers. Cochrane dotabase SystRev 2005; 3: CD OOO2302.25. Portero-Otin M, Pamplora R, Bellmunt MJ, Ruiz MC, prat J,Salvayre R, et al.Advanced glycation and product precursorsimpair epidermal growth factor receptor signalling.Diabetes 2002; 51: 1535-42.26. American Diabetes Association: Clinical practiceRecommendations 1997.27. Foot care in patients with diabetes mellitus. Diabetes care1998; 21 (Supp 1).28. Aragón J, Ortiz P, Hernández M; El pie diabético: Resultadosde nuestra experiencia. Atención primaria 1998; 22: 360.29. Aragón FJ, Hernández MJ, Daniel IM, Oriz PP. El pie diabético:Claves para un diagnostico y tratamiento adecuados.FOMECO 2000; 8: 10-25.
Terapia de células madre y génica, de la isquemiacrítica diabética de los miembros inferioresCARLOS VAQUERO, NOELIA CENIZO, JOSÉ ANTONIO GONZÁLEZ FAJARDO,LUCAS MENGIBAR, ENRIQUE SAN NORBERTO, ALVARO REVILLA Y BORJA MERINOServicio de Angiología y Cirugía Vascular. Hospital Clínico Universitario. Universidad de Valladolid. EspañaINTRODUCCIÓNLa enfermedad arterial periférica (EAP) sefundamenta en la obstrucción del flujo sanguíneoen arterias, excluyendo coronarias y arteriasintracraneales, siendo las de los miembrosinferiores las más frecuentemente afectadas.La arteriosclerosis es la principal causade EAP crónica (2). La enfermedad arterialperiférica, afecta en USA y Europa a20.000.000 de personas, siendo la forma masgrave la isquemia crítica de las extremidades(el 2-5%). El 65% de los casos presentan unadistribución difusa con afectación de sectoraorto-iliaco y de arterias bajo el ligamentoinguinal, esta afectación difusa se presentatípicamente en pacientes ancianos, varones,con frecuencia, diabéticos e hipertensos.EPIDEMIOLOGÍALa prevalencia de la claudicación intermitenteva del 1% en individuos de 55 a 60 añosa 6% en individuos de 80-85 años, sin embargocuando se aplica un test diagnóstico mássensible como el índice tobillo-brazo (
142 ■ PIE DIABÉTICOLas ventajas y limitaciones de la revascularizaciónquirúrgica en la enfermedad arterialperiférica son bien conocidas. En general, larevascularización mediante bypass y angioplastiapercutánea se reservan para pacientescon claudicación invalidante o con isquemiacrítica que comprometa la viabilidad de laextremidad, lo que supone que menos del10% de los enfermos que padecen claudicaciónintermitente se beneficia de tratamientorevascularizador (3). Esto deja un número significativode casos, con una clínica moderadaa severa, con escasas posibilidades de tratamientoefectivo. El ejercicio físico moderado ylos cambios en el hábito de vida, erradicandofactores de riesgo cardiovascular, son el tratamientoconservador más eficaz y pueden enocasiones estabilizar o mejorar la situaciónclínica pero es una estrategia terapéutica conlimitaciones evidentes; como la dificultad demotivar al paciente para el cumplimiento deltratamiento y el difícil acceso a programas deejercicio supervisados (7). Esta situación afectaespecialmente a pacientes con arteriopatíadistal difusa, que con frecuencia padecen diabetes,y a aquellos que ya han sido sometidosa intervenciones para revascularización quehan fracasado.En los últimos diez años ha crecido el interéspor conocer los mecanismos fisiológicosque regulan la formación de nuevos vasos. Losfactores principales que estimulan la formaciónde una red colateral de vasos sanguíneosson, en primer lugar, la duración e intensidadde la isquemia, stress e inflamación y la acciónde citoquinas tanto sistémicas como locales.La investigación en el tratamiento del cáncerha colaborado en el avance del conocimientode la angiogénesis, pretendiendo al bloqueareste proceso fisiológico detener el crecimientotumoral.TERMINOLOGÍASe entiende por angiogénesis la formaciónde nuevos capilares a partir de estructurasvasculares existentes previamente, es unproceso mediado por la migración y prolife-ración de células endoteliales en respuesta aestímulos como la hipoxia, la isquemia, el estiramientomecánico y la inflamación. La remodelaciónde la matriz extracelular y la formacióny expansión de tejidos perivasculares sonfenómenos claves para la angiogénesis (1, 3).En cambio vasculogénesis es el términoque se emplea para definir el proceso queconsiste en la formación de nuevos vasos sanguíneosa partir de células madre endotelialescon origen en la médula ósea, que se diferencianen células endoteliales que forman nuevasestructuras.Aunque antes se asumía que la vasculogénesissólo ocurría durante el periodo embrionarioen los últimos años hay una evidenciacreciente de que la neovascularización en eladulto implica los dos procesos descritos. Elnúmero de células progenitoras endotelialescirculante es relativamente pequeño, lademostración de que estímulos como laisquemia producen la movilización y proliferaciónde este tipo de células derivadas de lamédula ósea confirma que la neovascularizacióncomprende también procesos de «vasculogénesispostnatal».Es un fenómeno eminentemente fisiológicoen la cicatrización de heridas y la reparacióntisular en general pero también desempeña unpapel importante en el campo de la fisiopatologíade algunas enfermedades como la artritisreumatoide, la psoriasis y la retinopatía diabéticaproliferativa, así como en el crecimientotumoral primario y metastático (10).Un término más reciente es el de arteriogénesisque se refiere a un incremento enel calibre conexiones arteriolares colateralespreexistentes mediante el reclutamiento decélulas perivasculares y la expansión y remodelaciónde los componentes extracelularesde la pared arterial. La arteriogénesis incrementael tamaño y el grosor de la pared delos vasos colaterales. La tensión mecánica,más que la hipoxia, es el estímulo principalpara la arteriogénesis.Así, el desarrollo de nuevos vasos para instauraruna circulación colateral efectiva en laenfermedad arterial oclusiva periférica sebasa en los tres procesos descritos.
TERAPIA DE CÉLULAS MADRE Y GÉNICA, DE LA ISQUEMIA CRÍTICA DIABÉTICA… ■ 143REGULACIÓN DE LA ANGIOGÉNESISLos pasos clave en la angiogénesis (activaciónde células endoteliales, migración, proliferacióny reorganización) comienzan con laactivación del endotelio vascular mediante laacción de factores como la isquemia o la llegadade factores inductores del crecimientoque estimulan a las células endoteliales pararomper las uniones intercelulares produciendoun aumento de la permeabilidad vascular(10). Así comienza la migración de las primerascélulas que son seguidas por otras, iniciandola formación de nuevos capilares, laliberación local de metaloproteinasas y plasmina,sintetizadas localmente, colabora en ladegradación de la matriz extracelular. Las nuevascélulas endoteliales reestablecen nuevasuniones intercelulares formando estructurastubulares y en los últimos estadios se produceel reclutamiento de células de músculo lisoy fibroblastos que configuran vasos maduros.Estos pasos son regulados por un complejobalance de mecanismos pro y antiangiogénicos.En los últimos 20 años han sido identificadosmuchos de los factores que intervienenen este proceso. Entre los factores proangiogénicosmás importantes cabe destacarel Factor de Crecimiento del EndotelioVascular (VEGF) y el Factor de Crecimientode Fibroblastos básico (bFGF, también conocidocomo FGF2).El VEGF es un factor estimulador específicamentede las células endoteliales y juega unpapel importante en la proliferación y diferenciaciónde éstas, está especialmente reguladopor la hipoxia, induce la formación deVEGF y aumenta el número de receptores deVEGF. Es un factor secretado principalmentepor las plaquetas. Los genes humanos delVEGF que han sido identificados hasta la fechason el VEGF1, el VEGF2 o VEGF C, el VEGF3 oVEGF B, el VEGF D, el VEGF E y el factor decrecimiento de la placenta (PIGF). El VEGFposee algunas características que facilitan sutransferencia génica. En primer lugar, contieneuna secuencia de señal secretora que permiteque la proteína sea secretada de forma naturalpor células intactas, lo que hace que seactiven una serie de efectos paracrinos adicionales.En segundo lugar, sus lugares de altaafinidad son exclusivos para las EC, en consecuencialos efectos mitogénicos están limitadosa éstas. En tercer lugar, el VEGF posee unbucle autocrino que permite modular y amplificarla respuesta de las células endoteliales(8).Los FGFs son factores no secretados quecarecen de una secuencia peptídica señal, seliberan únicamente con la muerte celular o ensituaciones de isquemia celular. Son factoresespecíficos y estimulan la migración y proliferaciónde varios tipos de células como fibroblastosy células musculares. También estimulanla producción de metaloproteinasas quetienen un importante papel en la reorganizacióndel la matriz extracelular (3).Otros factores que intervienen en la regulaciónde la angiogénesis son las interaccionescelulares; leucocitos y plaquetas por contactocelular directo o bien mediante la liberaciónde citoquinas actúan sobre las células endotelialesinterviniendo así en la angiogénesis.Factores clínicos y bioquímicos también influyenen la formación y respuesta a estos factoresreguladores de la angiogénesis. Por ejemplo,la hipoxia es uno de los estimuladoresmás potentes para la angiogénesis (principalmentemediante la liberación de VEGF), encambio la diabetes y la hipercolesterolemiaestán asociados a una pobre respuesta a estímulosangiogénicos (3). Aunque la isquemia esun importante estímulo para la angiogénesishay evidencia que demuestra que en pacientescon EAP la angiogénesis endógena es insuficienteo está disminuida. La angiogénesis se hademostrado que está disminuida en ancianos,diabetes, dislipemia y en pacientes en tratamientocon medicamentos muy comunes enel manejo de la enfermedad cardiovascular(IECAS, estatinas, AINES). En cambio el ejerciciofísico estimula la angiogénesis endógena.Estudios más recientes describen nuevosfactores implicados en la angiogénesis comoel Factor inducido por hipoxia-1 (HIF-1) quees un factor que juega un papel importante enla angiogénesis endógena como respuesta a la
144 ■ PIE DIABÉTICOisquemia. El aumento de los niveles de HIF-1puede tener un importante papel en la angiogénesisterapéutica (18).ANGIOGÉNESIS TERAPÉUTICASe define como angiogénesis terapéuticael uso de agentes biológicos o materialesbioactivos para estimular el crecimiento denuevos vasos sanguíneos para restaurar oaumentar la perfusión de tejidos, revertir laisquemia o acelerar la curación de lesiones (6).La angiogénesis terapéutica tiene comoobjetivo superar las limitaciones de la respuestaangiogénica endógena incrementando significativamentela concentración de factores estimuladoresde la angiogénesis mediante la administracióndel gen que codifica la produccióndel factor de crecimiento, la administración deproteína recombinante o de células productorasde factores de crecimiento (12).El descubrimiento del mecanismo molecularde la angiogénesis fisiológica y patológicaha ayudado a reconocer dos tipos de enfermedades;unas en las que la angiogénesis terapéuticapuede reparar lesiones titulares (EAP,ateroesclerosis) y otras en las que la inhibiciónde la angiogénesis patológica puedecurar la enfermedad o al menos detener suprogresión (retinopatías, crecimiento tumoral,procesos inflamatorios crónicos). En estarevisión nos acercaremos al primer grupo deenfermedades y concretamente a la enfermedadarterial periférica crónica.TERAPIA GÉNICALa transferencia génica consiste en laintroducción de material genético en las célulassomáticas de un organismo con la intenciónde obtener altos niveles de expresión dedicho gen sin provocar efectos adversos en elreceptor(5).Hay dos sistemas de transferencia génica;viral y no viral. Los vectores virales comúnmenteutilizados son los adenovirus y retrovirus.Los métodos no virales suponen la introducciónde ADN desnudo en la zona objetivoAdministración IM de la terapia génica y celular.y el uso de liposomas. El músculo isquémicose muestra como una excelente diana en latransferencia génica, hay estudios quedemuestran que la transferencia génica intramusculartiene una eficiencia cinco vecesmayor cuando el músculo inyectado es isquémico.A pesar de unos resultados iniciales esperanzadores,la terapia génica intraarterial presentauna serie de limitaciones importantes;requiere acceso a una arteria que frecuentementepresenta lesiones difusas por ateroesclerosis.La transferencia génica medianteinyección intramuscular parece más práctica yeficiente(2). En varios estudios se ha observadocomo un prematuro cese en la expresiónde factores de crecimiento conduce a unaregresión en el proceso de angiogénesis, estoexplica los resultados negativos de los estudiosbasados en una estimulación de cortaduración (es el caso del ensayo clínico RAVE).TRANSFERENCIA GÉNICA DE VEGFEstudios preclínicos establecen que elVEGF tiene una actividad angiogénica suficientementepotente como para conseguir unbeneficio terapéutico significativo; el aumentode vasos colaterales visibles mediante angiografíay de capilares identificados medianteestudio histológico en conejos con isquemiacrítica ha demostrado esta actividad (8).
TERAPIA DE CÉLULAS MADRE Y GÉNICA, DE LA ISQUEMIA CRÍTICA DIABÉTICA… ■ 145Como hemos dicho la administración intraarterialtiene limitaciones inherentes que condicionanel éxito de la transferencia génica en laisquemia crítica, presumiblemente por la acciónde nucleasas circulantes y por la difusión irregulara través de la pared del vaso debida a la presenciade depósitos de calcio o de engrosamientode la íntima (5).Los estudios preclínicos han sido diseñados,por tanto, para establecer la viabilidad de latransferencia génica intramuscular de VEGF enla isquemia crítica de extremidades inferiorescon el objetivo de promover la angiogénesis terapéutica(14).En un estudio con pacientes con isquemiacrítica de las extremidades inferiores que presentabanúlceras isquémicas que no cicatrizabany/o dolor de reposo se ha demostrado que latransferencia génica intramuscular de VEGFpuede ser utilizada para realizar una angiogénesisterapéutica con éxito. El método empleadoha sido la transferencia génica mediante la inyecciónintramuscular de 4000µg de un plásmidode ADN desnudo que codifica VEGF. La expresióngénica fue documentada por un aumentotransitorio en las concentraciones séricas deVEGF, clínicamente se objetiva mediante la regresióndel dolor y de las lesiones, aumento enla distancia recorrida sin dolor, incremento en elíndice tobillo-brazo o la aparición de nuevos vasoscolaterales en la angiografía (5).El avance en el conocimiento de la relaciónentre la estructura de las proteínas y las unionesespecíficas del ADN han hecho posible lacreación de factores proteicos de transcripciónque pueden activar o reprimir específicamentela expresión de cualquier gen. Dos estudios publicadosen los últimos meses evalúan la utilidadpotencial de estos avances para el tratamientode la EAP, para ello administran (vía intramuscular)uno de estos factores proteicos para estimularla expresión del gen responsable de laformación de VEGFa a ratones (C57/BL6) deedad avanzada en los que se había inducido unaisquemia en extremidades de forma quirúrgica.Se observó un incremento en los niveles deVEGFa plasmáticos, proliferación de vasos sanguíneosy aumento del flujo sanguíneo en la extremidadestudiada (13, 17).La tromboangeitis obliterante (TAO) oEnfermedad de Buerger es una enfermedad vascularinflamatoria (no ateroesclerótica), segmentariaque afecta a arterias periféricas depequeño-mediano calibre de pacientes jóvenesfumadores. Se caracteriza con frecuencia portener una evolución ominosa a pesar del abandonodel hábito tabáquico, llevando al pacientecon frecuencia a un estadio de isquemia críticaasociada a lesiones tróficas y gangrena. Un primerestudio evaluó el tratamiento de isquemiacrítica en seis pacientes con TAO mediantetransferencia génica intramuscular de un plásmidode ADN desnudo que codifica la síntesisde VEGF concluyendo que la angiogénesis terapéuticamediante transferencia génica de VEGFsi se realiza antes del desarrollo de gangrenapuede ser una alternativa terapéutica válida enpacientes con TAO avanzada que no respondenal tratamiento médico estándar o a métodosquirúrgicos. Un ensayo clínico en fase 1 más recienteha ensayado la misma estrategia terapéuticay parece confirmar la seguridad y buenosresultados de esta modalidad terapéutica(11,12). Ambos estudios han sido realizados conmuestras de pequeño tamaño por lo que habráque esperar nuevos estudios.Diversos estudios están valorando este tipode angiogénesis terapéutica para evitar la reestenosisde la arteria femoral superficial tras eltratamiento quirúrgico mediante PTA. Se fundamentaen conseguir, estimulando la angiogénesis,una regeneración temprana del endoteliotras la agresión que supone la dilatación con balón,y, por tanto, reducir el engrosamiento de laíntima. Para ello se realiza la transferencia génicaadministrando el ADN en un hidrogel queenvuelve el catéter balón. Un estudio preliminarmuestra que es una técnica segura y que puedeser una estrategia terapéutica eficaz para evitarreestenosis tras la angioplastia en arteria femoralsuperficial (5).TERAPIA PROTEICAEl estudio TRAFFIC (4) ha sido una referenciaen el estudio de la angiogénesis terapéutica,pretende demostrar que la infusión
146 ■ PIE DIABÉTICOde rFGF2 mejora la situación clínica depacientes con claudicación intermitente porenfermedad arterial periférica (ateroesclerosisen arterias infrainguinales). Los resultadosmuestran como infusiones intraarteriales de30 µg/kg de rFGF2 producen en 90 días unaumento en la distancia recorrida sin claudicacióny mejora objetiva del índice tobillobrazo.Estos resultados se obtienen tanto enel grupo que recibió una dosis única como enel que recibió doble dosis, comparandoambos con un grupo placebo. No se apreciaronefectos secundarios debidos a la neovascularizaciónen otros órganos, aceleración dela ateroesclerosis, ni otros teóricos riesgos dela angiogénesis terapéutica.Ensayos clínicos realizados con phVEGFhan utilizado inyecciones intramusculares aleatorizadasy de forma ciega en 55 pacientescon dolor de reposo o con úlceras isquémicashan obtenido evidencias de mejoría clínicaen el 92% de los pacientes con dolor dereposo y en el 63% de aquellos con lesionestróficas durante un periodo de seguimientode 4-36 meses (8).La administración de Factor estimuladorde formación de colonias de granulocitos endosis bajas de forma local en tejidos isquémicostambién ha demostrado estimular la respuestaangiogénica a la isquemia, sin inducirleucocitosis severa. Parece por tanto unaestrategia terapéutica nueva y segura parainducir la angiogénesis terapéutica (20).ESTUDIO TAMARISLos pacientes con isquemia crítica demiembros tienen una alta tasa de amputacióny la mortalidad. Pusimos a prueba la hipótesisde que no viral 1 broblast fi factor de crecimiento(NV1FGF) mejoraría la supervivencialibre de amputación.Métodos En este ensayo de fase 3(EFC6145/TAMARIS), 525 pacientes con isquemiacrítica de miembros aptos para revascularizaciónfueron inscritos de 171 sitios en 30 países.Todos tenían úlceras isquémicas o gangrenaen las piernas de menores de la piel y cumplieroncon los criterios hemodinámicos (presiónen el tobillo
TERAPIA DE CÉLULAS MADRE Y GÉNICA, DE LA ISQUEMIA CRÍTICA DIABÉTICA… ■ 147sangre periférica ha promovido el estudiointensivo del potencial de la terapia celular. Laevidencia disponible hasta ahora sugiere quela implantación de células mononuclearesderivadas de médula ósea promueve la neovascularizaciónen tejidos isquémicos.También ha sido descrito que las célulasimplantadas no son sólo incorporadas en laformación de nuevos vasos sino que tambiénactúan secretando factores proangiogénicos.El mecanismo por el que la terapia celularactúa para mejorar la isquemia tisular aún noestá bien descrito (16).La primera aplicación de células mononuclearesderivadas de médula ósea (BM-MNC)se realizó en un estudio con pacientes con EAPavanzada de los que el 72% sufría diabetesmellitus. Se dividió a los pacientes en dos gruposde forma aleatoria, un grupo fue tratadomediante inyección intramuscular de BM-MNC, el otro grupo fue tratado con célulasmononucleares recogidas de la circulaciónperiférica (pMNC). Los pacientes tratados conBM-MNC experimentaron una mejoría significativaen la distancia recorrida sin dolor, el índicetobillo-brazo y la presión de oxígeno percutánea(9). Estos datos sugieren que la implantaciónde células mononucleares derivadas de lamédula ósea antóloga puede ser un tratamientoseguro y eficiente para la EAP, debido a lacapacidad de estas células para diferenciarse encélulas endoteliales y para secretar diversosfactores proangiogénicos (21).Un estudio reciente ha descrito el tratamientoa 29 pacientes con isquemia críticamediante la implantación de células mononuclearesperiféricas. El tratamiento ha sidodescrito como muy efectivo y asocia estaefectividad con el incremento de los nivelesplasmáticos de factores angiogénicos, en concretola interleukina 1beta (IL 1 beta). Lascélulas implantadas no secretan una cantidadsuficiente de IL 1beta pero estimulan a lascélulas musculares para que secreten a su vezfactores angiogénicos (16) para estimular laneovascularización de tejidos isquémicos.La implantación de células mononuclearesprovenientes de médula ósea autóloga (BM-MNC) en tejidos isquémicos promueve laangiogénesis pero se necesita la aspiración deuna cantidad considerable de médula ósea loque supone una limitación para la aplicaciónde esta terapia. En un estudio publicado en2006 se describe como la asociación terapéuticade una baja dosis de BM-MNC y la transferenciagénica de angioproteina 1 producemejores resultados que el tratamiento exclusivocon BM-MNC. Esta terapia combinadamejora cuantitativa y cualitativamente laangiogénesis obtenida mediante tratamientoexclusivo con BM-MNC y permite reducir laaspiración de médula ósea pues necesita dosismenores de BM-MNC (15). Otro estudioreciente compara el tratamiento medianteimplantación de BM-MNC en dos grupos deratas: uno con animales obesos y otro con animalesdelgados. En el grupo de ratas obesas seobserva una menor producción de VEGF, diferenciaciónendotelial y una menor recuperaciónde la isquemia inducida: en comparacióncon el grupo de animales no obesos (19).Basándose en la asociación de la isquemiacon la generación de radicales libres de oxígenoy con el daño en la microcirculación unartículo publicado en 2005 asocia a la implantaciónde BM-MNC un tratamiento metabólicocon antioxidantes y L-arginina (precursordel óxido nítrico) comparándolo con ungrupo tratado tan sólo con BM-MNC. Elresultado principal del estudio es que el tratamientocombinado de BM-MNC e intervenciónmetabólica mejora significativamente laangiogénesis en la isquemia inducida en extremidadesposteriores de ratones. Esta combinaciónaportó mejores que la monoterapiacon BM-MNC.Otra variante de estas estrategias combinadasha sido propuesta por un estudio queasocia el tratamiento con implantación decélulas mastocíticas, que son capaces desecretar factores proangiogénicos como elVEGF, con dosis bajas de radiación ionizante,que también tiene un efecto estimulador de laangiogénesis estimulando a las células mastocíticasen la producción de VEGF. Concluyeque una radiación ionizante a dosis bajasayuda a promover la angiogénesis en tejidosisquémicos (22).
148 ■ PIE DIABÉTICOSe utilizó este método de PB-MNC en unestudio piloto de 10 pacientes con CLI y losresultados fueron decepcionantes: el procesopara obtener el número de células es complejo,un paciente murió de un infarto de miocardio,probablemente por el riesgo desíndrome de hipercoagulabilidad que la administraciónde G-CSF (factor de crecimiento)inducida, y después de un seguimiento de 1año el 50% de los miembros amputados fuerontratados.PROYECTODEL ESTUDIO PETHEMAEnsayo clínico en fase I/II, prospectivo,abierto, no aleatorizado, de angiogénesis terapéuticaen pacientes diabéticos con isquemiacrítica de miembros inferiores medianteadministración de celulas CD133 positivasmovilizadas con G-CSFObjetivo Principal: Analizar la seguridady eficacia de las células CD 133+, obtenidasde sangre periférica, en el tratamiento depacientes diabéticos con isquemia crítica delas EE.II.Objetivos Secundarios:– Determinar la seguridad de la administraciónintramuscular de las células CD133+ movilizadas a Sangre Periférica.– Determinar la capacidad de las célulasCD 133+ de aumentar la revascularizaciónde MMII en pacientes diabéticoscon Isquemia crítica de las EE.II.– Evaluar el estado de salud global de lospacientes mediante los resultados notificadospor los pacientes a través de uncuestionario rellenado por ellos mismos,(SF-36).El estudio está dividido en tres fases:– Pre-tratamiento (4 semanas previas a lamovilización de células CD133).– Tratamiento (movilización, trasplantede células CD 133, y visitas a las 24horas pos-infusión, 4, 12 y 24 semanasdespués del trasplante).– Seguimiento (visitas a los 9 y 12 mesesdespués del trasplante).Población del estudio– Se incluirán un total de 20 pacientes.– Duración del ensayo.– El ensayo tendrá una duración estimadade 3 años.– En los 2 primeros años serán incluidosen el estudio los 20 enfermos previstos,y se realizará un seguimiento de losmismos durante un periodo adicionalde 12 meses.– Calendario y fecha prevista de finaliza–ción.Período de reclutamiento: 2 añosVariables principales de valoraciónVariables clínicas:• Variables de Eficacia:° Éxito técnico (si/no).° Dolor en reposo (mejoría en la escala dedolor).° Preservación o salvamento de la extremidad(no necesidad de amputación)(si/no).° Cicatrización de las lesiones cutáneas(si/no).• Variables de Seguridad:° Morbilidad (ausencia/presencia).° Ausencia de mortalidad (si/no).• Hemodinámicas:° Índice tobillo/brazo (valores entre 0 y 1).° Laser-Doppler (flujo).• Claudicometría:° Inicial (metro).° Absoluta (metro).° Caída de presiones (%) .° Tiempo de recuperación (minutos).• Colateralidad:° Arteriografía (escala 0-3).° Angio-RM (escala 0-3).• Calidad de vida:° Puntuación en la escala SF-36 versión 2en español.
TERAPIA DE CÉLULAS MADRE Y GÉNICA, DE LA ISQUEMIA CRÍTICA DIABÉTICA… ■ 149DISCUSIÓNEn pacientes con isquemia crítica de lasextremidades inferiores los ensayos clínicoshan demostrado una mejoría sintomática yhan aportado una evidencia objetiva de mejoríaen la perfusión, lo que sugiere que la angiogénesisterapéutica puede constituir un métodoalternativo de tratamiento en pacientes enlos que las terapias actualmente disponibleshan fallado o no son viables.Aunque se han descrito resultados prometedoresen las tres líneas de estudio y tratamiento;terapia génica, terapia con proteínarecombinante y terapia celular, es esta últimala que está siendo más desarrollada en losúltimos años. Las estrategias terapéuticascombinadas, que aportan el doble beneficiode reducir las dosis terapéuticas y potenciarel efecto angiogénico, y las nuevas posibilidadesque trae la experimentación con célulasmadre aportan a esta línea de investigación unprometedor futuro. En definitiva, tras revisarla literatura de los últimos años, parece que elabordaje con una terapia combinada es el másapropiado para desarrollar una angiogénesisterapéutica que al fin y al cabo no es más quela potenciación de la angiogénesis endógena.Los próximos objetivos de la investigaciónen el campo de la angiogénesis van a ser:determinar la dosis óptima, la formulación, lavía de administración y la combinación de factoresde crecimiento; determinar la necesidadesde células progenitoras endoteliales o lasuplementación con células madre; proporcionaruna angiogénesis terapéutica efectiva ysegura, así como adaptar la angiogénesis a lasnecesidades individuales de los pacientes.CONCLUSIONESLa terapia génica parece que no es unmétodo práctico muy adecuado para induciruna angiogénesis efectivaA pesar de los resultados negativos envarios ensayos clínicos de factores de crecimientoy la angiogénesis basada en citoquinas,BM-MNC en algunos casos han mostradoresultados prometedores.Estos estudios parecen apoyar el uso decélulas madre como estrategia práctica, seguray eficaz para lograr la angiogénesis terapéutica.Todavía hay mucho que aprender acercade la modalidad de tratamiento óptimo, ladosis, frecuencia y vía de administración.Es necesario que las técnicas de terapiacelular prueben su eficaciaLa terapia celular será posible, con las técnicasmás sencillas.BIBLIOGRAFÍA1. Collinso DJ, Donnelly R. Therapeutic angiogenesis in peripheralarterial disease: can biotechnology produce an effectivecollateral circulation?. Eur J Vasc Endovasc Surg. 2004Jul; 28(1):9-23. Review.2. Baumgartner I, Schainfeld R, Graziani L. Management ofperipheral vascular disease. Annu Rev Med. 2005; 56:249-72. Review.3. Emmerich J. Current state and perspective on medical treatmentof critical leg ischemia: gene and cell therapy. Int JLow Extrem Wounds. 2005 Dec;4(4):234-41. Review.4. Lederman Robert J et al. Therapeutic angiogenesis withrecombinant fibroblast growth factor 2 for intermittentclaudication (the TRAFFIC study): a randomised trial. Thelancet. 2002 Jun; 359:2053-2058.5. Schratzberger P, Kirchmair R, Vale PR, Losordo DW.Therapeutic angiogenesis by gene transfer in critical limband myocardial ischemia. Curr Pharm Des.2003;9(13):1041-7. Review.6. Tìmar J et al. Angiogenesis-Dependent diseases and angiogenesistherapy. Pathology Oncology Research.2001;7(2).85-94.7. Dean SM. Pharmacologic treatment for intermittent claudication.Vasc Med. 2002;7(4):301-9. Review.8. Vale Peter R, Losordo Douglas W, Symes J, Isner J M.Factores de crecimiento para la angiogénesis terapéuticaen las enfermedades cardiovasculares. Rev Esp Cardiol2001; 54: 1210-1224.9. Humpert PM, Eichler H, Lammert A, Hammes HP, NawrothPP, Bierhaus A. Adult vascular progenitor cells and tissueregeneration in metabolic syndrome.Vasa. 2005 May;34(2):73-8, 80. Review.10. Rodríguez-Morata A, Ros-Díe E. Implicaciones fisiopatologicasde la angiogénesis en la patología vascular. Angiología2003; 55(4): 352-360.11. Isner J M, Baumgartner I, Rauh G, Schainfeld R, Blair R,Manor O, Razvi S, Symes J. Treatment of thromboangiitisobliterans (Buerger’s disease) by intramuscular gene transferof vascular endothelial growth factor: preliminary clinicalresults. J Vasc Surg 1998 Dec; 28(8): 964-973.
150 ■ PIE DIABÉTICO12. Olin JW, Shih A. Thromboangiitis obliterans (Buerger’s disease).Curr Opin Rheumatol. 2006 Jan;18(1):18-24. Review.13. Xie D, Li Y, Reed EA, Odronic SI, Kontos CD, Annex BH. Anengineered vascular endothelial growth factor-activatingtranscription factor induces therapeutic angiogenesis inApoE knockout mice with hindlimb ischemia. J Vasc Surg.2006 Jun 3.14. Bobek V, Taltynov O, Pinterova D, Kolostova K. Gene therapyof the ischemic lower limb-Therapeutic angiogenesis.Vascul Pharmacol. 2006 Jun;44(6):395-405.15. Kobayashi K, Kondo T, Inoue N, Aoki M, Mizuno M,Komori K, Yoshida J, Murohara T. Combination of in vivoangiopoietin-1 gene transfer and autologous bonemarrow cell implantation for functional therapeuticangiogenesis. Arterioscler Thromb Vasc Biol. 2006Jul;26(7):1465-72.16. Tateno K, Minamino T, Toko H, Akazawa H, Shimizu N,Takeda S, Kunieda T, Miyauchi H, Oyama T, Matsuura K,Nishi J, Kobayashi Y, Nagai T, Kuwabara Y, Iwakura Y, NomuraF, Saito Y, Komuro I. Critical roles of muscle-secreted angiogenicfactors in therapeutic neovascularization. Circ Res.2006 May 12;98(9):1194-202.17. Yu J, Lei L, Liang Y, Hinh L, Hickey RP, Huang Y, Liu D, Yeh JL,Rebar E, Case C, Spratt K, Sessa WC, Giordano FJ. An engineeredVEGF-activating zinc finger protein transcriptionfactor improves blood flow and limb salvage in advancedagemice. FASEB J. 2006 Mar;20(3):479-81.18. Ho TK, Rajkumar V, Ponticos M, Leoni P, Black DC, AbrahamDJ, Baker DM. Increased endogenous angiogenic responseand hypoxia-inducible factor-1alpha in human critical limbischemia.J Vasc Surg. 2006 Jan;43(1):125-33.19. Li TS, Furutani A, Takahashi M, Ohshima M, Qin SL,Kobayashi T, Ito H,Hamano K. Impaired potency of bone marrow mononuclearcells for inducing therapeutic angiogenesis in obese diabeticrats. Am J Physiol Heart Circ Physiol. 2006Apr;290(4):H1362-9.20. Lee M, Aoki M, Kondo T, Kobayashi K, Okumura K, KomoriK, Murohara T. Therapeutic angiogenesis with intramuscularinjection of low-dose recombinant granulocyte-colonystimulating factor. Arterioscler Thromb Vasc Biol. 2005Dec;25(12):2535-41.21. Napoli C, Williams-Ignarro S, de Nigris F, de Rosa G, LermanLO, Farzati B, Matarazzo A, Sica G, Botti C, Fiore A, ByrnsRE, Sumi D, Sica V, Ignarro LJ. Beneficial effects of concurrentautologous bone marrow cell therapy and metabolicintervention in ischemia-induced angiogenesis in themouse hindlimb. Proc Natl Acad Sci U S A. 2005 Nov22;102(47):17202-6.22. Heissig B, Rafii S, Akiyama H, Ohki Y, Sato Y, Rafael T, Zhu Z,Hicklin DJ, Okumura K, Ogawa H, Werb Z, Hattori K. Lowdoseirradiation promotes tissue revascularization throughVEGF release from mast cells and MMP-9-mediated progenitorcell mobilization. J Exp Med. 2005 Sep 19;202(6):739-50.
Amputaciones en el pie diabéticoBORJA MERINO, ENRIQUE SAN NORBERTO, MIGUEL MARTÍN PEDROSA, RUTH FUENTE YCARLOS VAQUEROHospital Clínico Universitario de Valladolid. Valladolid. EspañaINTRODUCCIÓNLa Diabetes Mellitus (DM) es un problemade salud pública a nivel mundial. Su prevalenciaestá en aumento en todo el mundo. Según elConsenso sobre pie diabético de la SociedadEspañola de Angiología y Cirugía Vascular, éstese define como una alteración clínica de baseetiopatogénica neuropática e inducida por lahiperglucemia mantenida, en la que con o sincoexistencia de isquemia y, previo desencadenantetraumático, produce lesión y/o ulceracióndel pie (1). En este sentido, se ha demostradoque la DM, especialmente la tipo 2, incrementael riesgo de amputación del miembroinferior y se estima que los pacientes diabéticostienen una probabilidad entre 10 y 24superior a la de los no diabéticos de sufrir esteprocedimiento (2,3). Asimismo, en los EstadosUnidos, la DM es responsable del 45-60% detodas las amputaciones del miembro inferiorno traumáticas, ocurriendo la mitad en pacientescon una edad media de 65 años (4).Los factores de riesgo asociados a laamputación son: ser varón (relación hombre/mujerde 9/1), tener una edad mayor de60 años, ciertos grupos étnicos, pobre controlglucémico, diabetes mellitus de larga evolucióny haber recibido escasa información porparte del personal sanitario. Por otro lado,son indicaciones para la amputación todasaquellas circunstancias que afecten la vitalidad,estructura o función de una extremidad,que la conviertan en no funcional, o que demanera indirecta deterioren el estado generaldel paciente y pongan en riesgo su vida (5,6).En el pie diabético, la magnitud y severidadde una infección, así como la vascularizaciónarterial de la extremidad afectada, determinanel papel de la cirugía (7,8). El tratamiento, enestos casos, se divide en dos grupos: conservadory radical. Se denomina tratamientoconservador a los procedimientos de cirugíamenor, que incluyen: exéresis ungueales, drenajesde abscesos y limpiezas quirúrgicas. Laterapéutica radical implica la amputación deun miembro, que dependerá de la extensiónde la necrosis, inflamación o infección, ademásde la valoración del estado vascular de losmiembros inferiores del paciente. Éstos puedensufrir amputaciones consecutivas en lamisma extremidad o en la contralateral, conun pobre pronóstico a largo plazo, una tasa deletalidad a los 3 años entre 35% y 50% y unatasa acumulativa de reamputación entre el30% y 60% tras 1-3 años (9,10).Existen dos tipos básicos de amputación:la amputación menor, que corresponde a lasque se realizan por debajo del tobillo y estánlimitadas al pie; y la amputación mayor, quecorresponde a las realizadas por encima deéste. Pasaremos a estudiar las características,indicaciones y contraindicaciones de los diferentestipos de amputaciones englobadas encada grupo.CONSIDERACIONESPREOPERATORIAS Y PRINCIPIOSGENERALESDE LAS AMPUTACIONESEN EL PIE DIABÉTICO (11,12)Independientemente del nivel de amputaciónque realicemos, se han de tener en cuentauna serie de pautas terapéuticas y princi-
152 ■ PIE DIABÉTICOpios generales preoperatorios, intraoperatoriosy postoperatorios con el fin de minimizarlas potenciales complicaciones y riesgos derivadosde dicha técnica quirúrgica. Dentro deestos principios generales cabe destacar:a) Antes de plantear una amputación, seha de asegurar un correcto aporte arterialen el nivel de amputación que permita elcierre y la cicatrización de la misma, evitandoasimismo la infección.b) Aquellos pacientes que presenten insuficienciacardiaca, broncopatías o nefropa -tías, deben encaminarse a la intervención quirúrgicaen un estado adecuado de su patologíade base. Para tal fin, debe adecuarse los tratamientosfarmacológicos ambulatorios y adaptarlosa la situación de agresión inmuno-endocrino-metabólicaque indican la amputación oderivadas de la misma intervención quirúrgica.c) Emplear una adecuada antibioterapia.En los casos en los que no existan signosde infección se empleará de forma profilácticainiciándola preoperatoriamente y retirándolaa los dos días post-cirugía. Por el contrario,si existe infección previa, debe prolongarseen el postoperatorio hasta confirmar laevolución clínica correcta del muñón. Losantibióticos utilizados tienen que cubrir losgérmenes gram-positivos, gram-negativos yanaerobios. Asimismo se recomienda la realizaciónde lavados diarios del pie, especialmentede los espacios interdigitales y de lapierna. Este acto debe ir acompañado de eliminaciónde zonas de hiperqueratosis.d) Otra familia de fármacos a emplear enel periodo preoperatorio y perioperatorioson los analgésicos, de tal manera que eldolor es el origen principal de la aparición deedema en zonas declives en los enfermos conpatología arterial, ya que motiva que lospacientes permanezcan sentados durante eldía o incluso la noche, puesto que al situarseen decúbito se incrementa el dolor isquémico.e) En los días previos a la intervención elpaciente deberá comenzar los ejercicios derehabilitación. Con ello, consigue no perdermovilidad articular y masa muscular, así comoacostumbrarse a los ejercicios que deberárealizar durante el postoperatorio.f) Desde el punto de vista técnico y quirúrgico,se debe realizar una rigurosa hemostasiadurante la intervención quirúrgica, dadoque la aparición de hematoma conllevaría reinfeccióno necrosis. Asimismo deberemos aproximarsin tensión los bordes cutáneos, evitandola excesiva manipulación y los traumatismosde los tejidos blandos por la utilización de pinzasu otros instrumentos quirúrgicos.g) Realizaremos tracción de los trayectosnerviosos con la finalidad de que su secciónse localice más proximal que el resto delos tejidos, consiguiendo así su retracción y evitandoel posible desarrollo de neurinomas enla cicatriz. Se procederá de igual forma con lostendones y con los cartílagos articulares. Alser tejidos sin vascularización, pueden interferiren la formación de tejido de granulación.h) Asimismo, debe existir una adecuadaproporción entre la sección ósea y la longitudmúsculo-tendinosa y cutánea. De estaforma, se realizará una correcta aproximaciónde los tejidos, con buena cobertura ósea y sintensión cutánea. Además, no se deben dejaresquirlas óseas en la herida, ni rebordes cortantes.Finalmente, realizaremos lavados deforma reiterada en la herida quirúrgicacon abundante suero fisiológico y/ o antisépticoantes de proceder a su cierre.NIVELES DE AMPUTACIÓNLas condiciones que debe cumplir laamputación que consideremos realizar debeser que la necrosis esté localizada y bien delimitadaexclusivamente a la zona que vayamosa amputar. En el caso en que esta condiciónno se cumpla o que suceda alguna contraindicaciónde las que a continuación pasamos adescribir, se deberá proceder a realizar laamputación por un nivel más proximal.Las contraindicaciones a una determinadaamputación son:– La falta de línea de demarcación quecontenga a la necrosis.– Lesiones que se extiendan más proximalmenteal nivel seleccionado deamputación.
AMPUTACIONES EN EL PIE DIABÉTICO ■ 153– Infección no controlada ni localizada alárea a amputar.– Rubor de los dedos en posición pendiente.Una rápida palidez de los dedosy del pie al elevar la pierna y un ruborintenso al dejarla colgando, indican undesarrollo deficiente de colaterales.– Diferencia importante de temperaturaentre la línea de amputación y la regiónproximal del miembro.– Dolor en reposo intenso de la zona aamputar que se extiende más arriba dellugar de la incisión cutánea.Las amputaciones pueden dejarse cerradassi las lesiones están bien delimitadas a lazona amputada y no existe edema ni infección.La colocación de drenajes es opcional.Se puede emplear un drenaje de penroseunas 48 horas en caso de rezumamiento acusadode los tejidos intervenidos en la zonade la herida.AMPUTACIONESMENORES (11,13,14)Se denominan amputaciones menores aaquéllas que se limitan al pie. Dentro de éstaspodemos clasificarlas en:Amputaciones distales de los dedos.Se indican cuando la lesión necrótica selimita a las zonas acras de los dedos. En estoscasos es necesario extirpar todos los tejidosdesvitalizados y necróticos, resecando deforma total o parcial las falanges hasta quequeden bien recubiertas por los tejidos blandos,eliminando asimismo las carillas articularesque permanezcan al descubierto al tratarsede estructuras avasculares. En los casos enlos que exista infección, la dejaremos abiertapara su cierre por segunda intención o realizaciónde friedrich/reamputación en un segundotiempo quirúrgico posterior.Dentro de las amputaciones distales delos dedos, las podemos dividir en: transfalángica,digital transmetatarsiana y atípicas. Pasa -remos a explicar la técnica, indicaciones ycontraindicaciones de cada una de ellas:Amputación transfalángica: a nivel de lafalange proximal. Se realiza una incisión circular,en boca de pez o con colgajos plantares,dorsales o laterales, incidiendo de forma perpendicularen la piel hasta llegar al hueso.Posteriormente, se secciona la falange a travésde la diáfisis, dejando tejido blando suficientepara su recubrimiento. En esta amputaciónla resección de tejido es mínima, no precisandode rehabilitación dado que despuésde la misma el pie se mantiene con una buenafuncionalidad. Se indica en las lesiones circunscritasa nivel de falange media y distal conzona de piel suficiente a nivel de la base deldedo para cubrir la herida. Su realización estácontraindicada en casos de infección conextensión a tejidos blandos que engloben lafalange proximal, celulitis, artritis séptica de laarticulación metatarsofalángica o afectacióndel espacio interdigital. En caso de estar indicadodejar la amputación abierta, las incisionesse prolongarán en sentido proximal paraconseguir el drenaje de las vainas tendinosas.Habitualmente con un cuidado mediante apósitoshúmedos y curas con pomadas antibióticas,se consigue una cicatrización por segundaintención en aproximadamente un mes.Amputación digital transmetatarsiana:Consiste en la exéresis del dedo, de la articulaciónmetatarso-falángica y de la parte distaldel metatarsiano. En caso en que se ampute elsegundo, tercer o cuarto dedo, se realizará unaincisión en la base del dedo por sus carasinterna y externa, dejando algunos milímetrosde piel para permitir el cierre de la herida.Posteriormente, se prolongará hasta la caradorsal, procediendo de igual forma y realizandola misma incisión en la cara plantar. A continuación,abrimos la cápsula de la articulaciónmetatarso-falángica y se desarticula el dedo,resecando posteriormente la cabeza delmetatarsiano. Si se realizara, por el contrario,la amputación del primer o quinto dedos, deberárealizarse una incisión cutánea sobre sucara lateral en la base del metatarsiano, en
154 ■ PIE DIABÉTICOFigura 2. Amputación atípica.Figura 1. Amputación digital de primer dedo delpie.forma de raqueta, incluyendo todo el dedo yavanzando por el espacio interdigital (Fig.1).Al igual que en la amputación transfalángica,la deformidad del pie es mínima, manteniendosu funcionalidad y no precisando derehabilitación. Estaría indicada en aquellaslesiones irreversibles de los tejidos que englobenla falange proximal con indemnidad delespacio interdigital, del pliegue cutáneo y de laarticulación metatarso-falángica. Por el contrario,existe contraindicación en casos decelulitis a nivel del pie, artritis séptica de laarticulación metatarsofalángica, afección delespacio interdigital o lesiones de varios dedosdel pie. En este sentido, cuando se plantea laamputación de dos dedos, especialmente sison consecutivos, o si están tres afectados, espreferible la amputación transmetatarsiana detodo el antepié, puesto que la cicatrización esmás rápida y ofrece menos problemas derecurrencia de la patología responsable de laprimera amputación.Amputaciones atípicas: Están menosestandarizadas y se suele eliminar toda la piel,tejidos necróticos y las estructuras óseasafectadas, sin sobrepasar la parte proximal delos metatarsianos dado que de ser así, no seconseguiría una funcionalidad del pie. Sereservan para casos en los que existe unagangrena no estabilizada, con el fin de preservarel apoyo plantar del pie y del primer dedo,con las consiguientes repercusiones queconllevan en la dinámica y estabilidad y funcionalidaddel mismo. Generalmente, se dejaabierta para que la cicatrización se haga porsegunda intención o se realice en un segundotiempo quirúrgico (Fig. 2).Amputación transmetatarsianaConsiste en la resección de la totalidad delas falanges y de la epífisis distal de los metatarsianosdel pie (Fig. 3). Se describió por primeravez por McKittrick en el año 1949.Técnicamente, consiste en realizar una inci-Figura 3. Amputación transmetatarsiana.
AMPUTACIONES EN EL PIE DIABÉTICO ■ 155sión dorsal que cruza transversalmente el pieen la zona media de los metatarsianos, concluyendoal alcanzar el borde inferior de laprimera y quinta diáfisis. A continuación, laincisión sigue un ángulo recto que se prolongalongitudinalmente siguiendo el borde inferiorde los metatarsianos laterales hasta llegara un centímetro del surco de piel metatarsofalángico,donde se vuelve a cambiar de sentido,continuando de forma paralela a estesurco, hasta que se unen las dos incisiones.Posteriormente, los metatarsianos se seccionanparalelamente a la articulación tarsometatarsianaentre uno y dos centímetrosmás proximales que la incisión practicada enla piel. Por otro lado, la parte plantar del colgajose despega de la superficie inferior de losmetatarsianos mediante bisturí. Los tendonesflexores y extensores deben seccionarse de laforma más proximalmente posible, medianteuna maniobra de tracción previa a su sección.Asimismo, deben evitarse los hematomasmediante una hemostasia cuidadosa ya queson motivo de infección.Mediante esta amputación, se consigueuna aceptable funcionalidad del pie, no precisandode rehabilitación compleja. Sus indicacionesse extienden a aquellas lesiones queincluyan varios dedos y sus espacios interdigitaleso a los procesos que afecten al dorso delpie, en su tercio anterior y sin sobrepasar elsurco metatarso-falángico en la planta delmismo. Por el contrario, está contraindicadaen casos de infección profunda del antepié olesiones que afecten a la planta del pie.En este tipo de amputación, la afectacióndel dorso del pie, así como de la almohadillaplantar, constituyen dos aspectos de mal pronóstico.En el postoperatorio, los puntos sedeben retirar a partir de los 10-14 días tras laamputación y esperar otra semana o dos paracomenzar el apoyo. En el caso de realizar unaamputación abierta, el paciente debe permanecer2 ó 3 semanas en cama, para evitar unposible edema de los tejidos y esperar a quedesaparezcan los signos de infección y nohaya dolor.Asimismo, se han descrito otras amputacionesen zonas más posteriores del pie comoson las de Lisfranc, consistente en la desarticulacióntarsometatarsiana; o Chopart,consistente en la desarticulación astrágalo-escafoideay calcáneo-cuboidea. Cabe destacarque son amputaciones con un importante gradode inestabilidad, que se traduce por equinismoo equino-varo y, por estas razones, nose suelen realizar.AMPUTACIONESMAYORES (11,13-15)Son aquellas que no están limitadas al pie,extendiéndose más allá del mismo. Dentro deeste grupo podemos diferenciar los siguientesprocedimientos:Amputación de Syme:Técnica descrita en 1842 por el autor quele da nombre. Es aquella que se realiza a nivelde la articulación del tobillo. El nivel de disecciónósea se realiza en la tibia y peroné dístales,a unos 0.6 centímetros proximales a laarticulación del tobillo centralmente, formándoseun único colgajo posterior del talón.Técnicamente, consiste en realizar una incisióncutánea en el borde inferior del maléoloexterno, avanzando transversalmente por lacara anterior de la articulación del tobillohasta el borde inferior del maléolo interno. Acontinuación realizaremos un giro de 90º aeste nivel hacia la planta del pie ascendiendohasta el inicio de la incisión a nivel del maléoloexterno. Posteriormente, alcanzaremosestructuras óseas, ligando la arteria tibialanterior y seccionando los tendones anteriores.A continuación, se procederá a la aperturade la cápsula de la articulación del tobillo yse seccionarán los ligamentos laterales, forzandoel pie en una flexión plantar para facilitarla división de la cápsula posterior y poderacceder a la desinserción del tendón aquíleodel hueso calcáneo. Finalmente, se completa ladisección de este último y se separa del pie.El posterior despegamiento de las partesblandas de los maléolos y la retracción proximalpermiten seccionar la tibia y el peroné, a
156 ■ PIE DIABÉTICOun centímetro por encima de la superficiearticular. El colgajo del talón se rota anteriormentey después se sutura a la piel de la zonadorsal.La amputación de Syme está indicada encasos en los que fracase una amputacióntransmetatarsiana o en pacientes con gangrenao úlceras bien delimitadas del antepié (dorsaleso plantares) que imposibiliten la realizaciónde una amputación transmetatarsiana.Por el contrario, lesiones próximas al tobillocon poco espacio anatómico para la realizaciónde esta amputación o situaciones deisquemia e infección en el talón son contraindicacionesabsolutas. Asimismo, la existenciade un pie neuropático con ausencia de sensibilidaden el talón constituiría una contraindicaciónrelativa para realizar esta amputación.Con este tipo de amputación se consigueun buen muñón de apoyo, permitiendo unespacio suficiente entre el extremo delmuñón y el suelo, para la adaptación de la prótesisque supla sus funciones. En este sentido,en una publicación de 2003, se concluía queeste tipo de amputación conseguía una mejorcapacidad de andar y una mayor supervivenciacomparada con amputaciones infrarrotulianasen paciente diabéticos (16).No obstante, las dos causas más frecuentesde fracaso del muñón en esta amputaciónson debidas al desplazamiento posterior de laalmohadilla del talón y a la necrosis cutáneadebida al excesivo recorte de la piel. El mejorindicador de éxito de la amputación y que seobtenga una correcta cicatrización es la existenciade pulso tibial posterior positivo (17).Esta intervención no es muy recomendableen mujeres porque el muñón que se forma esmuy voluminoso y poco estético.Amputación de PirogoffConsiste en la sección de la tibia y elperoné exclusivamente por encima de lainterlinea articular, seccionando longitudinalmenteel calcáneo para llevarlo hacia la superficieproximal. Difiere de la amputación deSyme en que se permite conservar una porcióndel hueso calcáneo como zona de apoyo.Constituye ya un pie artificial y si no existedolor, el paciente puede llegar a andar sin prótesis.Variaciones de la misma para conservarmayor cantidad de almohadilla plantar y calcáneoson las amputaciones de Günther, Le Forto Spitzy. Puede producir deformidad equinodel calcáneo y tiene el inconveniente de queel muñón pierde poca altura con respecto alsuelo, lo que impide el acoplamiento posteriorde una prótesis a nivel de la articulacióndel tobillo, siendo necesaria por este motivocolocar un alza correctora en la extremidadcontralateral. El tratamiento y profilaxis de ladeformidad del calcáneo a causa de dichasamputaciones se consigue de dos formas: seccionandoel tendón calcáneo e inmovilizandocon un yeso el área durante 4-6 semanas.Este tipo de amputación aplicada enpacientes vasculares no ofrece buenos resultados,de tal forma en una publicación aparecidaen 2003 con un seguimiento durante 5años a 12 de estos pacientes, todos padecieronuna mala cicatrización o complicacionespostoperatorias (18).Amputación SupramaleolarEsta técnica queda relegada a casos depacientes graves con mal estado general, talescomo cardiópatas descompensados o neoplásicosavanzados, en los cuales gracias a surapidez de ejecución y traumatismo quirúrgicomínimo se puede ejecutar en casos de gangrenaascendente del pie. En determinadoscasos se puede cerrar, aunque la actuaciónmás habitual es dejarla abierta y transcurridos7-10 días, cuando se obtenga el control de lasepsis, realizar el cierre o plantear una amputaciónproximal.Amputación infrarrotulianao infracondíleaA diferencia de la amputación supracondílea,que veremos a continuación, preserva laarticulación de la rodilla permitiendo así elempleo de prótesis en aquellos enfermos enlos que, por sus condiciones físicas, no seríaposible si se realizaran amputaciones a un
AMPUTACIONES EN EL PIE DIABÉTICO ■ 157nivel más proximal. Por ello, es de elección enaquellos pacientes con buena calidad de vida,aporte arterial infrarrotuliano adecuado yexpectativas de protetización.Existen diferentes variantes técnicas a lahora de realizar una amputación infracondílea,siendo la más empleada la técnica deldoble colgajo o colgajo posterior. Para ello,se debe realizar una incisión transversal en eltercio medio de la pierna, a 12 centímetros dela tuberosidad tibial, marcando posteriormentedos líneas verticales a nivel medial y lateral,de similar extensión para su unión en la caraposterior de la pierna. Una vez se ha seccionadola piel y el tejido celular subcutáneodesde la cara anterior de la pierna hasta eltejido óseo, deberá liberarse este último hastaunos 3 centímetros sobre el nivel de la piel,seccionando asimismo con el electrobisturí eltejido muscular. Posteriormente seccionaremosla tibia en ángulo, dejando más proximalel borde anterior e identificaremos, seccionaremosy ligaremos por separado cada uno delos componentes de los paquetes vasculonerviosostibial y peroneo. Finalmente liberaremosel peroné con una gubia hasta 3-4centímetros de forma proximal a la tibia, lavaremos,realizaremos hemostasia y procederemosal cierre por planos de la amputación.En el postoperatorio inmediato colocaremosuna férula posterior con la intención demantener la extremidad en posición horizontal,evitando la flexión refleja inducida por eldolor y que podría conllevar a la retracciónde la musculatura y la flexión irreductible dela articulación de la rodilla.En este tipo de amputación el tipo demuñón resultante no es de carga, soportandoasí el peso el extremo proximal de la tibia.Obtiene, en comparación con la realizada através del muslo, un menor dolor del muñón,una menor tasa de mortalidad y una mejorrehabilitación, al conservar la articulaciónfémoropatelar. Por ello, es importante conservarel peroné dado que proporciona unaestructura piramidal al muñón y le permiteuna adecuada estabilidad.La realización de esta amputación estaríaindicada en casos de fracaso de la amputacióntransmetatarsiana y en pacientes con gangrenade pie, afectación de la región metatarsianae imposibilidad de realización de amputacióna ese nivel. Una creencia muy extendidaaunque incorrecta, es que la ausencia de pulsopoplíteo contraindica este tipo de amputación.Este modo de pensar no es correcto yse debe realizar la evaluación del nivel deamputación según las recomendaciones previamentecomentadas.Por el contrario, está contraindicada enenfermos que por su situación general no sevan a protetizar, en casos de gangrena extensade la pierna, flexión irreductible de más deveinte grados en la articulación de la rodilla,ausencia de pulso femoral, así como la existenciade patología arterial aguda del sector ilíacoo femoral, en los que hay que esperar 2-3meses para que se pueda desarrollar circulacionescolateral y la cicatrización sea segura.Desarticulación de la rodillaEste tipo de intervención conlleva la ventajade no requerir de sección ósea. Funcio -nalmente, presenta un muñón con brazo depalanca más largo y controlado por músculospotentes, con mejor posibilidad de rehabilitaciónen pacientes con buena calidad de vida.Técnicamente, es semejante a la empleadaen la amputación infracondílea. Rea liza -remos una incisión en «de boca de pez» tomandocomo referencia la línea articular. Acontinuación, se disecará la aponeurosis profundahasta la exposición de la cápsulaarticular, seccionando y desinsertando deltubérculo tibial el tendón rotuliano. Procederemosa la flexión de la rodilla en 90º, seccionaremosla cápsula posterior, que nospermitirá acceder al hueco poplíteo, separary ligar el paquete vasculo-nervioso. Finalmente,seccionaremos el resto de los tejidosblandos, completaremos la amputación yprocederemos al cierre de la aponeurosisprofunda y tejido subcutáneo.Se indica en aquellos casos en los que seaimposible realizar una amputación infrarrotuliana(dada la extensión de las lesiones) o porfracaso de ésta. Por el contrario, en pacientes
158 ■ PIE DIABÉTICOcon gangrena o infecciones de los tejidosadyacentes a la rodilla está contraindicadorealizar esta amputación.Existe la creencia de inaceptables complicacionesde la herida en pacientes diabéticos,pero en 2001, se ofrecieron buenos resultadosen una cohorte de 12 pacientes, obteniéndoseuna tasa de cicatrización adecuadadel 80% además de la ventaja en comparaciónde una amputación suprarrotuliana de unarehabilitación superior y un mejor control dela prótesis (19).Amputación supracondíleaEn este tipo de amputación se pierde laarticulación de la rodilla y la carga protésicase concentra en la zona isquiática y no directamentesobre el muñón, como sucede en ladesarticulación de la rodilla.Técnicamente, se ha de realizar una incisióncircular o en dos colgajos de igual tamaño,iniciándose la incisión en el punto mediode la cara interna del muslo al nivel donde vaa seccionarse el fémur, descendiendo haciafuera, y describiendo una curva amplia que,cruzando la cara anterior del muslo, siga unatrayectoria ascendente que finalice en elpunto de partida. Por otro lado, el colgajoposterior se prepara de igual forma.Posteriormente, profundizaremos en el tejidosubcutáneo y aponeurosis, continuando en lostejidos musculares hasta llegar al fémur. Acontinuación, se retrae proximalmente el colgajo,hasta el nivel de la incisión ósea, localizaremosy ligaremos por separado la arteria yvena femorales, seccionando y ligando el nerviociático a un nivel más proximal con el finde que no produzca neurinomas. La ligaduradel nervio ciático es importante para evitar lahemorragia debido a que la arteria acompañantesuele estar muy desarrollada en lospacientes diabéticos como mecanismo compensatoriode su isquemia. Finalmente, seccionaremosel resto de los músculos y del fémurtransversalmente en la unión del terciomedio-inferior (Fig. 4).Está indicada en casos de fracaso de cicatrizaciónen la amputación infracondílea oFigura 4. Amputación supracondílea.contractura de los músculos de la pantorrillacon flexión en la articulación de la rodilla. Porel contrario, no se deberá realizar este tipo deamputación en pacientes con extensión de lagangrena o infección a nivel del muslo.Desarticulación de la caderaSe realiza cuando están contraindicadastodas las técnicas previas anteriores, por gangrenademasiado extendida o por el fracasode una amputación suprarrotuliana en el terciomedio o superior del fémur, teniendo querecurrir a esta técnica (Fig. 5).Figura 5. Desarticulación de la cadera.COMPLICACIONESEN LAS AMPUTACIONESDEL PIE DIABÉTICOSe pueden dividir didácticamente en precoceso tardías según si aparecen en el primermes postoperatorio o transcurrido más tiempo(20):
AMPUTACIONES EN EL PIE DIABÉTICO ■ 159PRECOCESMuerte postoperatoria. Durante elprimer mes tras una amputación fallecen el6% de los pacientes sometidos a una amputacióninfrarrotuliana y alrededor del 12% ensuprarrotulianas.Trombosis venosa profunda delmuñón. Se ha publicado una incidencia entreel 5 y el 40%. Hay que tener en cuenta que enla pierna contralateral también se puede producir,puesto que se hallan incrementados losfactores de riesgo de trombosis, por lo cual,durante el periodo postoperatorio hay querealizar una apropiada profilaxis antitrombóticamediante heparinas de bajo peso molecularfundamentalmente.Hematoma. Puede provocar la aperturade la sutura cutánea al incrementar la presióndentro del muñón o ser un medio de cultivoexcelente para infecciones.Infección. Los porcentajes publicados seencuentran entre el 12 y el 28% de todos lospacientes. El fundamento de su terapéutica es eldrenaje precoz y suficiente. Se pueden dividir enextraaponeuróticas, cuyo tratamiento es suficientecon la retirada de algunos puntos de sutura,apósitos húmedos y una vigilancia estrechay diaria. Por el contrario, la existencia de una infecciónsubaponeurótica nos obligará a rehacerla amputación de nuevo en quirófano.Necrosis de bordes cutáneos. La cicatrizaciónadecuada del muñón se alcanza en el80-85% en las amputaciones por debajo de larodilla y entre el 85 y el 90% en aquéllas porencima de ésta. La incidencia de la necrosiscutánea se cifra entre el 3 y el 28% de todaslas amputaciones. Su terapéutica consiste enla resección del borde necrótico y la aplicaciónde apósitos húmedos, aunque en el casode existir una necrosis externa se debereconstruir el muñón en quirófano.Dolor en el muñón. Un cierto nivel dedolor más o menos controlable con analgesiacorrecta es común durante el proceso decicatrización. En cambio un incremento en elmismo o su unión a otros signos locales o sistémicospueden indicar infección, necrosis ola aparición de las llamadas sensaciones fantasmas.Sensaciones fantasmas. Reciben estecalificativo esas reminiscencias que conservael paciente de sentir el miembro amputado,no constituyendo en muchas ocasiones unasensación dolorosa como tal. Habitualmentedesaparecen en unas pocas semanas tras laintervención. Hay que diferenciar del dolor enmiembro fantasma que posteriormente serácomentado.TARDÍASGangrena del muñón. En este tipo desujetos afectos de compromiso vascular, elprogreso de la arteriosclerosis que ha provocadola amputación primaria avanza. De talforma, el 30-40% los pacientes diabéticos sereamputarán en los 3 años siguientes.Dolor en miembro fantasma. Se diferenciade las sensaciones fantasmas en que esclaramente doloroso y que aparece transcurridosdos, tres o más meses tras la intervenciónquirúrgica. Suele ser debido a la formaciónde un neuroma en el muñón al englobarseel extremo nervioso por tejido cicatricial.Su aparición es mayor en pacientes sometidosa amputaciones por encima de la rodilla y enaquellos que han padecido durante bastantetiempo dolores isquémicos previamente a lacirugía. Para su tratamiento se ha empleadocarbamazepina, terapéuticas quirúrgicas comosecciones nerviosas, cordotomías, simpatectomías,actuaciones sobre centros talámicos oincluso reamputaciones, todas ellas con discretosresultados.Contractura en flexión. Esta complicaciónpuede ocurrir en el postoperatorio tempranotras la intervención. Las etiologías másfrecuentes son el dolor en el muñón, la isquemiadel mismo o el dolor de miembro fantas-
160 ■ PIE DIABÉTICOma. Comienzan su relevancia clínica a partirde los 10 grados en la articulación de la caderay de 15 en la de la rodilla, puesto que contracturassuperiores motivan la disminuciónde la capacidad de andar y la incapacidad deuna fijación protésica adecuada.Muñón. Complicaciones locales a estenivel pueden ser óseas como osteoporosis,espolones óseos; excesiva cantidad de tejidosblandos (el llamado muñón bulboso) o la apariciónde callos y quistes epidérmicos.BIBLIOGRAFÍA1. Marinel.lo J, Blanes JI, Escudero JR, Ibáñez V, Rodríguez J.Consenso de la Sociedad Española de Angiología y CirugíaVascular sobre Pie Diabético. Angiología 1997;49:193-230.2. Reiber G, Boyko J, Smith E. Lower extremity foot ulcers andamputations in diabetes. En: Harris M, Conie C, Stern, editors.Diabetes in America. 2nd ed. Washington D.C.: USDepartament of Health and Human Services, Public HealthService, National Institutes of Health; 1995. DHHSPublication Nº (NIH) 95-1468.3. Trautner C, Haastert B, Giani G, Berger M. Incidence oflower limb amputations and diabetes. Diabetes Care1996;19:1006-9.4. Adera H, James K, Castronuova JJ, Byme M, Deshmukh R,Lohr J. Prediction of amputation wound healing with skinperfusion pressure. J Vasc Surg 1995; 21:823-9.5. Collado M, Real J, Walls M, Alario B, Blaso A, Gimili A, et al.Estudio de factores asociados con amputación en pacientesdiabéticos con ulceración en el pie. An Med Int2001;18:245-8.6. Troup TG. Epidemiology of lower extremity amputation incentres in Europe, North America and East Asia. The globallower extremity amputation study group. Br J Surg2000;87:328-37.7. Falanga V. Wound healing and its impairment in the diabeticfoot. Lancet 2005;366:1736-43.8. Hilton JR, Williams DT, Bevker DR, Harding KG. Wounddressings in diabetic foot disease. Clin Infect Dis2004;39:S100-3.9. American Diabetes Association. Diabetes facts and figures.Alexandria, VA: American Diabetes Association;2000.10. Pecoraro RE, Reiber G, Burgess EM. Pathways to diabeticlimb amputation: basis for prevention. Diabetes Care1990;13:513-21.11. Marinel.lo J, Blanes JL, Escudero JR, Ibáñez V, Rodríguez J.Tratado del pie diabético. Segunda Edición. Ed: Centro dedocumentación del Grupo Esteve. 2007.12. Thompson JF, Cowan AR. The diabetic foot. En Earnshaw JJ& Murie JA, ed. The Evidence for Vascular Surgery. SecondEdition. Shrewsbury (UK): Ed. tfm Publising Ltd, 2007;91-98.13. Davies N, Goode A, Yu D. Advanced endovascular interventionin the infra-inguinal region. En Earnshaw JJ & Murie JA,ed. The Evidence for Vascular Surgery. Second Edition.Shrewsbury (UK): Ed. tfm Publising Ltd, 2007;53-60.14. Ibáñez V, Blanes I, Escudero JR. El pie diabético, bases generalesy síndromes clínicos. En Tratado de las EnfermedadesVasculares SEACV. Vol II. Barcelona: Ed Viguera, 2006;1233-40.15. Documento de Consenso sobre el tratamiento antimicrobianode las infecciones del pié diabético. AsociaciónEspañola de Cirujanos (AEC), Sociedad Española deAngiología y Cirugía Vascular (SEACV), Sociedad Españolade Medicina Interna (SEMI) y Sociedad Española deQuimioterapia (SEQ). Angiología 2008; 60: 83-101.16. Pinzur MS, Stuck RM, Sage R. Syme ankle disarticulation inpatients with diabetes. J Bone Joint Surg Am 2003; 85: 1667-72.17. Francis H 3rd, Roberts JR, Clagett GP. The Syme amputation:success in elderly diabetic patients with palpable anklepulses. J Vasc Surg 1990;12:237-40.18. Taniguchi A, Tanaka Y, Kadono K. Pirogoff ankle disarticulationas an option for ankle disarticulation. Clin Orthop2003;414:322-8.19. Cull DL, Taylor SM. A reappraisal of a modified throughkneeamputation in patients with peripheral vascular disease.Am J Surg 2001;182:44-8.20. Gottschalk FA, Fisher DF Jr. Complications of amputation.En Ernst CB, Stanley JC, editors. Current therapy in vascularsurgery. 4 ed. Mosby; 2001. p. 1987-1999.
Nuevos avances en el tratamientodel pie diabéticoBORJA MERINO, JOSÉ ANTONIO GONZÁLEZ-FAJARDO, ÁLVARO REVILLA, JAMES TAYLOR,ISABEL ESTÉVEZ Y CARLOS VAQUEROServicio de Angiología y Cirugía Vascular. Hospital Clínico Universitario Valladolid. EspañaINTRODUCCIÓNSegún el Consenso sobre el Pie Diabéticode la Sociedad Española de Angiología yCirugía Vascular (SEACV), el pie diabético sepuede definir como «la alteración clínica, debase etiopatogénica neuropática e inducidapor la hiperglucemia mantenida, en la que cono sin coexistencia de isquemia y, previodesencadenante traumático, produce lesióny/o ulceración del pie» (1).La prevalencia de la diabetes mellitus esdel 6%, aunque se estima que está infradiagnosticada,existiendo un porcentaje similar depacientes que no son diagnosticados. Ademáses la séptima causa de muerte directa en lospaíses desarrollados, sin tener en cuenta supapel en la mortalidad cardiovascular (2).Según Brem y cols. (3), cada año se llevan acabo unas 82.000 amputaciones de las extremidadesen pacientes con diabetes mellitus. Lamayoría de éstas podrían evitarse siguiendoprotocolos estrictos que incluyan las siguientesmedidas multidisciplinares, publicadas por estegrupo (3) tras analizar la experiencia colectivade cuatro programas principales del pie diabéticoen los Estados Unidos y Europa. Así, unmanejo integral del pie diabético debe deincluir los siguientes pasos:a) Valoración, inspección y medición minuciosade la úlcera en el pie diabético, asícomo de posibles lesiones incipientes.b) Control óptimo de la glucosa.c) Desbridamiento quirúrgico de todo el tejidohiperqueratósico, infectado y no viables.d) Administración de antibióticos sistémicosy drenaje en los casos en los que el pacientepresente signos de celulitis y/o infecciónprofunda.e) Descargas y/o plantillas.f) Curas locales con hidrogeles. Puede sernecesario el empleo de terapias coadyuvantescomo las curas mediante presiónnegativa.g) Tratamiento con factores de crecimientoy/o terapia celular, en el caso en el que laherida no cicatrice después de 2 semanasrealizando este protocolo, o no exista evidenciade granulación y/o epitelización dela misma.Para la correcta aplicación de las medidasexpuestas es necesaria la existencia de centroscon adecuada disponibilidad para ello. Eneste sentido, hemos de reseñar los altos costessocioeconómicos derivados de su tratamiento,de ahí la importancia de su prevención.Durante las décadas anteriores se ha invertidotiempo y esfuerzo por parte de la industriaen la comercialización de nuevos apósitospara el tratamiento local del pie diabético. Locierto es que en los últimos años se ha evidenciadoque terapias aplicadas hasta entoncesa otros campos podrían ser empleadas en elpie diabético, siendo estos nuevos procedimientosaceptados con cierto recelo por partede los profesionales, ya fuera por el desconocimientoo necesidad de modificar los protocolosde actuación existentes o por el hipotéticoaumento del balance coste/beneficio.
162 ■ PIE DIABÉTICOLos objetivos de este estudio han sidoanalizar los últimos avances en el tratamientodel pie diabético y su eficacia como coadyuvantesa las terapias clásicas, teniendo encuenta los costes derivados de su aplicaciónclínica. Nos referiremos fundamentalmente ala terapia con presión negativa (TPN), oxigenoterapiahiperbárica, tratamiento con factoresde crecimiento-terapia celular, apósitomodulador de proteasas, terapia eléctrica ysuplementos dietéticos.TERAPIA DE PRESIÓN NEGATIVALa TPN consiste en la succión subatmosféricacontinua o intermitente (mediante presionesentre 50 y 175 mmHg) realizada sobrela herida quirúrgica a través de una esponja depoliuretano o de alcohol polivinílico y selladacon un plástico adherente transparente paraobtener un entorno cerrado. Todo ello estáconectado a una bomba eléctrica adherida aun recipiente que recoge el exudado de laherida, utilizando un tubo flexible. La esponjade poliuretano tiene poros de tamaños quevan desde 400 a 600 micras. La esponja dealcohol polivinílico presenta tamaño de losporos de 200 a 300 micras (4) (Fig. 1).Figura 1. Dispositivo V.A.C Therapy® (KCI, Oxford).El dispositivo más empleado es la V.A.CTherapy® (KCI, Oxford), que comenzó adesarrollarse en el año 1989 por los Dres.Louis Argenta y Michael Morykwas de laUniversidad Wake Forest (California delNorte) (4). Aunque inicialmente fue concebidacomo una terapia de cicatrización para lasheridas crónicas, sus indicaciones se hanextendido posteriormente a otro tipo deheridas (heridas agudas, quemaduras, pie diabéticoy osteomielitis), habiéndose demostradosu efectividad como terapia coadyuvante,especialmente en el pie diabético (5,7).Las indicaciones actuales de la TPN selimitan a (7): heridas abiertas crónicas (úlceraspor presión, úlceras vasculares y pie diabético),heridas agudas y traumáticas, incisionesdehiscentes, injertos por malla y colgajos. Porotro lado, no debemos emplear esta terapiaen situaciones de malignidad de la herida, tejidonecrótico con escarificación presente,osteomielitis sin tratar, ni en los casos en losque existan arterias o venas expuestas. Se hande tener especiales precauciones en pacientescon sangrado activo, tratamiento anticoagulante,heridas con hemostasia difícil, fístulas noexploradas o ante casos con vasos sanguíneosdebilitados (suturados o irradiados).La TPN actúa sobre las heridas del pie diabéticoreduciendo el edema local, aumentandola perfusión sanguínea local, la cicatrización,estimulando la proliferación de tejido degranulación, promoviendo la cicatrización enambiente húmedo y eliminando el exudado ylas moléculas que inhiben la correcta cicatrización(7). Por ello, en el pie diabético tiene suespecial utilidad en todas aquellas situacionesque retrasen el proceso de cicatrización delmismo, como son: la dificultad para la realizaciónde descargas, baja adherencia al tratamiento,presencia de exudado incontrolado,nivel de perfusión límite, infección u osteomielitisrecurrente o existencia de tejidos noviables en el lecho ulceroso (8,9).Son numerosos los estudios que avalan laeficacia de la TPN y VAC en el pie diabético.Así según Petrie y cols., la TPN consigue acortarel periodo de hospitalización, aumentandola tasa de cicatrización de heridas y el salvamentode la extremidad en sujetos con piediabético (10). Asimismo, en un estudio multicéntrico,aleatorizado y controlado realizadopor Apelqvist y cols., se afirma que la terapiaVAC es una terapia más eficiente, segura y
NUEVOS AVANCES EN EL TRATAMIENTO DEL PIE DIABÉTICO ■ 163económica para el tratamiento de las heridascomplicadas en el pie diabético en comparacióncon la aplicación de apósitos locales (11).Por otro lado, Braakenburg y cols., nodetectaron una diferencia significativa entre eléxito de la TPN-VAC y la efectividad de losapósitos locales para tratar heridas agudas ycrónicas. Sin embargo, sí encontraron que laTPN-VAC tenía importantes ventajas para lospacientes con diabetes mellitus y las enfermedadescardiovasculares, sugiriendo que estopuede deberse a un aumento de la angiogénesis(12).Asimismo, la TPN se traduce en unaimportante reducción del tamaño de laherida. Algunos estudios han demostradoque el volumen de la herida se podría reducirun 59%. (13,14). Con esta reducción, el tratamientocon TPN permite la curación de lasheridas por segunda intención, debiendo serconsiderada como una terapia alternativa enla escala reconstructiva, entre el cierre porsegunda intención y la aplicación de injertosde piel.En cuanto a la disminución del númerode bacterias, los resultados son discordantes.Morykwas y cols. demostraron, a travésde experimentos en animales, que el tratamientocon TPN reducía el recuento de bacteriasen el tejido aplicado (15). Blume y cols.,por el contrario, determinaron que la terapiaVAC no tiene un efecto consistente en la eliminaciónde bacterias, a través de estudios clínicos(16). Lo que sí existe un acuerdo es quela TPN facilita la eliminación segura de tejidoinfectado, con disminución de los esfacelos,facilitando la aparición de tejido de granulacióny, por consiguiente, acelerando la cicatrización(17,18).Si analizamos las tasas de recuperaciónde la extremidad, Armstrong (7,19,20) publicóuna cifra de salvamento de la extremidaddel 90,3% en un estudio llevado a cabo en 31sujetos. En este trabajo, el 3,2% fueron amputacionesinfrarrotulianas y el 6,5% restantetransmetatarsiana. Por otro lado, en un estudiode once pacientes realizado por Nather ycols., se logró el 100% de recuperación de laextremidad (8). También Ulusal y cols. (21), enuna publicación reciente, revelan tasas deamputación del 37% de los pacientes tratadoscon VAC (25% amputaciones transmetatarsianasy 12% de amputaciones mayores) y cifrasde recuperación funcional de la extremidaddel 88%.Valorando la duración media de hospitalizaciónpara los pacientes que recibieronTPN, las cifras se sitúan en 32 días según laserie de Ulusal (21), 23,3 días según Nather(8), 32,9 para la serie publicada porArmstrong (20) y 57,4 para el grupo de Clare(22). En resumen, la estancia media de hospitalizaciónque publica la literatura es 37,8 días(21). En este sentido, numerosos son los estudiosde coste-efectividad que establecen quela TPN es más efectiva y menos costosa encomparación con el tratamiento localmediante apósitos convencionales (22-25).A modo de conclusión final a este apartadopodemos establecer las siguientes recomendacionesestablecidas (26) para garantizarel éxito del tratamiento con TPN y, en consecuencia,la curación de la herida:a) Realizar un correcto diagnóstico diferencialpara realizar el tratamiento más adecuado.Debe empezarse por realizar untratamiento local adecuado.b) Asegurar el estado vascular del paciente.c) Desbridamiento de tejido no viable y controldel proceso séptico.d) Realizar una adecuada cobertura antibióticaguiada por cultivo.e) Extremar la precaución en pacientes anticoagulados(muy importante realizardeterminaciones de INR previamente alempleo de esta terapia).f) Realizar un correcto control del selladocon el dispositivo en los casos de úlcerascon abundante exudado.g) La TPN debe estar asociada a una descargaadecuada.h) Debe conseguirse la implicación delpaciente y familia para asegurar un buenfuncionamiento y adhesión al tratamiento.i) Optimizar el tiempo utilización, valorandosemanalmente el estado y las característicasde la lesión.
164 ■ PIE DIABÉTICOj) Seguir las indicaciones para acelerar la cicatrizacióny reducir coste, evitando elevar elcociente coste /beneficio.OXIGENOTERAPIA HIPERBÁRICASu empleo se halla limitado por su bajadisponibilidad y el elevado coste económico.Además de utilizarse en el tratamiento del piediabético, ha sido empleado en otros ámbitosy patologías en los últimos 20 años. Consisteen que el paciente inspire oxígeno a una concentracióndel 100% en un ambiente con presiónatmosférica aumentada. Un típico protocolode tratamiento de la úlcera del pie diabéticoimplica de 20 a 40 sesiones. El tratamientose da generalmente en sesiones diariasde 90 a 120 minutos, con presiones deentre 2,0 y 2,5 atmósferas (Fig. 2).Figura 2. Oxigenoterapia Hiperbárica.El uso del oxígeno hiperbárico para el tratamientode las úlceras del pie diabético se hafundamentado en bases científicas débilesdurante la última década. Los estudios prospectivosexistentes son pobres, con limitacionesmetodológicas debido al escaso tamañomuestral de los mismos que permitan extrapolarsólidas conclusiones.Sin embargo, los resultados positivos deestos estudios son concordantes con losdatos de estudios in vitro y mecanismos fisiológicosque apoyan el empleo de la oxigenoterapiahiperbárica para revertir la hipoxiainducida por la patología (28). La evidenciasugiere que el oxígeno hiperbárico reduce lastasas de amputación y aumenta la probabilidadde curación de las úlceras del pie diabéticoinfectado, debido a la mejoría en la oxigenacióndel tejido, lo que conllevaría una mejoraen la calidad de vida (29). Sin embargo,como ya hemos citado, representa una modalidadcostosa, que sólo está disponible enpocos centros. Por otra parte, los eventosadversos requieren una investigación másamplia en términos de seguridad. Por último,no está del todo claro qué pacientes se beneficiaránde esta terapia, en qué momento debeésta iniciarse o detenerse, así cómo la determinaciónde criterios de inclusión de pacientes.Cierta evidencia indica (28) que los parámetrosmicrovasculares, como la presión parcialtranscutánea de oxígeno (TcPO 2), podríanser útiles para predecir qué pacientes sebeneficiarán de la terapia pero, debido a queestos análisis están limitados por su escasotamaño muestral, deben ser interpretadoscon cautela. En conclusión, la oxigenoterapiahiperbárica parece prometedora, pero senecesita más experiencia antes de su aplicacióngeneralizada y estandarizada en el cuidadorutinario del pie diabético.En este sentido, actualmente, O’Reilly ycols. (30), están desarrollando el primer estudiodoble ciego, aleatorizado y controladocon el fin de evaluar la eficacia de la terapiacon oxígeno hiperbárico en la prevención delas amputaciones en pacientes diabéticos. Elobjetivo principal de este estudio es evaluar laeficacia de la oxigenoterapia hiperbárica asociadaa los cuidados locales convencionalesdel pie diabético (curas locales con apósitos,antibioterapia) en comparación con los cuidadosestándar de las úlceras en pacientes condiabetes mellitus. El estudio tendrá una duracióntotal de unos tres años y sus resultadosproporcionarán un aumento de la evidenciacientífica existente en cuanto a la eficacia,efectividad, eficiencia y análisis de coste-beneficiode esta modalidad de terapia.TERAPIA CELULAR: FACTORESDE CRECIMIENTOY CÉLULAS MADREEl tratamiento con factores de crecimientoestá siendo considerado como un método eficaze innovador para el tratamiento coadyuvanteen el pie diabético. Ahora bien, ¿cuál es su
NUEVOS AVANCES EN EL TRATAMIENTO DEL PIE DIABÉTICO ■ 165beneficio en este ámbito, por sí solo o en combinacióncon otras terapias, teniendo en cuentaaspectos médicos, sociales y económicos?En este sentido, Buchberger y cols. (31), atal efecto, publicaron una revisión en la querealizaron una búsqueda sistematizada queincluyera las publicaciones en alemán e inglésdesde 1990 a 2008. Identificaron 25 estudios(14 ensayos controlados aleatoriozados, 9 análisisde rentabilidad y 2 metaanálisis). La duraciónde los estudios analizados varió de 12 a 20semanas y la población de estudio incluyóentre 17 y 382 pacientes. El tratamiento conBecaplermina, rhEGF e implantes de pielDermagraft y Apligraf mostró un claro beneficiosobre el cierre completo de la herida quirúrgicay el tiempo de cicatrización en ocho delos 13 estudios. No existió evidencia de beneficiodel tratamiento con bFGF. En 4 de los 14estudios se publicó una proporción de eventosadversos del 30%, sin diferencias entre los gruposde tratamiento. En cuanto a los costes económicos,los resultados sólo evidenciaron unarentabilidad de la Becaplermina.La terapia basada en células madre, por suparte, es una opción prometedora para eltratamiento de pacientes con diabetes y dificultadpara la cicatrización de heridas. De losdiferentes tipos de células madre o progenitoras,las células madre endoteliales son lasque se han empleado a partir de modelosexperimentales en ensayos clínicos. Estaestirpe celular, ha sido probada hasta ahoraen pacientes con arteriopatía periférica, y losresultados son muy alentadores. Ya comienzana aplicarse en pacientes con úlceras diabéticas.Sus propiedades celulares, que permitenla manipulación genética y epigenética,hacen que las células progenitoras endotelialessean las candidatas para aplicarse deforma generalizada en el tratamiento del piediabético (32).En este sentido, comienza a haber algunapublicación de la aplicación de células madreen pacientes diabéticos. Así, Dubský y cols.(33), en un estudio prospectivo realizadorecientemente en 14 pacientes con el objetivode evaluar la seguridad y efectividad de laterapia celular, sugieren que la terapia concélulas madre en el pie diabético es unaopción terapéutica eficaz sin efectos adversospara los pacientes con enfermedad arterialperiférica grave. Además, afirman que este tratamientolleva a un aumento de la tensióntranscutánea de oxígeno, mejora la cicatrizaciónde la herida y disminuye el dolor enreposo.No obstante, los estudios clínicos publicadosen el campo de la terapia celular sonescasos y muy limitados en cuanto a tamañomuestral, con un alto potencial de sesgo, siendola validez de los resultados en cuanto a eficaciay coste-efectividad también limitada. Porotro lado, la duración del tratamiento y seguimientodel mismo en las series publicadas, noes suficiente para analizar las posibles recurrenciaso la aparición de efectos adversos,como tumores malignos.En conclusión, hay indicios de que la aplicaciónde factores de crecimiento y célulasmadre en las úlceras de pie diabético suponeun beneficio con respecto a las terapias convencionalesen términos de tasa de curación ycicatrización. No obstante, es necesaria laaparición de otros estudios con mayor calidadmetodológica, tamaño muestral adecuado ytiempo de seguimiento suficiente, con el finde aplicar una mejor evidencia científica quepermita la aplicación generalizada y de formasegura de esta terapia. Asimismo, son necesariosotros estudios que aporten resultadossobre la calidad de vida del paciente, así comode la aceptación y tolerancia a este tratamiento.Pese a todo a ello, las expectativasson altamente esperanzadoras.MATRIZ MODULADORADE PROTEASASPara conocer su utilidad, debemos teneren cuenta los mecanismos fisiopatológicosque se desencadenan durante el procesoinflamatorio. Así, existe un estancamiento enla fase inflamatoria (34) que dificulta el procesode cicatrización. Este estancamiento esdebido al aumento de enzimas proteolíticas(proteasas metaloproteinasas), a la disminu-
166 ■ PIE DIABÉTICOción de la concentración de factores de crecimientoy al favorecimiento del proceso catalíticoe inhibición de la mitosis celular. Además,la carga bacteriana debida a la infección en elpie diabético incrementa el nivel de proteasas(35), existiendo de forma paralela una disfunciónfibroblástica en el diabético que se hacepatente incluso en las heridas agudas (36).Conocidos los mecanismos etiopatogénicospodríamos plantearnos si podemos acelerarla velocidad de cicatrización y, en tal caso,de qué forma. Podríamos pensar en aumentarlos factores de crecimiento mediante la aplicaciónde PDGF (Becaplermín) o de factor decrecimiento epidérmico, no siendo esto suficientesi no se controlan las condiciones hostilesde la herida ni se restaura el equilibrioproteolítico modulando la cantidad de proteasas(37). Éstas se pueden controlar mediantela aplicación de una matriz moduladora deproteasas, el Promográn Matrix® (COR-C)(Johnson & Johnson Medical, New Brunswick,NJ, USA), compuesto por Celulosa OxidadaRegenerada (COR) en un 45% y ColágenoBovino (C) en un 55% (38). Actúa principalmenteuniéndose e inactivando las metaloproteinasas,lo que favorece la protección delos factores de crecimiento endógenos, quese liberan en el lecho de la herida de formagradual una vez que se han reducido las proteasas.De forma añadida la COR+C modulala función quimiotáctica y la proliferacióncelular de fibroblastos (36,38) (Fig. 3).Figura 3. Apósito Promográn Matrix® (COR-C)(Johnson & Johnson Medical, New Brunswick, NJ,USA).El COR-C está indicado en el pie diabéticopara tratar todas las lesiones postquirúrgicascon cierre por segunda intención, es deutilidad en procesos post-osteomielitis, ensituaciones que requieran proporcionar rápidacobertura ósea mediante tejido de granulacióncon el fin evitar reinfecciones y, además,presenta propiedades hemostáticas. Porel contrario, para aplicar el COR-C es necesarioel control del proceso séptico previomediante terapia de descontaminación y estácontraindicada su aplicación en casos dehipersensibilidad y en tejidos no viables o conlesiones reagudizadas (38).En cuanto a sus resultados, Lázaro y cols.(38) analizan la eficacia del apósitoPromogran® en la aceleración de la cicatrizaciónde úlceras de pie diabético de evoluciónprolongada. Para ello realizaron un estudiocontrolado, aleatorizado y comparativo en 40pacientes con úlceras de pie diabético de origenneuropático, con lesiones de una antigüedadsuperior a 6 semanas. Los pacientes fueronaleatorizados en 2 grupos; un grupo recibiótratamiento con apósito modulador deproteasas y el otro, al que se consideró grupocontrol, recibió tratamiento de la lesión segúnprotocolo estandarizado. Obtuvieron unacicatrización total, al finalizar las 6 semanas deseguimiento, del 63% de los pacientes tratadoscon Promogran® frente a un 15% de losdel grupo control (p < 0,03). Por otro lado, lamedia de tiempo de cicatrización fue de 23,3± 9,9 días en el grupo de estudio y de 40,6±1,15 días en el grupo control (p < 0,01), porlo que concluyen que la utilización de apósitosmoduladores de proteasas induce unamejor regeneración tisular que un buen tratamientolocal. Además, afirman, la combinaciónde COR-C con TPN, mejoraría los resultados,aunque faltan estudios más concluyentes queincluyan un mayor tamaño muestral.En cuanto a los estudios de coste-efectividad,según Ghatnekar y cols. (39), el COR-Csupone un ahorro de 2.000 euros por pacientey año respecto al tratamiento convencionalde las úlceras en el pie diabético. Por otrolado, más recientemente, Lázaro y cols. (40)realizaron un análisis de coste-efectividad del
NUEVOS AVANCES EN EL TRATAMIENTO DEL PIE DIABÉTICO ■ 167ensayo clínico previamente elaborado, enpacientes con úlceras neuropáticas de pie diabéticoy que fueron tratados con el apósitoCOR-C, demostrando que el tratamiento conapósito modulador de proteasas (COR+C)presenta una excelente relación coste-beneficio,según los resultados del NNT y del costeefectividadmedio. Además, el coste-efectividadmedio asociado al uso de COR+C eramenor que cuando se usaban apósitos convencionales(1.568,19 €). Según este estudio,con una inversión de 531,72 € en el uso deapósitos de COR+C se conseguiría ahorrar1.242,91 €; siendo además menores los costesque los establecidos por el estudioEURODIALE para el tratamiento de una úlceraneuropática (4.514 €).No obstante, estos estudios de costeefectividadtienen una serie de limitacionesmetodológicas, ya que dependen de las característicasde los diferentes sistemas sanitariosestudiados, de las características demográficasde los países en los que se realicen los estudiosy de los protocolos de atención a pacientescon pie diabético que estén vigentes enlos centros de estudio. Además, muchas veceses difícil identificar y controlar las variablesque influyen en la cicatrización, lo que puedeconducir a sesgos y errores. Por último, sueleexistir poca iniciativa por parte de los investigadorespara realizar estudios de coste-efectividadde las diferentes terapias sanitarias.En conclusión, y en base a los estudiosexistentes hasta el momento, podemos decirque la terapia con apósito modulador de proteasas(COR+C) es un tratamiento eficaz enlos pacientes con pie diabético, con mejoresresultados en términos de tasas de cicatrización,regeneración tisular, estancia hospitalariay costes económicos; en comparación los deltratamiento local mediante apósitos convencionales.ESTIMULACIÓN ELÉCTRICAA BAJO VOLTAJEDurante la inflamación, disminuye el óxidonítrico perilesional y, en consecuencia, se dificultala angiogénesis y se retrasa la cicatrización.La estimulación eléctrica a bajo voltaje(generador de pulsos) induce la neosíntesis dela proteína VEGF, aumenta la angiogénesis localy restaura el flujo sanguíneo en el área isquémica,favoreciendo la microcirculación (41).Para esta estimulación eléctrica, existe eldispositivo PhyBack PBK-2C® (ImpulseMedical Systems, Davie, FL). Aplica microcorrientescon achuras de pulso de 1-9 s, frecuenciasde 1-420 Hz y voltaje de 30-120 yamplitudes máximas de 100 mA. El dispositivoconsta de 2-4 cables, 4-8 electrodos y un softwareespecífico (Fig. 4). Está indicado en lassiguientes situaciones clínicas: alivio del doloragudo y crónico, daños musculares o espasmos,artritis, dolor neuropático, patologíasvasculares, así como en úlceras de diferenteetiología (42,43).Figura 4. Dispositivo PhyBack PBK-2C® (ImpulseMedical Systems, Davie, FL).Su aplicación en el tratamiento del pie diabéticose basa en la hipótesis de que el uso demicrocorrientes en las úlceras neuroisquémicasde pacientes diabéticos produce una mejoríaclínica en las mismas, secundaria a unaumento en los niveles de VEGF y óxido nítrico(42-44). En este sentido, este dispositivosería la alternativa terapéutica en el manejo delas úlceras neuroisquémicas en los pacientesdiabéticos, pero es necesaria una evidenciacientífica del uso de microcorrientes en el piediabético para establecer conclusiones mássólidas en términos de eficacia, coste, contraindicacionesy posibles efectos adversos.
168 ■ PIE DIABÉTICOAPORTES NUTRICIONALESEl estado nutricional deficiente es un factorsistémico de primer orden en la cronicidadde una úlcera. El ítem «IP» del documentode consenso de la Conferencia Nacional deConsenso sobre las <strong>Úlceras</strong> de la ExtremidadInferior (CONUEI) recomienda que en personasmayores de 65 años con úlceras de unaevolución superior a los 60 días se realice unaevaluación de su estado nutricional (nivel deevidencia 3 y grado de recomendación D).Por otro lado en cada fase de la cicatrizacióninterviene algún tipo de factor alimentarioque es importante destacar. Por ejemplo, en lafase inflamatoria, las ratios básicas relacionadascon la nutrición están a nivel de la síntesisdel colágeno (donde interviene la albúmina)y de la angiogénesis (donde participa lavitamina C). A nivel de la formación de la dela matriz extracelular, intervienen el zinc, laarginina, la vitamina C y el calcio (45).El ácido-lipoico es el componente principalde un complemento alimenticio llamadoBalnimax®. Además, este complemento tambiénestá compuesto por arginina (aminoácidomuy estudiado en nutrición y heridas), unaserie de antioxidantes, metionina, vitamina E,selenio y algunas otras vitaminas, sobretododel complejo B, que también tienen una funcióncomo cofactores de enzimas y comoantioxidantes. La acción sinérgica de todos loscomponentes de Balnimax® aporta nutrientesespecíficos para la cicatrización de lasheridas crónicas (46).En el estudio multicéntrico realizado conBalnimax® en heridas crónicas de diferenteetiología, se observa que una de cada cuatrolesiones ha cicatrizado totalmente y más del50% de las lesiones tienen menos de 1 cm 2 desuperficie tras finalizar el seguimiento a las 8semanas. Por otro lado, en los casos estudiados,se comprobó una excelente evoluciónhacia la cicatrización concluyendo así que esun tratamiento efectivo que favorece la cicatrizaciónde las heridas crónicas. Finalmente,en pacientes con úlceras neuropáticas, se evidencióuna mejor granulación de los tejidos,reduciendo el tiempo de curación de las heridasy paliando los síntomas de la neuropatíadiabética. No obstante, son necesarias evidenciascientíficas más sólidas en cuanto a resultadosclínicos y económicos a largo plazo, asícomo posibles complicaciones, para podergeneralizar esta modalidad terapéutica (47).CONCLUSIÓNPese a los avances científicos, el tratamientodel pie diabético debe seguir considerándosemultidisciplinar en el que el ejecentral sea la prevención así como la valoracióny el tratamiento integral individualizadodel paciente. Los nuevos avances en estecampo deben suponernos un aumento delarsenal terapéutico que nos ayuden a combatirla infección y preservar la extremidad delpaciente; pero en ningún caso nos deben conducira abandonar las medidas generales delcuidado de los pacientes con pie diabético.Los resultados de estas nuevas terapias puedenresumirse, a modo de conclusión, en lossiguientes apartados:a) La TPN constituye una terapia coadyuvantealtamente eficaz, con evidencias científicasque aportan excelentes resultados encuanto a tasa de cicatrización, curación,baja tasa de amputación de la extremidady disminución de la estancia hospitalariacon el consiguiente ahorro económico.b) La oxigenoterapia hiperbárica pareceprometedora, pero se necesita más experienciaantes de su aplicación generalizaday estandarizada en el cuidado rutinario delpie diabético. Debemos de esperar a lapublicación de los resultados del primerestudio doble ciego, aleatorizado y controlado.c) La terapia celular (factores de crecimientoy células madre) supone unbeneficio con respecto a las terapias convencionalesen términos de tasa de curacióny cicatrización, siendo necesaria laaparición de otros estudios de eficacia yseguridad, con mayor calidad metodológi-
NUEVOS AVANCES EN EL TRATAMIENTO DEL PIE DIABÉTICO ■ 169ca, que permita la aplicación generalizada yde forma segura de esta terapia. Pese atodo a ello, las expectativas son altamenteesperanzadoras.d) La terapia con apósito modulador deproteasas (COR+C) es un tratamientoeficaz en los pacientes con pie diabético,con mejores resultados en términos detasas de cicatrización, regeneración tisular,estancia hospitalaria y costes económicosque la terapia convencional, avalado porestudios con evidencia científica.e) La estimulación eléctrica a bajo voltajees una terapia incipiente que aún requierede mayor experiencia y publicación deresultados clínicos y de seguridad.f) Los aportes nutricionales constituyenuna alternativa terapéutica con óptimosresultados preliminares, aunque es necesariauna mayor evidencia para poder generalizaresta modalidad terapéutica.BIBLIOGRAFÍA1. Marinel-lo J, Blanes JI, Escudero JR, Ibáñez V, Rodríguez J.Consenso de la Sociedad Española de Angiología y CirugíaVascular sobre Pie Diabético. Angiología 1997;49:193-230.2. Centers for Disease Control. Diabetes. A serious healthproblem. In A. Glance 2000. Atlanta: Centers for DiseaseControl and Prevention;2000.3. Brem H, Sheehan P, Boulton AJ. Protocol for treatment ofdiabetic foot ulcers. Am J Surg 2004;187:1S-10S.4. Hunter S, Langemo D, Hanson D, Anderson J, Thomson P.The use of negative pressure wound therapy. Adv SkinWound Care 2007;20:90-5.5. Zgonis T, Roukis TS. A systematic approach to diabetic footinfections. Adv Ther 2005;22:244-62.6. Kloth LC. 5 Questions-and answers-about negative pressurewound therapy. Adv Skin Wound Care 2002;15:226-9.7. Armstrong DG, Lavery LA. Negative pressure wound therapyafter partial diabetic foot amputation: a multicentre,randomised controlled trial. Lancet 2005;366:1704-10.8. Nather A, Chionh SB, Han AY, Chan PP, Nambiar A.Effectiveness of vacuum-assisted closure (VAC) therapy inthe healing of chronic diabetic foot ulcers. Ann Acad MedSingapore 2010;39:353-8.9. Andrew JM, Boulton AJ, Vileikyte L. Diabetic foot problemsand their management around the world. In: Bowker JH,Pfeifer MA, editors. Levin and O’Neals «The diabeticFoot». 6th ed. St. Luois: Mosby, Inc.; 2001. p. 261-71.10. Petrie N, Potter M, Banwell P. The management of lowerextremity wounds using topical negative pressure. Int JLow Extrem Wounds 2003;2:198-206.11. Apelqvist J, Armstrong DG, Lavery LA. Resource utilizationand economic costs of care based on a randomised trial ofvacuum-assisted closure therapy in the treatment of diabeticwounds. Am J Surg 2008;195:782-8.12. Braakenburg A, Obdejin MC, Feitz R, Rooij IAL, GriethuysenAJ. The clinical efficacy and cost effectiveness of thevacuum-assisted closure technique in the management ofacute and chronic wounds: a controlled trial. PlastReconstr Surg 2006;118:390-7.13. Eginton MT, Brown KR, Seabrook GR, Towne JB, CambriaRA. A prospective randomised evaluation of negative-pressurewound dressings for diabetic foot wounds. Ann VascSurg 2003;17:645-9.14. Weed T, Ratliff C, Drake DB. Quantifying bacterial bioburdenduring negative pressure wound therapy: does thewound VAC enhance bacterial clearance? Ann Plast Surg2004;52:276-80.15. Morykwas MJ, Argenta LC, Shelton-Brown EI, McGuirt W.Vacuum-assisted closure: a new method for wound controland treatment: animal studies and basic foundation. AnnPlast Surg 1997;38:553-62.16. Blume PA, Walters J, Payne W, Ayala J, Lantis J. Comparisonof negative pressure wound therapy using vacuum-assistedclosure with advanced moist wound therapy in the treatmentof diabetic foot ulcers: a multicenter randomizedcontrolled trial. Diabetes Care 2008;31:631–636.17. Landsman A. Analysis of the SNaP Wound Care System, anegative pressure wound device for treatment of diabeticlower extremity wounds. J Diabetes Sci Technol2010;4:825-30.18. Chadwick P. The use of negative pressure wound therapy inthe diabetic foot. Br J Nurs 2009;18:12-25.19. Armstrong DG, Lavery LA, Abu-Rumman P, Espensen EH,Vazquez JR, Nixon BP, et al. Outcomes of subatmosphericpressure dressing therapy on wounds of the diabetic foot.Ostomy Wound Manage 2002;48:64-8.20. Armstrong DG, Kunze K, Martin BR, Kimbriel HR, NixonBP, Boulton AJ. Plantar pressure changes using a novel negativepressure wound therapy technique. J Am Podiatr MedAssoc 2004;94:456-60.21. Ulusal AE, Sahin MS, Ulusal B, Cakmak G, Tuncay C. Negativepressure wound therapy in patients with diabetic foot. ActaOrthop Traumatol Turc 2011;45:254-60.22. Clare MP, Fitzgibbons TC, McMullen ST, Stice RC, Hayes DF,Henkel L. Experience with the vacuum assisted closurenegative pressure technique in the treatment of non-healingdiabetic and dysvascular wounds. Foot Ankle Int2002;23:896-901.23. Flack S, Apelqvist J, Keith M, Trueman P, Williams D. An economicevaluation of VAC therapy compared with wounddressings in the treatment of diabetic foot ulcers. J WoundCare. 2008;17:71-8.24. Whitehead SJ, Forest-Bendien VL, Richard JL, Halimi S, VanGH, Trueman P. Economic evaluation of Vacuum AssistedClosure® Therapy for the treatment of diabetic foot ulcersin France. Int Wound J 2011;8:22-32.25. Vuorisalo S, Venermo M, Lepäntalo M. Treatment of diabeticfoot ulcers. J Cardiovasc Surg (Torino) 2009;50:275-91.26. The Role of Negative Pressure Wound Therapy in theSpectrum of Wound Healing. A Guidelines Document.Ostomy Wound Management. 2010;56:1–18.
170 ■ PIE DIABÉTICO27. Lázaro JL, March JR, Torres de Castro OG, Segovia T,Guadalix G. Guía de tratamiento del Pie Diabético conTerapia de Presión Negativa. 2006.28. Löndahl M, Fagher K, Katzman P. What is the role of hyperbaricoxygen in the management of diabetic foot disease?Curr Diab Rep 2011;11:285-93.29. Tiaka EK, Papanas N, Manolakis AC, Maltezos E. The Role ofHyperbaric Oxygen in the Treatment of Diabetic FootUlcers. Angiology 2011;25 (In Press).30. O’Reilly D, Linden R, Fedorko L, Tarride JE, Jones WG,Bowen JM, Goeree R. A prospective, double-blind, randomized,controlled clinical trial comparing standardwound care with adjunctive hyperbaric oxygen therapy(HBOT) to standard wound care only for the treatmentof chronic, non-healing ulcers of the lower limb inpatients with diabetes mellitus: a study protocol. Trials2011;7:69.31. Buchberger B, Follmann M, Freyer D, Huppertz H, Ehm A,Wasem J. The importance of growth factors for the treatmentof chronic wounds in the case of diabetic foot ulcers.GMS Health Technol Assess 2010;6:12.32. Wu SC, Marston W, Armstrong DG. Wound care: the roleof advanced wound healing technologies. J Vasc Surg2010;52:59S-66S.33. Dubský M, Jirkovská A, Bém R, Pagácová L, Fejfarová V, VargaM, et al. Treatment of critical limb ischemia and diabeticfoot disease by the use of autologous stem cells. Vnitr Lek2011;57:451-5.34. Schulz GS, Mast BA. Molecular analysis of the enviroment ofhealing and chronic wounds: cytokines, proteases andgrowth factors. Wounds 1998;10:1-14.35. Ling X, McLennan SV, Lo L, Natfaji A, Bolton T, Liu Y, et al.Bacterial Load Predicts Healing Rate in NeuropathicDiabetic Foot Ulcers. Diabetes Care 2007;30:378-80.36. Loot MA, Kenter SB, Au FL, Van Galen WJ, Middelkoop E,Bos JD, et al. Fibroblasts derived from chronic diabeticulcers differ in their response to stimulation with EGF, IGF-I, bFGF and PDGF-AB compared to controls. Eur J Cell Biol2002;81:153-60.37. Ben<strong>net</strong> NT, Schultz GS. Growth factors and healing.Biochemical properties of growth factors and their receptors.Am J Surg 1993;165:728-37.38. Lázaro JL, García E, Beneit JV, Martínez de Jesús FR, AragónFJ. Estudio Aleatorizado y comparativo de un apósito decolágeno y celulosa oxigenada regenerada en el tratamientode úlceras neuropáticas de pie diabético. Cir Esp2007;82:27-31.39. Ghatnekar O, Willis M, Persson U. Cost-effectiveness ostreatring deep diabetic foot ulcers with Promogran in fourEuropean countries. J Wound Care 2002;11:70-4.40. Lázaro JL, Aragón FJ, García E, Beneit JV, González M. ARestrospective Análisis of the Cost-Effectiveness of aCollagen/Oxidized Regenerated Cellulose Dressing in theTreatment of Neuropathic Diabetic Foot Ulcers. OstWound Management 2010;56:4-8.41. Masaki I, Yonemitsu Y, Yamashita A, Sata S, Tanii M, Komori K,et al. Angiogenic gene therapy for experimental critical limbischemia: acceleration of limb loss by over expression ofvascular endothelial growth factor 165 but not of fibroblastgrowth factor-2. Circ Res 2002;90:966-73.42. Kloth LC. Electrical stimulation for wound healing: a reviewof evidence from in vitro studies, animal experiments, andclinical trials. Int J Low Extrem Wounds 2005;4:23-44.43. Goldman R, Rosen M, Brewley B, Golden M. Electrotherapypromotes healing and microcirculation of infrapoplitealischemic wounds: a prospective pilot study. Adv SkinWound Care 2004;17:284-94.44. Ferroni P, Roselli M, Guadagni F, Martini F, Mariotti S,Marchitelli E, et al. Biological effects of a software-controlledvoltage pulse generator (PhyBack PBK-2C) on therelease of vascular endothelial growth factor (VEGF). Invivo 2005;19:949-58.45. Marinel·lo J. Abordaje integral de la cicatrización de las heridascrónicas e importancia de la nutrición. En Nuevasestrategias para mejorar y acelerar la cicatrización:Balnimax®. ISBN: 978-84-7429-520-7. Barcelona, 2011.46. Verdú J. Evidencias científicas sobre la actividad del ácido -lipoico y presentación de nuevos estudios. En Nuevasestrategias para mejorar y acelerar la cicatrización:Balnimax®. ISBN: 978-84-7429-520-7. Barcelona, 2011.47. Padrós C. Acción de un complemento alimenticio a base deácido -lipoico en el tratamiento de las úlceras neuropáticas.En Nuevas estrategias para mejorar y acelerar la cicatrización:Balnimax®. ISBN: 978-84-7429-520-7. Barcelona, 2011.
Organización funcional de una Unidadde pie diabético. Posibilidades de integracióncon PodologíaROSA MARÍA MORENO CARRILES* Y ANA ESTHER LEVY BENASULI***Angiología y Cirugía Vascular. Hospital Universitario La Princesa. Madrid. España**Podología. Universidad Europea de Madrid. EspañaDEFINICIÓNLa Sociedad Española de Angiología yCirugía Vascular (SEACV) define el pie diabético(1) como una «entidad clínica de baseetiopatogénica neuropática inducida por lahiperglucemia mantenida, en la que, con o sincoexistencia de isquemia y previo desencadenantetraumático, se produce lesión y/oulceración del pie».ESCENARIO GLOBALSe estima por el International WorkingGroup on the Diabetic Foot que existen unos250 millones de personas con diabetes a nivelmundial (2), afectando a un 6% de la poblaciónadulta con un rango de edad ente 20 y 79años. Se calcula así mimo que en 2025 estenúmero puede alcanzar a 380 millones y queimplicaría una prevalencia del 7.1% en adultos,también en España (3).La diabetes se asocia con varios tipos decomplicaciones a corto y largo plazo que si nose tratan pueden ser fatales. Todas tienen elpotencial de reducir la calidad de vida tanto delos propios pacientes como de sus familiares.Las complicaciones a largo plazo se establecenfundamentalmente en base a una etiologíametabólica, micro y macrovascular. Entre ellasse incluyen las de afectación cerebro vascular,cardiovascular, enfermad arterial periférica(EAP), incluida la renal, retinopatía y neuropatía.Las alteraciones del pie son una fuente demorbilidad y la causa mas frecuente de hospitalizaciónen pacientes con Diabetes. La ulceración,la infección, gangrena y amputaciónson complicaciones significativas de la enfermedady su coste ha sido estimado en billonesanuales en los Estados Unidos (4, 5). El piede Charcot también constituye una causa deamenaza de pérdida de la extremidad.La existencia de una ulcera, es el precursormas frecuente de la amputación y sedeben realizar actuaciones preventivas de lamisma. Cuyo efecto al poner en prácticaprotocolos de actuación diminuyen drásticamentesu incidencia y morbilidad asociada,tal y como nos demuestra la evidenciacientífica.También es sabido que la diabetes esla causa más frecuente de amputaciónno traumática de la extremidad inferioren Europa y USA.La estancia media hospitalaria de lospacientes diabéticos con ulcera es un59% mas larga que la de los pacientes que nola padecen (6).La tasa de amputaciones oscila entre el 2,5y 6/1000 pacientes/año y el riesgo para losdiabéticos es de 8 a 15 veces mayor frente alos no diabéticos (7).Se ha calculado que al menos un 15% delos diabéticos padecerá a lo largo de su vidaalguna úlcera y alrededor del 85% de lospacientes que sufren amputaciones las hanpadecido previamente (2).
172 ■ PIE DIABÉTICOTras la amputación de una extremidadinferior, la incidencia de una nueva úlcera o deamputación contralateral a los dos y cincoaños es del 50% y la supervivencia de estospacientes es significativamente menor que ladel resto de la población (8). Finalmente seestima que cada año, 3.8 millones de adultosmueren por causa de la diabetes.RIESGOS ESPECÍFICOSEN LA POBLACIÓN DIABÉTICARiesgo de ulceraciónLa ulcera se produce en relación a variosfactores de riesgo identificados en múltiplesestudios (9-11). Entre ellos se encentra laexistencia de neuropatía, EAP, limitación de lamovilidad articular, deformidades osteo-articulares,aumento de la presión plantar sobreuna prominencia ósea, traumatismos menores,disminución de la agudeza visual e historiaprevia de ulceración o amputación.Las alteraciones biomecánicas en ausenciade sensibilidad, propician la aparición de dañocutáneo en forma de ampolla y posteriormentehiperqueratosis.La EAP raramente condiciona la ulcera inicialmentepero es responsable del retraso enla cicatrización y eleva consiguientemente elriesgo de amputación (12-14), impidiendo unaadecuada oxigenación y difusión del antibiótico.Riesgo de infecciónLas infecciones son mas comunes y gravesen diabéticos que en no diabéticos. Tienen unriesgo mas elevado de padecer osteomielitissuperior (15). Las infecciones que padecensuelen se polimicrobianas (16-18). La diabetesno controlada genera una disminución de larespuesta leucocitaria.Riesgo de artropatíaEl 1% de los diabéticos desarrolla artropatíade Charcot (18-19). Está condicionada porla existencia de deformidades, neuropatía sensitivay traumatismos menores.Riesgo de amputaciónSu incidencia se ha estimado entre un 2 yun 16% (19-23). Es entre 15 y 40 veces másfrecuente en diabéticos que en no diabéticos(24-27).Cundo se diagnostica diabetes la EAPsuele estar presente en un 8% e los pacientes,sin embargo al cabo de 20 años de evoluciónesta frecuencia alcanza un 45% (28, 29).Los factores de riesgo de la amputaciónson: la neuropatía, EAP, infección, historia previade ulcera, los traumatismos, la existenciade Pie de Charcot, las alteraciones oculares, elmal control de la glucemia, la edad avanzada yel sexo masculino.Interés de la constitución de unaUnidad de Pie DiabéticoLa magnitud del problema esta ampliamentedocumentada en la literatura nivelmundial e igualmente se ha determinado queel mejor cuidado de estos pacientes ha dehacerse desde una perspectiva multidisciplinar.En algunos centros se ha planteado comoprioridad, estandarizar el proceso de diagnósticoy tratamiento del pie diabético de formaconjunta por todos los elementos implicados.El objetivo de éste planteamiento ha deperseguirse con la intención de obtener losmejores resultados en cuanto a la tasa deamputación en este grupo poblacional, y optimizarlos recursos existentes en los Centros,todo lo cual implica un cuidado de la máximacalidad que conlleva evitar un número excesivode ingresos a través de urgencias y suprimirla estancias hospitalarias innecesarias.La consecución de éstos objetivos ha demantenerse a base de realizar las medidas quese proponen desde las guías clínicas de difusióninternacional y un acuerdo previo entretodos los profesionales que participan en lasatenciones que han de dispensarse a lospacientes que padecen la entidad clínica reconocidacomo pie diabético.
ORGANIZACIÓN FUNCIONAL DE UNA UNIDAD DE PIE DIABÉTICO… ■ 173ENTIDADES CLÍNICAS<strong>Úlceras</strong>En ellas deben evaluase todos los factoresque influyen en su curación. La existencia deisquemia, infección de partes blandas, osteomielitisy neuropatía.La evaluación vascular constará del examende los pulsos, relleno venoso, existenciade palidez con la elevación y rubor en ladependencia. Si no existen pulsos deben realizarseevaluaciones hemodinámica: doppler,presiones segmetarias, registro e volumen depulso segmentario (PVR), Indice Dedo brazoy presión capilar de oxigeno (PcO2), naturalmentebajo la supervisión de un CirujanoVascular (30).También son de ayuda las pruebas de imagencomo Resonancia Magnética o CT.Deben registrarse las característicasmorfológicas de la ulcera, su posible etiología(química o mecánica), el carácter de lalesión: neurológica, isquémica o neuro isquémica(31). Así mismo la talla, profundidad,estado de los márgenes, base y localizacióngeográfica.Tiene especial interés la exploración ósea,si este se puede tocar es indicativo de osteomielitis.Las características del olor y del exudadotambién pueden predecir el posibleagente causal de la infección, que se confirmaramediante la toma de cultivo.Clasificación de las úlcerasLas clasificaciones que ocasionalmenteson engorrosas y difíciles de recordar proporcionanla vía adecuada para propiciar lacomunicación científica y por ello, facilitar elanálisis de los resultados de las diferentemedidas terapéuticas.De especial utilidad es la categorizaciónde las ulceras, éstas deben estratificarse básicamente,según su etiología, en neuropáticasisquémicas o mixtas.La clasificación internacionalmente másaceptada, por su sencillez, es la de Wagner(32). En ella no se clasifica si existe infección,isquemia, neuropatía u otras características, locual supone importantes limitaciones:Grado0 No abierta, deformidad o celulitis.1 Úlcera superficial.2 Úlcera profunda, afecta tendón, ligamento,fascia profunda o capsula articular.3 Úlcera profunda con absceo, osteomielitis osepsis articular.4 Gangrena local en antepe o talón.5 Gangrena de todo el pie.Tabla I. Clasificación de Wagner.Para describir ciertas consideraciones seha creado la Clasificación de la Universidad deTexas San Antonio (UTSA) que asocia profundidadcon isquemia o infección (33).GradoEstadio 0 I II IIIA Lesión pre o post Superficial no afecta Tendón o capsula huesoulcera catrizada tendón cápsula articularo huesoB Infectada Infectada Infectada InfectadaC Isquémica Isquémica Isquémica IsquémicaD Infectada e isquémica Infectada e isquémica Infectada e isquémica Infectada e isquémicaTabla II. Clasificación de la Universidad de Texas San Antonio (UTSA).
174 ■ PIE DIABÉTICOOtra de las Clasificaciones disponibles esla denominada PEDIS desarrollada por elInternational Working Group on the Diabetic Foot,en la que se evalúa perfusión, extensión, profundidad,infección y sensibilidad. P (perfusion),E (extent/size), D (depth of tissue loss),I (infection) and S (sensation). Hay niveles del1 al 4 para cada uno de estos factores.El DEPA Scoring System, publicado en2004 define la profundidad D (depth of theulcer), extensión de la colonización E (extentof bacterial colonization), fase de la ulcera P(phase of ulcer) y Etiología asociada A (associatedetiology). Según el nivel de intensidadde cada característica se puntúan de 1 a 3. Lapuntuación total clasifica la ulcera e implicadiferentes medidas terapéuticas e inclusive seaproxima a una impresión pronostica.DescargaLa reducción de la presión en el pie diabéticoes esencial en el tratamiento (34-38).La descarga evita el traumatismo y promuevela curación, especialmente cuando laausencia de sensibilidad no interpone medidaprotectora alguna. Las medidas de descargavarian desde un simple fieltro hasta undispositivo Walker. Los pacientes deben llevarlohasta conseguir la curación completa(39-42).Infecciones en el pie diabéticoLa infección es una causa de hospitalizaciónen pacientes con diabetes mellitus y tambiénun factor causal de amputación (43-45).Básicamente el tipo de infección que requierehospitalización son las que provocan amenazade pérdida de extremidad (46-47). Todas lasque cursan con afectación en extensiónmenor de 2 cm, y ausencia de síntomas generalesdeben manejarse de manera ambulatoriaprevia toma de cultivo.Las que provocan amenaza, tras hospitalización,deben ser sometidas a desbridamientoamplio incidiendo los compartimentos del piey realizando amputación abierta si se requiere(48, 49).Pie de Charcot. OsteoartropatíaneuropáticaEs una alteración progresiva caracterizadapor la luxación articular, fracturas patológicasy destrucción severa de la arquitectura delpie. Puede condicionar importantes deformidadese inclusive generar la necesidad deamputación mayor.En esta entidad suelen existir pulsos palpables,con signos de neuropatía autonómicay motora, ausencia de reflejos, luxación articular,deformidad y comúnmente celulitis.COMPONENTES DE LAS UNIDADESDE PIE DIABÉTICOA lo largo del tiempo y en diferentes localizacionesgeográficas se han constituido gruposmultidisciplinares, cuya composición envirtud de las condiciones de cada Centro uOrganización, son algo variables, pero existenuna serie de elementos fijos en la constituciónde éstos grupos.Desde el punto de vista médico es elementoconstitucional imprescindible laEndocrinología y la Angiología y CirugíaVascular. Sobre estos básicos, se añade la participaciónde Enfermería, deseablementeespecializada, para realizar la atención y curaslocales de lo pacientes, así como el papeldesarrollado por este estamento de Edu -cador/a en Diabetes.Sobre ese grupo pueden superponerse lasactuaciones de Traumatología, Cirugía Gene -ral, Cirugía Plástica, Medicina Interna, especialmentecuando se dispone de equipos especialmentededicados a Patología Infecciosa,Nefrología, Rehabilitación y Dermatología ypor último y menos comúnmente la par -ticipación de otros profesionales sanitarios,los Podólogos. La dificultad para integrara estos profesionales radica básicamente, ensu ausencia a nivel de los Centros Públicos.De hecho en nuestro país su participación secircunscribe a muy pocos Centros.La realización de convenios o consorcioscon estos profesionales son posibles en base
ORGANIZACIÓN FUNCIONAL DE UNA UNIDAD DE PIE DIABÉTICO… ■ 175a acuerdos de colaboración que contemplenactividades docentes para Podología y en contrapartidaasistencia a los pacientes que suponenun grupo de población que constituyebase de sus estudios y su práctica clínica.Deben confeccionarse por tanto criteriosprecisos de colaboración conjunta especialmenteentre Endocinología, Enfermería,Cirugía Vascular y Podología.Definición de funcionesEs imprescindible ante la perspectiva deorganización de una Unidad de Pie Diabético,establecer unas funciones definidas para cadauno de los elemento participantes.EndocrinologíaDeben realizar un control exhaustivo de ladiabetes, realizando una historia global, quecomprenda la duración de la diabetes, el controlglucémico, la valoración del estado nutricional,los hábitos sociales, la medicaciónhabitual, posibles alergias, historia de hospitalizacióny/o cirugía previa y evaluación vascularelemental.A nivel general deberán también catalogarla actividad diaria, la existencia de hiperqueratosis, deformidades estructurales, y síntomasde neuropatía.Con este propósito realizaran elNeuropathy Disability Score, el NeuropathySymtoms Score y el Menphis NeuropathyInstrument Store.El propio endocrinólogo también realizaráuna inspección de la ulceración, o de los signosde Pie de Charcot, antes de derivarlo alCirujano Vascular o Traumatólogo y PodólogoRealizará también estudios complementariostales como Hemograma, bioquímica,Glico hemoglobina, PCR, cultivo local, hemocultivosi procede y análisis de orina.También cuando sean precisas se realizaranpruebas radiológicas desde la simpleradiografía simple capaz de mostrar la existenciade osteomielitis, fracturas luxaciones,calcificaciones, gas, artritis o alteraciones biomecánicas.La utilización de pruebas de medicinanuclear con Tecnecio (Tc 99) o Indio (I-111) son de utilidad para la detección y seguimientode la infección.Angiología y Cirugía VascularDeben confirmar de manea objetiva laexistencia de Enfermedad Arterial Periféricaasociada y estratificarla, en aras a realizar eltratamiento complementario mas adecuado.Realizarán el Diagnóstico Vascular NoInvasivo, mediante los estudios previamentemencionados. Realizarán revisiones periódicas.Pautarán tratamiento farmacológicoespecifico. Iniciarán el tratamiento quirúrgicoo endovascular cuando se precise esencialmenteen los casos de Isquemia Crítica, conamenaza de pérdida de la extremidad porIsquemia Grado III y IV o por infección tambiénamenazante.Realizarán los procedimientos de revascularización,pertinente o los ablativos en casode pie diabético complicado.Establecerá los criterios de actuaciónurgente o electiva. En virtud de la situación concretade cada Centro pondrá en práctica loscriterios de hospitalización cuando esta proceday conjuntamente, previa actuación protocolariacon Endocrinología realizará la pare delPROCESO asignada realizando el ingreso delpaciente en el área convenida por cada Centroaunque la atención se dispense de forma continuadapor las dos especialidades.Con respecto al manejo de las <strong>Úlceras</strong> y dela Infección tendrá un papel protagonista en elestablecimiento de la indicación de desbridamiento,tratamiento local mediante apósitos yotro tipo de medios como la terapia por vacío,entre otros. Realizarán evaluación de las ulcerasy trabajará conjuntamente con la Enfermeríaselectivamente entrenada y con Podología.Educadoras de EnfermeríaEjecutarán un plan de prevención yEducación del paciente de Riesgo. Implicarán alos pacientes en programas de autosuficienciavisual y motriz así como mentalizarlos para la
176 ■ PIE DIABÉTICOautoexploración diaria. Advertir de productosprohibidos, formación para la realización dehábitos higiénicos y ayuda para la selección decalzado adecuado.Esta educación debe impartirse, de formaindividual o en pequeños grupos prioritariamentea los pacientes con polineuropatía obien a los mayores de 65 años a efecto de realizarprevención primaria.A nivel de enfermería también se realizarála exploración estructural del pie y antehallazgos compatibles con pie de riesgo sederivará a Podología o Cirugía Vascular.Aportación de la Podologíaa un abordaje integral del pie diabéticoLa aportación de estos profesionales significaun complemento ideal a todo el espectrode cuidados impartidos a los pacientes conPie Diabético, la utilización de técnicas paraconseguir la descarga de áreas de presión,previamente estudiadas y la atención dispensadaa las ulceras en diferentes estadios evolutivoses un complemento de gran interésque no existe comúnmente en los CentrosPúblicos de nuestro País.Manejo de las alteraciones biomecánicasLas alteraciones morfo funcionales del pietienen un papel relevante tanto en la prevenciónde la ulceración como en la influencia de la cicatrización,una vez que la lesión ya está presente.Las alteraciones biomecánicas generanmovimientos compensatorios que se traducenen fuerzas lesivas para los tejidos. Estasfuerzas tienen componentes de compresión,tracción y cizallamiento y son las responsablesdel aumento de la presión y el roce. Nosolo a nivel de la piel, sino en estructuras másprofundas como la fascia plantar, tendones,bursas, capsula articular y hueso.Estos factores generan la aparición defocos que pueden constituir una puerta deentrada a la infección tanto a nivel superficial,como profundo. El aumento de la presiónplantar es un indicador de alteración biomecánicadel pie no necesariamente asociado adeformidades severas.Las lesiones superficiales más significativasrelacionadas con las complicaciones del piediabético son: rozaduras, alteraciones de laplaca ungueal, callosidades y hematomas subqueratósicos.Básicamente se relacionan conlas deformidades digitales y de las articulacionesmetatarso-falángicas, así como con la desviaciónde los ejes de la articulación subastragalinay la limitación de la movilidad del tobillo,agentes cruciales en la génesis de fuerzaspatológicas.Los movimientos compensatorios de alteracionesfuncionales son en gran medida losresponsables de micro y macro-roturas fasciales,capsulitis, sinovitis, bursitis y atrapamientosde las ramas nerviosas del pie. Su clínica puedeconfundirse con la neuropatía diabética.El estrés repetido sobre las estructuras articularesen pacientes con neuropatía severa esuna de las causas fundamentales de la Artropatíade Charcot, (entidad infra diagnosticada), quepor falta de criterios diagnósticos precoces,evoluciona hasta los estadios de colapso de lascolumnas medial y lateral del pie.Las deformidades pueden objetivarse conuna simple inspección del pie. Su ausencia nodescarta la presencia de fuerzas lesivas que puedengenerar lesión, y detener la cicatrización encaso de que la ulceración ya esté presente.Las alteraciones dinámicas, relacionadascon movilidad anómala y desaxación requierenun examen podológico más exhaustivo.Éste ira encaminado a la determinación delpatrón mecánico. La inspección, la exploraciónfuncional articular y la monitorización de lospatrones mecánicos (podobarometría dinámicay análisis cualitativo de la marcha) permitenla detección de incrementos de presión yfuerzas lesivas que favorecen las complicacionesdel pie diabético y que pueden ser prevenidascon la instauración de tratamientos ortésicosdiseñados a medida.Las ortesis son dispositivos que se em pleanpara disminuir la presión, las fuerzas tangencialesy las fuerzas de torsión generadas por las alteracionesbiomecánicas del pie. Su eficacia dependede una valoración biomecánica exhaustivaque posibilite la elaboración de dispositivos amedida de las necesidades de cada paciente.
ORGANIZACIÓN FUNCIONAL DE UNA UNIDAD DE PIE DIABÉTICO… ■ 177Diversos estudios concluyen en que laspresiones plantares dinámicas se elevan enlos pies diabéticos neuropáticos y neuro-isquémicosfavoreciendo la aparición de lesionesulcerosas en los puntos más solicitadosmecánicamente como consecuencia de alteracionesestructurales y/o funcionales del pie.Todo paciente con riesgo neuropáticoy/o vascular debiera ser valoradobiomecánicamente para establecerel riesgo de sufrir lesión en el pie.En primer término cualquier profesionalpuede realizar el cribaje básicopara posteriormente remitir al serviciode podología a aquellos pacientesque requieran una exploración másespecífica encaminada a determinarel plan de cuidados podológicos.La exploración básica que se demuestraeficaz para la detección dealteraciones podológicas por personalno adiestrado en la patología delpie, es la que se denomina «Exploraciónpodológica de los 2 minutos»(figura 1), en la que mediante unsencillo cuestionario quedan recogidoslos aspectos básicos de la patología morfo-funcionaldel pie.Tras la realización de esta exploración básicay en función de la presencia de alteraciónmecánica conjugada con el riesgo riesgo neuro-isquémicose propone el plan de cuidadosmás apropiado a cada nivel (figuras 2 y 3).Figura 2. Riesgo Biomecánico.Figura 1. Screening de Riesgo.Manejo de la HiperqueratosisLa formación de hiperqueatosises un marcador fiable de riesgode ulceración en pacientescon neuropatía severa y/o patologíaisquémica, y siempre indicaalteración biomecánica de base.Las zonas de hiperqueratosissurgen en el pie como respuestaa la presión sostenida, bien porun calzado inadecuado o bienpor alteraciones estáticas o dinámicasque sobrecargan las estructurassubyacentes a la lesióndérmica.Su presencia, puede aumentarhasta 10 veces la presión del áreaen la que ésta se encuentra, porello es fundamental la exéresisperiódica de estas lesiones paraevitar la ulceración y descargar
178 ■ PIE DIABÉTICOFigura 3. Tratamiento Ortopodologico Profiláctico.de presión la zona mediante ortesis plantares,ortesis digitales y calzado adecuado.Existe la creencia de que una correctahidratación del pie disminuye la aparición deeste tipo de lesiones, pero esta premisa escompletamente falsa. Mantener un óptimoestado de hidratación es adecuado para evitarlesiones por descamación en pies con muchaxerosis y mantener la piel con una elasticidadadecuada que la proteja de los traumatismosque sobrevienen del uso de calzado, pero enningún caso la hidratación es un cuidado suficientepara evitar la aparición de la callosidady evitar que esta genere lesiones más severas.Sólo la descarga y el cuidado podológicoperiódico (quiropodia) evitan los riesgos quede ella se derivan.Los pacientes con autosuficiencia visual ymotriz deben capacitarse para desarrollarhábitos podológicos saludables, vigilar el estadode sus pies, y reconocer las lesiones porlas que deben acudir al especialista. Lospacientes que carecen de autosuficiencia yapoyo familiar debieran tener cubiertas estaspremisas por el sistema público de salud.Los profesionales de la salud implicadosen el cuidado del paciente diabético debentransmitir con claridad los hábitos adecuadosy sobre todo incidir en los aspectos más relevantespara la prevención de la lesión y lainfección.Decálogo de cuidados del pieEnte otras labores, el Podólogo es elencargado de transmitir a los pacientes unaserie de consejos que resultan de especialinterés.Lavar a diario los pies con agua templaday jabón suave, siempre con agua a chorro (esimportante evitar el «remojado prolongadoen agua estancada» puesto que elagua de lavado es un vehículo de infecciónen presencia de grietas, fisuras ypequeñas heridas).Secar cuidadosamente, prestando especialinterés en los espacios interdigitales y elsurco plantar digital ya que son zonas deasiento predilecto para dermatofitos y cándidasagentes responsables de erosiones y fisurasdérmicas.Hidratar a diario con cremas específicas.Hacerlo siempre de noche antes de ir a lacama (ya que calzarse después de aplicarcrema humedece en exceso favorecien-
ORGANIZACIÓN FUNCIONAL DE UNA UNIDAD DE PIE DIABÉTICO… ■ 179do la maceración y el asiento de bacterias).Evitar la hidratación en la zonainterdigital y el surco plantar digital yaque en estos espacios se acumula exceso deproducto favoreciendo la maceración cutáneay la aparición de lesiones e infección.No manipular durezas y callosidadesy bajo ningún concepto aplicar parches oungüentos callicidas ya que pueden provocarquemaduras severas. Acudir al podólogo. (Loscentros de día de los ayuntamientos, en todaslas comunidades autónomas, disponen de unplan de cuidados podológicos a bajo preciodestinado a los mayores).Emplear calzado transpirable a ser posiblede piel suave, con suela gruesa ni muy rígida nimuy flexible, con una horma que no comprimael pie y preferentemente ajustable porcordones.En caso de que aparezca una herida o fisuraen el pie, aplicar antisépticos como la clorhexidinay/o la povidona yodada diluida ensuero y cubrir con gasa. Si la lesión nomejora en una semana o presenta irritacióno exudado acudir al centro desalud.Sólo para pacientes con autosuficienciamotriz y visual o con ayuda familiar:Cortar las uñas rectas, dejando unos milímetrosde placa y redondear los bordes (conlima de cartón) para evitar lesiones en losdedos. En caso de engrosamiento disminuir elespesor de la placa mediante limado.No utilizar tijeras, ni objetos puntiagudosde corte que puedan provocar lesiones.En caso de que la uña se clave (onicocriptosis),no manipular bajo ningún concepto yacudir al podólogo. El riesgo infección en lazona es muy elevado y las lesiones por manipulacióninadecuada originan complicacionesmuy severas.Manejo de la ulceración diabéticaEl manejo adecuado de la ulceraciónrequiere el control de los factores clave quecondicionan la evolución de la lesión y lamonitorización sistemática de la herida nosconduce a la valoración objetiva de la evoluciónclínica y la adaptación correcta del plande cuidados. La monitorización de la heridadebe realizarse mediante documentación gráficay valoración sistemática de los parámetroslocales y generales: (figura 4).Figura 4. Manejo básico de la ulceración.
180 ■ PIE DIABÉTICOLa presión sostenida en unaulcera puede inhibir la cicatrizacióne incluso es la responsable delaumento de tamaño de las lesiones.La descarga mediante dispositivosespecíficos tales como el padding oalmohadillado, calzado de fomentode cicatrización, ortesis específicas yayudas de marcha, han de constituirun estándar en la práctica clínicahabitual.La infección imposibilita la cicatrizacióny puede originar graves complicacionese incluso la muerte. Sólo apartir del control de la carga bacterianacomienzan a cobrar eficacia laamplia gama de productos de fomentode cicatrización encaminados amantener el lecho ulceroso en condicionesadecuadas para conseguir lagranulación y la epitelización.El grado de isquemia del pacientecondicionará la posibilidad de cicatrizacióny el manejo de la lesión como«viable» o «no viable». En ausencia depulsos o con índices de isquemia severa, elpaciente requiere revascularización para posibilitarla cicatrización, en caso de no ser candidatoa cirugía el objetivo principal será delimitarla lesión y prevenir la infección.Un control glucémico inadecuado dificultaráo paralizará la cicatrización y aumentaráel riesgo de infección.El tipo y cantidad de exudado, la presenciade olor y los cambios eritemato-edematososdel borde de la herida nos orientan hacia evoluciónpositiva o negativa de la carga bacteriana.La presencia de esfacelos e hiperqueratosisdebe controlarse mediante el desbridamientoperiódico con bisturí, de esta maneramantenemos el lecho ulceroso libre de contaminantesque inhiben la granulación yfomentan el riesgo de infección.La valoración «PIC» (Control de Presión,Infección y Circulación) hace alusión a losfactores que van a determinar la viabilidad dela cicatrización en primer término y nos permiteestablecer un árbol de decisiones para elmanejo clínico del paciente. (figura 5).Figura 5. Tratamiento de Descarga Provisional.SUMARIOLa prevalencia de la diabetes y los múltiplesriesgos que conlleva, en especial los relativosa la producción de complicaciones en elpie, conllevan una elevada morbimortalidad,incluida una tasa de amputación muy superiora la que ocurre en población no diabética yunos costes crecientes dado el incremento dela población que la padece.La creación de equipos pluridisciplinares,capaces de establecer medidas preventivas yterapéuticas precoces, ha de establecerse enlos diferentes Centros contando con la colaboraciónimprescindible de Endocrinólogosy Cirujanos Vasculares, sin embargo laampliación de éste núcleo se enriquece demanera ostensible y ampliamente demostradacon el trabajo conjunto de otrosEspecialistas Médicos, Enfermería especializaday sin duda con la dedicación dePodólogos en la consecución de los objetivosdictados en la actualidad por la evidenciade la literatura.
ORGANIZACIÓN FUNCIONAL DE UNA UNIDAD DE PIE DIABÉTICO… ■ 181BIBLIOGRAFÍA1. Marinel-lo J, Blanes JI, Escudero JR, et al. Consenso de laSEACV sobre pie diabético.Angiología 1997; 5: 193-230.2. Internacional Working Group on the Diabetic Foot.International Consensus on the3. Diabetic Foot. TheNederlands, 1999.3. Martín P, Díaz A, Durán A, García de la Torre N, Benedí, ACalvo I, Serrano FJ, Moñux G, Charro A y Calle-Pascual PPie diabético Endocrinol Nutr. 2006;53(1):60-7. 4.4. Centers for Disease Control and Prevention. Data andTrends:National Diabetes Surveillance System, Vol. 2006,National Center for Chronic Disease Prevention andHealth Promotion,Atlanta, 2005.5. Reiber GE, Boyko EJ, Smith DG. Lower extremity footulcers and amputations in diabetes. In: Diabetes in America,2nd ed,pp 409-427 , edited by MI Harris, C Cowie, and MPStern, NIH Publication 1995; No. 95-1468.6. Centers for Disease Control and Prevention. Diabetes: aserious health problem. At-a-Glance 2000, Center forDisease Control and Prevention, 2000.7. Pavicic T, Korting HC. Xerosis and callus formation as a keyto the diabetic foot syndrome: Dermatologic view of theproblem and its management. JDDG 2006; 4: 935-941.8. Reiber GE, Boyko EJ, Smith DG. Lower extremity footulcers and amputations in diabetes. En: Harris MI, Cowie C,Stern MP (Eds.) Diabetes in America, 2nd ed. (NIH publ. no.95-1468). U.S. Government Printing Office, WashingtonDC, 1995.9. Singh N, Armstrong DG, Lipsky BA. Preventing foot ulcersin patients with diabetes. JAMA 2005; 293:217-22810. Boulton AJ, Kirsner RS, Vileikyte L. Clinical practice.Neuropathic diabetic foot ulcers. N Engl J Med 2004;351:48-55.11. Boulton AJ. The diabetic foot: from art to science. The 18thCamillo Golgi lecture. Diabetologia, 2004.12. Pecoraro RE, Reiber GE, Burgess EM. Pathways to diabeticlimb amputation: basis for prevention. Diabetes Care1990;13:513-521.13. Pecoraro RE. Chronology and determinants of tissue repairin diabetic lower extremity ulcers. Diabetes 1991; 40:1305-1313.14. Gibbons GW. Lower extremity bypass in patients with diabeticfoot ulcers. Surg Clin North Am 2003; 83:659-669.15. Shah BR, Hux JE. Quantifying the risk of infectious diseasesfor people with diabetes. Diabetes Care 2003; 26:510-513.16. American Diabetes Association. Consensus DevelopmentConference on Diabetic Foot Wound Care. Diabetes Care1999; 22:1354.17. Caputo GM, Joshi N, Weitekamp MR. Foot infections inpatients with diabetes. Am Fam Physician 1997;56:195-202.18. Goldstein EJ, Citron DM, Nesbit CA. Diabetic foot infections.Bacteriology and activity of 10 oral antimicrobialagents against bacteria isolated from consecutive cases.Diabetes Care 1996; 19:638-641, 1996.19. Sinha S, Munichoodapa CS, Kozak GP. Neuroarthropathy(Charcot joints) in diabetes mellitus. Medicine 1972;51:191-210.20. Sanders LJ, Frykberg RG. Diabetic neuropathic osteoarthropathy:The Charcot foot. In: The High Risk Foot inDiabetes Mellitus, pp 325-333, edited by RG Frykberg,Churchill Livingstone, New York, 1991.21. Ramsey SD, Newton K, Blough D, McCulloch DK, SandhuN, Reiber GE, Wagner EH. Incidence, outcomes, and cost offoot ulcers in patients with diabetes. Diabetes Care 1999;22:382-387.22. Lavery LA, Armstrong DG, Wunderlich RP, Tredwell J,Boulton AJ. Diabetic foot syndrome: evaluating the prevalenceand incidence of foot pathology in MexicanAmericans and non-Hispanic whites from a diabetes diseasemanagement cohort. Diabetes Care 2003; 26:1435-1438.23. Moss SE, Klein R, Klein BE. The prevalence and incidence oflower extremity amputation in a diabetic population. ArchIntern Med 1992; 152:610-616.24. Resnick HE, Carter EA, Sosenko JM, Henly SJ, Fabsitz RR,Ness FK, Welty TK, Lee ET, Howard BV. Incidence of lowerextremityamputation in American Indians: the StrongHeart Study. Diabetes Care 2004; 27:1885-1891.25. American Diabetes Association. Diabetes 1996 VitalStatistics, American Diabetes Association, Alexandria, VA,1996.26. Reiber GE, Boyko EJ, Smith DG. Lower extremity footulcers and amputations in diabetes. In: Diabetes in America,2nd ed, pp 409-427 , edited by MI Harris, C Cowie, and MPStern, NIH Publication 1995; No. 95-1468.27. Lavery LA, Ashry HR, van Houtum W, Pugh JA, Harkless LB,Basu S. Variation in the incidence and proportion of diabetesrelatedamputations in minorities. Diabetes Care 1996;19:48-52.28. Resnick HE, Valsania P, Phillips CL. Diabetes mellitus andnontraumatic lower extremity amputation in black andwhite Americans: the National Health and NutritionExamination Survey Epidemiologic Follow-up Study, 1971-1992. Arch Intern Med 1999; 159:2470-2475.29. Melton LJ, Macken KM, Palumbo PJ, Elveback LR. Incidenceand prevalence of clinical peripheral vascular disease in apopulationbased cohort of diabetic patients. Diabetes Care1980;3:650-654.30. Pirart J. Diabetes mellitus and its degenerative complications:a prospective study of 4,400 patients observed between1947 and 1973. Diabetes Care 1978; 1:168.31. Lee HM, Wang Y, Sostman HD, Schwartz LH, Khilnani NM,Trost DW, Ramirez de Arellano E, Teeger S, Bush HL. Distallower extremity arteries: evaluation with two-dimensionalMR digital subtraction angiography. Radiology 1998;207:505-512.32. International Working Group on the Diabetic Foot.International Consensus on the Diabetic Foot, edited by JApelqvist, K Bakker, WH Van Houtum, MH Nabuurs-Franssen, and NC Schaper. Vol. 2005. International WorkingGroup on the Diabetic Foot, Maatricht, 1999.33. Wagner FW. The dysvascular foot: a system for diagnosisand treatment. Foot and Ankle 1981; 2:64-122.34. Lavery LA, Armstrong DG, Harkless LB. Classification ofDiabetic Foot Wounds. J Foot Ankle Surg 1996; 35:528-531.
182 ■ PIE DIABÉTICO35. Frykberg RG, Lavery LA, Pham H, Harvey C, Harkless L,Veves A. Role of neuropathy and high foot pressures in diabeticfoot ulceration. Diabetes Care 1998; 21:1714-1719.36. Boulton AJ. Pressure and the diabetic foot: clinical scienceand offloading techniques. Am J Surg 2004; 187:17S-24S.37. Lavery LA, Armstrong DG, Wunderlich RP, Tredwell J,Boulton AJ.Predictive value of foot pressure assessment aspart of a populationbased diabetes disease managementprogram. Diabetes Care 2003; 26:1069- 1073.38. Rathur HM, Boulton AJ. Pathogenesis of foot ulcers and theneed for offloading. Horm Metab Res 37(Suppl 1):61-68,2005. Armstrong DG, Nguyen HC, Lavery LA, van SchieCH, Boulton AJM, Harkless LB. Offloading the diabetic footwound: a randomized clinical trial. Diabetes Care 2001;24:1019-1022.39. Armstrong DG, Lavery LA, Wu S, Boulton AJ. Evaluation ofremovable and irremovable cast walkers in the healing ofdiabetic foot wounds: a randomized controlled trial.Diabetes Care 2005; 28:551-554.40. American Diabetes Association. Consensus DevelopmentConference on Diabetic Foot Wound Care. Diabetes Care1999; 22:1354.41. Caputo GM, Cavanagh PR, Ulbrecht JS, Gibbons GW,Karchmer AW. Assessment and management of foot diseasein patients with diabetes.N Engl J Med 1994; 331:854-860.42. International Working Group on the Diabetic Foot.International Consensus on the Diabetic Foot, edited by JApelqvist, K Bakker, WH Van Houtum, MH Nabuurs-Franssen, and NC Schaper. Vol. 2005. International WorkingGroup on the Diabetic Foot, Maatricht, 1999.43. Singh N, Armstrong DG, Lipsky BA. Preventing foot ulcersin patients with diabetes. [Review]. JAMA 2005; 293:217-228.44. Moss SE, Klein R, Klein BE. The 14-year incidence of lowerextremity amputations in a diabetic population. The Wi s co n s i n Epidemiologic Study of Diabetic Retinopathy.Diabetes Care 1999; 22:951-959.45. Frykberg RG. An evidence-based approach to diabetic footinfections. Am J Surg 2003; 186:44S-54S.46. Reiber GE. The epidemiology of diabetic foot problems.Diabet Med 13(Suppl 1):S6-S11, 1996.47. Gibbons GW, Eliopoulos GM. Infection of the diabetic foot.In:Management of Diabetic Foot Problems, p 121, edited byGP Kozak, DR Campbell, RG Frykberg, and GMHabershaw, WB Saunders, Philadelphia, 1995.48. American Diabetes Association. Consensus DevelopmentConference on Diabetic Foot Wound Care. Diabetes Care1999; 22:1354.49. Calhoun JH, Cantrell J, Cobos J, Lacy J, Valdez RR, HokansonJ, Mader JT. Treatment of diabetic foot infections: Wagnerclassification, therapy, and outcome. Foot and Ankle 1988;9:101-106.50. van Baal JG. Surgical treatment of the infected diabetic foot.Clin Infect Dis 2004; 39(Suppl 2):S123-S128.ANEXO ICuestionarios para el cribaje y estratificación del riesgo neuropáticoNSS: PARESTESIASHormigueo,quemazón, pinchazos Si (2) No (0)Las molestias aumentan Por la noche (2) día y noche (1), durante el día (0)Se localizan En los pies (2) pies y piernas (1), no en pies (0)Calman Con movimientos (2) de pie (1) otros (0)Despiertan por la noche (1) No (0)Total puntos (max 9) =Piel seca, fría, sin velloUñas anchas y gruesasDeformidadesCallos<strong>Úlceras</strong>Total puntos (max 10) =MNIS: ASPECTO DEL PIEPie derechoPie izquierdoNo (0) Si (1) No (0) Si (1)
ORGANIZACIÓN FUNCIONAL DE UNA UNIDAD DE PIE DIABÉTICO… ■ 183MONOFILAMENTO 10 g: PERCEPCIÓN DE PRESIÓN (en 4 puntos)Mano: dorso Derecho IzquierdoDedo gordo cara ventralDedo gordo cara plantar5.º dedo cara plantarTalón plantarSISTEMÁTICA DE EXPLORACIÓN CON DIAPASÓN 128 HZDerechoIzquierdoPresente Dismin Abolida Presente Dismin AbolidaMano: maleolo radialPie: dedo gordoPie: 5º dedoNEUROPATHY DISABILITY SCORE (NDS):ROT Aquíleo: (martillo de reflejos) Si (0) Si con refuerzo No (2 x lado)(1 x lado)Sensib. térmica:(mango de martillo/diapasón) Si (0) No (1 x lado)Sensib. algésica:(palillo en base uña 1er dedo) Si (0) No (1 x lado)Sensib. vibratoria:(diapasón 128 Hz)* Si (0) No (1 x lado)Puntos Total (max 10) =
ISBN: 978-84-615-9336-1