Capítulo 13. Calor y la primera ley de - DGEO
Capítulo 13. Calor y la primera ley de - DGEO
Capítulo 13. Calor y la primera ley de - DGEO
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
Cap. <strong>13.</strong> <strong>Calor</strong> y <strong>la</strong> Primera Ley <strong>de</strong> <strong>la</strong> Termodinámica<br />
una altura l<strong>la</strong>mada nivel <strong>de</strong> con<strong>de</strong>nsación, que es <strong>la</strong> altura don<strong>de</strong> comienza <strong>la</strong><br />
con<strong>de</strong>nsación y eventualmente <strong>la</strong> formación <strong>de</strong> nubes y <strong>de</strong> precipitación. Sobre<br />
ese nivel <strong>la</strong> tasa <strong>de</strong> enfriamiento con <strong>la</strong> altura se reduce por <strong>la</strong> liberación<br />
<strong>de</strong> calor <strong>la</strong>tente y ahora se l<strong>la</strong>ma gradiente adiabático húmedo, su valor varía<br />
<strong>de</strong>s<strong>de</strong> -5º C/km a -9º C/km <strong>de</strong> disminución con <strong>la</strong> altura, <strong>de</strong>pendiendo <strong>de</strong> si el<br />
aire tiene un alto o bajo contenido <strong>de</strong> humedad.<br />
<strong>13.</strong>7.4 Proceso isotérmico.<br />
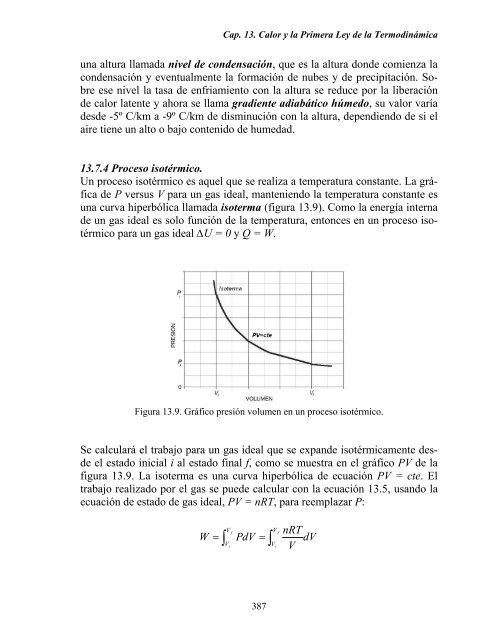
Un proceso isotérmico es aquel que se realiza a temperatura constante. La gráfica<br />
<strong>de</strong> P versus V para un gas i<strong>de</strong>al, manteniendo <strong>la</strong> temperatura constante es<br />
una curva hiperbólica l<strong>la</strong>mada isoterma (figura <strong>13.</strong>9). Como <strong>la</strong> energía interna<br />
<strong>de</strong> un gas i<strong>de</strong>al es solo función <strong>de</strong> <strong>la</strong> temperatura, entonces en un proceso isotérmico<br />
para un gas i<strong>de</strong>al ∆U = 0 y Q = W.<br />
Figura <strong>13.</strong>9. Gráfico presión volumen en un proceso isotérmico.<br />
Se calcu<strong>la</strong>rá el trabajo para un gas i<strong>de</strong>al que se expan<strong>de</strong> isotérmicamente <strong>de</strong>s<strong>de</strong><br />
el estado inicial i al estado final f, como se muestra en el gráfico PV <strong>de</strong> <strong>la</strong><br />
figura <strong>13.</strong>9. La isoterma es una curva hiperbólica <strong>de</strong> ecuación PV = cte. El<br />
trabajo realizado por el gas se pue<strong>de</strong> calcu<strong>la</strong>r con <strong>la</strong> ecuación <strong>13.</strong>5, usando <strong>la</strong><br />
ecuación <strong>de</strong> estado <strong>de</strong> gas i<strong>de</strong>al, PV = nRT, para reemp<strong>la</strong>zar P:<br />
W =<br />
∫<br />
V<br />
V<br />
i<br />
f<br />
PdV<br />
=<br />
387<br />
∫<br />
V<br />
V<br />
i<br />
f<br />
nRT<br />
dV<br />
V