Rapport annuel 2019
Rapport annuel 2019
Rapport annuel 2019
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
34 Groupe de produits Accès au marché<br />
Certificats délivrés pour des médicaments<br />
et des transplants standardisés<br />
m<br />
Les entreprises titulaires d’autorisations<br />
d’exploitation peuvent en demander<br />
des copies (certificats) en anglais. Ces certificats<br />
prouvent aux clients ou aux autorités<br />
d’autres pays l’existence d’une autorisation<br />
d’exploitation en cours de validité dans un<br />
format standardisé internationalement. Les<br />
entreprises qui exportent des médicaments<br />
ou des transplants standardisés peuvent<br />
demander une attestation du statut de<br />
l’autorisation en Suisse, qui peut être établie<br />
en français, anglais ou espagnol.<br />
Activités :<br />
Depuis l’introduction du nouveau format d’autorisation<br />
d’exploitation, les fabricants de médicaments, leurs<br />
partenaires commerciaux et les autorités en charge<br />
du contrôle des médicaments peuvent consulter les<br />
certificats directement dans la base de données Eudra-<br />
GMDP de l’EMA. En conséquence, le nombre de certificats<br />
BPF/BPD établis a diminué.<br />
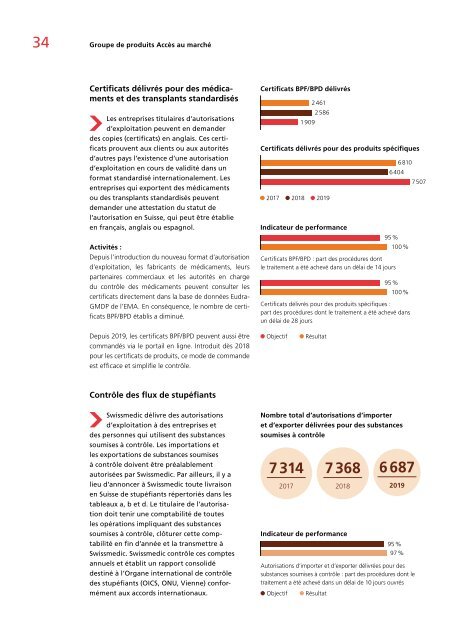
Certificats BPF/BPD délivrés<br />
1 909<br />
2 461<br />
2 586<br />
Certificats délivrés pour des produits spécifiques<br />
2017 2018 <strong>2019</strong><br />
Indicateur de performance<br />
6 404<br />
95 %<br />
Certificats BPF/BPD : part des procédures dont<br />
le traitement a été achevé dans un délai de 14 jours<br />
95 %<br />
6 810<br />
100 %<br />
100 %<br />
Certificats délivrés pour des produits spécifiques :<br />
part des procédures dont le traitement a été achevé dans<br />
un délai de 28 jours<br />
7 507<br />
Depuis <strong>2019</strong>, les certificats BPF/BPD peuvent aussi être<br />
commandés via le portail en ligne. Introduit dès 2018<br />
pour les certificats de produits, ce mode de commande<br />
est efficace et simplifie le contrôle.<br />
Objectif<br />
Résultat<br />
Contrôle des flux de stupéfiants<br />
m<br />
Nombre total d’autorisations d’importer<br />
et d’exporter délivrées pour des substances<br />
soumises à contrôle<br />
7 314<br />
2017<br />
Swissmedic délivre des autorisations<br />
d’exploitation à des entreprises et<br />
des personnes qui utilisent des substances<br />
soumises à contrôle. Les importations et<br />
les exportations de substances soumises<br />
à contrôle doivent être préalablement<br />
autorisées par Swissmedic. Par ailleurs, il y a<br />
lieu d’annoncer à Swissmedic toute livraison<br />
en Suisse de stupéfiants répertoriés dans les<br />
tableaux a, b et d. Le titulaire de l’autorisation<br />
doit tenir une comptabilité de toutes<br />
les opérations impliquant des substances<br />
soumises à contrôle, clôturer cette comptabilité<br />
en fin d’année et la transmettre à<br />
Swissmedic. Swissmedic contrôle ces comptes<br />
<strong>annuel</strong>s et établit un rapport consolidé<br />
destiné à l’Organe international de contrôle<br />
des stupéfiants (OICS, ONU, Vienne) conformément<br />
aux accords internationaux. Objectif Résultat<br />
7 368<br />
2018<br />
Indicateur de performance<br />
6 687<br />
<strong>2019</strong><br />
95 %<br />
97 %<br />
Autorisations d’importer et d’exporter délivrées pour des<br />
substances soumises à contrôle : part des procédures dont le<br />
traitement a été achevé dans un délai de 10 jours ouvrés