- Page 1:
CANNABIS E D A N N I A L L A S A L
- Page 4 and 5:
CANNABIS E DANNI ALLA SALUTE Aspett
- Page 7:
Giovanni Serpelloni Dipartimento Po
- Page 10 and 11:
Maurizio Gomma Dipartimento delle D
- Page 12 and 13:
PARTE SECONDA CANNABIS: ASPETTI GEN
- Page 14 and 15:
12 16.2 Uso di cannabis e disturbi
- Page 16 and 17:
PARTE QUINTA STRATEGIE DI PREVENZIO
- Page 18 and 19:
stano per il loro effimero divertim
- Page 20 and 21:
gera” anche per il ruolo di “ga
- Page 22 and 23:
Sono fiducioso sul fatto che sia st
- Page 25 and 26:
Sintesi Serpelloni Giovanni 1 , Tit
- Page 27 and 28:
condo la nostra opinione, la teoria
- Page 29 and 30:
THC durante l’adolescenza è stat
- Page 31 and 32:
la capacità dei neuroni di svilupp
- Page 33 and 34:
La marijuana causa ipoperfusione ce
- Page 35 and 36:
te tutte queste disfunzioni (14% ma
- Page 37 and 38:
È evidente, a questo punto, che es
- Page 39 and 40:
Volumetric MRIstudy of brain in chi
- Page 41 and 42:
• Galvan A, Hare TA, Parra CE, Pe
- Page 43:
• U.S. DEPARTMENT OF HEALTH AND H
- Page 47 and 48:
1. Le dieci caratteristiche salient
- Page 49 and 50:
ne giovanissime che proprio per la
- Page 51 and 52:
fascia di popolazione che assume le
- Page 53 and 54:
7. Accesso ai trattamenti Negli ult
- Page 55 and 56:
Sono state, inoltre, messe a punto
- Page 57 and 58:
frontare il problema sulla base del
- Page 59 and 60:
liconsumo di sostanze (associazione
- Page 61 and 62:
istretti, rivolte soprattutto ai gr
- Page 63 and 64:
Infine, si ritiene prioritario atti
- Page 65 and 66:
La riabilitazione soprattutto in am
- Page 67 and 68:
ta, il terrorismo e il traffico int
- Page 69:
Amministrazioni centrali nei confro
- Page 72 and 73:
Consumo di droga tra i giovani L’
- Page 74 and 75:
Stile di vita, modelli “prestazio
- Page 76 and 77:
La rete web Spazi virtuali di espre
- Page 78 and 79:
Alcuni principi base Fattori condiz
- Page 80 and 81:
78 alla rispondenza ai bisogni funz
- Page 82 and 83:
Uguali fattori di rischio, diversi
- Page 84 and 85:
Strategia complessiva di azione 82
- Page 87:
PARTE SECONDA Cannabis: aspetti gen
- Page 90 and 91:
Pianta annuale Pianta dioica Caratt
- Page 92 and 93:
90 Δ9-THC. 6. Cannabiciclolo (CBL)
- Page 94 and 95:
Cannabis Sativa, Indica e Ruderalis
- Page 96 and 97:
Sinsemilla Semi di cannabis e olio
- Page 98 and 99:
96 Tabella 2 - Informazioni disponi
- Page 100 and 101:
Principali rotte del traffico e spa
- Page 102 and 103:
100 mente contenuti per l’acquist
- Page 104 and 105:
102
- Page 106 and 107:
104 potrebbe aver complessivamente
- Page 108 and 109:
106 La situazione europea Malgrado
- Page 110 and 111:
108 le sostanze stupefacenti più r
- Page 112 and 113:
110 determinati siti di produzione
- Page 114 and 115:
112 di crescita dei consumi di cann
- Page 116 and 117:
7% i soggetti l’hanno usata nell
- Page 118 and 119:
Prevalenza una tantum: negli Usa 49
- Page 120 and 121:
Picchi negli anni ‘70 e ‘90 Neg
- Page 122 and 123: Tabella 2 - Risultati per singolo p
- Page 124 and 125: ESPAD: Nel 2007 stabilizzazione del
- Page 126 and 127: La cocaina si associa alla cannabis
- Page 128 and 129: 126 Bibliografia • Currie C, Gabh
- Page 130 and 131: Soggetti naive Sperimentatori inizi
- Page 132 and 133: Tabacco, alcol, droga come gateway
- Page 134 and 135: Organizzazione del capitolo 132 con
- Page 136 and 137: Il rischio in chi usa cannabis prec
- Page 138 and 139: Nel Regno Unito i risultati di un
- Page 140 and 141: 138 Bibliografia • Baumesteir SE,
- Page 142 and 143: Risk management, sostanze e mansion
- Page 144 and 145: 1,2% dei soggetti positivi al test
- Page 146 and 147: Esercito Italiano con l’1% di tes
- Page 148 and 149: Patente di guida e mansioni a risch
- Page 150 and 151: 148
- Page 153 and 154: 8. La maturazione del cervello: tem
- Page 155 and 156: del cervello maturo è quindi rilev
- Page 157 and 158: Figura 3 - Visione laterale dell’
- Page 159 and 160: All’inizio dell’adolescenza si
- Page 161 and 162: Figura 11 - Il periodo di rischio (
- Page 163 and 164: in bambini rimasti orfani ed istitu
- Page 165 and 166: Il gruppo di ricerca della Dott.ssa
- Page 167 and 168: Thompson (2009). Le alterazioni str
- Page 169 and 170: K, Blair C, Royal J, Hugdahl K, Pet
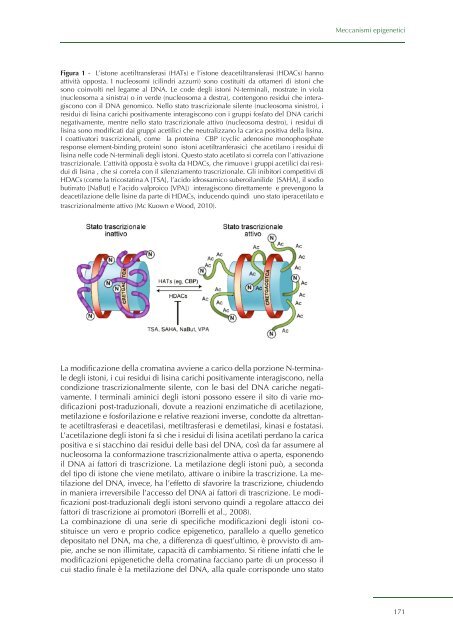
- Page 171: 9. Meccanismi epigenetici nella dip
- Page 175 and 176: et al., 2007) e questo sposta a fav
- Page 177 and 178: Meccanismi epigenetici e desensitiz
- Page 179 and 180: Tabella 1 - Effetto dell’acetilaz
- Page 181 and 182: Tabella 3 - Ruolo del CREB nel comp
- Page 183 and 184: 10. Il sistema endocannabinoide e l
- Page 185 and 186: Tabella 1 - Funzioni in cui è coin
- Page 187 and 188: come il giudizio (ad esempio, la co
- Page 189 and 190: viaggiare in direzione retrograda l
- Page 191 and 192: giormente localizzato su determinat
- Page 193 and 194: • Berrendero F, Sepe N, Ramos JA,
- Page 195 and 196: 11. Cannabinoidi esogeni: i fitocan
- Page 197 and 198: Il THC è un prodotto piuttosto ins
- Page 199 and 200: Il cannabigerolo (CBG, Figura 6) è
- Page 201 and 202: 12. I cannabinoidi sintetici Seri C
- Page 203 and 204: Figura 3 - Molecola del THC e del W
- Page 205 and 206: seguito riportato. Da analisi condo
- Page 207 and 208: Figura 7 - Esempi di prodotti tipo
- Page 209 and 210: era presente in percentuale dell’
- Page 211 and 212: grado 2 (potenziale rischio di grav
- Page 213 and 214: Tabella 2 - Miscele di erbe segnala
- Page 215 and 216: sulenza, la segnalazione di ben cin
- Page 217 and 218: del territorio di Alba (Figura 13),
- Page 219 and 220: 13. Dipendenza da cannabinoidi: dal
- Page 221 and 222: alla luce e una al buio per 6,5 gio
- Page 223 and 224:
Determinazioni morfometriche Morfom
- Page 225 and 226:
1.41; P = 0.19)] (Figura 4, Tabella
- Page 227 and 228:
L’analisi post hoc ha mostrato un
- Page 229 and 230:
Dipendenza da cannabinoidi: dalla m
- Page 231 and 232:
Discussione Dipendenza da cannabino
- Page 233 and 234:
sostanze (Nesler & Aghajan 1997; Ne
- Page 235 and 236:
Dipendenza da cannabinoidi: dalla m
- Page 237 and 238:
14. Effetti dell’uso di cannabis
- Page 239 and 240:
evitare che il cervello sia esposto
- Page 241 and 242:
Questi effetti psicoattivi sono acc
- Page 243 and 244:
Effetti dell’uso di cannabis sul
- Page 245 and 246:
Effetti dell’uso di cannabis sul
- Page 247 and 248:
Effetti dell’uso di cannabis sul
- Page 249 and 250:
agazzi che hanno usato marijuana ma
- Page 251 and 252:
Effetti dell’uso di cannabis sul
- Page 253 and 254:
15. Effetti cronici dell’uso di m
- Page 255 and 256:
di sostanze) durante l’adolescenz
- Page 257 and 258:
Effeti cronici sul cervello e sulle
- Page 259 and 260:
Effeti cronici sul cervello e sulle
- Page 261 and 262:
Effeti cronici sul cervello e sulle
- Page 263 and 264:
Effeti cronici sul cervello e sulle
- Page 265 and 266:
Effeti cronici sul cervello e sulle
- Page 267 and 268:
16. La comorbilità psichiatrica ne
- Page 269 and 270:
Sembrano esposti ad un rischio magg
- Page 271 and 272:
al, 2008). Trattamento della comorb
- Page 273 and 274:
La comorbilità psichiatrica nei so
- Page 275 and 276:
17. Uso di cannabis in adolescenza
- Page 277 and 278:
Infine, l’espressione dinamica di
- Page 279 and 280:
iamenti dell’ontognensi del siste
- Page 281 and 282:
Andreano and Cahill, 2009). Disturb
- Page 283 and 284:
ebrali anche i livelli di cFos dopo
- Page 285 and 286:
mento e la memoria di lavoro risult
- Page 287 and 288:
patologia (D’Souza et al., 2009).
- Page 289 and 290:
affects the behavioural responses o
- Page 291 and 292:
phr Bull 34: 1111-1121. • Henquet
- Page 293 and 294:
K, Drmota T, Greasley PJ (2007) The
- Page 295 and 296:
18. Il consumo di cannabis in gravi
- Page 297 and 298:
Il consumo di cannabis in gravidanz
- Page 299 and 300:
Il consumo di cannabis in gravidanz
- Page 301 and 302:
Dalla letteratura risulta evidente
- Page 303 and 304:
Il consumo di cannabis in gravidanz
- Page 305 and 306:
Il consumo di cannabis in gravidanz
- Page 307 and 308:
Il consumo di cannabis in gravidanz
- Page 309 and 310:
19. Principi di funzionamento del n
- Page 311 and 312:
di materia grigia ed una percentual
- Page 313 and 314:
zione del sangue (BOLD) tra gli ado
- Page 315 and 316:
Figura 5 - Immagine SPECT del metab
- Page 317 and 318:
20. Mappatura cerebrale delle aree
- Page 319 and 320:
sicologici atti a valutare le funzi
- Page 321 and 322:
Mappatura cerebrale del craving e d
- Page 323 and 324:
Mappatura cerebrale del craving e d
- Page 325 and 326:
Mappatura cerebrale del craving e d
- Page 327 and 328:
Bibliografia Mappatura cerebrale de
- Page 329 and 330:
21. I danni derivanti dal consumo d
- Page 331 and 332:
Effetti sull’apparato cardiovasco
- Page 333 and 334:
Effetti sul sistema immunitario Ci
- Page 335 and 336:
I danni derivanti dal consumo di ca
- Page 337 and 338:
22. L’impiego medico dei cannabin
- Page 339 and 340:
prattutto nei giovani, circa l’in
- Page 341 and 342:
meccanismo, rappresentando un poten
- Page 343 and 344:
La stimolazione dell’appetito è
- Page 345 and 346:
pilota randomizzato, su 44 pazienti
- Page 347 and 348:
Tabella 1 - Potenziali campi di uti
- Page 349 and 350:
• Tramèr MR et al. Cannabinoids
- Page 351 and 352:
23. Farmacologia e tossicologia dei
- Page 353 and 354:
ia prospettica a breve e a lungo in
- Page 355 and 356:
Farmacologia e tossicologia dei der
- Page 357 and 358:
Farmacologia e tossicologia dei der
- Page 359 and 360:
gradativi FAAH o MAGL ad opera di d
- Page 361 and 362:
Farmacologia e tossicologia dei der
- Page 363 and 364:
Farmacologia e tossicologia dei der
- Page 365 and 366:
24. Guida sotto l’influenza di so
- Page 367 and 368:
Il fine settimana rappresenta il pe
- Page 369 and 370:
Gli studi sperimentali vengono effe
- Page 371 and 372:
Gli studi sperimentali indicano che
- Page 373 and 374:
ischi di provocare incidenti, e mol
- Page 375 and 376:
un ulteriore effetto sinergico di r
- Page 377 and 378:
Tabella 4 - Caratteristiche socio-a
- Page 379 and 380:
Figura 4 - Prevalenza delle sostanz
- Page 381 and 382:
Guida sotto l’influenza di sostan
- Page 383 and 384:
25. Effetti dell’uso di cannabis
- Page 385 and 386:
cognitive dei suoi individui” (ib
- Page 387 and 388:
ad affrontare l’ansia e lo stress
- Page 389 and 390:
cietà ed agenzie educative, che co
- Page 391:
PARTE QUARTA Cannabis: aspetti comu
- Page 394 and 395:
Effetti Neuropsicologia dell’età
- Page 396 and 397:
Impatto dei mass media sulla salute
- Page 398 and 399:
Televisione e reality show Packagin
- Page 400 and 401:
398 tale importanza il ruolo degli
- Page 402 and 403:
400
- Page 404 and 405:
Online drugstore Spazi di espressio
- Page 406 and 407:
Disponibilità della cannabis in In
- Page 408 and 409:
Parafrenalia www.youtube.com www.we
- Page 410 and 411:
408 Sitografia • www.drugstore.co
- Page 412 and 413:
Anni 30-50 Anni 60-70 Anni 80-90 41
- Page 414 and 415:
Cocco di nonna L’erba di Grace 41
- Page 416 and 417:
Road trip Shrink 414 me che balla e
- Page 418 and 419:
Weeds The Shield 416 Titolo origina
- Page 420 and 421:
South Park 418 Titolo originale: So
- Page 422 and 423:
420
- Page 424 and 425:
Flower Power, Rock Psichedelico e l
- Page 426 and 427:
I brani politicizzati Il reggae e l
- Page 428 and 429:
Disponibilità 426 Canzoni di quest
- Page 430 and 431:
428 David Crosby (the Byrds) 1964 -
- Page 432 and 433:
430 Bibliografia • Herd D, “Add
- Page 434 and 435:
Alimenti 432 cessaria ad ottenere u
- Page 436 and 437:
Bevande 434 Gomme Indica Flower Hem
- Page 438 and 439:
Ricette 436 Cannabis Instant Coffee
- Page 440 and 441:
438 Tabella 3 - Elenco di alcuni pr
- Page 442 and 443:
Le procedure analitiche La strument
- Page 444 and 445:
442 Sitografia • http://thefullpi
- Page 446 and 447:
Messaggi adeguati Giovani, core tar
- Page 448 and 449:
Età Soggetti 11-14 anni Soggetti v
- Page 450 and 451:
Evidenziare le conseguenze del cons
- Page 452 and 453:
Esortare a dare il buon esempio Seg
- Page 454 and 455:
Chiarezza e coerenza Azioni concret
- Page 456 and 457:
454 caci. In quest’ottica, è ind
- Page 458 and 459:
456 and Mental Health Services Admi
- Page 460 and 461:
La segmentazione del target Giovani
- Page 462 and 463:
Le argomentazioni persuasive Le arg
- Page 464 and 465:
462 Mercken 2010), e la necessità
- Page 466 and 467:
464
- Page 469 and 470:
33. Indicazioni strategiche di prev
- Page 471 and 472:
positivi nella prevenzione dall’u
- Page 473 and 474:
ze psicotrope e stupefacenti e che
- Page 475 and 476:
C. Prevenzione e agenzie educative
- Page 477 and 478:
Figura 3 - Agenzie educative tradiz
- Page 479 and 480:
3. Allerta genitoriale e diagnosi p
- Page 481 and 482:
tere è che “non sei un pazzo se
- Page 483 and 484:
prassi e se mantengono un registro
- Page 485 and 486:
astinenza quando l’accesso al com
- Page 487 and 488:
2. Coinvolgimento diretto dei ragaz
- Page 489 and 490:
zato dagli stimoli che il soggetto
- Page 491 and 492:
cutive. E’ importante che il grup
- Page 493 and 494:
inseriti nei normali programmi scol
- Page 495 and 496:
funzione educativa, e le difficolt
- Page 497 and 498:
5. Diagnosi precoce e supporto alle
- Page 499 and 500:
anche il coinvolgimento attivo dei
- Page 501 and 502:
te il tempo libero, di frequentare
- Page 503 and 504:
TRACCIA PER POSSIBILI ORIENTAMENTI
- Page 505 and 506:
degli operatori che evitino o ritar
- Page 507 and 508:
• Tipo 2: i genitori non restano
- Page 509 and 510:
poliassuntori, recidivanti, manager
- Page 511 and 512:
grado, nel rispetto delle specifich
- Page 513 and 514:
non autorizzate, il traffico e lo s
- Page 515 and 516:
Tabella 6 - Sistema degli indicator
- Page 517 and 518:
9. Controlli antidroga e antialcol
- Page 519 and 520:
games on prosocial behaviors: inter
- Page 521 and 522:
• Soares B.G., Lima M.S., Reisser
- Page 523 and 524:
34. Adolescenti e cannabis: quali t
- Page 525 and 526:
Medicina generale e ambulatori di p
- Page 527 and 528:
isogno di ricevere una accurata inf
- Page 529 and 530:
• una breve valutazione/screening
- Page 531 and 532:
interesse e apertura mentale. Quind
- Page 533 and 534:
• Dennis, M., Titus, J.C., Diamon
- Page 535:
PARTE SESTA Allegati
- Page 538 and 539:
536 re sottovalutato o trattato con
- Page 540 and 541:
538 la collusione o luna superficia
- Page 542 and 543:
540 13. Il Libro Verde sulla Tutela
- Page 544 and 545:
542 6. che si promuova e si increme
- Page 546 and 547:
544 Ricerca scientifica sulle Dipen
- Page 548:
546