Eksamen, Kemi C, d. 9-10. juni 2011, 2010v, NGHF, Morten ...
Eksamen, Kemi C, d. 9-10. juni 2011, 2010v, NGHF, Morten ...
Eksamen, Kemi C, d. 9-10. juni 2011, 2010v, NGHF, Morten ...
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
<strong>Eksamen</strong>, <strong>Kemi</strong> C, d. 9-<strong>10.</strong> <strong>juni</strong> <strong>2011</strong>, <strong>2010v</strong>, <strong>NGHF</strong>, <strong>Morten</strong> Rasmussen<br />
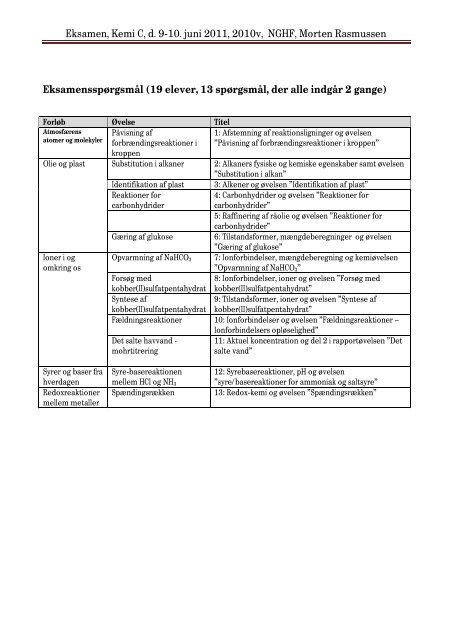
<strong>Eksamen</strong>sspørgsmål (19 elever, 13 spørgsmål, der alle indgår 2 gange)<br />
Forløb Øvelse Titel<br />
Atmosfærens<br />
atomer og molekyler<br />
Påvisning af<br />
forbrændingsreaktioner i<br />
kroppen<br />
1: Afstemning af reaktionsligninger og øvelsen<br />
”Påvisning af forbrændingsreaktioner i kroppen”<br />
Olie og plast Substitution i alkaner 2: Alkaners fysiske og kemiske egenskaber samt øvelsen<br />
”Substitution i alkan”<br />
Ioner i og<br />
omkring os<br />
Syrer og baser fra<br />
hverdagen<br />
Redoxreaktioner<br />
mellem metaller<br />
Identifikation af plast 3: Alkener og øvelsen ”Identifikation af plast”<br />
Reaktioner for<br />
carbonhydrider<br />
4: Carbonhydrider og øvelsen ”Reaktioner for<br />
carbonhydrider”<br />
5: Raffinering af råolie og øvelsen ”Reaktioner for<br />
carbonhydrider”<br />
Gæring af glukose 6: Tilstandsformer, mængdeberegninger og øvelsen<br />
”Gæring af glukose”<br />
Opvarmning af NaHCO3 7: Ionforbindelser, mængdeberegning og kemiøvelsen<br />
”Opvarmning af NaHCO3”<br />
Forsøg med<br />
8: Ionforbindelser, ioner og øvelsen ”Forsøg med<br />
kobber(II)sulfatpentahydrat kobber(II)sulfatpentahydrat”<br />
Syntese af<br />
9: Tilstandsformer, ioner og øvelsen ”Syntese af<br />
kobber(II)sulfatpentahydrat kobber(II)sulfatpentahydrat”<br />
Fældningsreaktioner 10: Ionforbindelser og øvelsen ”Fældningsreaktioner –<br />
Ionforbindelsers opløselighed”<br />
Det salte havvand - 11: Aktuel koncentration og del 2 i rapportøvelsen ”Det<br />
mohrtitrering<br />
salte vand”<br />
Syre-basereaktionen 12: Syrebasereaktioner, pH og øvelsen<br />
mellem HCl og NH3<br />
”syre/basereaktioner for ammoniak og saltsyre”<br />
Spændingsrækken 13: Redox-kemi og øvelsen ”Spændingsrækken”
<strong>Eksamen</strong>, <strong>Kemi</strong> C, d. 9-<strong>10.</strong> <strong>juni</strong> <strong>2011</strong>, <strong>2010v</strong>, <strong>NGHF</strong>, <strong>Morten</strong> Rasmussen<br />
1 Afstemning af reaktionsligninger og øvelsen ”Påvisning af forbrændingsreaktioner i kroppen”<br />
Du skal redegøre for reglerne for afstemningen af reaktionsligninger idet du tager udgangspunkt i<br />
reaktionsligningerne på bilag 1.<br />
Du skal med udgangspunkt i laboratorieudstyret gennemgå øvelsen ”Påvisning af forbrændingsreaktioner i<br />
kroppen” under hvilken du forklarer observationer fra forsøget og som minimum inddrager følgende<br />
reaktionsskemaer:<br />
A: CO2(g) CO2(aq)<br />
B: C6H12O6 + O2 CO2 + H2O (Ikke afstemt)<br />
OBS: Det forventes ikke at du afstemmer ovenstående reaktionsskemaer<br />
Forklar hvad der kendetegner en forbrændingsreaktion og evt. hvad forskellen på en fuldstændig og<br />
ufuldstændig forbrændingsreaktion er.<br />
Vurder om metoden til at påvise forbrændingsreaktioner i kroppen er pålidelig og angiv eventuelle<br />
svagheder ved metoden.<br />
Der kan opskrives flere relevante reaktionsskemaer fra forsøget og/eller relateres til andre forsøg.<br />
Relevante stikord der kan inddrages i samtalen:<br />
- Ufuldstændig og fuldstændig forbrænding<br />
- Indikatorer<br />
- pH-værdi<br />
- reaktanter<br />
- produkter<br />
- ladningsbevarelse<br />
Bilag 1:<br />
CH4 + O2 CO2 + H2O<br />
Cl2 + CH4 CH3Cl + _____<br />
CO2 + H2O H2CO3<br />
Bilag 2:<br />
Som bilag til eksamensspørgsmålet medfølger desuden kemikalier og apparatur til den relevante øvelse.
<strong>Eksamen</strong>, <strong>Kemi</strong> C, d. 9-<strong>10.</strong> <strong>juni</strong> <strong>2011</strong>, <strong>2010v</strong>, <strong>NGHF</strong>, <strong>Morten</strong> Rasmussen<br />
2 Alkaners fysiske og kemiske egenskaber samt øvelsen ”Substitution i alkan”<br />
Redegør for alkaner som stofgruppe. Du skal i denne forbindelse komme ind på smelte og kogepunkter for<br />
de uforgrenede alkaner (se bilag 1).<br />
Du skal med udgangspunkt i laboratorieudstyr og kemikalier gennemgå øvelsen ”Substitution i alkan” under<br />
hvilken du forklarer observationer fra forsøget og som minimum inddrager følgende reaktionsskemaer:<br />
A: Br2(aq) Br2(heptan)<br />
B: C7H16 + Br2 C7H15 + HBr<br />
C: HBr + H2O Br - + H3O +<br />
Vurder på baggrund af forsøgets resultater om der er sket en substitutionsreaktion i jeres forsøg.<br />
Der kan opskrives flere relevante reaktionsskemaer fra forsøget og/eller relateres til andre forsøg.<br />
Relevante stikord der kan inddrages i samtalen:<br />
- navngivning<br />
- strukturformel samt zig-zag formel<br />
- tilstandsformer<br />
- elektronparbindingen<br />
Bilag 1:<br />
Som bilag til eksamensspørgsmålet medfølger desuden kemikalier og apparatur til den relevante øvelse.
<strong>Eksamen</strong>, <strong>Kemi</strong> C, d. 9-<strong>10.</strong> <strong>juni</strong> <strong>2011</strong>, <strong>2010v</strong>, <strong>NGHF</strong>, <strong>Morten</strong> Rasmussen<br />
3 Alkener og øvelsen ”Identifikation af plast”<br />
Med udgangspunkt i bilag 1 og bilag 2 skal du redegøre for alkener som stofgruppe og forklare hvorledes<br />
plastdannelsen foregår. Du kan her bl.a. komme ind på strukturformel, polaritet, bindingstyper og kendte<br />
kemiske reaktionstyper.<br />
Med udgangspunkt i laboratorieudstyret ønskes en gennemgang af øvelsen ” Identifikation af plast”, under<br />
hvilken du forklarer hvordan man adskiller de forskellige plasttyper og forklarer forskellen i den<br />
fuldstændige og ufuldstændige forbrænding. I din gennemgang skal du som minimum inddrage følgende<br />
reaktionsskemaer:<br />
A: CxHy(s) + O2(g) CO2 + H2O (ikke afstemt)<br />
B: CxHy(s) + O2(g) C(s) + CO2 + H2O (ikke afstemt)<br />
OBS: Det forventes ikke at du afstemmer ovenstående reaktionsskemaer<br />
Vurder styrker og svagheder ved de 5 forskellige test som blev udført i øvelsen.<br />
Du kan også relatere til andre forsøg, forklare hvorledes man kan eksperimentere med fremstilling af andre<br />
plasttyper eller redegøre for ulemperne ved anvendelse af PVC-plast.<br />
Relevante stikord der kan inddrages i samtalen:<br />
- Initiatorer<br />
- Terminator<br />
- Momomer<br />
- Termoplast<br />
- Polymer<br />
- carbonhydrider<br />
- Forbrændingsreaktioner<br />
Bilag 1:<br />
Bilag 2:<br />
__________________________________________<br />
Som bilag til eksamensspørgsmålet medfølger desuden kemikalier og apparatur til den relevante øvelse.
<strong>Eksamen</strong>, <strong>Kemi</strong> C, d. 9-<strong>10.</strong> <strong>juni</strong> <strong>2011</strong>, <strong>2010v</strong>, <strong>NGHF</strong>, <strong>Morten</strong> Rasmussen<br />
4 Carbonhydrider og øvelsen ”Reaktioner for carbonhydrider”<br />
Redegør med udgangspunkt i bilag 1 for opbygningen af alkaner, alkener og arener og karakteriser deres<br />
fysiske og kemiske egenskaber. Du kan her bl.a. komme ind på strukturformel, polaritet, smelte- og<br />
kogepunkter samt kendte reaktioner de kan deltage i.<br />
Med udgangspunkt i laboratorieudstyret og bilagene ønskes en gennemgang af øvelsen ”Reaktioner for<br />
carbonhydrider”, under hvilken du forklarer formålet, udførelsen og hvorledes observationerne skal<br />
fortolkes. I din gennemgang skal du som minimum inddrage følgende reaktionsskemaer:<br />
A: C7H16 + O2 CO2 + H2O (ikke afstemt)<br />
B: C6H5CH3 + O2 CO2 + H2O + CO + C (ikke afstemt)<br />
C: C7H16 + Br2 C7H15Br + HBr Afstemt<br />
OBS: Det forventes ikke at du afstemmer ovenstående reaktionsskemaer<br />
Vurder styrker og svagheder ved hhv. forbrændingstesten og reaktionen med Br2.<br />
Du er velkommen til at opskrive andre reaktionsskemaer eller relatere til andre forsøg.<br />
Relevante stikord der kan inddrages i samtalen:<br />
- Addition<br />
- Substitution<br />
- Ufuldstændig og fuldstændig forbrænding<br />
- Reaktionstyper<br />
- Kvalitativ/kvantitativ analyse<br />
Bilag 1:<br />
Som bilag til eksamensspørgsmålet medfølger desuden kemikalier og apparatur til den relevante øvelse.
<strong>Eksamen</strong>, <strong>Kemi</strong> C, d. 9-<strong>10.</strong> <strong>juni</strong> <strong>2011</strong>, <strong>2010v</strong>, <strong>NGHF</strong>, <strong>Morten</strong> Rasmussen<br />
5 Raffinering af råolie og øvelsen ”Reaktioner for carbonhydrider”<br />
Redegør kort for råoliens indholdsstoffer og for råoliens raffineringsprocesser på raffinaderiet.<br />
Med udgangspunkt i laboratorieudstyret og bilagene ønskes en gennemgang af øvelsen ”Reaktioner for<br />
carbonhydrider”, under hvilken du forklarer formålet, udførelsen og hvorledes observationerne skal<br />
fortolkes. I din gennemgang skal du som minimum inddrage følgende reaktionsskemaer:<br />
A: C7H16 + O2 CO2 + H2O (ikke afstemt)<br />
B: C6H5CH3 + O2 CO2 + H2O + CO + C (ikke afstemt)<br />
C: C7H16 + Br2 C7H15Br + HBr Afstemt<br />
OBS: Det forventes ikke at du afstemmer ovenstående reaktionsskemaer<br />
Vurder styrker og svagheder ved hhv. forbrændingstesten og reaktionen med Br2.<br />
Du er velkommen til at opskrive andre reaktionsskemaer eller relatere til andre forsøg.<br />
Relevante stikord der kan inddrages i samtalen:<br />
- Addition<br />
- Substitution<br />
- Ufuldstændig og fuldstændig forbrænding<br />
- Reaktionstyper<br />
- Kvalitativ/kvantitativ analyse<br />
Bilag 1:<br />
Bilag 2:<br />
Som bilag til eksamensspørgsmålet medfølger desuden kemikalier og apparatur til den relevante øvelse
<strong>Eksamen</strong>, <strong>Kemi</strong> C, d. 9-<strong>10.</strong> <strong>juni</strong> <strong>2011</strong>, <strong>2010v</strong>, <strong>NGHF</strong>, <strong>Morten</strong> Rasmussen<br />
6 Tilstandsformer, mængdeberegninger og øvelsen ”Gæring af glukose”<br />
Du skal redegøre for tilstandsformerne gas, flydende og fast form. Du skal desuden færdiggøre<br />
nedenstående reaktion, der beskriver opløsningen af glukosemonohydrat i vand, og angive manglende<br />
tilstandsformer:<br />
C6H12O6H2O(s ) C6H12O6 ( ) + H2O ( )<br />
Glukosemonohydrat<br />
Du skal med udgangspunkt i laboratorieudstyret gennemgå øvelsen ”Gæring af glukose” under hvilken du<br />
forklarer observationer fra forsøget og som minimum inddrager følgende reaktionsskemaer:<br />
A: C6H12O6(aq) 2 CO2(g) + 2 CH3CH2OH(aq)<br />
B: C6H12O6(aq) + 6O2 (aq) 6 CO2(g) + 6 H2O (l)<br />
Forklar begreberne masse, molar masse og stofmængde og forklar hvordan man kan udregne massen af<br />
det teoretiske udbytte af alkohol ud fra en kendt masse på glukosen.<br />
Angiv mulige årsager til at man ikke opnår et praktisk udbytte på 100% og vurder hvad man eksperimentelt<br />
kan gøre for at opnå et højere udbytte.<br />
Der kan opskrives andre relevante reaktionsskemaer og/eller relateres til andre forsøg.<br />
Relevante stikord der kan inddrages i samtalen:<br />
- Indikatorer<br />
- pH-værdi<br />
- aerob og anaerob processer<br />
Bilag 1:<br />
Bilag 2:<br />
Som bilag til eksamensspørgsmålet medfølger desuden kemikalier og apparatur til den relevante øvelse.
<strong>Eksamen</strong>, <strong>Kemi</strong> C, d. 9-<strong>10.</strong> <strong>juni</strong> <strong>2011</strong>, <strong>2010v</strong>, <strong>NGHF</strong>, <strong>Morten</strong> Rasmussen<br />
7 Ionforbindelser, mængdeberegning og kemiøvelsen ”Opvarmning af NaHCO3”<br />
Du skal redegøre for opbygningen af ionforbindelser generelt herunder inddrage hvilke ioner der indgår i<br />
Na2CO3 og Ca(OH)2.<br />
Du skal med udgangspunkt i laboratorieudstyret gennemgå øvelsen ”Opvarmning af NaHCO3” i det du<br />
forklarer formålet, metoden og hvordan observationerne og resultaterne fra forsøget kan fortolkes. Du skal<br />
inddrage de tre reaktioner fra bilag 1 i din gennemgang.<br />
Afstem de tre reaktioner på bilag 1 og forklar hvordan man med hjælp af mængdeberegninger, kan finde<br />
frem til hvilken af reaktionerne der er forløbet. (Det er ikke et krav at du udfører beregningerne).<br />
Vurder hvilken betydning det vil få for resultaterne hvis den anvendte NaHCO3 har været fugtig.<br />
Du kan også relatere til andre forsøg.<br />
Du kan komme ind på følgende:<br />
Positive og negative ioner<br />
Navngivning af ioner og salte<br />
Ædelgasreglen<br />
Ionbinding<br />
Stofmængde, masse, den molare masse og formelmasse<br />
Du skal selv disponere stoffet. Inddrag bilagene<br />
BILAG 1: Ikke alle reaktionerne er ikke afstemt.<br />
Bilag 2:<br />
A: NaHCO3(s) Na2O(s) + H2O + CO2<br />
B: NaHCO3(s) NaOH(s) + CO2<br />
C: NaHCO3(s) Na2CO3(s) + H2O + CO2<br />
Som bilag til eksamensspørgsmålet medfølger desuden kemikalier og apparatur til den relevante øvelse.
<strong>Eksamen</strong>, <strong>Kemi</strong> C, d. 9-<strong>10.</strong> <strong>juni</strong> <strong>2011</strong>, <strong>2010v</strong>, <strong>NGHF</strong>, <strong>Morten</strong> Rasmussen<br />
8 Ionforbindelser, ioner og øvelsen ”Opvarmning af kobber(II)sulfatpentahydrat”<br />
Du skal redegøre for ionernes ladning samt opbygningen af ionforbindelser.<br />
Du skal med udgangspunkt i laboratorieudstyret gennemgå øvelsen ” Forsøg med<br />
kobber(II)sulfatpentahydrat” under hvilken du forklarer formålet, metoden og observationerne. Du skal<br />
inddrage følgende reaktionsskemaer i din gennemgang:<br />
A: CuSO4·5H2O(s) CuSO4 ( ) + __H2O(g)<br />
B: CuSO4·5H2O(s) Cu 2+ ( ) + SO4 2- ( ) + __H2O(l)<br />
C: CuCl2·2H2O(s) Cu 2+ (aq) + 2Cl - (aq) 2H2O(g)<br />
D: Na2SO4·10H2O(s) 2Na + (aq) + SO4 2- (aq) + 10H2O(l)<br />
Vurder hvilke konklusioner der kan drages af observationerne fra forsøget.<br />
Du kan også opskrive andre relevante reaktionsskemaer og/eller relatere til andre forsøg. Endelig kan du<br />
vurdere hvordan man kan afgøre om der netop er 5 krystalvand i den anvendte forbindelse.<br />
Relevante stikord der kan inddrages i samtalen:<br />
- iongitter<br />
- ædelgasreglen<br />
- vandig opløsning<br />
- metaller og ikke-metaller<br />
- simple og sammensatte ioner<br />
- krystalvand<br />
- tilstandsformer<br />
- reaktionstyper<br />
BILAG 1:<br />
BILAG 2:<br />
Som bilag til eksamensspørgsmålet medfølger kemikalier og apparatur til den relevante øvelse.
<strong>Eksamen</strong>, <strong>Kemi</strong> C, d. 9-<strong>10.</strong> <strong>juni</strong> <strong>2011</strong>, <strong>2010v</strong>, <strong>NGHF</strong>, <strong>Morten</strong> Rasmussen<br />
9 Tilstandsformer, ioner og øvelsen ”Syntese af kobber(II)sulfatpentahydrat”<br />
Du skal med udgangspunkt i vand redegøre for tilstandsformerne fast, væske og gas. Dertil skal du forklare<br />
for hvad der sker når en ionforbindelse opløses i vand.<br />
Du skal med udgangspunkt i laboratorieudstyret gennemgå øvelsen ” Syntese af<br />
kobber(II)sulfatpentahydrat” under hvilken du forklarer udførslen og observationer fra forsøget. I din<br />
gennemgang skal du som minimum inddrage følgende reaktioner:<br />
A: Cu(OH)2,CuCO3( ) 2OH-(aq) + 2Cu 2+ (aq) + CO3 2- (aq)<br />
B: 2OH-(aq) + H2SO4 (aq) __________ + SO4 2- (aq) Ikke afstemt<br />
C: CO3 2- (aq) + H2SO4 (aq) __________ + SO4 2- (aq) Ikke afstemt<br />
Forklar hvad der sker med de ioner i udgangsstoffet (Cu(OH)2,CuCO3(s)), som ikke findes i det færdige<br />
produkt.<br />
Det praktiske udbytte i øvelsen ligger altid under det teoretisk mulige. Vurder hvilke trin i forsøget, der<br />
giver de største tab i udbytteprocenten.<br />
Du kan opskrive andre relevante reaktionsskemaer, relatere til andre forsøg eller vurdere hvad der ville<br />
have sket hvis man havde brugt HCl i stedet for H2SO4.<br />
Relevante stikord der kan inddrages i samtalen:<br />
- fordampning<br />
- ækvivalente mængder<br />
- urenheder<br />
- simple og sammensatte ioner<br />
- krystalvand<br />
- reaktionstyper<br />
BILAG 1:<br />
Som bilag til eksamensspørgsmålet medfølger kemikalier og apparatur til den relevante øvelse.
<strong>Eksamen</strong>, <strong>Kemi</strong> C, d. 9-<strong>10.</strong> <strong>juni</strong> <strong>2011</strong>, <strong>2010v</strong>, <strong>NGHF</strong>, <strong>Morten</strong> Rasmussen<br />
10 Ionforbindelser og øvelsen ”Fældningsreaktioner – Ionforbindelsers opløselighed”<br />
Redegør med udgangspunkt i bilag 1 for elektronernes fordeling om kernen og beskriv<br />
sammenhængen til ladningen på de simple ioner som magnesiumatomet og chloratomet danner.<br />
Du skal med udgangspunkt i kemikalier og laboratorieudstyr gennemgå øvelsen ”Fældningsreaktioner -<br />
Ionforbindelsers opløselighed” under hvilken du forklarer udførslen og observationer fra øvelsen. I din<br />
gennemgang skal du som minimum inddrage følgende reaktioner:<br />
A: Cl - (aq) + Ag + (aq) AgCl(s)<br />
B: BaCl2( ) + CuSO4( ) BaSO4( ) + CuCl2( ) Angiv selv tilstandsformer<br />
Forklar hvordan observationerne fra forsøget relaterer til ionforbindelsernes opløselighed. Vurder hvilke<br />
ionforbindelser man kan anvende til at teste om der er bly(II)ioner (Pb 2+ ) i en vandprøve.<br />
Du kan opskrive andre relevante reaktionsskemaer eller relatere til andre forsøg.<br />
Relevante stikord der kan inddrages i samtalen:<br />
Bilag 1<br />
Positive og negative ioner<br />
Aktuel/formel koncentration<br />
Ionbindingen<br />
Bilag 2: Tabel over udvalgte ionforbindelsers opløselighed.<br />
Fældningsreaktioner<br />
Ædelgasreglen<br />
Navngivning af ioner og ionforbindelser<br />
Som bilag til eksamensspørgsmålet medfølger kemikalier og apparatur til den relevante øvelse.
<strong>Eksamen</strong>, <strong>Kemi</strong> C, d. 9-<strong>10.</strong> <strong>juni</strong> <strong>2011</strong>, <strong>2010v</strong>, <strong>NGHF</strong>, <strong>Morten</strong> Rasmussen<br />
11 Aktuel koncentration og del 2 i rapportøvelsen ”Det salte vand”<br />
Du skal redegøre for begreberne stofmængde og koncentration. Du skal i denne forbindelse komme ind på<br />
forskellen i formel og aktuel koncentration gerne med udgangspunkt i de opløste ionforbindelser fra det<br />
aktuelle eksperiment: 0,05M AgNO3(aq) og 0,1M K2CrO4(aq).<br />
Du skal med udgangspunkt i laboratorieudstyret gennemgå del 2 i rapportøvelsen ”Det salte havvand”<br />
(Mohrtitrering) under hvilken du forklarer metoden og observationer fra forsøget. I din gennemgang skal<br />
du som minimum inddrage følgende reaktioner:<br />
A: Ag + ( ) + Cl - ( ) AgCl ( ) Angiv selv tilstandsformer<br />
B: 2Ag + ( ) +CrO4 2- ( ) Ag2CrO4( ) Angiv selv tilstandsformer<br />
Forklar desuden hvordan den aktuelle koncentration af en eller flere selvvalgte ioner ændres under<br />
tilsætningen af AgNO3(aq).<br />
Angiv hvilke fejlkilder der er i forsøget, og vurder hvordan de påvirker resultatet.<br />
Hvis der er tid kan du også forklare princippet i udregningerne af saltets masseprocent i havvandet, eller<br />
der kan relateres til andre forsøg.<br />
Relevante stikord der kan inddrages i samtalen:<br />
- Titrerreaktion<br />
- Titrand<br />
- Titrator<br />
- Ioner i havvand<br />
- Ækvivalenspunkt<br />
- Fældningsreaktion<br />
Bilag 1: Bilag 2:<br />
Som bilag til eksamensspørgsmålet medfølger desuden kemikalier og apparatur til den relevante øvelse.
<strong>Eksamen</strong>, <strong>Kemi</strong> C, d. 9-<strong>10.</strong> <strong>juni</strong> <strong>2011</strong>, <strong>2010v</strong>, <strong>NGHF</strong>, <strong>Morten</strong> Rasmussen<br />
12 Syrebasereaktioner, pH og øvelsen ”syre/basereaktioner for ammoniak og saltsyre”<br />
Redegør med udgangspunkt i bilag 1 og bilag 2 kort for elektronparbindingen og for syrebasedefinitionerne.<br />
Du skal med udgangspunkt i laboratorieudstyret gennemgå øvelsen ”syre/basereaktioner mellem<br />
ammoniak og saltsyre” under hvilken du forklarer fremgangsmetoden og observationerne. I din<br />
gennemgang skal du som minimum inddrage følgende reaktioner:<br />
A: NH3(aq ) NH3(g)<br />
B: NH3(aq)+H2O(l)NH4 + ( )+OH - ( ) Angiv selv tilstandsform<br />
C: NH3( g ) +HCl( g ) NH4Cl( ) Angiv selv tilstandsform<br />
Vurder i hvilket omfang reaktionerne fra forsøget påvirker pH.<br />
Der kan opskrives andre relevante reaktionsskemaer eller relateres til andre forsøg.<br />
Relevante stikord der kan inddrages i samtalen:<br />
- definitioner på syrer og baser<br />
- pH-skalaen<br />
- sur, neutral eller basisk opløsning<br />
- vands syre/base-egenskaber<br />
- H3O + og OH -<br />
- vands ionprodukt<br />
- simple og sammensatte ioner<br />
- tilstandsformer<br />
Bilag 1: (Basen ammoniak)<br />
Bilag 2: (Dannelsen af saltsyre ud fra frie atomer)<br />
Som bilag til eksamensspørgsmålet medfølger kemikalier og apparatur til den relevante øvelse.
<strong>Eksamen</strong>, <strong>Kemi</strong> C, d. 9-<strong>10.</strong> <strong>juni</strong> <strong>2011</strong>, <strong>2010v</strong>, <strong>NGHF</strong>, <strong>Morten</strong> Rasmussen<br />
13 Redox-kemi og øvelsen ”Spændingsrækken”<br />
Du skal med udgangspunkt i reaktionerne på bilag 1 redegøre for redoxteorien og i denne sammenhæng<br />
forklare relevante begreber.<br />
Derefter skal du gennemgå øvelsen ”Spændingsrækken”. Du skal forklare udførslen og observationerne.<br />
Der kan med fordel relateres til bilag 1 eller du kan opskrive andre relevante reaktionsskemaer fra<br />
eksperimentet.<br />
Vurder hvordan resultaterne kan bruges til at opstille spændingsrækken.<br />
Du kan også diskutere, hvilken betydning spændingsrækken har for hvilke metaller, man i naturen kan finde<br />
som rene metaller, og hvilke man i naturen kun kan finde som ionforbindelser.<br />
Der kan relateres til andre forsøg evt. inden for syre-baseteorien.<br />
Relevante stikord der kan inddrages i samtalen:<br />
- ædelmetaller<br />
- reduktion<br />
- oxidation<br />
- grundlæggende regler for redoxreaktioner mellem metaller<br />
- elektronegativitet<br />
- reduktionsmiddel<br />
- oxidationsmiddel<br />
Bilag 1:<br />
Reaktion A: Mg Mg 2+ + 2e -<br />
Reaktion B: Ag + + e - Ag<br />
Reaktion C: Ca + Cu 2+ Ca 2+ + Cu<br />
Bilag 2: (Uddrag af spændingsrækken)<br />
Li, K, Ba, Ca, Na, Mg, Al, Zn, Fe, Sn, Pb, H, Cu, Hg, Ag, Pt, Au<br />
Som bilag til eksamensspørgsmålet medfølger desuden kemikalier og apparatur til den relevante øvelse.