Naturfag - naturligvis - KennethHansen.net
Naturfag - naturligvis - KennethHansen.net
Naturfag - naturligvis - KennethHansen.net
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
12. Syrer og baser<br />
To vigtige grupper af kemiske stoffer er syrerne og baserne.<br />
En syre er et stof, der kan afgive en H + -ion<br />
En base er et stof, der kan optage en H + -ion<br />
Her er nogle eksempler på syrer, sammen med den relevante syrereaktion:<br />
HCl :<br />
+<br />
HCl → H<br />
−<br />
+ Cl<br />
H2SO4 : H2SO4 → HSO 4 + H<br />
31<br />
− +<br />
−<br />
HSO4 : HSO4 SO4 H<br />
2<br />
− − +<br />
→ +<br />
(Vi siger, at H SO<br />
2 4 er en divalent syre, da den kan fraspalte to<br />
hydrogenioner)<br />
− +<br />
H2 O : H2O → OH + H<br />
Her er nogle baser og basereaktioner:<br />
+ +<br />
3 4<br />
NH 3 : NH + H → NH<br />
OH − : OH + H → H2O H2 O : H2O + H → H3O -<br />
+<br />
+ +<br />
Bemærk, at H O<br />
2 både kan reagere som syre og base. Dette kaldes en amfolyt.<br />
Andre amfolytter er NH 3 og ionen HS − .<br />
Generelt gælder, at et kan optræde som syre, hvis det indeholder hydrogen, som er<br />
bundet til oxygen, nitrogen, svovl eller et halogen. Hydrogenatomer bundet til<br />
kulatomer vil normalt aldrig kunne fraspaltes.<br />
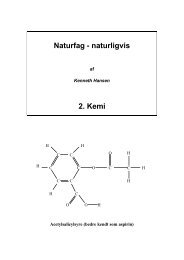
Betragt eksempelvis ethanol:<br />
H<br />
H<br />
H<br />
C C O<br />
H H<br />
Her er det kun det markerede hydrogenatom, der kan fraspaltes og give syreadfærd.<br />
H