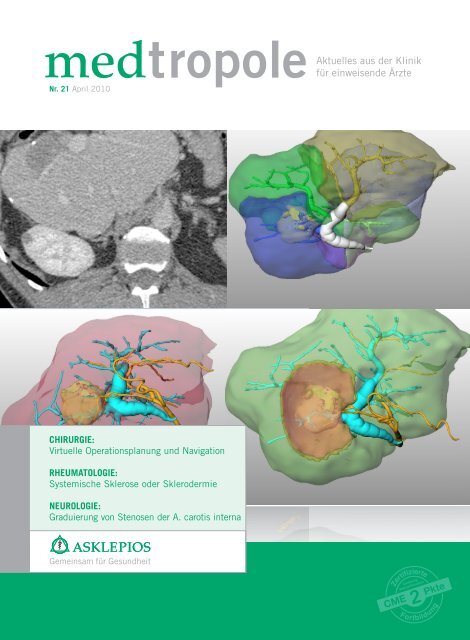
medtropoleAktuelles aus der Klinik für einweisende Ärzte - Asklepios
medtropoleAktuelles aus der Klinik für einweisende Ärzte - Asklepios
medtropoleAktuelles aus der Klinik für einweisende Ärzte - Asklepios
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
medtropole Aktuelles<br />
Nr. 21 April 2010<br />
CHIRURGIE:<br />
Virtuelle Operationsplanung und Navigation<br />
RHEUMATOLOGIE:<br />
Systemische Sklerose o<strong>der</strong> Sklero<strong>der</strong>mie<br />
NEUROLOGIE:<br />
Graduierung von Stenosen <strong>der</strong> A. carotis interna<br />
<strong>aus</strong> <strong>der</strong> <strong>Klinik</strong><br />
<strong>für</strong> <strong>einweisende</strong> <strong>Ärzte</strong>
Impressum<br />
Redaktion<br />
Jens Oliver Bonnet<br />
(verantw.)<br />
Prof. Dr. Dr. Stephan Ahrens<br />
Prof. Dr. Christian Arning<br />
PD Dr. Oliver Detsch<br />
Dr. Birger Dulz<br />
PD Dr. Siegbert Faiss<br />
Dr. Christian Frerker<br />
Dr. Annette Hager<br />
Dr. Susanne Huggett<br />
Prof. Dr. Uwe Kehler<br />
Dr. Jürgen Ma<strong>der</strong>t<br />
Prof. Dr. Jörg Schwarz<br />
PD Dr. Gunther Harald Wiest<br />
Prof. Dr. Gerd Witte<br />
Cornelia Wolf<br />
Her<strong>aus</strong>geber<br />
<strong>Asklepios</strong> <strong>Klinik</strong>en<br />
Hamburg GmbH<br />
Unternehmenskommunikation<br />
Rudi Schmidt V. i. S. d. P.<br />
Rübenkamp 226<br />
22307 Hamburg<br />
Tel. (0 40) 18 18-82 66 36<br />
Fax (0 40) 18 18-82 66 39<br />
E-Mail:<br />
medtropole@asklepios.com<br />
Auflage: 15.000<br />
Erscheinungsweise:<br />
4 x jährlich<br />
ISSN 1863-8341<br />
Editorial<br />
Liebe Leserinnen und Leser,<br />
auf dem Titel erkennen Sie Sie einen Ausschnitt <strong>aus</strong> den aufwendigen Rekonstruktionen,<br />
welche basierend auf CT-Daten <strong>für</strong> die detaillierte und computernavigierten<br />
Operationsplanung und <strong>der</strong>en Navigation bei Leberteilresektion<br />
notwendig sind. Hier bringen Prof. Karl-J. Oldhafer und sein Team mit den<br />
Oberärzten Dr. Stavrou und Dr. Falk neue Expertise nach Hamburg-Barmbek,<br />
die beson<strong>der</strong>s <strong>für</strong> Patienten mit Lebermetastasen o<strong>der</strong> primären Lebertumoren<br />
eine kurative Chance bietet. Diese Rekonstruktionen helfen, die Grenze <strong>der</strong><br />
Resektabilität immer weiter voran zu schieben, und werden durch eine Ko -<br />
operation mit dem Fraunhofer-Institut in Bremen ermöglicht.<br />
Die Demenz ist ein zunehmend häufige Erkrankung und damit – neben dem Schicksal des Einzelnen<br />
und <strong>der</strong> Angehörigen – nicht zuletzt auch ein gesundheitspolitisches Thema, mit dem wir alle<br />
uns <strong>aus</strong>einan<strong>der</strong>setzen müssen. Dr. Wächtler zeigt <strong>aus</strong>führlich auf, dass es sich bei <strong>der</strong> dementiellen<br />
Entwicklung in immerhin knapp zehn Prozent um behebbare Ursachen wie Normaldruckhydro -<br />
cephalus, operable Tumoren o<strong>der</strong> chronische Intoxikation handelt. Die notwendigen Schritte zur<br />
Diagnostik und die <strong>aus</strong> <strong>der</strong> Diagnose abzuleitenden therapeutischen Schritte entnehmen Sie bitte<br />
dem Artikel ab Seite 782.<br />
Dass die Stenose <strong>der</strong> Arteria carotis interna ein häufiges Krankheitsbild ist, ist bekannt. Symptomatische<br />
Carotisstenosen tragen auch ein Risiko einer erneuten Symptomatik mit zum Teil über<br />
zehn Prozent Schlaganfallrisko pro Jahr, weshalb eine Sekundärprophylaxe indiziert ist – ab einem<br />
höhergradigen Stenosebild. Was aber ist eine höhergradige Stenose? Hier wie<strong>der</strong>sprechen sich<br />
häufig die Aussagen von Ultraschall und MR- beziehungsweise CT-Angiographie. Dies ist zu<br />
einem großen Teil <strong>der</strong> unterschiedlichen Messmethodik geschuldet, welche bei <strong>der</strong> Ultraschallmessung<br />
nach ECST Strömungswerte wie auch von Lumen zu dem gesamten Durchmesser ins<br />
Verhältnis setzt – im Gegensatz zu den Kriterien <strong>der</strong> MR- und CT-basierten Auswertung, die das<br />
Verhältnis zu dem Durchmesser des Gefäßes hinter <strong>der</strong> Stenose erfasst. In dieser Ausgabe stellt<br />
Prof. Arning wichtige Än<strong>der</strong>ungen vor, die eine Vergleichbarkeit <strong>der</strong> Verfahren ermöglicht.<br />
Sollte dieses Thema <strong>für</strong> Sie interessant sein, ist <strong>der</strong> Artikel zur Revision und Transferierung <strong>der</strong><br />
DEGUM-Ultraschall-Kriterien in die NASCET-Definition <strong>für</strong> Sie mit den aktuellen Haupt- und<br />
Nebenkriterien ein Muss.<br />
Bitte beachten Sie neben den interessanten Artikeln über Systemische Sklero<strong>der</strong>mie, den kardio -<br />
logisch-interventionellen Verschluss bei Vorhofflimmern, die Spondylodese bei degenerativen Ver -<br />
än<strong>der</strong>ungen <strong>der</strong> HWS und weitere Themen auch die Ankündigung <strong>der</strong> kommenden Einweiser -<br />
befragung auf <strong>der</strong> Rückseite dieses Heftes.<br />
Ich wünsche ich Ihnen ein anregendes Studium <strong>der</strong> Artikel und verbleibe mit besten Grüßen<br />
Ihr<br />
Prof. Dr. Roland Brüning<br />
Ärztlicher Direktor <strong>der</strong> <strong>Asklepios</strong> <strong>Klinik</strong> Barmbek
Inhalt<br />
772 | CHIRURGIE<br />
Virtuelle Operationsplanung<br />
und Navigation in <strong>der</strong> Leberchirurgie<br />
776 | RHEUMATOLOGIE<br />
Komplexe Erkrankung mit vielfältigen Komplikationen:<br />
Systemische Sklerose o<strong>der</strong> Sklero<strong>der</strong>mie<br />
780 | KARDIOLOGIE<br />
Schlaganfallprophylaxe bei Patienten mit Vorhofflimmern:<br />
Perkutaner Verschluss des linken Herzohrs<br />
782 | PSYCHIATRIE<br />
Demenzen im Alter<br />
Häufigkeit, Erscheinungsformen, therapeutische Ansätze<br />
786 | NEUROCHIRURGIE<br />
Ventrale Spondylodese bei degenerativen Erkrankungen <strong>der</strong> Halswirbelsäule<br />
789 | ALLGEMEIN- UND VISZERALCHIRURGIE<br />
Marketing o<strong>der</strong> echter Fortschritt?<br />
Single Port Surgery macht Fortschritte – aber es gibt noch viele Fragezeichen<br />
792 | NEUROLOGIE<br />
Graduierung von Stenosen <strong>der</strong> A. carotis interna<br />
794| PERSONALIA<br />
796 | LABORMEDIZIN<br />
Tuberkulose – ein Update<br />
Aktuelle Strategien <strong>für</strong> Diagnostik und Therapie<br />
800 | KLINIKBEWERTUNG IN DER VIERTEN DIMENSION<br />
Einweiserzufriedenheit –<br />
ein wichtiger Indikator <strong>für</strong> die Qualität einer <strong>Klinik</strong><br />
S. 772<br />
S. 786<br />
S. 796
Medtropole | Ausgabe 21 | April 2010<br />
Virtuelle Operationsplanung<br />
und Navigation in <strong>der</strong> Leberchirurgie<br />
Prof. Dr. Karl J. Oldhafer, Dr. Gregor A. Stavrou<br />
Bei Tumorerkrankungen <strong>der</strong> Leber stellt die Leberresektion auch heute noch die einzige Therapie mit kurativer<br />
Intention dar. Die in den vergangenen 20 Jahren erzielten enormen Fortschritte in Operationstechnik und<br />
perioperativem Management ermöglichen, die Leberresektion heute in spezialisierten Zentren mit akzeptabler<br />
Morbidität und nahezu ohne Mortalität durchzuführen. [1] Allerdings steigt das Risiko <strong>für</strong> Komplikationen und ein<br />
postoperatives Leberversagen mit <strong>der</strong> Komplexität des Eingriffs und dem Resektions<strong>aus</strong>maß deutlich. [2] Die exakte<br />
Planung des Eingriffs ist daher <strong>für</strong> das Ergebnis ebenso wichtig wie die Erfahrung des Operateurs. Aus diesem<br />
Grund hat die computerassistierte Resektionsplanung in unserem Zentrum <strong>für</strong> Hepatobiliäre Chirurgie einen<br />
großen Stellenwert.<br />
Die <strong>für</strong> eine <strong>aus</strong>reichende postoperative<br />
Leberfunktion notwendige kritische Parenchymmenge<br />
ist von vielen Faktoren abhängig<br />
und nur schwer zu bestimmen – eine<br />
kritische Grenze von 25 Prozent des funktionellen<br />
Leber<strong>aus</strong>gangsvolumens sollte<br />
bei nicht vorgeschädigter Leber aber nicht<br />
unterschritten werden. Dabei sind <strong>für</strong> die<br />
<strong>aus</strong>reichende Funktion <strong>der</strong> Restleber <strong>der</strong>en<br />
Vaskularisation und biliäre Drainage entscheidend.<br />
Die von Couinad beschriebene<br />
Aufteilung <strong>der</strong> Leber in acht Segmente mit<br />
regelhafter Aufteilung <strong>der</strong> intrahepatischen<br />
Gefäßversorgung erwies sich in anatomischen<br />
und radiologischen Studien als idealisierte<br />
Darstellung. Tatsächlich besteht<br />
eine große Variationsbreite im Hinblick auf<br />
die Größe <strong>der</strong> einzelnen Segmente und<br />
<strong>der</strong>en Vaskularisation, [3] was die Abschätzung<br />
<strong>der</strong> funktionellen Reservekapazität<br />
insbeson<strong>der</strong>e bei <strong>aus</strong>gedehnten Resektionen<br />
erschwert.<br />
772<br />
Virtuelle Operationsplanung<br />
Die zweidimensionale CT- und MRT-<br />
Diagnostik kann zwar Tumoren und ihre<br />
Lagebeziehung zu Gefäßen visualisieren<br />
und auch das Volumen <strong>der</strong> Restleber<br />
abschätzen, doch eine Volumetrie <strong>der</strong> einzelnen<br />
Gefäßterritorien und somit eine<br />
Abschätzung <strong>der</strong> genauen funktionellen<br />
Reservekapazität ist damit nicht möglich.<br />
Dies ist insofern bedeutsam, da anhand<br />
<strong>der</strong> 2D-Daten nicht <strong>der</strong> Einfluss des notwendigen<br />
Sicherheitsabstandes beziehungsweise<br />
<strong>der</strong> individuellen Operationsstrategie<br />
auf die Vaskularisation visualisert<br />
werden kann. Das führt zu einem deutlich<br />
erhöhten Risiko <strong>für</strong> min<strong>der</strong>durchblutete<br />
o<strong>der</strong> schlecht drainierte Bezirke <strong>der</strong> Restleber<br />
und damit auch zu einer erhöhten Rate<br />
an Infektionskomplikationen und Leberversagen.<br />
Die dreidimensionale Operationsplanung<br />
des vom Fraunhofer-MeVis Institut entwickelten<br />
Software-Tools HepaVision ermöglichte<br />
einen entscheidenden Schritt: [4]<br />
Heute lässt sich mit den weiterentwickelten<br />
Systemen LiverAnalyzer und LiverExplorer<br />
ein patientenindividueller Resektions-<br />
vorschlag ermitteln, <strong>der</strong> die anatomischen<br />
Gegebenheiten respektiert und das perioperative<br />
Risiko des Patienten minimiert.<br />
Grundlage <strong>der</strong> Planung ist ein hochauflösendes,<br />
mehrphasiges Multi-Slice-CT <strong>der</strong><br />
Leber. Dar<strong>aus</strong> werden sämtliche intrahepatischen<br />
Strukturen (Tumor, Arterie, Pforta<strong>der</strong><br />
Lebervenen und wenn nötig auch<br />
Gallenwege) segmentiert, in einer hierarchischen<br />
Struktur registriert und dreidimensional<br />
rekonstruiert (Abb. 1, Verarbeitungsschema).<br />
So lässt sich das <strong>für</strong> jeden<br />
Gefäßast abhängige Territorium visualisieren.<br />
Dies ermöglicht eine virtuelle OP-Planung,<br />
in <strong>der</strong> die Schnittführung nicht nur<br />
die individuelle Leberanatomie, son<strong>der</strong>n<br />
auch die topographische Beziehung <strong>der</strong><br />
Tumore zu den vaskulären Strukturen und<br />
damit den gefährdeten Gefäßterritorien<br />
berücksichtigt. Der Chirurg kann den Einfluss<br />
unterschiedlicher Resektionsebenen<br />
auf das Restlebervolumen simulieren und<br />
damit die verbleibende vaskuläre Versorgung<br />
und Drainage genau berechnen. So<br />
wird die optimale Schnittführung ermittelt,<br />
die den onkologischen Kriterien genügt<br />
und eine möglichst große funktionelle<br />
Reservekapazität erlaubt (Abb. 2). Ist zu
Abb. 1: Verarbeitungsschema <strong>der</strong> MeVis-Software – die Gefäßanatomie wird <strong>aus</strong> den<br />
2D-CT-Daten her<strong>aus</strong>segmentiert und die resultierenden Gefäßterritorien <strong>der</strong> einzelnen<br />
Gefäßäste werden berechnet; anhand <strong>der</strong> 3D-Daten wird ein Resektionsvorschlag<br />
ermittelt<br />
diesem Zeitpunkt bereits die kritische<br />
Grenze an Restlebervolumen erreicht, lässt<br />
sich die Reservekapazität durch verschiedene<br />
Strategien wie die Pforta<strong>der</strong>embolisation<br />
o<strong>der</strong> das zweizeitige Vorgehen steigern<br />
(Abb. 3).<br />
Ein weiterer Aspekt betrifft die hepatische<br />
Drainage. Das lebervenöse System ist deutlich<br />
variabler als das portalvenöse System.<br />
Die 3D-Visualisierung ermöglicht durch<br />
Analyse <strong>der</strong> venösen Risikoterritorien eine<br />
wesentlich bessere Abschätzung <strong>der</strong> venösen<br />
Drainage als die konventionelle CT-<br />
Planung. Bereits bei <strong>der</strong> Planung kann so<br />
ein gefährdetes Areal identifiziert werden –<br />
das Risiko lässt sich intraoperativ durch<br />
eine entsprechende venöse Rekonstruktion<br />
minimieren. So wird gegebenenfalls ein<br />
gefährdetes Areal mitreseziert, um spätere<br />
Komplikationen, beispielsweise durch ein<br />
gestautes Areal, zu vermeiden. Kann auf<br />
die Parenchymreserve nicht verzichtet werden,<br />
ist so eine gezielte venöse Rekonstruktion,<br />
beispielsweise durch ein Interponat,<br />
möglich (Abb. 4). Abb. 4 zeigt einen<br />
Fall in dem ein großer Teil <strong>der</strong> Restleber<br />
durch eine kräftige Segment-III-Vene drainiert<br />
wird, <strong>der</strong>en Stamm aber in <strong>der</strong> Resek-<br />
tionslinie liegt. Durch venöse Rekonstruktion<br />
des Gefäßes mit einem V. Saphena<br />
Interponat auf die V. Cava konnte eine<br />
Min<strong>der</strong>durchblutung vermieden werden,<br />
so dass eine <strong>aus</strong>reichende Reservekapazität<br />
resultierte.<br />
Der Vorteil <strong>der</strong> 3D-Planung wird beson<strong>der</strong>s<br />
bei erweiterten Hemihepatektomien links<br />
deutlich, bei denen in <strong>der</strong> CT-Volumetrie<br />
meist <strong>aus</strong>reichend Restparenchym zu verbleiben<br />
scheint, es aber vermehrt zu Problemen<br />
<strong>der</strong> venösen Drainage kommt –<br />
was unter an<strong>der</strong>em mit <strong>der</strong> komplexen<br />
und variablen Anatomie <strong>der</strong> mittleren<br />
Lebervene zusammenhängen könnte. Die<br />
3D-Analyse sorgt bei diesen komplexen<br />
Resektionen <strong>für</strong> eine verbesserte Sicherheit<br />
<strong>der</strong> Operationsplanung (Abb. 5). Auch bei<br />
Rezidiveingriffen ist die Analyse sehr hilfreich,<br />
da in diesen Fällen nach durch<strong>aus</strong><br />
komplexen Voroperationen, bedingt durch<br />
die Hypertrophie <strong>der</strong> Restleber, keine typische<br />
Anatomie mehr vorhanden ist, so dass<br />
eine Operationsplanung selbst <strong>für</strong> lokale<br />
Resektionen schwierig sein kann (Abb. 6).<br />
Eine Analyse <strong>der</strong> eigenen Daten unserer<br />
prospektiven Datenbank von 2005 – 2007<br />
Chirurgie<br />
identifizierte 137 Patienten die sich zur<br />
Klärung <strong>der</strong> Operabilität vorstellten. Eine<br />
Resektion wurde bei 108 Patienten durchgeführt.<br />
In 34 Fällen wurde die MeVis Analyse<br />
benutzt (m = 20, w = 14, Altersdurchschnitt<br />
64 Jahre) – kolorektale Metastasen<br />
wurden dabei in 24, primäre Tumore in<br />
zehn Fällen behandelt, bei acht Resektionen<br />
handelte es sich um einen Zweiteingriff.<br />
Das Operationsspektrum beinhaltete Segmentektomien<br />
(13), Hemihepatektomien<br />
(4), erweiterte Resektionen (6), Mesohepatektomie<br />
(1). Bei allen Patienten stellte die<br />
Operationsplanung <strong>für</strong> den Operateur<br />
einen Sicherheitsgewinn dar. In drei Fällen<br />
än<strong>der</strong>te sich die Strategie nach <strong>der</strong> Analyse<br />
(Mesohe patektomie > inoperabel [1],<br />
inoperabel > erweiterte Rechtsresektion<br />
[1]/ Mesohe patektomie [1]). In diesen Fällen<br />
war die Tumorlokalisation im medianen<br />
Sektor (2) sowie rechten Lappen und<br />
medianem Sektor (1). Die Strategie konnte<br />
in zwei Fällen nicht verfolgt werden<br />
(Rechtshepatektomie > erweiterte Rechtshepatektomie,<br />
Rechtshepatektomie > Anteriore<br />
Segmentektomie. Postoperativ trat bei<br />
keinem unserer Pa tienten eine klinisch<br />
relevante Leberinsuffizienz auf.<br />
773
Medtropole | Ausgabe 21 | April 2010<br />
Abb. 2: Patient mit einem großen Tumor <strong>der</strong> rechten Leber. Lagebeziehung des Tumors zu Gefäßen und Volumina<br />
werden ersichtlich. Durch Berechnung <strong>der</strong> Gefäßterritorien <strong>der</strong> Vaskularisation kann in diesem Fall eine anatomische<br />
Gefäßvariante <strong>aus</strong>genutzt werden. Wird eine Trisegmentektomie durchgeführt, ist die OP nicht möglich. Bei <strong>der</strong><br />
atypischen Resektion kann auf Grund <strong>der</strong> Drainage über eine posteriore rechte Lebervene mehr Parenchym erhalten<br />
werden. Die Patientin konnte erfolgreich primär operiert werden.<br />
Abb. 3: Casus einer Patientin, bei <strong>der</strong> eine Trisegmentektomie rechts wegen Klatskintumors notwendig ist. In <strong>der</strong> 3D-<br />
Aufarbeitung zeigt sich ein <strong>für</strong> die OP zu kleiner linker Rest-Leberlappen, nach portaler Embolisationsbehandlung<br />
zur Wachstumsstimulation reichen Restparenchymgröße und funktionelle Reservekapazität <strong>aus</strong>, so dass die Patientin<br />
erfolgreich operiert werden konnte.<br />
Navigierte Leberchirurgie<br />
Trotz <strong>der</strong> großen Fortschritte bleibt die<br />
Um setzung des virtuellen Plans in <strong>der</strong><br />
Weichgewebschirurgie nach wie vor<br />
schwierig, denn im Gegensatz zu an<strong>der</strong>en<br />
chirurgischen Disziplinen ist die intraoperative<br />
Verformung des Organs nur schwer<br />
vorhersehbar. Mittlerweile wurde ein stereotaktisches<br />
Navigationssystem <strong>für</strong> die<br />
Leberchirurgie entwickelt, das sich die<br />
Fortschritte <strong>der</strong> 3D-Operationsplanung<br />
zunutze macht. Die durch die Segmentierung<br />
<strong>der</strong> Gefäßanatomie in den Planungsdaten<br />
entstandene 3D-Gefäßlandkarte lässt<br />
sich durch einen stereotaktisch navigierten<br />
intraoperativen Ultraschallkopf mit dem<br />
774<br />
Lebervolumen LLebervolumen<br />
(LV)�2670ml (LVV)<br />
��<br />
��<br />
�2670ml<br />
��<br />
��<br />
��<br />
��<br />
��<br />
��<br />
��<br />
��<br />
��<br />
��<br />
��<br />
��<br />
��<br />
��<br />
�<br />
Tumorvolumen� TTuumorvolumen��<br />
��<br />
��<br />
��<br />
��<br />
��<br />
��<br />
��<br />
��<br />
��<br />
��<br />
��<br />
��<br />
��<br />
��<br />
��<br />
��<br />
960ml<br />
Funktionelles FFunktionelles<br />
LV� LV V��<br />
��<br />
��<br />
��<br />
��<br />
��<br />
��<br />
��<br />
��<br />
��<br />
��<br />
��<br />
��<br />
��<br />
��<br />
��<br />
��<br />
1710ml<br />
Trisegmentektomie<br />
T Trisegmentektomie<br />
Resektat�� RResektat��<br />
�� �� �� �� �� �� �� �� �� �� �� �� �� �� �� �� �� �� �� �� �� �� �� �� �� �� �� �� �� �� �� �� �� 2350ml<br />
Restparenchym� RRestparenchym��<br />
��<br />
��<br />
��<br />
��<br />
��<br />
��<br />
��<br />
��<br />
��<br />
��<br />
��<br />
��<br />
��<br />
��<br />
��<br />
��<br />
310ml<br />
17,8% 117,8%<br />
des funktionellen LV LVV<br />
PVE<br />
Atypische Atypiscche<br />
Resektion<br />
bei Posteriorer<br />
RLV V möglich (Pfeil)<br />
Resektat�� Resektat��<br />
�� �� �� �� �� �� �� �� �� �� �� �� �� �� �� �� �� �� �� �� �� �� �� �� �� �� �� �� �� �� �� �� �� 1600ml<br />
Restparenchym� Restpareenchym��<br />
��<br />
��<br />
��<br />
��<br />
��<br />
��<br />
��<br />
��<br />
��<br />
��<br />
��<br />
��<br />
��<br />
��<br />
��<br />
��<br />
1000ml<br />
37% des dess<br />
gesamten LV V<br />
58% des dess<br />
funktionellen LV V<br />
Situs abgleichen. Über einen stereotaktisch<br />
navigierten Ultraschalldissektor kann nun<br />
eine schonende Resektion auf <strong>der</strong> vorher<br />
am Computer geplanten optimierten<br />
Resektionslinie erfolgen, um <strong>für</strong> den<br />
Patienten ein bestmögliches Ergebnis zu<br />
erreichen. Vorteile bietet die Navigation<br />
vor allem bei komplexen Fragestellungen.<br />
Technisch anspruchsvolle Resektionen wie<br />
zentrale o<strong>der</strong> erweiterte Hemihepatektomien<br />
eignen sich ebenso wie Wie<strong>der</strong>holungseingriffe<br />
an voroperierten Patienten<br />
<strong>für</strong> eine navigierte Resektion.<br />
Eine große Her<strong>aus</strong>for<strong>der</strong>ung sind aktuell<br />
Patienten mit kolorektalen Lebermetastasen,<br />
die so gut auf eine Chemotherapie<br />
Abb. 4: Patient mit einem großen Tumor – aufgrund <strong>der</strong><br />
außergewöhnlich prominenten Segment III-Vene ist eine<br />
reduzierte Drainage im Bereich <strong>der</strong> Restleber zu erwarten,<br />
die ein Leberversagen verursachen könnte. Die Vene<br />
wird intraoperativ dargestellt und durch ein Gefäßinterponat<br />
rekonstruiert. Postoperativ trat keine Leberinsuffizienz<br />
auf.<br />
angesprochen haben, dass sie in <strong>der</strong> Bildgebung<br />
nicht mehr nachweisbar sind.<br />
Diese sogenannte „Complete Clinical<br />
Response“ bedeutet aber <strong>für</strong> die Patienten<br />
keine Heilung, die Datenlage zeigt eine<br />
hohe Rezidivwahrscheinlichkeit innerhalb<br />
von zehn Monaten. [5] Die Patienten sollten<br />
in dieser Phase bestmöglicher Tumorkontrolle<br />
operiert werden, was <strong>für</strong> den Chirurgen<br />
aber ein großes technisches Dilemma<br />
darstellt: Bisher war es nicht möglich,<br />
einen nicht visualisierbaren, eventuell<br />
intraoperativ nicht tastbaren Herd zu entfernen.<br />
Die mo<strong>der</strong>ne computerassistierte<br />
Chirurgie kann auch dieses Dilemma lösen,<br />
indem sie die CT-Daten vor und nach <strong>der</strong><br />
Chemotherapie fusioniert und dar<strong>aus</strong><br />
einen Resektionsvorschlag ermit telt, <strong>der</strong><br />
dann durch das Navigationssystem um -<br />
gesetzt wird (Abb. 7 und 8). Im eigenen<br />
Kollektiv gelang uns so die Resektion<br />
eines nicht sichtbaren und auch intra -<br />
operativ nicht visualisierbaren Tumors in<br />
Segment IV. [6]<br />
Fazit<br />
Die virtuelle Operationsplanung ist insbeson<strong>der</strong>e<br />
bei komplexen Leberresektionen<br />
in unserem klinischen Vorgehen fest etabliert.<br />
Auch in <strong>der</strong> navigierten Leberchirurgie<br />
werden weiter Fortschritte erzielt, die es
Abb. 5: Planungsdaten bei einem Patienten, <strong>der</strong> eine<br />
erweiterte Hemihepatektomie links benötigt. Diese ist<br />
auf Grund <strong>der</strong> fehlenden anatomischen Referenzpunkte<br />
äußerst komplex, weshalb die genaue Planung und<br />
Identifizierung <strong>der</strong> Tumorlage in Bezug zur Vaskularisation<br />
<strong>der</strong> Leber und <strong>der</strong> Resektionsfläche entscheidend ist.<br />
uns in Zukunft ermöglichen, die Patienten<br />
noch sicherer zu behandeln. Insbeson<strong>der</strong>e<br />
auf Grund <strong>der</strong> engen Zusammenarbeit mit<br />
dem Fraunhofer MeVis Institut bei <strong>der</strong><br />
Weiterentwicklung <strong>der</strong> virtuellen Operationsplanung<br />
und des Navigationssystems<br />
können wir unseren Patienten in <strong>der</strong> <strong>Asklepios</strong><br />
<strong>Klinik</strong> Barmbek eine chirurgische Be -<br />
handlung auf mo<strong>der</strong>nstem und technisch<br />
anspruchsvollsten Niveau ermöglichen.<br />
Die Patienten können sich ambulant über<br />
die eigens eingerichtete Leberchirurgische<br />
Sprechstunde vorstellen o<strong>der</strong> Kontakt über<br />
die 24h Service Hotline aufnehmen.<br />
Literatur<br />
[1] Belghiti J, Hiramatsu K, Benoist S, Massault P, Sauvanet<br />
A, Farges O. Seven hundred forty-seven hepatectomies in<br />
the 1990s: an update to evaluate the actual risk of liver<br />
resection. J Am Coll Surg 2000; 191(1): 38-46.<br />
[2] Lang H, Sotiropoulos GC, Brokalaki EI, Radtke A, Frilling<br />
A, Molmenti EP, Malago M, Broelsch CE. Left hepatic<br />
trisectionectomy for hepatobiliary malignancies. J Am Coll<br />
Surg 2006; 203(3): 311-21.<br />
[3] Abdalla EK, Denys A, Chevalier P, Nemr RA, Vauthey<br />
JN. Total and segmental liver volume variations: implications<br />
for liver surgery. Surgery 2004; 135(4): 404-10.<br />
[4] Oldhafer KJ, Hogemann D, Stamm G, Raab R, Peitgen<br />
HO, Galanski M. (3-dimensional [3-D] visualization of the<br />
liver for planning extensive liver resections). Chirurg 1999;<br />
70(3): 233-8.<br />
Chirurgie<br />
Abb. 6 (oben): Fall eines Patienten mit 4. Rezidiv einer Metastase (bislang Langzeitüberleben<strong>der</strong> 11 Jahre nach ED des<br />
Tumorleidens). Die ursprüngliche Anatomie ist nach Rechts- und Linksresektionen nicht mehr erkennbar, die Hauptperfusion<br />
regelrecht über den Hilus aufgespannt. Bei <strong>der</strong> Resektion muss <strong>der</strong> Pforta<strong>der</strong>hauptast rekonstruiert werden,<br />
da dieser sehr nah am Tumor liegt.<br />
Abb. 7/8 (links/unten): Patient mit einer „Complete Clinical Response“ seiner kolorektalen Metastasen in <strong>der</strong> Bildgebung<br />
nach Chemotherapie. Durch Fusion <strong>der</strong> CT-Daten vor und nach Chemotherapie kann die Tumorlage identifiziert<br />
werden. Aus diesen Daten wird ein Resektionsvorschlag erstellt, <strong>der</strong> dann durch Einsatz des Navigationssystems<br />
umgesetzt wird. Intraoperativ war <strong>der</strong> Tumor we<strong>der</strong> sicht- noch tastbar. Die Resektion wurde anhand <strong>der</strong> 3D-Daten<br />
navigiert durchgeführt – im Resektat fanden sich vitale Tumorzellen.<br />
Kontakt<br />
Prof. Dr. Karl J. Oldhafer,<br />
Dr. Gregor A. Stavrou<br />
I. Chirurgische Abteilung – Allgemein- und<br />
Viszeralchirurgie / Darmzentrum (zert.)<br />
<strong>Asklepios</strong> <strong>Klinik</strong> Barmbek<br />
Rübenkamp 220, 22291 Hamburg<br />
Tel. (0 40) 18 18-82 28 11<br />
Fax (0 40) 18 18-82 28 19<br />
E-Mail: k.oldhafer@asklepios.com<br />
Leberchirurgische Sprechstunde<br />
Mi. 13 – 16 Uhr, Terminabsprache:<br />
Tel. (0 40) 18 18-82 22 21<br />
E-Mail: g.stavrou@asklepios.com<br />
24-h-Service Hotline Leberchirurgie<br />
Tel. (01 75) 765 54 64<br />
[5] Benoist S, Brouquet A, Penna C, Julie C, El Hajjam M,<br />
Chagnon S, Mitry E, Rougier P, Nordlinger B. Complete<br />
response of colorectal liver metastases after chemotherapy:<br />
does it mean cure? J Clin Oncol 2006; 24(24): 3939-45.<br />
[6] Oldhafer KJ, Stavrou GA, Pr<strong>aus</strong>e G, Peitgen HO, Lueth<br />
TC, Weber S. How to operate a liver tumor you cannot see.<br />
Langenbeck’s archives of surgery / Deutsche Gesellschaft<br />
fur Chirurgie 2009; 394(3): 489-94.<br />
775
Medtropole | Ausgabe 21 | April 2010<br />
Komplexe Erkrankung mit vielfältigen Komplikationen:<br />
Systemische Sklerose o<strong>der</strong> Sklero<strong>der</strong>mie<br />
Dr. Keihan Ahmadi-Simab<br />
Die systemische Sklerose (SSc, Sklero<strong>der</strong>mie) zählt als „entzündlich-rheumatische Systemerkrankung“ zur<br />
Gruppe <strong>der</strong> Kollagenosen. Sie ist eine Erkrankung des Bindegewebes, die durch eine Akkumulation von Proteinen<br />
<strong>der</strong> Extrazellularmatrix in <strong>der</strong> Haut und in inneren Organen gekennzeichnet ist. Klinische Ausprägung und<br />
Verlauf <strong>der</strong> SSc zeigen eine große Variabilität und sind Ausdruck <strong>der</strong> pathogenetischen Heterogenität.<br />
Epidemiologie<br />
Die Inzidenz <strong>der</strong> systemischen Sklerose<br />
liegt bei 1,9 – 5 pro 100.000 Einwohner mit<br />
einer Zunahme in den vergangenen Jahrzehnten.<br />
Die Prävalenz wird mit 5 – 20 pro<br />
100.000 Einwohner angegeben. Die Frequenz<br />
<strong>der</strong> SSc nimmt mit steigendem Lebensalter<br />
zu. Das weibliche Geschlecht überwiegt,<br />
beson<strong>der</strong>s im jüngeren Erwachsenenalter<br />
(Frauen : Männern 3 – 9:1). Das Durchschnittsalter<br />
bei Erstdiagnose <strong>der</strong> SSc liegt<br />
bei 50 Jahren, die Mortalität bei 2 – 4 pro<br />
einer Million Einwohner.<br />
Klassifikation<br />
Die internationale Klassifikation <strong>der</strong> SSc<br />
unterscheidet zwei Grundtypen:<br />
1. Limitierte Form mit Hautbeteiligung<br />
distal <strong>der</strong> Handgelenke und des<br />
Gesichts bei fehlen<strong>der</strong> o<strong>der</strong> späterer<br />
Beteiligung <strong>der</strong> inneren Organe. Eine<br />
Son<strong>der</strong>form <strong>der</strong> limitierten SSc ist das<br />
so genannte CREST-Syndrom, das folgende<br />
Symptome umfasst: Calcinosis<br />
cutis, Raynaud-Syndrom, Ösophagusbeteiligung,<br />
Sklerodaktylie und Tele -<br />
angiektasien (Abb. 1).<br />
776<br />
2. Diffuse Form mit Hautfibrose proximal<br />
<strong>der</strong> Handgelenke und auch des<br />
Stamms mit früher Beteiligung <strong>der</strong><br />
inneren Organe. Etwa 20 Prozent <strong>der</strong><br />
Patienten werden dem diffusen Typ<br />
zugeordnet.<br />
Pathogenese<br />
Die exakten Mechanismen, die zur Entstehung<br />
<strong>der</strong> SSc führen und ihr Fortschreiten<br />
begünstigen, sind noch weitgehend unklar.<br />
Typische histopathologische Merkmale <strong>der</strong><br />
SSc sind die markante Akkumulation von<br />
Proteinen <strong>der</strong> Extrazellulärmatrix. Hinzu<br />
kommen morphologische Verän<strong>der</strong>ungen<br />
<strong>der</strong> kleinen Gefäße sowie Störungen <strong>der</strong><br />
zellulären und humoralen Immunantwort<br />
mit dem Auftreten von verschiedenen,<br />
zum Teil krankheitsspezifischen Autoantikörpern.<br />
[1] Diskutiert wird eine mögliche<br />
Veranlagung. Auch externe Faktoren könnten<br />
in Frage kommen. Einmal in Gang<br />
gesetzt, sind an <strong>der</strong> Entwicklung <strong>der</strong> systemischen<br />
Sklerose im Wesentlichen drei verschiedene<br />
Zellsysteme beteiligt: Immunzellen,<br />
Endothel-Zellen und Fibroblasten.<br />
Klinisches Erscheinungsbild<br />
Hautbeteiligung<br />
Die Haut ist bei allen Varianten früher o<strong>der</strong><br />
später mehr o<strong>der</strong> weniger beteiligt. Die SSc<br />
beginnt fast immer an den Händen. Die<br />
Hautsklerose verläuft in drei abgrenzbaren<br />
Stadien:<br />
1. Ödematöse Phase: In <strong>der</strong> initialen ödematösen<br />
Phase bemerken die Patienten<br />
straffe o<strong>der</strong> aufgedunsene Finger, im<br />
Verlauf meist mit Entwicklung einer<br />
ödematösen und schmerzlosen Schwellung.<br />
Zu den Ursachen des Ödems<br />
zählen erhöhte Ablagerung von Matrixbestandteilen<br />
des extrazellulären Bindegewebes,<br />
Entzündung und mikrovaskuläre<br />
Schäden mit flüssigen<br />
Extravasaten (Abb. 2).<br />
2. Indurative Phase: Die Haut wird<br />
zunehmend glänzend, straff und prall,<br />
haftet stark an <strong>der</strong> Subkutis an. Während<br />
sich die Dermis in dieser Phase<br />
durch Kollagenablagerung verdickt,<br />
wird die Epi<strong>der</strong>mis zunehmend dünner.<br />
Durch Sklerosierung <strong>der</strong> Gesichtshaut<br />
(Abb. 3) wird das Gesicht „kleiner“,<br />
die Nase spitzer, die Haut ist
Organ Häufigkeit %<br />
Hautbeteiligung 100<br />
Raynaud-Syndrom 99<br />
Muskuloskeletales System 30 – 60<br />
Gastrointestinaltrakt 10 – 90<br />
Lunge 21 – 80<br />
Herz 12 – 23<br />
Niere 9 – 16<br />
Sicca-Syndrom 30 – 40<br />
Urogenitaltrakt 60 – 80<br />
Nervensystem 4 – 7<br />
Pulmonalarterielle Hypertonie 15 – 19<br />
Tabelle 1: Organbeteiligung bei Patienten mit systemischer<br />
Sklerose<br />
straff und glänzt, die Wangen sind faltenlos<br />
und die Lippen werden schmaler.<br />
Die periorale subkutane Fibrose und<br />
die Beteiligung <strong>der</strong> temporomandibulären<br />
Gelenke behin<strong>der</strong>n die Mundöffnung<br />
(Mikrostomie) und im weiteren<br />
Verlauf kommt es zu einer verstärkten<br />
perioralen, radiären Fältelung (Tabakbeutelmund<br />
– Abb. 4).<br />
3. Atrophische Phase: In <strong>der</strong> meist erst<br />
nach mehreren Jahren folgenden atrophischen<br />
Phase wird die verhärtete<br />
Dermis wie<strong>der</strong> weicher und schließlich<br />
wesentlich dünner als die normale Haut.<br />
Extrakutane Manifestationen<br />
Als Systemerkrankung kann die SSc jedes<br />
Organsystem betreffen (Tab. 1) [2] :<br />
Sicca-Syndrom: Die Beteiligung <strong>der</strong> Speicheldrüsen<br />
führt in etwa 30 Prozent <strong>der</strong><br />
Fälle zum Sicca-Syndrom mit Xerophthalmie<br />
und Xerostomie.<br />
Gastrointestinaltrakt: Es kommt zur Atrophie<br />
und Fibrose <strong>der</strong> glatten Muskulatur.<br />
Dar<strong>aus</strong> resultieren klinisch ösophageale<br />
Dysmotilität, Refluxbeschwerden, peptische<br />
Ösophagitis, Barrett-Ösophagus,<br />
Strikturen <strong>der</strong> Speiseröhre und atonische<br />
Erweiterungen und Dyskinesien des Dünnund<br />
Dickdarmes.<br />
Lunge: Die Lunge gehört mit einem Anteil<br />
von 70 Prozent aller Organbeteiligungen<br />
zu den am häufigsten betroffenen Organen.<br />
Klinisch erscheinen die Verän<strong>der</strong>ungen als<br />
Lungenfibrose (Abb. 5) und Alveolitis.<br />
Die Lungenmanifestationen mit Pulmonalarterieller<br />
Hypertonie sind <strong>für</strong> mit <strong>der</strong> SSc<br />
assoziierte Todesfälle hauptverantwortlich.<br />
Niere: Die Niere ist mit <strong>der</strong> Ausbildung<br />
von Gefäßfibrosen <strong>der</strong> Interlobärarterien<br />
und Arteriolen, Mikroinfarkten, Tubulusatrophien<br />
und Schrumpfnieren beteiligt.<br />
Aufgrund des Einsatzes von ACE-Hemmern<br />
sank die Sterblichkeit an <strong>der</strong> Nierenbeteiligung<br />
(renale Krise) deutlich.<br />
Herz: Mögliche Manifestationen sind Myokardfibrose,<br />
Perikarditis, Störungen des<br />
Reizleitungssystems und Arrhythmien, Cor<br />
pulmonale sowie Herzinsuffizienz.<br />
Muskuloskeletales System: Am Skelett<br />
und an den Muskeln tritt die SSc in Form<br />
von Arthritis, Tendovaginitis, Synovitis,<br />
Myositis und Myopathie in Erscheinung.<br />
Rheumatologie<br />
Abb. 1: Teleangiektasien Abb. 2: Dermatosklerose <strong>der</strong> Hand in ödematöser Phase<br />
Nervensystem: Eine Beteiligung des Nervensystems<br />
wird sowohl im Bereich <strong>der</strong><br />
kranialen Nerven, hier beson<strong>der</strong>s als Trigeminusneuralgie,<br />
als auch an den peripheren<br />
Nerven als periphere Polyneuropathie<br />
gesehen.<br />
Urogenitaltrakt: Bei 81 Prozent <strong>der</strong> männlichen<br />
Patienten findet sich erektile Dysfunktion,<br />
56 Prozent <strong>der</strong> Frauen leiden an<br />
sexuellen Funktionsstörungen.<br />
Vaskulopathien: Eine Gemeinsamkeit <strong>der</strong><br />
vielgestaltigen Ausprägungen <strong>der</strong> systemischen<br />
Sklerose scheint letztlich eine progrediente<br />
Vaskulopathie zu sein:<br />
Pulmonal-arterielle Hypertonie (PAH)<br />
Die PAH betrifft etwa 15 Prozent <strong>der</strong><br />
Patienten mit systemischer Sklerose und ist<br />
trotz <strong>der</strong> verfügbaren Therapien noch<br />
immer mit einer hohen Mortalität verbunden.<br />
Die Prognose ist nochmals schlechter<br />
als bei Patienten mit idiopathischer pulmonal-arterieller<br />
Hypertonie. [3] Daher sollten<br />
alle Patienten mit SSc regelmäßig, mindestens<br />
ein Mal im Jahr, mittels Echokardiographie<br />
auf Frühformen einer PAH untersucht<br />
werden.<br />
777
Medtropole | Ausgabe 21 | April 2010<br />
Abb. 3: Sklerosierung <strong>der</strong> Gesichtshaut Abb. 4: Tabakbeutelmund<br />
Raynaud-Syndrom/digitale Ulzerationen<br />
Das Raynaud-Syndrom (Abb. 6) ist ein<br />
„Frühsymptom“, das bei nahezu allen SSc-<br />
Patienten auftritt und häufig viele Jahre<br />
zuvor erstmals beobachtet wurde. Es ist<br />
durch anfallsweise auftretende Vasospasmen<br />
<strong>der</strong> Fingerarterien gekennzeichnet.<br />
Der initialen Zyanose folgt eine Weißverfärbung<br />
und schließlich eine postischämische<br />
Hyperämie mit Rötung <strong>der</strong> Finger.<br />
Aufgrund <strong>der</strong> Min<strong>der</strong>durchblutung können<br />
sich an Finger- und Zehenkuppen<br />
digitale Nekrosen (Abb. 7) bilden. Digitale<br />
Ulzerationen sind schwer heilende,<br />
schmerzhafte Geschwüre an den Fingern,<br />
die bei etwa 50 Prozent aller Patienten mit<br />
SSc als Komplikation auftreten können. [4]<br />
Diagnostik<br />
Bei den meisten Patienten kommt es frühzeitig<br />
zu einer Raynaud-Symptomatik.<br />
Wichtig zur Diagnosestellung ist vor allem<br />
das typische klinische Erscheinungsbild<br />
mit Dermatosklerose, Sklerodaktylie,<br />
Mikrostomie, Amimie, Teleangiektasie,<br />
Kalzinosen und akralen Erosionen. Von<br />
den Antikörpern sind vor allem die ANA,<br />
Scl-70, CENP und Anti-Centromer-Antikörper<br />
(Abb. 8) diagnostisch wichtig. Zu<br />
778<br />
den organspezifischen Untersuchungsverfahren<br />
gehören Röntgen und eventuell<br />
HRCT des Thorax, EKG, Lungenfunktionsmessung,<br />
Echokardiografie, Ösophagusmanometrie<br />
und Kapillarmikroskopie. Die<br />
Sonographie <strong>der</strong> Haut kann sowohl im entzündlichen<br />
als auch im sklerotischen Stadium<br />
spezifische Verän<strong>der</strong>ungen zeigen.<br />
1980 publizierte das American College of<br />
Rheumatology (ACR) Kriterien zur Klassifikation<br />
<strong>der</strong> SSc (Tab. 2).<br />
Therapiekonzepte<br />
Allgemeine Maßnahmen<br />
Zur Erhaltung und Besserung <strong>der</strong> Gelenkfunktion<br />
sind leichte körperliche Betätigung,<br />
Krankengymnastik und Lymphdrainagen<br />
wichtig. Vor allem bei Ösophagusverän<strong>der</strong>ungen<br />
ist die häufige Einnahme kleiner<br />
Mahlzeiten hilfreich. Die Kost sollte dabei<br />
schlackenreich sein, um die Peristaltik<br />
anzuregen.<br />
Vasoaktive Substanzen<br />
Neben den allgemeinen durchblutungsför<strong>der</strong>nden<br />
Maßnahmen (Kälteschutz, Kneten<br />
zum Beispiel in warmer Hirse, Nikotinkarenz<br />
etc.) ist eine medikamentöse Therapie<br />
bei Patienten mit prolongierten schmerz-<br />
Hauptkriterium<br />
Typische sklero<strong>der</strong>mieforme Hautverän<strong>der</strong>ungen proximal<br />
<strong>der</strong> Metakarpophalangeal- und/o<strong>der</strong> <strong>der</strong> Metatarsophalangealgelenke.<br />
Typische sklero<strong>der</strong>mieforme Hautverän<strong>der</strong>ungen<br />
sind definiert als verfestigte, verdickte, nicht eindrückbare<br />
Hautverhärtung. Lokalisierte Sklero<strong>der</strong>mieformen (Morphea,<br />
lineare Sklero<strong>der</strong>mie) müssen <strong>aus</strong>geschlossen sein<br />
Nebenkriterien<br />
Sklerodaktylie: oben definierte sklero<strong>der</strong>mieforme Hautverän<strong>der</strong>ungen<br />
beschränkt auf die Finger<br />
Fingerkuppenulzera: Narben von Fingerkuppenulzera<br />
o<strong>der</strong> Gewebeverlust <strong>der</strong> Fingerbeere infolge Ulzera. Exogene<br />
Ursachen inkl. Trauma müssen <strong>aus</strong>geschlossen<br />
sein<br />
Bilaterale, basal betonte Lungenfibrose: Lineare o<strong>der</strong><br />
linear-noduläre Aufhellungen auf dem Standardröntgenthoraxbild<br />
mit Betonung <strong>der</strong> basalen Abschnitte. Eine<br />
primäre Lungenerkrankung muss <strong>aus</strong>geschlossen sein<br />
Tabelle 2: Derzeit gültige Klassifikationskriterien des American<br />
College of Rheumatology (ACR) <strong>für</strong> die systemische Sklerose.<br />
Zur Diagnosestellung muss <strong>der</strong> Patient entwe<strong>der</strong> das Haupt -<br />
kriterium o<strong>der</strong> zwei Nebenkriterien erfüllen.<br />
haften Raynaud-Attacken o<strong>der</strong> ischämischer<br />
Gewebsschädigung indiziert. Medikamente<br />
<strong>der</strong> ersten Wahl sind Kalziumantagonisten.<br />
ACE-Hemmer verbessern zusätzlich<br />
die renale Prognose durch Schutz vor <strong>der</strong><br />
hypertensiven renalen Krise. Prostazyklin<strong>der</strong>ivate<br />
(Iloprost) erwiesen sich insbeson<strong>der</strong>e<br />
zur Abheilung digitaler Ulzera als<br />
wirksam. [5] Eine Placebo kontrollierte Studie<br />
zeigte die Wirksamkeit von Endothelin-I-<br />
Antagonisten (Bosentan) zur Prävention<br />
digitaler Ulzera. Bei PAH ließen sich mit<br />
Prostazyklin<strong>der</strong>ivaten in inhalativer Form<br />
Verbesserungen <strong>der</strong> körperlichen Belastbarkeit<br />
<strong>der</strong> Patienten nachweisen. Für<br />
Bosentan zeigte sich eine verbesserte<br />
Überlebensrate.<br />
Immunmodulatoren<br />
Die Aktivierung des Immunsystems ist<br />
bereits in <strong>der</strong> frühen Phase <strong>der</strong> SSc ein<br />
wichtiger Stimulus <strong>für</strong> die vaskulären und<br />
fibrotischen Läsionen. Die klassischen<br />
Immunsuppressiva sind bei <strong>der</strong> Dermato -<br />
sklerose meist unwirksam. Die heute eingesetzten<br />
immunsuppressiven Substanzen<br />
umfassen Glukokortikoide, Cyclophosphamid<br />
und Methotrexat (MTX). Aufgrund <strong>der</strong><br />
erheblichen potentiellen Nebenwirkungen<br />
<strong>der</strong> Glukokortikoide und <strong>der</strong> möglichen
Abb. 5: HRCT, Lungenfibrose<br />
Abb. 6: Raynaud-Syndrom<br />
Induktion einer renalen Krise sollte ihr<br />
Einsatz in <strong>der</strong> Therapie <strong>der</strong> SSc bestimmten<br />
Indikationen (z. B. Alveolitis) vorbehalten<br />
bleiben. Cyclophosphamid wird bei<br />
spezifischen Organmanifestationen eingesetzt,<br />
etwa bei interstitieller Lungenerkrankung<br />
und neutrophiler Alveolitis. [6]<br />
Cyclophosphamid wird außerdem als<br />
Sekundärtherapie bei hochentzündlichen<br />
Verläufen eingesetzt – oft kombiniert mit<br />
Glukokortikoiden o<strong>der</strong> <strong>der</strong> Plasmapherese.<br />
Künftige Therapieoptionen<br />
Ein Ansatz ist die Therapie <strong>der</strong> Fibrose mit<br />
Imatinib, einem Hemmer <strong>der</strong> Tyrosinkinase-Aktivität<br />
des platelet-<strong>der</strong>ived growth<br />
factor (PDGF)-Rezeptors. Der PDGF-<br />
Rezeptor spielt in <strong>der</strong> Pathogenese <strong>der</strong> SSc<br />
eine wichtige Rolle. Derzeit befasst sich<br />
eine Multicenterstudie mit <strong>der</strong> Wirksamkeit<br />
von Imatinib bei SSc. Noch steht das<br />
Ergebnis einer europaweiten prospektiven,<br />
kontrollierten und randomisierten Studie<br />
zum Nutzen einer Stammzelltransplantation<br />
bei rasch fortschreiten<strong>der</strong> diffuser SSc<br />
<strong>aus</strong> (ASTIS-Studie, Autologous Stem Cell<br />
Transplantation International Sclero<strong>der</strong>ma;<br />
http://www.ASTIStrial.com). [7] Zwischenergebnisse<br />
dieser wichtigen Studie deuten<br />
Abb. 7: Digitale Nekrosen<br />
auf eine rasche Reduktion <strong>der</strong> Hautsklerose<br />
und einen Progressionsstopp <strong>der</strong> Sklerose<br />
innerer Organe hin. Damit verbunden<br />
scheint die Sterblichkeit dieser beson<strong>der</strong>s<br />
schweren Verlaufsform <strong>der</strong> SSc reduziert<br />
zu sein.<br />
Kontakt<br />
Dr. Keihan Ahmadi-Simab<br />
Rheumatologie, klinische Immunologie,<br />
Nephrologie<br />
<strong>Asklepios</strong> <strong>Klinik</strong> Altona<br />
Paul-Ehrlich-Straße 1<br />
22763 Hamburg<br />
Tel. (0 40) 18 18-81 11 24<br />
Fax (0 40) 18 18-81 48 00<br />
E-Mail: keihan.ahmadi@asklepios.com<br />
Literatur<br />
Rheumatologie<br />
Abb. 8: Anti-Centromer-<br />
Antikörper, Vorkommen bei<br />
<strong>der</strong> limitierten Form <strong>der</strong><br />
SSc<br />
[1] Zuber JP, Spertini F. Immunological basis of systemic<br />
sclerosis. Rheumatology (Oxford). 2006; 45(3): iii23-5.<br />
[2] Hunzelmann N, Genth E, Krieg T et al. The registry of<br />
the German network for systemic sclero<strong>der</strong>ma: frequency<br />
of disease subsets and patterns of organ involvement.<br />
Rheumatology 2008; 47: 1185-92.<br />
[3] Ahmadi-Simab K, Hellmich B, Gross WL. Bosentan for<br />
severe pulmonary arterial hypertension related to systemic<br />
sclerosis with interstitial lung disease. Eur J Clin Invest.<br />
2006; 36(3): 44-8.<br />
[4] Ahmadi-Simab K. Raynaud-Syndrom und akrale<br />
Ischämiesyndrome. In: Müller-Ladner U. UNI-MED,<br />
1. Aufl. 2006<br />
[5] Saar P, Müller-Ladner U. Systemic sclerosis – a challenge<br />
in rheumatology, Z Rheumatol. 2006; 65(5): 429-38; quiz<br />
439-40.<br />
[6] Latsi PI, Wells AU. Evaluation and management of<br />
alveolitis and interstitial lung disease in sclero<strong>der</strong>ma.<br />
Curr Opin Rheumatol 2003; 15: 748-55.<br />
[7] van Laar JM, Farge D, Tyndall A. Autologous Stem cell<br />
Transplantation International Sclero<strong>der</strong>ma (ASTIS) trial:<br />
hope on the horizon for patients with severe systemic<br />
sclerosis. Ann Rheum Dis 2005; 64(10): 1515.<br />
779
Medtropole | Ausgabe 21 | April 2010<br />
Schlaganfallprophylaxe bei Patienten mit Vorhofflimmern:<br />
Perkutaner Verschluss des linken Herzohrs<br />
Prof.(ROK) Dr. med. habil. Jai-Wun Park<br />
Vorhofflimmern ist eine Herzrhythmusstörung, die durch eine hohe und unregelmäßige elektrische Aktivität <strong>der</strong><br />
Herzvorhöfe mit einer Impulsfrequenz von 350 bis 500 pro Minute charakterisiert ist. In diesem Zustand ist eine<br />
effektive Kontraktion <strong>der</strong> Vorhöfe nicht mehr möglich. Mit circa 60 Prozent aller Arrhythmien ist das Vorhofflimmern<br />
die häufigste therapiebedürftige Herzrhythmusstörung.<br />
Epidemiologische Studien zeigen, dass bis<br />
zu 1,5 Prozent <strong>der</strong> Bevölkerung in den<br />
westlichen Industrielän<strong>der</strong>n von Vorhofflimmern<br />
betroffen sind, allein in Deutschland<br />
etwa 800.000 Erwachsene. Dabei weist<br />
die Häufigkeit <strong>der</strong> Rhythmusstörung eine<br />
deutliche Abhängigkeit vom Lebensalter<br />
auf. Die zunehmenden Verän<strong>der</strong>ungen <strong>der</strong><br />
Alterspyramide werden in den kommenden<br />
Jahren die Prävalenz dieser Erkrankung<br />
dramatisch weiter ansteigen lassen. [1]<br />
In <strong>der</strong> Altersgruppe <strong>der</strong> über 60-Jährigen<br />
beträgt die Häufigkeit von Vorhofflimmern<br />
etwa vier Prozent, bei den über 70-Jährigen<br />
sieben Prozent [2] und nach Ezekowitz bei<br />
den über 84-Jährigen 17 Prozent. [3]<br />
Patienten mit Vorhofflimmern haben ein<br />
fünffach erhöhtes Risiko, einen Schlaganfall<br />
zu erleiden. [4,5] Je<strong>der</strong> sechste Schlaganfall-<br />
Patient leidet an einem Vorhofflimmern<br />
und Thromboembolien <strong>aus</strong> dem linken<br />
Herzohr werden beim überwiegenden<br />
Anteil dieser Patienten unterstellt. Vitamin<br />
K-Antagonisten sind die am häufigsten<br />
verordnete Therapie zur Schlaganfall-Prophylaxe<br />
bei Patienten mit Vorhofflimmern.<br />
Trotz des gut belegten Nutzens dieser Therapie<br />
bliebt die konsequente Umsetzung in<br />
praxi wegen des engen therapeutischen<br />
Fensters und einem erhöhten Blutungsrisiko<br />
oft schwierig.<br />
Als Alternative zur Antikoagulation wurden<br />
chirurgische Entfernung beziehungsweise<br />
Verschluss [6] sowie drei verschiedene,<br />
katheterbasierte Verschluss-Systeme des<br />
780<br />
linken Herzohrs entwickelt: PLAATOTM ,<br />
WATCHMAN ® und Amplatzer Cardiac<br />
Plug ® . Mit allen drei Systemen lässt sich<br />
das linke Herzohr perkutan verschließen.<br />
Das PLAATOTM-System <strong>der</strong> Firma „ev3“<br />
war das erste System, mit dem linke Herzohren<br />
von Patienten mit Vorhofflimmern<br />
erfolgreich verschlossen wurden. [7,8,9] Der<br />
Hersteller zog das Produkt aber in 2006<br />
vom Markt zurück. In <strong>der</strong> randomisierten<br />
Protect AF Studie wurden <strong>der</strong> Nutzen und<br />
die Sicherheit des WATCHMAN ® -Systems<br />
belegt, [10,11] sodass daraufhin dessen FDA-<br />
Zulassung erfolgte. [12] Das ACP-System ist<br />
die Weiterentwicklung des <strong>für</strong> den Verschluss<br />
des Vorhofseptumdefektes und<br />
des offenen Foramen Ovale konzipierten<br />
AMPLATZER ® Doppelscheiben-Systems. [13]<br />
Es ist ein selbst-expandierendes Implantat<br />
<strong>aus</strong> einem Nitinol-Gerüst mit Polyester-<br />
Membran. Im Gegensatz zu den beiden<br />
an<strong>der</strong>en Implantaten besteht das sehr flexible<br />
ACP-Implantat <strong>aus</strong> einem „lobe“ <strong>für</strong><br />
die Verankerung an <strong>der</strong> Herzohrwand<br />
und einem „disc“ <strong>für</strong> das übergangslose<br />
Abdichten des Herzohrostiums. „Lobe“<br />
und „disc“ sind zentral durch eine Taille<br />
miteinan<strong>der</strong> verbunden und lassen sich<br />
unabhängig voneinan<strong>der</strong> bewegen. So<br />
können sich beide Teile den anatomischen<br />
Gegebenheiten des individuellen Patienten<br />
flexibel und somit atraumatisch anpassen.<br />
Aufgrund <strong>der</strong> <strong>aus</strong>geprägten Flexibilität<br />
sind ein Zurückholen des ACP-Implantates<br />
in den Führungskatheter und eine Repositionierung<br />
wie<strong>der</strong>holt möglich.<br />
Welche Patienten sind <strong>für</strong> den perku -<br />
tanen Verschluss des linken Herzohrs<br />
geeignet?<br />
Prinzipiell ist <strong>der</strong> Katheter basierte mechanische<br />
Verschluss des linken Herzohrs eine<br />
gute Alternative <strong>für</strong> alle Vorhofflimmer-<br />
Patienten, die wegen eines erhöhten Schlaganfall-Risikos<br />
einer Dauer-Marcumarisierung<br />
bedürfen. Allerdings sollte die Indikation<br />
<strong>für</strong> dieses neue Verfahren streng gestellt<br />
werden, bis genügend Erfahrungen mit <strong>der</strong><br />
Intervention selbst und auch genügend klinische<br />
Langzeitergebnisse vorliegen. Konkret<br />
heißt das: Mindestens zwei o<strong>der</strong> mehr<br />
Risikofaktoren <strong>für</strong> Schlaganfall (Alter > 75<br />
Jahre, Diabetes mellitus, Hypertonie, Herzinsuffizienz,<br />
Schlaganfall-Anamnese) sowie<br />
Probleme unter Dauer-Marcumarisierung<br />
(Marcumar-Komplikation, Non-Compliance,<br />
Kontraindikation).<br />
Welche Formen von Vorhofflimmern<br />
werden behandelt?<br />
Der katheter-basierte mechanische Verschluss<br />
des linken Herzohrs ist kein „Konkurrenzverfahren“<br />
zur medikamentösen,<br />
elektrischen o<strong>der</strong> chirurgischen Therapie<br />
des Vorhofflimmerns, da er das Vorhofflimmern<br />
nicht k<strong>aus</strong>al (Erreichen eines stabilen<br />
Sinusrhythmus) behandelt, son<strong>der</strong>n prophylaktisch<br />
das Auftreten eines embolischen<br />
Schlaganfalls verhin<strong>der</strong>t. Dies gilt<br />
sowohl <strong>für</strong> das paroxysmale als auch <strong>für</strong><br />
das persistierende Vorhofflimmern.
Abb. 1: ACP in <strong>der</strong> Seitenansicht<br />
Mit welchen Risiken ist das Verfahren<br />
verbunden?<br />
Die Komplikationen sind wie bei je<strong>der</strong><br />
interventionellen Therapie von <strong>der</strong> Erfahrung<br />
des Operateurs abhängig. Seltene,<br />
aber mögliche Komplikationen, die erwähnt<br />
werden müssen, sind: Perikardtamponade,<br />
Implantat-Embolie und Thrombembolie.<br />
Kontakt<br />
Prof. (ROK) Dr. med. habil.<br />
Jai-Wun Park<br />
Chefarzt <strong>der</strong> 1. Medizinischen Abteilung –<br />
Kardiologie<br />
<strong>Asklepios</strong> <strong>Klinik</strong> Harburg<br />
Eißendorfer Pferdeweg 52<br />
21075 Hamburg<br />
Tel. (0 40) 18 18-86 22 16<br />
Fax (0 40) 18 18-86 24 31<br />
E-Mail j.park@asklepios.com<br />
Abb. 2: a – Freisetzen des ACP-lobe am Herzohreingang<br />
b – Verankerung des ACP-lobe am Herzohrhals<br />
c – komplettes Abdichten des Herzohrs nach Freisetzen<br />
des ACP-disc<br />
Abb. 3: Fluoroskopisches Bild des ACP-Systems nach<br />
Implantation<br />
Abb. 4: Komplette Reendothelialisierung 3 Monate nach<br />
ACP Implantation (Tierversuch)<br />
a<br />
b<br />
c<br />
Literatur<br />
Kardiologie<br />
[1] Go AS, Hylek EM, Phillips KA, et al. Prevalence of diagnosed<br />
atrial fibrillation in adults: national implications for<br />
rhythm management and stroke prevention: the Anticoagulation<br />
and Risk Factors in Atrial Fibrillation (ATRIA)<br />
Study. JAMA 2001; 285: 2370-75.<br />
[2] Kannel WB, Abbott RD, Savage DD, McNamara PM.<br />
Epidemiologic features of chronic atrial fibrillation: the Framingham<br />
study. N Engl J Med 1982; 306: 1018-22.<br />
[3] Ezekowitz MD, Netrebko PI. Anticoagulation in<br />
management of atrial fibrillation. Curr Opin Cardiol 2003;<br />
18: 26-31.<br />
[4] Fuster V, Ryden LE, CannonDS, et al. ACC/AHA/ESC<br />
2006 guidelines for the management of patients with atrial<br />
fibrillation: a report of the American College of Cardiology/<br />
American Heart Association Task Force on Practice Guidelines<br />
and the European Society of Cardiology Committee<br />
for Practice Guidelines (Writing Committee to Revise the<br />
2001 Guidelines for the Management of Patients with Atrial<br />
Fibrillation): developed in cooperation with the European<br />
Heart Rhythm Association and the Heart Rhythm<br />
Society. Circulation 2006; 114(7): e257-e354. [Erratum, Circulation<br />
2007; 116(6): e138.]<br />
[5] Food and Drug Administration. Circulatory Devices<br />
Panel Meeting: April 23, 2009, briefing information. (Accessed<br />
May 28, 2009, at http://www.fda.gov/ohrms/dockets/<br />
ac/09/briefing/2009-4434b1-00-Index.html.)<br />
[6] Halperin JL,Gomberg-Maitland M. Obliteration oft the<br />
left atrial appendage for prevention of thromboembolism.<br />
J Am Coll Cardiol 2003; 42: 1259-61.<br />
[7] Sievert H, Lesh MD, Trepels T, et al. Percutaneous left<br />
atrial appendage transcatheter occlusion to prevent stroke<br />
in high-risk patients with atrial fibrillation: early clinical<br />
experience. Circulation 2002; 105: 1887-9.<br />
[8] Park J-W, Gerk U, Franke R-P, Jung F. Post mortem<br />
analysis of a left atrial appendage occlusion device<br />
(PLAATOTM ) in a patient with permanent atrial fibrillation.<br />
Cardiology 2009; 112: 205-8.<br />
[9] Park J-W, Gerk U, Leithäuser B, et al. Percutaneous left<br />
atrial appendage transcatheter occlusion (PLAATO) for<br />
stroke prevention in atrial fibrillation: 2-years outcome.<br />
J Invas Cardiol 2009; 21: 446-50.<br />
[10] Brown Fountain R, Holmes DR, et al. The PROTECT<br />
AF (WATCHMAN left atrial appendage system for embolic<br />
PROTECTion in patients with atrial fibrillation) Trial. Am<br />
Heart J 2006; 151: 956-61.<br />
[11] Holmes DR, et al. Protect AF Late Breaking Trial: Randomized<br />
Prospective Trial of Percutaneous LAA Closure vs<br />
Warfarin for Stroke Prevention in AF. ACC & i2 Summit<br />
2009, Orlando, FL (Abstract).<br />
[12] Food and Drug Administration. Circulatory System<br />
Devices Panel Meeting – April 23, 2009.<br />
http://www.fda.gov/cdrh/panel/summary/circ-042309.html.<br />
[13] Meier B, Palacios I, Windecker S, et al. Transcatheter<br />
left atrial appendage occlusion with Amplatzer devices to<br />
obviate anticoagulation in patients with atrial fibrillation.<br />
Catheter Cardiovasc Interv 2003; 60: 417-22.<br />
781
Medtropole | Ausgabe 21 | April 2010<br />
Demenzen im Alter<br />
Häufigkeit, Erscheinungsformen, therapeutische Ansätze<br />
Dr. Cl<strong>aus</strong> Wächtler<br />
Demenzen werden häufiger – weil wir<br />
älter werden<br />
Die mo<strong>der</strong>ne Alzheimer-Forschung begann<br />
Anfang des 20. Jahrhun<strong>der</strong>ts mit dem<br />
deutschen Nervenarzt Alois Alzheimer, <strong>der</strong><br />
die damals 51-jährige Auguste Deter in <strong>der</strong><br />
„Städtischen Irrenanstalt Frankfurt“ wegen<br />
einer Demenz betreute. An<strong>der</strong>s als heute<br />
war die „Senile Demenz“ damals eine seltene<br />
Erkrankung. Die Erkrankungshäufigkeit<br />
steigt nach dem 65. Lebensjahr steil an<br />
und betrifft mehr als 30 Prozent <strong>der</strong> über<br />
90-Jährigen. Man schätzt die Zahl <strong>der</strong><br />
Demenzkranken in Deutschland heute auf<br />
mehr als eine Million. Die Zahl wird sich<br />
bis zum Jahr 2050 mehr als verdoppeln.<br />
Angehörige leisten durchschnittlich sechs<br />
bis zehn Stunden täglich Betreuungsarbeit.<br />
Demenzkranke stellen aber auch logistische<br />
und personelle Anfor<strong>der</strong>ungen an<br />
Pflegeheime und Krankenhäuser. [11]<br />
Diagnostisches Vorgehen in <strong>der</strong> Praxis<br />
Die Diagnose Demenz sollte möglichst<br />
früh gestellt werden. Verdächtige Symptome<br />
sind:<br />
Vergessen; Schwierigkeiten bei komplexeren<br />
täglichen Verrichtungen; Vernachlässigung<br />
von Hobbys; sozialer Rückzug und weniger<br />
Eigeninitiative, aber auch Reizbarkeit und<br />
ungewöhnliche Stimmungsschwankungen;<br />
Probleme, sich in frem<strong>der</strong> Umgebung<br />
zurechtzufinden o<strong>der</strong> die passenden Wörter<br />
zu finden.<br />
Bei Verdacht auf eine Demenz wird geprüft,<br />
ob es sich noch um eine „Leichte Kognitive<br />
Störung“ (Mild Cognitive Impairment:<br />
782<br />
MCI) handelt. Im Vor<strong>der</strong>grund stehen subjektive<br />
Angaben über kognitive Beeinträchtigungen,<br />
aber auch objektivierbare Störungen.<br />
Eine Demenz liegt (noch) nicht vor.<br />
Auch eine Depression, die im Alter häufig<br />
mit kognitiven Störungen einhergeht, ist<br />
sorgfältig <strong>aus</strong>zuschließen. Der Untersucher<br />
sollte sich ein Repertoire von Screening-<br />
Verfahren aneignen, die er gut beherrscht,<br />
die zur Demenzdiagnostik geeignet sind<br />
und die sich zeitökonomisch einsetzen lassen.<br />
Dies trifft auf keinen Test mehr zu als<br />
auf den international meist verwendeten<br />
Mini-Mental State (MMS). [5] Er identifiziert<br />
aber keine Frühformen speziell bei Menschen<br />
mit guter Ausgangsintelligenz. Neuere<br />
Tests, wie <strong>der</strong> DemTect , [7] sind zur<br />
Frühdiagnostik besser geeignet. In Kombination<br />
mit weiteren neuropsychologischen<br />
Testverfahren, wie dem Uhrentest, [15] einer<br />
Wortflüssigkeitsaufgabe (z. B. Benennung<br />
von Tieren in einer Minute) und <strong>der</strong> Exploration<br />
des Patienten und seiner Angehörigen<br />
insbeson<strong>der</strong>e zur Alltagsbewältigung<br />
lässt sich in <strong>der</strong> Regel eine relativ sichere<br />
Abschätzung von noch altersassoziierten<br />
(„benignen“) kognitiven Leistungseinbußen<br />
o<strong>der</strong> leichter kognitiver Beeinträchtigung<br />
einerseits und beginnen<strong>der</strong> Demenz<br />
an<strong>der</strong>erseits vornehmen. [17]<br />
Bestätigt sich <strong>der</strong> Verdacht auf eine Demenz,<br />
muss in einem zweiten Schritt festgestellt<br />
werden, um welche <strong>der</strong> mehr als 60 De -<br />
menzformen es sich handelt. Dazu dienen<br />
eine körperliche Untersuchung, Labortests,<br />
[1] CCT o<strong>der</strong> MRT.<br />
Bei Unsicherheit in <strong>der</strong> diagnostischen<br />
Zuordnung, Auffälligkeiten des bisherigen<br />
Verlaufs, <strong>aus</strong>geprägter psychischer Begleitsymptomatik<br />
o<strong>der</strong> Verhaltensstörungen<br />
muss <strong>der</strong> Facharzt eingeschaltet werden.<br />
Dem Facharzt ebenso wie <strong>der</strong> Memory-<br />
Clinic bleibt die Aufgabe, neben einer<br />
erweiterten apparativen und laborchemischen<br />
Untersuchung differenziertere Testverfahren<br />
einzusetzen. Dabei schlägt das<br />
CERAD-Verfahren [13] einen Mittelweg<br />
zwischen Minimallösung (z. B. MMS) und<br />
zeitaufwändigeren differenzierteren Testbatterien<br />
ein.<br />
Die Liquordiagnostik gehört noch nicht zu<br />
den Routineverfahren. Ergeben sich aber<br />
Hinweise auf eine entzündliche Genese <strong>der</strong><br />
Demenz o<strong>der</strong> fällt die Abgrenzung einer<br />
degenerativen Erkrankung von einer an<strong>der</strong>en<br />
Demenzursache schwer, kann <strong>der</strong><br />
Liquor zusätzliche Sicherheit schaffen.<br />
Folgende Verteilung <strong>der</strong> Demenzen findet<br />
sich: Alzheimer’sche Erkrankung: ca. 60 %,<br />
vaskuläre Demenz: ca. 10 %, Mischform:<br />
ca. 10 %, Lewy-Körperchen-Demenz:<br />
ca. 10 %, fronto-temporale Demenz: unter<br />
1 %, potentiell reversible (behebbare)<br />
Demenzen: ca. 9 % (u. a. Hypo- und Hyperthyreose,<br />
Vitamin B12-Mangel, chron.<br />
hypoxische Zustände, chron. Intoxikation<br />
durch Psychopharmaka o<strong>der</strong> Alkohol,<br />
Hyponatriämie, Anämie, Encephalitis,<br />
Normaldruckhydrocephalus etc.).<br />
Aufklärung<br />
Liegt eine Demenz vor, sollte in <strong>der</strong> Regel<br />
eine Aufklärung erfolgen. Neben <strong>der</strong> Aufklärung<br />
über die Erkrankung beinhaltet<br />
ein solches Gespräch Informationen über
Demenz Spezifika von Verlauf, Symptomatik Labor/apparativ Neuropsychologisch<br />
Alzheimersche Erkrankung<br />
Frontotemporale Demenz (FTD)<br />
Lewy-Körperchen-Demenz<br />
Parkinsondemenz<br />
Vaskuläre Demenz<br />
therapeutische Möglichkeiten, juristische<br />
Vorkehrungen (z. B. Betreuungsvollmacht)<br />
und Unterstützung von Seiten <strong>der</strong> Selbsthilfe<br />
(Alzheimer-Gesellschaft) o<strong>der</strong> Pflegeeinrichtungen<br />
sowie über mögliche Einschränkungen<br />
<strong>der</strong> Fahrtüchtigkeit.<br />
Differenzierte Therapie<br />
Die Leichte Kognitive Störung (MCI) stellt<br />
noch keine Indikation <strong>für</strong> eine medikamentöse<br />
antidementive Therapie dar. Schon<br />
heute würde man aber MCI-Patienten eine<br />
Verlaufs-Kontrolle (nach 6 bis 9 Monaten)<br />
raten und präventive Strategien empfehlen.<br />
Therapeutische Grundprinzipien bei<br />
nachgewiesener Demenz:<br />
Die Therapie sollte „personenzentriert“<br />
(den speziellen Bedürfnissen des Betroffenen<br />
angepasst, unter Berücksichtigung<br />
seiner Biographie), verlaufsabhängig (bei<br />
Patienten im frühen Stadium stehen De -<br />
pression und Angst ebenso im Fokus wie<br />
<strong>der</strong> Erhalt kognitiver Funktionen; im mittleren<br />
Stadium treten psychische Begleitsymptome<br />
und Verhaltensstörungen in den<br />
Vor<strong>der</strong>grund), kombiniert und vernetzt<br />
erfolgen.<br />
Dazu gehören auch die Vermeidung ungeeigneter,<br />
z. B. anticholinerg wirksamer<br />
Medikamente (z. B. Antiparkinsonmittel<br />
wie Biperiden o<strong>der</strong> Metixen, urologische<br />
Chron. progrediente Gedächtnisstörung, Auffälligkeiten<br />
Sprache (Dysphasie) und Wahrnehmung<br />
(Agnosie), motorische Fehlhandlungen (Apraxie)<br />
Je nach Prägnanztyp mit führen<strong>der</strong> Wesensän<strong>der</strong>ung<br />
(Haupttyp), nicht-flüssiger Aphasie (primärprogressive<br />
Aphasie) o<strong>der</strong> flüssiger, semantischer<br />
Aphasie (semantische Demenz)<br />
Progrediente Demenz mit Fluktuation <strong>der</strong> Kognitionen<br />
(insbeson<strong>der</strong>e Aufmerksamkeit, Wachheit),<br />
rezidiv. visuellen Halluzinationen, Parkinsonsymptomatik<br />
bzw. Neuroleptika-Überempfindlichkeit<br />
Langsam progrediente Demenz, die sich bei vorbestehen<strong>der</strong><br />
Parkinsonerkrankung entwickelt, häufig<br />
assoziiert mit Apathie, affektiven und paranoid-halluzinatorischen<br />
Symptomen<br />
Gruppe von Demenzen; z. B. bei Multiinfarkt<br />
Demenz: apoplektischer Beginn; früh einsetzende<br />
fokale Zeichen wie Hemiparese, sensorische Ausfälle,<br />
Gesichtsfelddefekte; fluktuierende o<strong>der</strong> stufenweise<br />
Progression <strong>der</strong> kognitiven Defizite<br />
Spasmolytika wie Solifenacin o<strong>der</strong> Tolterodin<br />
[3] ) und die Behandlung körperlicher<br />
Begleiterkrankungen.<br />
Im Verlauf treten bei fast allen Demenzkranken<br />
und unabhängig von <strong>der</strong> Demenzursache<br />
psychische und Verhaltenssymptome<br />
auf. Folgende Behandlungsstrategien<br />
wurden vor allem bei Alzheimerkranken<br />
untersucht, können aber auch bei Demenzen<br />
an<strong>der</strong>er Genese eingesetzt werden:<br />
■ Es gilt zu klären, ob äußere Stressoren<br />
(z. B. gespannte Beziehung zum Pflegenden,<br />
störende Geräusche) o<strong>der</strong><br />
innere Auslöser (z. B. Schmerz, Obstipation,<br />
Hunger) vorliegen und beeinflusst<br />
werden können.<br />
■ Regelmäßige kognitive Stimulation<br />
verbessert Kognition und Lebensqualität.<br />
[16] Eine Kombination kognitiver<br />
Stimulation mit motorischer Aktivierung<br />
zeigt darüber hin<strong>aus</strong> günstige<br />
Effekte auf Kognition, Depression und<br />
Verhaltensstörungen. [14] Tanzen gilt als<br />
Therapie, die Bewegung anregt, aber<br />
auch Erinnerungen weckt und die Kognitionen<br />
aktiviert. [4]<br />
■ Kognitiv-verhaltenstherapeutische<br />
Techniken führen zu einer Abnahme<br />
<strong>der</strong> Depression – auch bei den Angehö-<br />
rigen. [18]<br />
Atrophie (CCT, MRT) in spezifischen<br />
Hirnarealen, im Verlauf zunehmend;<br />
spezifische Liquorbefunde<br />
Beim Haupttyp: vor allem frontale<br />
und/o<strong>der</strong> temporale Atrophie<br />
Vermin<strong>der</strong>te dopaminerge Aktivität in<br />
den Basalganglien, in SPECT o<strong>der</strong><br />
PET<br />
Keine spezifischen Befunde; CCT<br />
o<strong>der</strong> MRT zum Ausschluss an<strong>der</strong>er<br />
Erkrankungen<br />
In CCT/MRT relevante cerebro-vaskuläre<br />
Läsionen<br />
Potenziell reversible Demenzen Je nach zugrundeliegen<strong>der</strong> Erkrankung<br />
Tabelle 1: Charakteristika <strong>der</strong> wichtigsten Demenzerkrankungen<br />
Psychiatrie<br />
■ Ein auf die Angehörigen zielen<strong>der</strong><br />
Behandlungsansatz schützt diese vor<br />
depressiver Dekompensation und<br />
zögert die Heimeinweisung hin<strong>aus</strong>. [12]<br />
■ Die Schulung <strong>der</strong> Mitarbeiter erwies<br />
sich als wirksam, psychische Symptome<br />
zu min<strong>der</strong>n. [10]<br />
Dagegen ist die Wirksamkeit <strong>der</strong> Validation,<br />
[2,19] einer Technik des empathischen,<br />
bestärkenden, also „validierenden“<br />
Vorgehens, bisher nicht bewiesen.<br />
Uns scheint aber eine entsprechende<br />
Haltung des Personals im Heim o<strong>der</strong><br />
im Krankenh<strong>aus</strong> ein wesentlicher Faktor.<br />
Darüber hin<strong>aus</strong> beobachten wir<br />
positive Effekte eines räumlichen<br />
Umfeldes, das den Demenzkranken die<br />
Orientierung erleichtert. Mittlerweile<br />
liegen Erfahrungen über bauliche Erfor<strong>der</strong>nisse<br />
<strong>für</strong> Demenzkranke vor. [6]<br />
Die Demenzkranken sollten gut geleitet<br />
sein, die Räume sowohl Mobilität als<br />
auch Rückzug ermöglichen sowie Sinnesreize<br />
bieten.<br />
■ Treten schwere psychische und Verhaltenssymptome<br />
wie Unruhe, Schlaflosigkeit,<br />
Depression, Angst o<strong>der</strong> Aggressivität<br />
auf, können Psychopharmaka<br />
unabdingbar sein. Die S3-Leitlinie<br />
„Demenzen“ empfiehlt psychosoziale<br />
Interventionen, hält aber Psychopharmaka<br />
<strong>für</strong> indiziert, „… wenn psychosoziale<br />
Interventionen nicht effektiv, nicht<br />
<strong>aus</strong>reichend o<strong>der</strong> nicht verfügbar“<br />
seien. [1]<br />
Störungen des episodischen Gedächtnisses,<br />
des Neugedächtnisses, <strong>der</strong> Wortfindung,<br />
<strong>der</strong> visuell-räumlichen Organisation<br />
Beim Haupttyp: Inadäquates Sozialverhalten;<br />
Fehlen schwerer Gedächtnis- o<strong>der</strong><br />
visuell-räumlicher Störungen<br />
Demenz mit Einschränkungen im Alltag,<br />
bei <strong>der</strong> Aufmerksamkeit sowie bei exekutiven<br />
und visuo-perzeptiven Funktionen; das<br />
Gedächtnis zu Beginn relativ gut erhalten<br />
Störungen <strong>der</strong> Aufmerksamkeit, exekutiver<br />
Funktionen (z. B. Initiierung und Planung,<br />
kognitive Flexibilität), visuell-räumlicher<br />
Funktionen<br />
Häufig: Verän<strong>der</strong>ungen <strong>der</strong> Persönlichkeit,<br />
affektive Störungen wie Depression, emotionale<br />
Inkontinenz – neuropsycholog. Störungen<br />
je nach Lokalisation <strong>der</strong> cerebralen<br />
Schädigung<br />
783
Medtropole | Ausgabe 21 | April 2010<br />
Die Leitlinie empfiehlt bei agitiertem und<br />
aggressivem Verhalten und bei Halluzinationen<br />
und Wahn Risperidon (0,5 – 2 mg )<br />
o<strong>der</strong> Aripiprazol (2,5 – 15 mg ), wobei Risperidon<br />
„on label“ wäre, Aripiprazol „off<br />
label“. Im klinischen Alltag haben sich<br />
darüber hin<strong>aus</strong> Quetiapin (50 – 150 mg ),<br />
Melperon (25 – 200 mg ) und Pipamperon<br />
(40 – 120 mg ), bei Unruhe und aggressivem<br />
Verhalten auch Trazodon (bis 150 mg )<br />
bewährt.<br />
Bei Demenzkranken, die mit Antipsychotika<br />
behandelt wurden, sind die Mortalität<br />
höher und zerebrovaskuläre Ereignisse<br />
häufiger. Die Medikamente sollten daher<br />
möglichst niedrig dosiert und nur befristet<br />
eingesetzt werden (ggf. nur Tage o<strong>der</strong><br />
Wochen; in <strong>der</strong> Praxis ist die „3-Monats-<br />
Regel“ adäquat).<br />
Für Patienten mit Demenz und Depression<br />
hat sich die medikamentöse antidepressive<br />
Therapie als wirksam erwiesen. Die besten<br />
Nachweise zu Wirksamkeit und Verträglichkeit<br />
scheinen <strong>für</strong> Citalopram (20– 40 mg),<br />
Mianserin (30 – 60 mg) und Moclobemid<br />
(400 mg ) vorzuliegen. Im klinischen Alltag<br />
setzen wir darüber hin<strong>aus</strong> Mirtazapin<br />
(15 – 45 mg) ein.<br />
Für Demenz und Schlafstörungen wird<br />
keine Evidenz basierte Empfehlung <strong>aus</strong>gesprochen.<br />
[1] Im klinischen Alltag ergeben<br />
sich folgende Optionen: Vorrang haben<br />
nicht pharmakologische Maßnahmen wie<br />
Schlafhygiene (kein Fernsehen am Abend/<br />
kein Schlaf am Tag) sowie Lichtexposition<br />
(1.000 – 10.000 Lux, 30 bis 90 Minuten täglich,<br />
nicht später als drei Stunden vor dem<br />
Schlafen). Auch körperliche Bewegung<br />
wird empfohlen. Eine Kombination gilt als<br />
784<br />
wirksamer als jede <strong>der</strong> einzelnen Maßnahmen.<br />
Beim Versagen: Zolpidem (5 – 10 mg )<br />
o<strong>der</strong> Zopiclon (3,75 – 7,5 mg), Mirtazapin<br />
(7,5 mg ), evtl. Prothipendyl 40 – 80 mg.<br />
Therapie spezieller Demenzformen<br />
M. Alzheimer<br />
Wird eine Demenz vom Alzheimer-Typ<br />
bestätigt, sollte die Behandlung mit einem<br />
Antidementivum begonnen werden. Die<br />
heute zur Verfügung stehenden Antidementiva<br />
sind die drei Cholinesterasehemmer<br />
(ChEHe) Donepezil, Rivastigmin und<br />
Galantamin (bei „leichter“ bis „mittelschwerer“<br />
Demenz) und <strong>der</strong> Wirkstoff<br />
Memantin (bei „mo<strong>der</strong>ater“ und „schwerer“<br />
Demenz).<br />
Die Antidementiva sollten auf die maximal<br />
empfohlene Zieldosis aufdosiert werden.<br />
Nach drei bis sechs Monaten gilt es, den<br />
Erfolg <strong>der</strong> Therapie abzuschätzen. Auf die<br />
Verordnung eines ChEHes reagieren kurzfristig<br />
etwa ein Viertel mit einer Besserung,<br />
die Hälfte stabilisiert sich, ein Viertel verläuft<br />
ungebremst progredient. Erfolg<br />
bedeutet, dass vorübergehend ein Stillstand<br />
des Krankheitsprozesses erreicht<br />
wurde o<strong>der</strong> sogar eine Besserung eintritt.<br />
Bei ungebremster Progression wird <strong>der</strong><br />
Wechsel eines ChEHes auf einen an<strong>der</strong>en<br />
empfohlen; Evidenz da<strong>für</strong>, den ChEHe<br />
beim Fortschreiten <strong>der</strong> Erkrankung und<br />
Erreichen des schweren Verlaufsstadiums<br />
abzusetzen, gibt es bisher nicht. [1]<br />
Für eine bessere Wirkung eines Cholinesterasehemmers<br />
im Vergleich mit den an<strong>der</strong>en<br />
gibt es bisher keinen Beleg. Allerdings<br />
unterscheiden sich die ChEHe in <strong>der</strong> Ver-<br />
abreichungsform sowie bezüglich Nebenwirkungen<br />
und Wechselwirkungen (z. B.<br />
unterschiedliche Wirkung auf das Cyt. P-<br />
System).<br />
Die Datenlage zur Prävention <strong>der</strong> Alzheimerdemenz<br />
ist immer noch unbefriedigend.<br />
Aufgrund weitgehenden Konsenses<br />
unter Experten [1] können <strong>der</strong>zeit alle Maßnahmen<br />
empfohlen werden, die auch vor<br />
Herz-Kreislauf-Erkrankungen schützen<br />
sollen. Hierzu gehören bestmögliche Einstellung<br />
eines Bluthochdrucks, einer Fettstoffwechselstörung<br />
und eines Diabetes<br />
mellitus sowie bei Übergewicht Gewichtsreduktion,<br />
gesunde vitaminreiche („mediterrane“)<br />
Ernährung, regelmäßige körperliche<br />
Bewegung (knapp eine halbe Stunde<br />
täglich körperliche Ertüchtigung [8] ), die<br />
Reduktion eines übermäßigen Alkoholkonsums<br />
(Grenzwert = ca. 0,1 l Wein/d) und<br />
<strong>der</strong> Verzicht auf Nikotin. Als beson<strong>der</strong>s<br />
wichtig wird kognitive Aktivität verbunden<br />
mit sozial aktivem Leben angesehen.<br />
Vorsorgende Maßnahmen sollten möglichst<br />
lange vor dem Alter beginnen.<br />
Frontotemporale Demenz (FTD)<br />
Bezüglich einer antidementiven Medikation<br />
gibt es keine Therapieempfehlung.<br />
Eine kleinere Studie zeigte gute Effekte<br />
von Trazodon auf die Verhaltenssymptome<br />
Irritabilität, Agitiertheit, Depressivität und<br />
Essstörungen. [9]<br />
Lewy-Körperchen-Demenz<br />
Es gibt Hinweise auf die Wirksamkeit von<br />
Rivastigmin auf Verhaltenssymptome. Der<br />
Einsatz bei Lewy-Körperchen-Demenz<br />
wäre „off label“.
Vaskuläre Demenz<br />
Es gibt keine <strong>aus</strong>reichende Evidenz <strong>für</strong> die<br />
Wirksamkeit eines Antidementivums bei<br />
vaskulärer Demenz. Im Einzelfall kann<br />
eine Behandlung mit einem AChEHe o<strong>der</strong><br />
Memantin erwogen werden, es handelt<br />
sich aber um einen „off label“-Gebrauch.<br />
Konsequent sollten alle Risikofaktoren<br />
behandelt werden, die zu weiteren vaskulären<br />
Schädigungen führen könnten.<br />
Parkinsondemenz<br />
Rivastigmin ist als Antidementivum „on<br />
label“. Für Patienten mit Parkinsondemenz,<br />
Lewy-Körperchen-Demenz und verwandten<br />
Erkrankungen, die an psychotischen<br />
Symptomen leiden, sind klassische<br />
und viele atypische Neuroleptika kontraindiziert.<br />
Einsetzbare Neuroleptika sind hier<br />
Clozapin und mit geringerer Evidenz Que-<br />
tiapin. [1]<br />
Potenziell reversible Demenzen<br />
Hier sollte umgehend eine pathogenetisch<br />
orientierte Therapie eingeleitet werden,<br />
etwa mit einem Schilddrüsenhormon bei<br />
Schilddrüsenunterfunktion o<strong>der</strong> mit einer<br />
Vitamin-B12-Substitution bei entsprechendem<br />
Vitaminmangel.<br />
Fazit<br />
In Zukunft werden wir über wirksamere<br />
Medikamente gegen Demenz und speziell<br />
die Alzheimer-Krankheit verfügen. Acetylcholinesterasehemmer<br />
und Memantine<br />
sowie nicht-medikamentöse Therapieverfahren,<br />
eine Optimierung <strong>der</strong> Versorgungsstrukturen<br />
und möglichst früh einsetzende<br />
präventive Maßnahmen sind <strong>der</strong>zeit das<br />
Wirksamste, das wir gegen Demenzen tun<br />
können. Wünschenswert wäre, dass in<br />
weit<strong>aus</strong> größerem Umfang als bisher<br />
Demenzkranke in den Genuss des heute<br />
therapeutisch Möglichen kämen.<br />
Weitere Informationen<br />
Gezielte Schulungsmaßnahmen <strong>für</strong> H<strong>aus</strong>und<br />
Fachärzte:<br />
Deutsche Akademie <strong>für</strong> Gerontopsychiatrie<br />
und -psychotherapie e.V. (DAGPP)<br />
Geschäftsstelle<br />
Postfach 1366, 51657 Wiehl<br />
E-Mail: GS@dagpp.de.<br />
Literatur<br />
[1] Deutsche Gesellschaft <strong>für</strong> Psychiatrie, Psychotherapie<br />
und Nervenheilkunde DGPPN), Deutsche Gesellschaft <strong>für</strong><br />
Neurologie (DGN) (Hrsg). (2009) S3-Leitlinie „Demenzen“<br />
(www.depression.versorgungsleitlinien.de)<br />
[2] Feil N. Validation – ein neuer Weg zum Verständnis alter<br />
Menschen. Wien 1992: Altern und Kultur, 3. Auflage<br />
[3] Fick DM, Cooper JW, Wade WE, Waller JL, Maclean JR,<br />
Beers MH. Updating the Beers criteria for potentially inappropriate<br />
medication use in ol<strong>der</strong> adults: results of a US<br />
consensus panel of experts. Arch Intern Med. 2003;<br />
163(22): 2716-24.<br />
[4] Förstl H. Tanzen kann die Kognition des dementen<br />
Patienten verbessern. Medical Tribune, Ausgabe 1/2009,<br />
Seite 6.<br />
[5] Folstein MF, Folstein SE, McHugh PR. Mini-Mental<br />
State. J. psychiatr. Res. 1975; 12: 189-98.<br />
[6] Heeg S, Bäuerle K (2008) Heimat <strong>für</strong> Menschen mit<br />
Demenzen. Mabuse, Frankfurt<br />
[7] Kessler J, Calabrese P, Kolbe E, Berger F. Dem Tect:<br />
Ein neues Screening-Verfahren zur Unterstützung <strong>der</strong><br />
Demenzdiagnostik. Psycho. 2000; 26: 343-7.<br />
Psychiatrie<br />
[8] Lautenschlager NT, Cox KL, Flicker L et al. Effect of<br />
physical activity on cognitive function in ol<strong>der</strong> adults at<br />
risk for Alzheimer disease: a randomized trial. JAMA. 2008;<br />
300: 1027-37.<br />
[9] Lebert F, Stekke W, Hasenbroek X C, Pasquier F. Frontotemporal<br />
dementia: a rendomised, controlled trial with<br />
trazodone. Dement Geriatr Cogn Disord. 2004; 17(4): 355-9.<br />
[10] McCallion P, Toseland RW, Lacey D, Banks S. Educating<br />
nursing assistants to communicate more effectively<br />
with nursing home residents with dementia. Gerontologist.<br />
1999; 39: 546-58.<br />
[11] Melchinger H. Demenzerkrankungen – chronische<br />
Versorgungsdefizite. Deutsches <strong>Ärzte</strong>blatt. 2007; 1004:<br />
A3236-7.<br />
[12] Mittelman MS, Roth DL, Coon DW, Haley WE.<br />
Sustained benefit of supportive intervention for depressive<br />
symptoms in caregivers of patients with alzheimer’s<br />
disease. Am J Psychiatry 2004; 161: 850-6.<br />
[13] Morris JC, Heyman A, Mohs RC et al. The consortium<br />
to establish a registry for Alzheimer’s Disease (CERAD).<br />
Part I. Clinical and neuropsychological assessment of Alzheimer’s<br />
disease. Neurology. 1989; 39(9): 1159-65.<br />
[14] Olazaran J, Muniz R, Reisberg B et al. Benefits of cognitive-motor<br />
intervention in MCI and mild to mo<strong>der</strong>ate<br />
Alzheimer disease. Neurology. 2004; 63: 2348-53.<br />
[15] Shulman K. Clock-Drawing: is it the ideal cognitive<br />
screening test? Int J Geriatr Psychiatry. 2000; 15: 548-61.<br />
[16] Spector A, Thorgrimsen L, Woods B et al. Efficacy of<br />
an evidence based cognitive stimulation therapy programme<br />
for people with dementia. British Journal of Psychiatry.<br />
2003; 183: 248-54.<br />
[17] Stoppe G, Bergmann F, Bohlken J et al. Ambulante<br />
Versorgung von Demenzkranken – Kompetenzen sinnvoll<br />
verbinden. Der H<strong>aus</strong>arzt. 2005; 1: 48-53.<br />
[18] Teri L, Logsdon RG, Uomoto J, McCurry SM. Behavioral<br />
treatment of depression in dementia patients: a controlled<br />
clinical trial. J Gerontol B Psychol Sci Soc Sci. 1997; 57:<br />
159-66.<br />
[19] Toseland RW, Diehl M, Freeman K et al. The impact of<br />
validation group therapy on nursing home residents with<br />
dementia. J Appl Gerontol. 1997; 16: 31-50.<br />
Kontakt<br />
Dr. Cl<strong>aus</strong> Wächtler<br />
V. Abteilung <strong>für</strong> Psychiatrie und<br />
Psychotherapie<br />
Gerontopsychiatrie<br />
<strong>Asklepios</strong> <strong>Klinik</strong> Nord – Ochsenzoll<br />
Langenhorner Ch<strong>aus</strong>see 560<br />
22419 Hamburg<br />
Tel. (0 40) 18 18-87 23 37<br />
Fax (0 40) 18 18-87 16 05<br />
E-mail: c.waechtler@asklepios.com<br />
785
Medtropole | Ausgabe 21 | April 2010<br />
Ventrale Spondylodese bei degenerativen<br />
Erkrankungen <strong>der</strong> Halswirbelsäule<br />
Dr. Gerd Manthei<br />
Die in den 1950-iger Jahren von Smith und Robinson [1] sowie Cloward [2] eingeführte ventrale Diskektomie und<br />
Fusion o<strong>der</strong> ventrale Spondylodese hat sich als Routineeingriff und „Gold-Standard“ in <strong>der</strong> Therapie degenerativer<br />
HWS-Erkrankungen etabliert. Anhand des eigenen Patientengutes <strong>aus</strong> den Jahren 1996 bis 2008 mit 805 operierten<br />
Patienten soll das Behandlungsverfahren vorgestellt und diskutiert werden.<br />
Demographisch bedingt nimmt die Häufigkeit<br />
degenerativer Wirbelsäulenerkrankungen<br />
zu. 20 Prozent aller Arbeits<strong>aus</strong>fälle<br />
und 50 Prozent <strong>der</strong> vorzeitig gestellten<br />
Rentenanträge erfolgen auf Grund bandscheibenbedingter<br />
Erkrankungen. [3] Die<br />
zervikalen Bandscheibenerkrankungen<br />
stellen etwa ein Drittel aller bandscheibenbedingten<br />
Erkrankungen. [4] Die zervikale<br />
Myelopathie gilt in Deutschland und den<br />
Vereinigten Staaten als häufigste Wirbelsäulenerkrankung<br />
<strong>der</strong> über 55-Jährigen. [5]<br />
Mit <strong>der</strong> Alterung <strong>der</strong> Bandscheibe nimmt<br />
mit dem Wassergehalt und die Höhe des<br />
Nucleus pulposus ab, die Scherkräfte am<br />
Faserring nehmen zu. Kommt es zu einem<br />
Einriss im Faserring und einem Austritt<br />
von Bandscheibengewebe, sprechen wir<br />
von einem weichen Bandscheibenvorfall<br />
(softdisc prolapse). Die Verschmälerung<br />
<strong>der</strong> Bandscheibe beeinträchtigt zudem die<br />
Stabilität des Wirbelsegmentes, die Wirbelgelenke<br />
und Bandstrukturen werden überlastet.<br />
Der Körper versucht durch knöcherne<br />
Anbauten an Wirbeln und Wirbelgelenken<br />
diese Instabilität im Sinne einer „Autofusion“<br />
[6] zu beheben. Bedrängen diese Kno-<br />
786<br />
chenanbauten Rückenmarkes o<strong>der</strong> Nervenwurzeln,<br />
sprechen wir von einem harten<br />
Bandscheibenvorfall (harddisc prolapse). [7]<br />
Klinische Symptomatik<br />
Das zervikale Lokalsyndrom macht initial<br />
mit Nackenschmerzen und schmerzhafter<br />
Bewegungseinschränkung auf sich aufmerksam,<br />
beson<strong>der</strong>s bei chronischen Fällen<br />
auch mit Ausstrahlung in den Hinterhauptbereich<br />
(Zervikocephalgie) und vegetativen<br />
Störungen.<br />
Die zervikale Radikulopathie verursacht<br />
häufig bewegungsabhängige Schmerzen<br />
mit einer Ausstrahlung in die Arme<br />
(Brachialgie), bei zunehmen<strong>der</strong> Wurzelkompression<br />
mit sensiblen Störungen<br />
(Dysaesthesien, Paraesthesien) und dem<br />
betroffenen Segment entsprechenden<br />
Paresen. Zeichen einer zervikalen Myelopathie<br />
sind Missempfindungen in Armen<br />
und Beinen, eine spastische Gangstörung<br />
sowie eine Störung <strong>der</strong> Feinmotorik. Häufige<br />
Frühsymptome sind auch eine zeitweise<br />
auftretende Gefühllosigkeit <strong>der</strong><br />
Arme sowie ein anfallartiger Kraftverlust<br />
<strong>der</strong> Hände. [8]<br />
Diagnostik<br />
Neben <strong>der</strong> klinischen Untersuchung ist<br />
heute die MRT, insbeson<strong>der</strong>e mit T2gewichteten<br />
Aufnahmen, die Untersuchungsmethode<br />
<strong>der</strong> Wahl (Abb.1). Sie<br />
ermöglicht eine gute Darstellung des Myelon,<br />
seiner Reserveräume und <strong>der</strong> Nervenwurzeln.<br />
Zur besseren Darstellung <strong>der</strong><br />
knöchernen Verhältnisse kommt die Computertomographie<br />
zum Einsatz. Röntgennativaufnahmen<br />
mit Funktionsaufnahmen<br />
in Ante- und Retroflexion liefern einen Eindruck<br />
über das Ausmaß <strong>der</strong> degenerativen<br />
Verän<strong>der</strong>ungen und weisen mögliche In -<br />
stabilitäten nach.<br />
OP-Indikation<br />
Bei <strong>der</strong> zervikalen Radikulopathie besteht<br />
eine absolute OP-Indikation bei akuten,<br />
signifikanten und progredienten Paresen<br />
(Paresegrad 3/5 o<strong>der</strong> schlechter). Eine<br />
Operation wird empfohlen bei therapiere-
Abb. 1: MRT eines Patienten mit einer Spinalkanal -<br />
stenose HW3/4/5/6 mit intramedullärer Signalanhebung<br />
als Ausdruck einer Myelopathie<br />
sistenten Schmerzen trotz intensiver konservativer<br />
Maßnahmen über vier Wochen,<br />
progredienten neurologischen Ausfällen<br />
sowie persistierenden neurologischen Ausfällen<br />
mit radikulären Schmerzen. [9]<br />
Bei <strong>der</strong> zervikalen spondylotischen Myelopathie<br />
besteht die Indikation zur operativen<br />
Dekompression bei rascher Progredienz<br />
<strong>der</strong> klinischen Symptomatik, Auftreten signifikanter<br />
autonomer Störungen (Blase,<br />
Mastdarm, Potenz) sowie unzureichendem<br />
Erfolg einer konservativen Therapie bei<br />
Progredienz <strong>der</strong> neurologischen Sympto-<br />
matik. [10]<br />
Operatives Vorgehen<br />
Ziel des Eingriffs ist die Dekompression<br />
<strong>der</strong> geschädigten neuronalen Strukturen<br />
sowie die Stabilisierung <strong>der</strong> betroffenen<br />
zervikalen Bewegungssegmente (Abb.2).<br />
Bei <strong>der</strong> zervikalen Radikulopathie erfolgt<br />
die Dekompression über eine ventrale<br />
Discektomie mit Resektion des hinteren<br />
Längsbandes sowie raumfor<strong>der</strong>n<strong>der</strong><br />
Retrospondylophyten mit Erweiterung <strong>der</strong><br />
Neuroforamina. Bei <strong>der</strong> zervikalen Myelopathie<br />
ist zudem häufig eine Entlastung<br />
des Myelon durch eine (partielle) Resektion<br />
eines o<strong>der</strong> mehrerer Wirbelkörper notwendig.<br />
Die Stabilisierung <strong>der</strong> Wirbelsegmente<br />
gewährleistet eine instrumentierte<br />
Abb.2: Schematische Darstellung <strong>der</strong> ventralen Dekompression und Spondylodese<br />
ventrale Spondylodese. Dabei werden als<br />
ventrale Abstützung autologe trikortikale<br />
Knochenspäne o<strong>der</strong> allogene Implantate<br />
(PEEK, Carbon, Titan) verwendet (Abb. 3).<br />
Durch eine ventrale Verplattung lassen sich<br />
ein sekundärer ventraler Höhenverlust<br />
durch Einsinken <strong>der</strong> Implatate und eine<br />
dar<strong>aus</strong> resultierende Kyphosierung verhin-<br />
<strong>der</strong>n. [11]<br />
Eigenes Patientengut<br />
In den Jahren 1995 bis 2008 wurden in<br />
unserer <strong>Klinik</strong> 805 Patienten im Alter zwischen<br />
22 und 92 Jahren in <strong>der</strong> oben geschil<strong>der</strong>ten<br />
Weise operiert (Tab. 1). Bei 548 (68%)<br />
bestand eine radikuläre Symptomatik, bei<br />
204 (25 %) Patienten stand eine medulläre<br />
Symptomatik im Vor<strong>der</strong>grund; 64 dieser<br />
Patienten waren aufgrund <strong>der</strong> medullären<br />
Neurochirurgie<br />
Abb. 3: Intraoperativer Situs bei Versorgung von 2 Wirbelsegmenten: Im oberen Segment ist bereits ein 6 mm Cage<br />
eingefügt. Auffräsen des unteren ZWR, intraoperative Durchleuchtungskontrolle mit korrekter Cagelage<br />
Symptomatik nicht mehr ohne Hilfe gehfähig.<br />
Unter einem zervikalen Lokalsyndrom<br />
litten 53 Patienten (7 %).<br />
Das Durchschnittsalter <strong>der</strong> Patienten mit<br />
einer radikulären Symptomatik betrug<br />
50,8 Jahre, das <strong>der</strong> Patienten mit medullären<br />
Störungen 62 (noch gehfähig) beziehungsweise<br />
72 Jahre (nicht gehfähig). Patienten<br />
mit einer radikulären Störung hatten eine<br />
durchschnittliche Anamnesedauer von<br />
neun (0,5 – 36) Monaten. Bei Patienten mit<br />
medullärer Symptomatik betrug diese 14,8<br />
(0,1 – 94) Monate.<br />
Während <strong>der</strong> Eingriff bei 77 Prozent <strong>der</strong><br />
Patienten mit radikulären Beschwerden auf<br />
ein Bewegungssegment beschränkt werden<br />
konnte, war bei 88 Prozent <strong>der</strong> Patienten<br />
mit einer Myelopathie die Versorgung von<br />
2 – 4 Segmenten notwendig (Abb. 4).<br />
787
Medtropole | Ausgabe 21 | April 2010<br />
Abb. 4: Zervikale Myelopathie, Dekompression und<br />
ventrale Spondylodese HW 3/4/5/6/7<br />
Ergebnisse<br />
662 Patienten (82 %) konnten nach drei und<br />
zwölf Monaten nachuntersucht werden.<br />
Die Behandlungsergebnisse wurden in<br />
Anlehnung an ODOM et al. [7] klassifiziert<br />
(Tab.2).<br />
Beim zervikalen Radikulärsyndrom zeigte<br />
sich bereits drei Monate postoperativ bei<br />
mehr als 90 Prozent <strong>der</strong> Patienten eine gute<br />
bis sehr gute Besserung <strong>der</strong> Beschwerden.<br />
Bei <strong>der</strong> zervikalen Myelopathie zeigten die<br />
neurologischen Ausfälle eine insgesamt<br />
verzögerte Rückbildung. Immerhin profitierten<br />
ein Jahr postoperativ 70 Prozent <strong>der</strong><br />
Patienten von dem Eingriff, vor allem<br />
Patienten mit geringeren neurologischen<br />
Ausfällen (Tab. 3).<br />
Die Komplikationsrate beträgt insgesamt<br />
fünf Prozent. Am häufigsten beobachtet<br />
werden meist passagere Heiserkeit und<br />
Schluckstörungen (Läsion des N. recurrens<br />
in 2 %, lokales Hämatom in 1,2 %). Radikuläre<br />
Läsionen sind selten (0,4 %). Bei sieben<br />
Patienten mit einer zervikalen Myelopathie<br />
war eine zusätzliche Entlastung des<br />
Rückenmarkes von dorsal notwendig.<br />
Fazit<br />
Bei <strong>der</strong> Behandlung degenerativer Halswirbelsäulenerkrankungen<br />
ist die ventrale<br />
Dekompression mit anschließen<strong>der</strong> Fusion<br />
788<br />
Präoperative Symptomatik Alter Anamnese (Monate)<br />
Radilulär (n = 548) 50,8 9 (0,5 – 36)<br />
Medullär, noch gehfähig (n = 140) 62,3 14,8 (0,1 – 94)<br />
Medullär, nicht gehfähig (n = 64) 72 6 (0,1 – 24)<br />
Lokal (n = 53) 57,6 22 (8 – 48)<br />
nach 3 Monaten nach 12 Monaten<br />
n n % n %<br />
Schmerz 514 478 93 493 96<br />
Sensibilität 464 417 90 436 94<br />
Motorik 263 200 76 231 88<br />
nach 3 Monaten nach 12 Monaten<br />
n % n %<br />
Vollständige Remission 478 93 493 96<br />
Gute Rückbildung 417 90 436 94<br />
Geringe Remission 200 76 231 88<br />
Keine Än<strong>der</strong>ung 40 27 6 4<br />
Verschlechtert 9 6 4 3<br />
als zuverlässiges Operationsverfahren etabliert.<br />
Die Erfolgsrate liegt bei Patienten mit radikulären<br />
Beschwerden über 90 Prozent. Seit<br />
einigen Jahren kann diesen Patienten als<br />
alternatives Operationsverfahren die<br />
Implantation einer Bandscheibenprothese<br />
angeboten werden. Dabei sind die initialen<br />
Erfolgsraten im eigenen Patientengut zwar<br />
ähnlich gut, Langzeitergebnisse liegen aber<br />
nicht vor und die Entwicklung dieser<br />
dynamischen Implantate ist nicht abgeschlossen.<br />
Bei <strong>der</strong> zervikalen spondylotischen<br />
Myelopathie ist das primäre Behandlungsziel,<br />
ein Fortschreiten <strong>der</strong> Erkrankung<br />
und damit eine zunehmende Immobilität<br />
zu verhin<strong>der</strong>n. Da insbeson<strong>der</strong>e Patienten<br />
in einem früheren Krankheitsstadium von<br />
einer Operation profitieren, ist bei Vorliegen<br />
verdächtiger Symptome eine frühzeitige<br />
neurologische Differenzialdiagnostik<br />
indiziert.<br />
Literatur<br />
[1] Smith GW, Robinson RA. The treatment of certain cervical-spine<br />
disor<strong>der</strong>s by anterior removal of the intervertebral<br />
disc and interbody fusion.<br />
J Bone Joint Surg. 1958; 40-A(3): 607-23.<br />
[2] Cloward R. The anterior approach for removal of ruptured<br />
cervical discs; J<br />
Neurosurg. 1958; 15: 602-17.<br />
[3] Krämer J. Bandscheibenbedingte Erkrankungen, Ursachen;<br />
Diagnose, Behandlung, Vorbeugung, Begutachtung:<br />
Georg Thieme Verlag, Stuttgart, New York, 5. Aufl. 2006<br />
Tab. 1: Zervikale degenerative<br />
Radikulo-/Myelopathie<br />
n = 805; 366 weibl., 439 männl.,<br />
Alter 22 – 92 Jahre<br />
Tab. 2: Zervikale degenerative Radikulopathie,<br />
Behandlungsergebnisse<br />
nach ventraler Fusion,<br />
n = 514 von 548 Patienten<br />
Tab. 3: Zervikale degenerative Myelopathie,<br />
Behandlungsergebnisse<br />
nach ventraler Fusion, n = 148 von<br />
204 Patienten<br />
[4] Schrö<strong>der</strong> J, Wassmann H. Polymethylmethacrylat<br />
(PMMA) in <strong>der</strong> Halsbandscheibenchirurgie – gegenwärtige<br />
Situation in Deutschland. Zentralbl Neurochir. 2002; 63:<br />
33-6.<br />
[5] Whitecloud TS. Anterior surgery for cervical spondylotic<br />
myelopathy. Spine. 1988; 13: 861-3.<br />
[6] Wang B, Liu H, Wang H, Zhou D. Segmental instability<br />
in cervical spondylotic myelopathy with severe disc degeneration.<br />
Spine. 2006; 12: 1327-31.<br />
[7] Odom GL, Finney W, Woodhall B, Durham NC. Cervical<br />
disc lesions. JAMA 1958; 166: 23-8.<br />
[8] Lunsfort LD, Bissonette D, Janetta PJ, Sheptak PE,<br />
Zorub DS. Anterior surgery for cervical disc disease. Part 2:<br />
Treatment of cervical spondylotic myelopathy in 32 cases. J<br />
Neurosurg. 1980; 53: 12-9.<br />
[9] Leitlinie Zervikales Wurzelkompressionsyndrom (Entwurf)<br />
DGNC, 2008.<br />
[10] AWMF: Leitlinie Zervikale Spondylotische Myelopathie,<br />
DGN, 2008.<br />
[11] Perlick L, Zan<strong>der</strong> D, Kraft N, Wallny T, Diedrich O,<br />
Schmitt O. Operative Ergebnisse <strong>der</strong> monosegmentalen<br />
ventralen Fusion mit Plattenosteosynthese bei <strong>der</strong> therapieresistenten<br />
chronischen Zervikobrachialgie. Z Orthop.<br />
2000; 138: 452-8.<br />
Kontakt<br />
Dr. Gerd Manthei<br />
Sektionsleiter Neurochirurgie<br />
ASKLEPIOS <strong>Klinik</strong> St. Georg<br />
Tel. (0 40) 18 18-85 24 12<br />
Fax (0 40) 18 18-85 34 37<br />
E-Mail: g.manthei@asklepios.com
Marketing o<strong>der</strong> echter Fortschritt?<br />
Der erreichte Stand <strong>der</strong> laparoskopischen<br />
Weiterentwicklungen<br />
Die neuen Techniken lassen sich in drei<br />
Gruppen zusammenfassen:<br />
■ NOTES (natural orifice transluminal<br />
endoscopic surgery):<br />
Narbenfreies Operieren über natürliche<br />
Körperöffnungen wie Magen o<strong>der</strong> Rektum<br />
bei beiden Geschlechtern o<strong>der</strong> die<br />
Scheide <strong>der</strong> Frau<br />
■ SILS/LESS (single incision laparoscopic<br />
surgery/laparoendoscopic single site<br />
surgery): Operieren über eine bis zu<br />
30 mm grosse Inzision am Nabel, wobei<br />
zur Erleichterung <strong>der</strong> technisch komplizierteren<br />
Verfahren neue Instrumente,<br />
z. B. mit winkelbaren Griffen verwendet<br />
werden<br />
■ „Hybrid“-Techniken (auch e-NOTES):<br />
Kombinationen bei<strong>der</strong> Techniken mit<br />
meist transvaginalem Zugang sowie<br />
einem umbilikalen 5-mm-Trokar.<br />
Bei NOTES-Eingriffen kommen flexible<br />
Instrumente <strong>aus</strong> <strong>der</strong> Endoskopie zum Einsatz.<br />
Auch erfahrene Gastroenterologen<br />
und Laparoskopeure erreichen hierbei<br />
jedoch nur schwer eine <strong>aus</strong>reichende Stabilität<br />
<strong>für</strong> eine optimale Gewebedissektion.<br />
Erste Berichte zeigen prohibitiv hohe Komplikationsraten.<br />
[1] Im Gegensatz dazu ist<br />
eine rasche Zunahme von SILS- und<br />
Hybrid-Techniken zu verzeichnen. Hierbei<br />
kommen starre o<strong>der</strong> abwinkelbare Instrumente<br />
zum Einsatz, die bereits <strong>aus</strong> <strong>der</strong><br />
konventionellen Laparoskopie bekannt<br />
sind (Abb. 1). Bei guten laparoskopischen<br />
Vorkenntnissen gestaltet sich die praktische<br />
Umsetzung dieser neuen Techniken<br />
<strong>aus</strong> unserer Erfahrung meist problemlos.<br />
Auch größere Eingriffe sind machbar.<br />
Neue Instrumente versprechen kürzere<br />
Operationszeiten, schnellere Lernkurven<br />
und weniger Komplikationen.<br />
Allgemein- und Viszeralchirurgie<br />
Single Port Surgery macht Fortschritte – aber es gibt noch viele Fragezeichen<br />
Axel Mahn<br />
Prof. Dr. Friedrich Kallinowski<br />
Laparoskopische Operationen, zum Beispiel zur Entfernung <strong>der</strong> Gallenblase, sind heute in den meisten <strong>Klinik</strong>en<br />
Standard. Neue minimalinvasive Operationstechniken scheinen nun rasend schnell um sich zu greifen, so dass<br />
man meinen könnte, die konventionell laparoskopische Operationsweise wäre bereits überholt. Naturgemäß<br />
fasziniert die heutige Weiterentwicklung hin zu einem Zugang, vielleicht sogar zur Nutzung einer natürlichen<br />
Körperöffnung zur narbenfreien Chirurgie, Laien und Fachleute gleichermaßen. Experten sehen aber neben <strong>der</strong><br />
spannenden Technik auch eine verlängerte Lernkurve, längere Operationszeiten, erhöhte Kosten und möglicherweise<br />
erhöhte Komplikationsraten. In einer Zeit, in <strong>der</strong> Patienten das Krankenh<strong>aus</strong> nach schonenden offenen<br />
Operationen, Frühmobilisation und raschem Kostaufbau in <strong>der</strong> Regel am siebten postoperativen Tag auch nach<br />
größeren Eingriffen wie<strong>der</strong> verlassen, fällt es schwer, Vorteile laparoskopischer Entwicklungen zu belegen.<br />
Welche Weiterentwicklungen sind denn vor dem Hintergrund des erreichten hervorragenden Standards beson<strong>der</strong>s<br />
vielversprechend?<br />
Weniger als minimal-invasiv?<br />
Nach 20-jähriger Suche nach dem echten<br />
Vorteil <strong>der</strong> laparoskopischen Operation<br />
wurde festgestellt, dass die Rate an Narbenbrüchen<br />
und die Häufigkeit von Adhäsionen<br />
durch die Bauchspiegelung vermin<strong>der</strong>t<br />
werden. Folgerichtig versucht man<br />
nun, die Anzahl <strong>der</strong> Zugänge bei laparoskopischen<br />
Operationen weiter zu reduzieren,<br />
um diese Vorteile <strong>aus</strong>zubauen. Der<br />
Hauptgrund des klinischen Erfolges <strong>der</strong><br />
laparoskopischen Technik gegenüber <strong>der</strong><br />
offenen Chirurgie liegt nämlich nicht im<br />
besseren kosmetischen Effekt, son<strong>der</strong>n in<br />
<strong>der</strong> rascheren postoperativen Erholung,<br />
<strong>der</strong> vermin<strong>der</strong>ten post-operativen Darmparalyse<br />
sowie <strong>der</strong> Reduktion von Wundinfekten<br />
und Narbenhernien. Sind diese<br />
Vorteile wie im Fall <strong>der</strong> Appendektomie<br />
nicht nachweisbar, wird die Technik nicht<br />
weiter <strong>aus</strong>gebaut. [2] An dieser Stelle beginnen<br />
die Fragezeichen, die nur über die<br />
789
Medtropole | Ausgabe 21 | April 2010<br />
Abb. 1: Single Port Laparoskopische Sigmaresektion erweitert mit Hemikolektomie links bei schwerer Divertikulitis an <strong>der</strong> <strong>Asklepios</strong> <strong>Klinik</strong> Harburg im Februar 2010;<br />
man sieht links das Aufsetzen des vorbereiteten Gelports (Applied Medical), rechts den Situs während <strong>der</strong> Präparation<br />
sorgfältige Analyse <strong>der</strong> Vorgehensweise in<br />
jedem einzelnen Verfahren zu beseitigen<br />
sind.<br />
Für die laparoskopische Cholecystektomie<br />
ist klar, dass <strong>der</strong> Übergang von einer offenen<br />
zu einer laparoskopischen Technik<br />
eine Reduktion <strong>der</strong> Narbenbrüche, aber<br />
auch eine Erhöhung <strong>der</strong> Rate an Gallenwegsverletzungen<br />
gebracht hat. Für die<br />
laparoskopische Appendektomie ist ein<br />
genereller Vorteil nicht mehr nachweisbar.[2]<br />
Bei den laparoskopischen Kolonund<br />
Rektumresektionen wird bestenfalls<br />
ein gleichwertiger Therapiestandard<br />
erzielt. Für an<strong>der</strong>e Eingriffe liegen keine<br />
gesicherten Erkenntnisse vor. Ob bei <strong>der</strong><br />
Single Port-Technik ein – längerer – o<strong>der</strong><br />
bei <strong>der</strong> konventionell laparoskopischen<br />
Technik mehrere – kürzere – Zugänge<br />
„besser“ sind, ist vollständig ungeklärt.<br />
Trotzdem werden die neuen Techniken in<br />
Kursen vermittelt. Die Industrie begleitet<br />
die Einführung mit neuen Geräten, <strong>der</strong>en<br />
Nutzen nicht überprüft ist. Erwartet wird<br />
eine kürzere Erholungszeit <strong>der</strong> Patienten,<br />
aber über die Risiken <strong>der</strong> neuen Techniken<br />
wird wenig gesprochen.<br />
790<br />
Risiken <strong>der</strong> neuen Techniken<br />
■ Auch erfahrene laparoskopische Operateure<br />
benötigen eine gewisse Zeit,<br />
um sich an die notwendigen Arbeitsschritte<br />
zu gewöhnen. Hilfreich sind<br />
Beidhändigkeit und die Bereitschaft,<br />
mit gekreuzten Instrumenten zu arbeiten.<br />
Dies scheint eine Leistung zu sein,<br />
die nicht mehr alle Kandidaten <strong>aus</strong><br />
dem Stand erbringen können. Im Mittel<br />
resultiert eine verlängerte Lernkurve.<br />
■ Die Sicht wird durch die geringen<br />
Winkel <strong>der</strong> Instrumente zueinan<strong>der</strong><br />
eingeschränkt. Daher sind längere<br />
Operationszeiten bei einer SILS/LESS-<br />
Cholezystektomie gegenüber <strong>der</strong> konventionell<br />
laparoskopischen Operation<br />
einzukalkulieren. Bei einem straff organisierten<br />
operativen Tagesprogramm<br />
wird die generelle Einführung <strong>der</strong><br />
Single Port Operationen zu einer Einschränkung<br />
<strong>der</strong> operativen Leistung<br />
führen.<br />
■ Dies führt zu einer Reduktion <strong>der</strong><br />
DRG-Erlöse und gemeinsam mit den<br />
Einmalmaterialien zu erhöhten Kosten<br />
in den INEK-Kalkulationshäusern.<br />
■ Eine längere Operationsdauer bedeutet<br />
auch längere Narkosezeiten, die bei<br />
dem Pneumoperitoneum immer auch<br />
längere kardiale Belastungen bedingen.<br />
■ Ob dadurch erhöhte Komplikationsraten<br />
o<strong>der</strong> eine strengere Patientenselektion<br />
in Kauf zu nehmen sind, ist noch<br />
ungeklärt.<br />
■ Sind Narbenbrüche bei längeren<br />
Zugängen o<strong>der</strong> Adhäsionsbeschwerden<br />
nach SILS-, LESS- o<strong>der</strong> Hybrid-Operationen<br />
wirklich seltener als bei <strong>der</strong> konventionellen<br />
laparoskopischen Technik?<br />
Man muss auch festhalten, dass die heutigen<br />
konventionell laparoskopischen Wahleingriffe<br />
mit abschließenden Hautverschlussmöglichkeiten<br />
vergleichbare<br />
günstige kosmetische Ergebnisse zeigen.<br />
Die Verwendung von Intracutannähten<br />
o<strong>der</strong> Steristrips im Bereich von 5-mm-<br />
Zugängen o<strong>der</strong> generell die Verwendung<br />
von Hautklebern führen zu ansprechenden<br />
Erscheinungsbil<strong>der</strong>n (Abb. 2). Patienten<br />
sind schon begeistert über die Tatsache,<br />
dass bei einem Hautverschluss we<strong>der</strong><br />
Klammern noch Fäden entfernt werden<br />
müssen. Die kleinen Zugänge verheilen<br />
regelhaft gut und führen zu exzellenten<br />
kosmetischen Resultaten.
Patientenselektion<br />
Patienten entscheiden sich <strong>für</strong> die neuen<br />
Verfahren bei sachgerechter Aufklärung<br />
nicht ohne Bedenken. Allerdings nehmen<br />
Patienten auch eine Risikoerhöhung in<br />
Kauf, wenn sie von Vorteilen überzeugt<br />
sind. Schweizer Daten zeigen nicht überraschend,<br />
daß diese Bereitschaft abnimmt, je<br />
höher die eingegangenen Risiken beziffert<br />
werden. [3] Patienten sind zu 97 Prozent<br />
bereit, eine Erhöhung <strong>der</strong> Komplikationsrate<br />
auf drei Prozent hinzunehmen, wenn<br />
die Operation ohne Narben durchgeführt<br />
werden kann. Eine Erhöhung <strong>der</strong> Komplikationsrate<br />
auf neun Prozent führte in dieser<br />
Umfrage zu einer Abnahme <strong>der</strong> Akzeptanz<br />
auf drei Prozent. Einzelne <strong>Klinik</strong>en<br />
berichten, dass die weit überwiegende<br />
Zahl <strong>der</strong> Patienten die neuen Verfahren<br />
wünscht. Diese Einschätzung wird durch<br />
die Erkenntnis relativiert, dass die Laparoskopie<br />
nur gute Ergebnisse zeigt, wenn<br />
sie zügig und komplikationsarm durchgeführt<br />
werden kann. [4] Späte Konversionen<br />
können von prohibitiv hohen Komplikationsraten<br />
gefolgt sein. Daher sind schlankere<br />
und jüngere Patienten mit einfacheren<br />
Befunden eher geeignet, bei entsprechendem<br />
Wunsch mit einem Single Port- o<strong>der</strong><br />
einem Hybrid-Verfahren operiert zu werden.<br />
Fazit<br />
Der rasanten technischen Entwicklung<br />
mo<strong>der</strong>ner Laparoskopie und Endoskopie<br />
steht <strong>der</strong> deutliche Kostendruck des Ge -<br />
sundheitswesens gegenüber. Das Einweginstrumentarium<br />
<strong>für</strong> eine entsprechende<br />
Operation wird kaum durch eine Verkürzung<br />
<strong>der</strong> Liegezeit gegengerechnet werden<br />
können. Ausgewählte Patienten profitieren<br />
möglicherweise bereits jetzt von den mo -<br />
<strong>der</strong>nen Techniken. Das gemeinsame Interesse<br />
<strong>der</strong> Fachwelt und <strong>der</strong> Industrie wird<br />
die Entwicklung neuer Instrumente weiter<br />
vorantreiben. Beispiele sind winkelbare<br />
Optiken, geknickte Instrumente, innovative<br />
Seilzüge und Bewegungstechniken, robo -<br />
tergestützte Operationstechniken, gelartige<br />
Zugangssysteme und vieles an<strong>der</strong>e mehr.<br />
Die Zukunft hat begonnen und wir gestalten<br />
die Entwicklung mit.<br />
Kontakt<br />
Literatur<br />
Allgemein- und Viszeralchirurgie<br />
Abb. 2: Situs am dritten postoperativen Tag nach Single Port Operation (links) und nach konventionell laparoskopischer Sigmaresektion in <strong>der</strong> <strong>Asklepios</strong> <strong>Klinik</strong> Harburg<br />
im Februar 2010<br />
Prof. Dr. Friedrich Kallinowski<br />
Allgemein- und Viszeralchirurgie<br />
Eißendorfer Pferdeweg 52<br />
21075 Hamburg<br />
Tel. (0 40) 18 18-86 25 34<br />
Fax (0 40) 18 18-86 34 57<br />
E-Mail: f.kallinowski@asklepios.com<br />
[1] Nobutsugu A, Hirohisa T, Hisayo U et al. Single port<br />
endoscopic cholecystectomy: a bridge between laparoscopic<br />
and translumenal endoscopic surgery. J Hepatobiliary<br />
Pancreat Surg 2009; 16: 633-8.<br />
[2] Köckerling F, Schug-Paß C, Grund S. Laparoskopische<br />
Appendektomie – <strong>der</strong> neue Standard? Chirurg 2009; 80:<br />
594-601.<br />
[3] Hagen ME, Christen D, Morel P. Cosmetic issues of<br />
Notes: results of an enquiry for possible justification of<br />
NOTES approaches. Endoscopy 2008; 40: 581-3.<br />
[4] Farke S, Roblick UJ: Evidenzbasierte laparoskopische<br />
Chirurgie – Divertikulitis. Viszeralchirurgie 2006; 41: 258-61.<br />
791
Medtropole | Ausgabe 19 | Oktober 2009<br />
Graduierung von Stenosen<br />
<strong>der</strong> A. carotis interna<br />
Revision und Transferierung <strong>der</strong> DEGUM-Ultraschall-Kriterien<br />
in die NASCET-Definition<br />
Prof. Dr. Christian Arning<br />
Bisher bezogen sich die Ultraschallkriterien zur Graduierung von Karotisstenosen in Deutschland auf die lokale<br />
Durchmesserreduktion, entsprechend <strong>der</strong> in <strong>der</strong> europäischen ECST-Studie benutzten Definition. Um die Konfusion<br />
durch verschiedene, nebeneinan<strong>der</strong> benutzte Stenosegrad-Definitionen zu beseitigen, empfiehlt die interdisziplinäre<br />
S3-Leitlinienkonferenz „Karotisstenose“ nun die einheitliche Verwendung <strong>der</strong> in <strong>der</strong> amerikanischen NASCET-<br />
Studie verwendeten Systematik (distaler Stenosegrad).<br />
Wichtigstes Kriterium <strong>für</strong> die Entscheidung<br />
über invasive o<strong>der</strong> nicht-invasive Behandlung<br />
extrakranieller Stenosen <strong>der</strong> A. carotis<br />
interna ist <strong>der</strong> Stenosegrad. [1] Bei asymptomatischen<br />
Stenosen gilt darüber hin<strong>aus</strong> die<br />
rasche Zunahme des Stenosegrades als<br />
Indikator <strong>für</strong> ein erhöhtes Schlaganfallrisiko.<br />
[2] Bei <strong>der</strong> Stenosegradbestimmung ergeben<br />
sich aber nicht unerhebliche Probleme<br />
durch unterschiedliche Stenosegrad-Definitionen:<br />
Nach ECST wird <strong>der</strong> Stenosegrad<br />
in Relation zum ursprünglichen Lumen,<br />
nach NASCET in Relation zum distalen<br />
Lumen <strong>der</strong> A. carotis interna bestimmt<br />
(Abb. 1). [3,4] Für die radiologische Stenosegraduierung<br />
mit DSA, CTA und MRA hat<br />
sich die NASCET-Graduierung weitgehend<br />
durchgesetzt, während sich die Ultraschallkriterien<br />
<strong>der</strong> Deutschen Gesellschaft <strong>für</strong><br />
Ultraschall in <strong>der</strong> Medizin (DEGUM)<br />
weiterhin an ECST orientierten. [6] So kann<br />
dieselbe Stenose vom Radiologen mit 50<br />
Prozent (nach NASCET) und vom Ultraschall-Untersucher<br />
mit 70 Prozent (entsprechend<br />
ECST) graduiert werden.<br />
792<br />
Solange <strong>Ärzte</strong>n dieses Problem bewusst ist,<br />
ist eine Umrechnung von NASCET- auf<br />
ECST-Definition möglich. [7] Werden die<br />
verschiedenen Definitionen aber nicht<br />
beachtet, ist mit einer fehlerhaften Indikationsstellung<br />
zu Interventionen zu rechnen.<br />
Deshalb soll künftig nur noch die Graduierung<br />
anhand <strong>der</strong> NASCET-Definition<br />
verwendet werden.<br />
Die DEGUM-Stenosekriterien wurden<br />
anlässlich <strong>der</strong> Anpassung an die NASCET-<br />
Definition überarbeitet und in einer aktuellen<br />
Übersicht <strong>aus</strong>führlich erläutert. [8]<br />
An<strong>der</strong>s als in <strong>der</strong> angloamerikanischen<br />
Literatur, die im wesentlichen einen Parameter<br />
verwendet, um Stenosen oberhalb<br />
von 70 Prozent (NASCET) zu erfassen,<br />
ermöglicht <strong>der</strong> multiparametrische Ansatz<br />
<strong>der</strong> DEGUM-Graduierung die Beschreibung<br />
hochgradiger Stenosen in Zehn-Prozent-Schritten.<br />
(Tab. 1).<br />
Haupt- und Zusatzkriterien<br />
Alle sonographischen Kriterien haben ihre<br />
Grenzen und können, allein angewandt, zu<br />
Fehlbeurteilungen führen. Der große Vorteil<br />
<strong>der</strong> multiparametrischen Stenosegraduierung<br />
liegt darin, dass sich die verschiedenen<br />
Kriterien ergänzen. So ermöglicht die<br />
zusammenfassende synoptische Bewertung<br />
aller Befunde eine Einteilung in mehrere<br />
gut abgrenzbare Stenosegrade. Wegen<br />
<strong>der</strong> unterschiedlichen Zuverlässigkeit <strong>der</strong><br />
einzelnen Kriterien werden sie in Hauptund<br />
Zusatzkriterien differenziert.<br />
Hauptkriterien sind die Darstellung des<br />
Stenosebefundes im B-Bild beziehungsweise<br />
Farb-Doppler-Bild (zum Nachweis<br />
geringer Stenosebefunde und zur Unterscheidung<br />
zwischen Stenose und Gefäßverschluss),<br />
die Messung <strong>der</strong> Strömungsgeschwindigkeit<br />
im Stenosemaximum (<strong>für</strong><br />
mittelgradige und hochgradige Stenosen)<br />
(Abb. 2), die Messung <strong>der</strong> poststenotischen<br />
Strömungsgeschwindigkeit (zur Erkennung<br />
höchstgradiger Stenosen) sowie <strong>der</strong>
Abb. 1. Verschiedene Stenosegrad-Definitionen: Der<br />
lokale Stenosegrad (nach ECST) bezieht sich auf das<br />
ursprüngliche Lumen, <strong>der</strong> distale Stenosegrad (nach<br />
NASCET) auf das distale Lumen. D: distaler Gefäßdurchmesser,<br />
L: lokaler Gefäßdurchmesser, R: residualer<br />
Gefäßdurchmesser. [5]<br />
Nachweis beziehungsweise das Fehlen von<br />
Kollateralkreisläufen.<br />
Als Zusatzkriterien werden indirekte Stenosezeichen<br />
an <strong>der</strong> A. carotis communis<br />
berücksichtigt, außerdem <strong>der</strong> Nachweis<br />
von Strömungsstörungen, die diastolische<br />
Strömungsgeschwindigkeit, das Konfetti-<br />
Zeichen und gegebenfalls Stenoseindizes.<br />
Die Zusatzkriterien erhöhen die Sicherheit<br />
des Befundes, indem sie die Hauptkriterien<br />
ergänzen, und haben beson<strong>der</strong>e Bedeutung<br />
bei Mehrgefäßprozessen.<br />
DEGUM-Kriterien<br />
Mit dem multiparametrischen Konzept<br />
<strong>der</strong> DEGUM-Kriterien liegen inzwischen<br />
umfangreiche Erfahrungen über einen<br />
Zeit raum von fast 25 Jahren vor: Sie zeigen,<br />
dass Ultraschall eine hervorragende<br />
Methode zur Stenosegraduierung ist, wenn<br />
eine differenzierte synoptische Beurteilung<br />
mit verschiedenen hämodynamischen und<br />
Bildkriterien erfolgt. Wie bei allen diagnostischen<br />
Verfahren sind valide Befunde nur<br />
bei qualifizierter Anwendung durch einen<br />
gut <strong>aus</strong>gebildeten und erfahrenen Unter -<br />
sucher zu erwarten. Dann ist die Sonographie<br />
aber ein äußerst valides Verfahren zur<br />
Diagnostik von Stenoseprozessen an <strong>der</strong><br />
A. carotis, das den Einsatz <strong>der</strong> risikobehafteten<br />
intraarteriellen Angiographie auf<br />
wenige sehr spezielle Fragestellungen<br />
beschränkt.<br />
Literatur<br />
[1] Arning C. Behandlung von Karotisstenosen. Dtsch Med<br />
Wochenschr 2005; 130: 2513-7.<br />
[2] Hennerici M, Hülsbömer HB, Hefter H, Lammerts D,<br />
Rautenberg W. Natural history of asymptomatic extracranial<br />
arterial disease. Results of a long-term prospective study.<br />
Brain 1987;110: 777-91.<br />
[3] ECST Collaborative Group. Randomised trial of endarterectomy<br />
for recently symptomatic carotid stenosis: final<br />
results of the MRC European Carotid Surgery Trial (ECST).<br />
Lancet 1998; 351: 1379-87.<br />
[4] North American Symptomatic Carotid Endarterectomy<br />
Trial Collaborators. Beneficial effect of carotid endarterectomy<br />
in symptomatic patients with high-grade carotid stenosis.<br />
N Engl J Med 1991; 325: 445-53.<br />
[5] Arning C. Farbkodierte Duplexsonographie <strong>der</strong> hirnversorgenden<br />
Arterien, 3. Auflage. Stuttgart – New York: Thieme;<br />
2002<br />
Abb. 2: Ultraschallbefund einer<br />
mittelgradigen Karotisstenose von<br />
etwa 50 Prozent (nach NASCET)<br />
Neurologie<br />
Tab. 1: Stenosegraduierung <strong>der</strong> A. carotis interna (<strong>aus</strong> [8])<br />
Stenosegrad (NASCET-Definition) [%] 10 20 – 40 50 60 70 80 90 Verschluss<br />
Stenosegrad alt (ECST-Definition) [%] 45 50 – 60 70 75 80 90 95 Verschluss<br />
1. B-Bild +++ +<br />
2. Farb-Doppler-Bild + +++ + + + + + +++<br />
3. Syst. Spitzengeschwindigkeit<br />
im Stenosemaximum [cm/s] ca.<br />
200 250 300 350 – 400 100 – 500<br />
Haupt -<br />
kriterien<br />
Zusatzkriterien<br />
4. Syst. Spitzengeschwindigkeit<br />
poststenotisch [cm/s]<br />
5. Kollateralen und Vorstufen<br />
(Periorbitalarterien/ACA)<br />
6. Diastolische Strömungsverlangsamung<br />
prästenotisch (ACC)<br />
7. Strömungsstörungen<br />
poststenotisch<br />
8. Enddiastolische Strömungsgeschwindigkeit<br />
im Stenose -<br />
maximum [cm/s] ca.<br />
[6] Wid<strong>der</strong> B, von Reutern GM, Neuerburg-Heusler D.<br />
Morphologische und dopplersonographische Kriterien zur<br />
Bestimmung von Stenosierungsgraden an <strong>der</strong> A. carotis<br />
interna. Ultraschall in Med 1986; 7: 70-5.<br />
[7] Rothwell PM, Gibson RJ, Slattery J, Sellar RJ, Warlow<br />
CP. Equivalence of measurements of carotid stenosis. A<br />
comparison of three methods on 1001 angiograms. European<br />
Carotid Surgery Trialists' Collaborative Group. Stroke<br />
1994; 25: 2435-9.<br />
[8] Arning C, Wid<strong>der</strong> B, von Reutern GM, Stiegler H, Görtler<br />
M. Ultraschallkriterien zur Graduierung von Stenosen<br />
<strong>der</strong> A. carotis interna. Revision <strong>der</strong> DEGUM-Kriterien und<br />
Transfer in NASCET-Stenosierungsgrade. Ultraschall in<br />
Med 2010; 31 (im Druck).<br />
Kontakt<br />
>50
Medtropole | Ausgabe 21 | April 2010<br />
KONTAKT<br />
Prof. Dr. Ulrich Budde<br />
Hämostaseologie<br />
MEDILYS Laborgesellschaft mbH<br />
Paul-Ehrlich-Straße 1<br />
22763 Hamburg<br />
Tel. (0 40) 18 18-81 59 75<br />
Fax (0 40) 18 18-81 49 48<br />
E-Mail: u.budde@asklepios.com<br />
Prof. Dr. Ulrich Budde<br />
MEDILYS:<br />
Neuer Leiter <strong>für</strong> Hämostaseologie<br />
Prof. Dr. Ulrich Budde leitet seit Januar<br />
den Bereich Hämostaseologie bei MEDI-<br />
LYS. Budde wurde 1944 in Olsberg geboren,<br />
wuchs in Dortmund auf und studierte<br />
Humanmedizin in Bonn. Nach zwei Jahren<br />
Weiterbildung in <strong>der</strong> Anästhesie des Krankenh<strong>aus</strong>es<br />
Düren nahm er 1975 die Weiterbildung<br />
zum Arzt <strong>für</strong> Transfusionsmedizin<br />
im Institut <strong>für</strong> Experimentelle Hämatologie<br />
und Transfusionsmedizin <strong>der</strong> Universität<br />
Bonn unter Prof. Egli auf. 1984 erhielt er<br />
den Johann-Lukas-Schoenlein-Preis und<br />
begann eine langjährige Zusammenarbeit<br />
mit Ted Zimmerman und Zaverio Ruggeri<br />
in <strong>der</strong> Scripps Research Foundation im<br />
kalifornischen La Jolla. 1985 habilitierte<br />
sich Budde mit <strong>der</strong> Arbeit „Das von-Willebrand-Syndrom:<br />
Diagnose, Klassifikation<br />
und Therapie“. Im gleichen Jahr wechselte<br />
er in das Gerinnungslabor des UK Eppendorf,<br />
1986 wurde er dann Leiter <strong>der</strong> Transfusionsmedizin<br />
und Hämostaseologie des<br />
AK Harburg. 1997 wurde Budde zum Professor<br />
<strong>der</strong> Universität Hamburg berufen.<br />
1997 bis 2009 arbeitete er im nie<strong>der</strong>gelassenen<br />
Bereich in Hamburg. Bei MEDILYS<br />
wird Budde das diagnostische Angebot im<br />
Bereich <strong>der</strong> Spezialgerinnung erweitern.<br />
Da<strong>für</strong> steht am Standort Altona rund um<br />
die Uhr ein hochspezialisiertes Labor zur<br />
Verfügung. Ein weiterer wichtiger Aspekt<br />
seiner Arbeit ist die Durchführung großer<br />
Zulassungsstudien.<br />
794<br />
Dr. Jörg Elsner<br />
<strong>Asklepios</strong> <strong>Klinik</strong> St. Georg:<br />
Neuer Sektionsleiter <strong>der</strong><br />
Plastischen- und Handchirurgie<br />
Dr. Jörg Elsner, bisher Geschäftsführen<strong>der</strong><br />
Oberarzt am Diakoniekrankenh<strong>aus</strong> Rotenburg/Wümme,<br />
ist seit dem 1. April als<br />
neuer Sektionsleiter <strong>der</strong> Plastischen-,<br />
Rekonstruktiven- und Handchirurgie des<br />
Chirurgisch-Traumatologischen Zentrums<br />
an <strong>der</strong> <strong>Asklepios</strong> <strong>Klinik</strong> St. Georg tätig.<br />
Elsner wurde bei Köln geboren und wuchs<br />
in Bonn auf. Sein Studium <strong>der</strong> Human -<br />
medizin absolvierte er in Gießen und<br />
Würzburg sowie Teile seiner praktischen<br />
Ausbildung in <strong>der</strong> Schweiz. Seine chirur -<br />
gische Ausbildung absolvierte er unter<br />
an<strong>der</strong>em an den Universitätskliniken in<br />
Düsseldorf und Tübingen. Nach seiner<br />
Facharztanerkennung <strong>für</strong> Chirurgie erhielt<br />
er unter Prof. Dr. Peter Brüser am Malteser<br />
Krankenh<strong>aus</strong> in Bonn seine handchirurgische<br />
Ausbildung, bevor er ans <strong>Klinik</strong>um<br />
Bremen Mitte wechselte.<br />
Elsner ist Facharzt <strong>für</strong> Chirurgie/Hand -<br />
chirurgie und Facharzt <strong>für</strong> Plastische und<br />
Ästhetische Chirurgie. Zudem ist er<br />
ordentliches Mitglied mehrerer nationaler<br />
Fachgesellschaften und Autor bzw. Co-<br />
Autor diverser wissenschaftlicher Artikel<br />
und Studien. Elsner sieht seinen Tätigkeitsschwerpunkt<br />
sowohl in <strong>der</strong> akuten und<br />
elektiven Handchirurgie als auch in <strong>der</strong><br />
KONTAKT<br />
Dr. Jörg Elsner<br />
Fachbereich Plastische, Rekonstruktive und<br />
Handchirurgie<br />
Chirurgisch-Traumatologisches Zentrum<br />
<strong>Asklepios</strong> <strong>Klinik</strong> St. Georg<br />
Tel. (0 40) 18 18-85 24 12<br />
Fax (0 40) 18 18-85 34 37<br />
E-Mail: jo.elsner@asklepios.com<br />
mo<strong>der</strong>nen rekonstruktiven Chirurgie des<br />
Weichgewebes inklusive <strong>der</strong> mikrochirurgischen<br />
Rekonstruktion durch Eigen -<br />
gewebstransfer. Ein weiterer Tätigkeits -<br />
bereich in <strong>der</strong> <strong>Asklepios</strong> <strong>Klinik</strong> St. Georg<br />
wird die elektive Vorfußchirurgie sein. Er<br />
verfügt über die volle Zulassung nach § 37<br />
<strong>der</strong> Berufsgenossenschaften <strong>für</strong> schwere<br />
Handverletzungen.
Dr. Christoph Goetz Prof. Dr. Christian Wülfing<br />
<strong>Asklepios</strong> <strong>Klinik</strong> Harburg:<br />
Neue Sektion Neurochirurgie<br />
Am 1. April 2010 übernahm Dr. Christoph<br />
Goetz, bisher Chefarzt <strong>der</strong> Neurochirurgie<br />
in <strong>der</strong> ENDO-<strong>Klinik</strong> Hamburg, die Leitung<br />
<strong>der</strong> neuen Sektion Neurochirurgie unter<br />
dem Dach <strong>der</strong> Abteilung <strong>für</strong> Orthopädie<br />
und Unfallchirurgie in <strong>der</strong> <strong>Asklepios</strong> <strong>Klinik</strong><br />
Harburg. Nach seinem Medizinstudium in<br />
Göttingen und Lübeck begann Dr. Goetz<br />
seine ärztliche Weiterbildung an <strong>der</strong> <strong>Klinik</strong><br />
<strong>für</strong> Neurochirurgie <strong>der</strong> Medizinischen<br />
Hochschule Hannover unter Prof. Hermann<br />
Dietz. 1991 promovierte er an <strong>der</strong><br />
<strong>Klinik</strong> <strong>für</strong> Augenheilkunde, 1993 erwarb er<br />
die Zusatzbezeichnung Rettungsmedizin<br />
und 1995 die Facharztanerkennung <strong>für</strong><br />
Neurochirurgie. Ab 1996 baute Dr. Goetz<br />
als Leiten<strong>der</strong> Oberarzt mit Prof. Sollmann<br />
die neu eingerichtete Neurochirurgische<br />
<strong>Klinik</strong> des Städtischen <strong>Klinik</strong>ums Braunschweig<br />
auf. Währenddessen erwarb er die<br />
Anerkennung „Spezielle Neurochirurgische<br />
Intensivmedizin“ und schloss eine Ausbildung<br />
„Ärztliches Qualitätsmanagement“<br />
<strong>der</strong> nie<strong>der</strong>sächsischen <strong>Ärzte</strong>kammer ab.<br />
2005 wechselte Dr. Goetz als Chefarzt an<br />
die Hamburger ENDO-<strong>Klinik</strong>. In <strong>der</strong><br />
<strong>Asklepios</strong> <strong>Klinik</strong> Harburg wird Dr. Goetz<br />
neue Schwerpunkte in den Bereichen<br />
Mikrochirurgie <strong>der</strong> Wirbelsäule, Bandscheibenersatz,<br />
Behandlung von Instabilitäten<br />
<strong>der</strong> Wirbelsäule, Hirnchirurgie und<br />
Eingriffe an den Peripheren Nerven aufbauen.<br />
Seine Sektion wird auch an <strong>der</strong> Versorgung<br />
von Wirbelsäulen- und Schädelverletzungen<br />
beteiligt sein. Neben seinen<br />
Aufgaben in <strong>der</strong> <strong>Asklepios</strong> <strong>Klinik</strong> ist Dr.<br />
Goetz als Entwickler von Wirbelsäulen -<br />
implantaten, Gutachter und Betreuer von<br />
Boxern des Boxstalls Universum sowie als<br />
Ringarzt tätig.<br />
KONTAKT<br />
Dr. Christoph Goetz<br />
Sektionsleiter Neurochirurgie<br />
Abt. <strong>für</strong> Orthopädie und Unfallchirurgie<br />
<strong>Asklepios</strong> <strong>Klinik</strong> Harburg<br />
Eißendorfer Pferdeweg 52, 21075 HH<br />
Tel. (0 40) 18 18-86 27 98<br />
Fax (0 40) 18 18-86 30 80<br />
Terminvergabe: (0 40) 18 18-86 23 02<br />
E-Mail ch.goetz@asklepios.com<br />
<strong>Asklepios</strong> <strong>Klinik</strong> Altona:<br />
Neue Leitung <strong>der</strong> Urologie<br />
Am 1. April 2010 übernahm Prof. Dr.<br />
Chris tian Wülfing als Nachfolger von Prof.<br />
Dr. Hermann Becker die Leitung <strong>der</strong> urologischen<br />
Abteilung in <strong>der</strong> <strong>Asklepios</strong> <strong>Klinik</strong><br />
Altona. Der bisherige leitende Oberarzt in<br />
<strong>der</strong> <strong>Klinik</strong> und Poliklinik <strong>für</strong> Urologie am<br />
Universitätsklinikum Münster wurde 1972<br />
in Hiltrup geboren, studierte an <strong>der</strong> Westfälischen-Wilhelms-Universität<br />
in Münster,<br />
London, Basel und Providence (USA).<br />
Wülfing promovierte bei Prof. Hertle in<br />
Münster zum Thema „Immunhistochemische<br />
Untersuchungen von Metallothionein<br />
und des p53-Tumor-Suppressor-Gens an<br />
Harnblasenkarzinomen“ (Summa cum<br />
laude) und absolvierte dort auch seine<br />
Weiterbildung zum Facharzt <strong>für</strong> Urologie.<br />
2005 folgten die Habilitation mit dem<br />
Thema „Molekulare Prognosemarker des<br />
invasiven Harnblasenkarzinoms und <strong>der</strong>en<br />
Bedeutung <strong>für</strong> eine molekulare Therapie“,<br />
die Erteilung <strong>der</strong> Venia legendi <strong>für</strong> das<br />
Fach Urologie und die Ernennung zum<br />
Oberarzt <strong>der</strong> <strong>Klinik</strong> und Poliklinik <strong>für</strong><br />
Urologie.<br />
2006 erhielt Wülfing die Zusatzbezeichnung<br />
„Medikamentöse Tumortherapie“<br />
und 2008 die <strong>für</strong> „Spezielle Urologische<br />
Chirurgie“. Im Januar 2008 wurde er zum<br />
leitenden Oberarzt <strong>der</strong> <strong>Klinik</strong> und Poliklinik<br />
ernannt, im Oktober 2009 zum Außerplanmäßigen<br />
Professor <strong>der</strong> Medizinischen<br />
Fakultät <strong>der</strong> Westfälischen-Wilhelms-Universität<br />
Münster berufen. Wegen seiner<br />
didaktischen Fähigkeiten erhielt er im<br />
Jahre 2003 den Preis „Lehrer des Jahres“<br />
<strong>der</strong> medizinischen Fakultät. Wülfings wissenschaftliche<br />
Schwerpunkte umfassen<br />
unter an<strong>der</strong>en die Molekularbiologie und<br />
KONTAKT<br />
Prof. Dr. Christian Wülfing<br />
Abteilung <strong>für</strong> Urologie<br />
<strong>Asklepios</strong> <strong>Klinik</strong> Altona<br />
Paul-Ehrlich-Straße 1<br />
22763 Hamburg<br />
Tel. (0 40) 18 18-81 16 61<br />
Fax (0 40) 18 18-81 49 10<br />
Ambulanz (0 40) 18 18-81 42 02<br />
E-Mail: c.wuelfing@asklepios.com<br />
Personalia<br />
Prognosefaktoren urologischer Tumore, die<br />
„Molecular Targeted Therapy“ des Nierenzellkarzinoms<br />
sowie die Chemotherapie<br />
des hormonrefraktären Prostatakarzinoms<br />
und des Harnblasenkarzinoms. Er be -<br />
herrscht das gesamte Spektrum <strong>der</strong> ope -<br />
rativen und konservativen Urologie, seine<br />
klinischen Schwerpunkte liegen in <strong>der</strong><br />
urologischen Laparoskopie (retroperito -<br />
neoskopische Nierenchirurgie und lapa -<br />
roskopische Prostatektomie EERPE), <strong>der</strong><br />
Endourologie (PCNL, flexible URS, Laser -<br />
lithotripsie, HAL-TURB) und <strong>der</strong> Uro -<br />
onkologie (radikale Tumorchirurgie, medikamentöse<br />
Tumortherapie).<br />
Wülfing ist Mitglied mehrerer nationaler<br />
und internationaler Fachgesellschaften und<br />
Autor zahlreicher wissenschaftlicher Artikel<br />
und Buchbeiträge. In <strong>der</strong> <strong>Asklepios</strong> <strong>Klinik</strong><br />
Altona möchte Prof. Wülfing das medizinische<br />
Angebot <strong>aus</strong>bauen und um die<br />
Schwerpunkte Uroonkologie und Laparoskopie<br />
erweitern.<br />
795
Medtropole | Ausgabe 21 | April 2010<br />
Tuberkulose – ein Update<br />
Aktuelle Strategien <strong>für</strong> Diagnostik und Therapie<br />
Dr. Hanns Christian Lücking<br />
Prof. Dr. Hinrik von Wulffen<br />
Weltweit stellt die Tuberkulose neben AIDS und Malaria eine <strong>der</strong> größten Her<strong>aus</strong>for<strong>der</strong>ungen <strong>der</strong> Infektiologie<br />
dar, ein Drittel <strong>der</strong> Weltbevölkerung gilt als latent mit M. tuberculosis infiziert. [1] Dagegen ist <strong>der</strong> Rückgang <strong>der</strong><br />
Tuberkulose im 20. Jahrhun<strong>der</strong>t in Deutschland beeindruckend, und sicher verdanken wir diese Entwicklung <strong>der</strong><br />
Einführung hochpotenter Tuberkulostatika und eines Impfstoffes, aber auch den Än<strong>der</strong>ungen des Hygienebewusstseins<br />
und <strong>der</strong> tatsächlichen hygienischen Verhältnisse. Es ist an dieser Stelle aber auch wichtig, sich über den<br />
Charakter <strong>der</strong> Tuberkulose als einer Epidemie im Klaren zu sein. [2]<br />
Epidemiologie<br />
Epidemien beginnen unter bestimmten<br />
Vor<strong>aus</strong>setzungen irgendwann und ebben<br />
auch wie<strong>der</strong> ab (auch ohne Chemotherapie<br />
und ohne Impfung), meist als Folge eines<br />
gegenseitigen Anpassungsprozesses von<br />
Erreger und Wirt. Sie kehren zurück, sind<br />
mal stärker und mal schwächer. Es liegt in<br />
ihrer Natur, dass dies bei <strong>der</strong> Tuberkulose<br />
langsamer von statten geht als zum Beispiel<br />
bei Noroviren o<strong>der</strong> einer Grippe -<br />
pandemie. Während die sich über Monate<br />
bis Jahre erstrecken, bemisst sich eine<br />
Tuberkuloseepidemie über Jahrzehnte bis<br />
Jahrhun<strong>der</strong>te! Am Anfang stehen rasche<br />
töd liche Verläufe im Vor<strong>der</strong>grund, die<br />
Infektiosität ist noch gering, da es chronische<br />
Verläufe mit offener Lungentuberkulose<br />
zu diesem Zeitpunkt noch gar nicht<br />
gibt. Später, mit häufigen chronischen Verläufen,<br />
flacht die Mortalität ab, durch die<br />
chronischen Träger nimmt jedoch die In -<br />
fektiosität zu. Irgendwann lässt dann auch<br />
die Morbidität nach. Trifft die voranschreitende<br />
Epidemie auf eine neue, „jungfräuliche“<br />
Population, beginnt sie dort von vorn.<br />
Unsere Tb-Epidemie in Europa begann<br />
ungefähr Mitte des 18. Jahrhun<strong>der</strong>ts mit<br />
dem Beginn <strong>der</strong> industriellen Revolution in<br />
796<br />
England und den damit verbundenen sozialen<br />
Verwerfungen. An<strong>der</strong>e Teile Europas<br />
folgten entsprechend später. Nach Osteuropa<br />
gelangte die Tuberkulose erst spät, noch<br />
1880 war sie in Russland fast unbekannt.<br />
Wahrscheinlich wurde auch Spanien erst<br />
später erreicht. Die Sklaven <strong>aus</strong> Afrika<br />
waren bei ihrer Ankunft in Amerika völlig<br />
frei von Tuberkulose, Äquatorialafrika<br />
wurde wohl erst im 20. Jahrhun<strong>der</strong>t betroffen.<br />
Dies ist auch eine Erklärung, warum<br />
die Verquickung von Tuberkulose und HIV<br />
in Afrika beson<strong>der</strong>s verheerend ist: In Afrika<br />
stieß HIV auf eine Bevölkerung, die sich<br />
noch im aufsteigenden Schenkel <strong>der</strong> Tb-<br />
Pandemie befindet! Weltweit gesehen ist<br />
somit die Tuberkulose noch weiter auf<br />
dem Vormarsch, während sie bei uns in<br />
Deutschland immer weiter an Bedeutung<br />
verloren hat. Auch unsere eigenen Daten<br />
<strong>aus</strong> dem Hamburger Raum <strong>aus</strong> den vergangenen<br />
vier Jahren weisen weiter auf<br />
einen fallenden Trend hin (Abb. 1).<br />
Laut WHO sterben pro Jahr weltweit etwa<br />
drei Millionen Menschen an Tuberkulose,<br />
in Deutschland waren es im Jahr 2007 139.<br />
Weltweit rechnet man <strong>der</strong>zeit mit etwa<br />
neun Millionen Neuerkrankungen pro Jahr,<br />
in Deutschland waren es im Jahr 2007<br />
5.020. Das entspricht einer Inzidenz von<br />
6,1 pro 100.000 Einwohner. Führend sind<br />
dabei die Stadtstaaten, Hamburg an <strong>der</strong><br />
Spitze mit einer Inzidenz von 9,0 im Jahr<br />
2007. [3] Zum Vergleich: Die Inzidenzen in<br />
osteuropäischen Staaten liegen zum Teil<br />
deutlich über 50! So verwun<strong>der</strong>t es nicht,<br />
dass nahezu die Hälfte <strong>der</strong> Neuerkrankungen<br />
in Deutschland bei Bürgern <strong>aus</strong>ländischer<br />
Herkunft gefunden wird (43 Prozent<br />
im Jahr 2007).<br />
TNF-Antagonisten und Tuberkulose<br />
Seit nunmehr zwölf Jahren sind die ersten<br />
TNF-Antagonisten auf dem Markt. Mittlerweile<br />
werden sehr viele Patienten mit diesen<br />
so genannten Biologika behandelt. Das<br />
Indikationsspektrum umfasst neben <strong>der</strong><br />
Rheumatoiden Arthritis und an<strong>der</strong>en rheumatischen<br />
Erkrankungen auch die Psoriasis<br />
und chronisch entzündliche Darmerkrankungen<br />
und somit große Patientenpopulationen.<br />
Bereits relativ früh wurden unter<br />
diesen Therapien Reaktivierungen von<br />
Tuberkulose und an<strong>der</strong>en granulomatösen<br />
Erkrankungen wie Listeriose beobachtet.<br />
Tumornekrosefaktor (TNF) spielt eine zentrale<br />
Rolle bei <strong>der</strong> initialen Immunantwort<br />
gegenüber Infektionen. Bei <strong>der</strong> Tuberkulose<br />
bewirkt TNF eine Aktivierung von<br />
Makrophagen, Rekrutierung weiterer Zel-
len, die Granulombildung sowie die Aufrechterhaltung<br />
<strong>der</strong> Integrität <strong>der</strong> Granulome.<br />
Inzwischen weiß man aber auch, dass es<br />
erhebliche Unterschiede zwischen den Präparaten<br />
gibt: Präparate, die <strong>aus</strong> monoklonalen<br />
Antikörpern gegen TNF bestehen<br />
(z. B. Infliximab o<strong>der</strong> Adalimumab), führen<br />
sehr viel häufiger zu Reaktivierungen als<br />
Präparate wie Etanercept, die als lösliche<br />
TNF-Rezeptoren fungieren. [4] Das Auftreten<br />
und Fortschreiten klinisch apparenter Neuinfektionen<br />
begünstigen dagegen beide<br />
Arten von TNF-Antagonisten vermutlich<br />
gleichermaßen. Je mehr diese Medikamente<br />
auch in Län<strong>der</strong>n mit höherer Tbc-Inzidenz<br />
eingesetzt werden, desto häufiger<br />
wird wohl auch diese unerwünschte Ne -<br />
benwirkung auftreten. Vor einer Therapie<br />
mit TNF-Antagonisten werden Patienten<br />
deswegen heute auf das Vorliegen einer<br />
latenten Tuberkulose untersucht. Im positiven<br />
Fall wird meist eine mehrmonatige<br />
Chemoprävention mit Isoniazid (INH)<br />
empfohlen und <strong>der</strong> Beginn <strong>der</strong> Therapie<br />
mit TNF-Antagonisten um einen Monat<br />
verschoben. Bei Auftreten einer Tuberku -<br />
lose unter <strong>der</strong> Therapie sollten TNF-Antagonisten<br />
aber nicht unbedingt abgesetzt<br />
werden, da es sonst zu paradoxen Ver-<br />
schlechterungen <strong>der</strong> Tuberkulose kommen<br />
kann.<br />
Diagnostik<br />
Neben Mikroskopie (Abb. 2) und Kultur<br />
sind seit einigen Jahren auch molekular -<br />
biologische Verfahren fest im mykobakteriologischen<br />
Labor etabliert. Für den<br />
Direktnachweis von M. tuberculosis in<br />
Originalmaterialien stehen mehrere kommerzielle<br />
Testsysteme zur Verfügung, die<br />
überwiegend auf <strong>der</strong> Technik <strong>der</strong> Poly -<br />
merase-Kettenreaktion basieren. Vor allem<br />
auch <strong>aus</strong> Kostengründen sollten diese Tests<br />
aber nur restriktiv eingesetzt werden:<br />
■ zur Untersuchung (mikroskopisch<br />
negativer) respiratorischer Sekrete von<br />
Risikopatienten (z. B. Immunsupprimierte,<br />
Kin<strong>der</strong>)<br />
■ bei Verdacht auf ein schweres tuberkulöses<br />
Krankheitsbild (z. B. Meningitis,<br />
Generalisation)<br />
■ zur Abklärung mikroskopisch zweifelhafter<br />
Präparate.<br />
Der molekularbiologische Direktnachweis<br />
darf keinesfalls als Kulturersatz verwendet<br />
werden, da die verwendeten Nukleinsäure-<br />
Amplifikationstechniken (NAT) im Vergleich<br />
Labormedizin<br />
Abb. 1: Rückgang <strong>der</strong> Nachweise von M. tuberculosis<br />
(M. tub.) bei gleichbleiben<strong>der</strong> Nachweisrate von M.<br />
avium-intracellulare Komplex (MAI) und M. gordonae<br />
(M. gord.) im Einsendematerial des Tb-Labors von<br />
MEDILYS zwischen 2006 und 2009<br />
zur Kultur bei mikroskopisch negativen<br />
Proben lediglich eine Sensitivität von<br />
80 – 90 Prozent erreichen. Zudem wird<br />
immer eine bewachsene Kultur <strong>für</strong> die<br />
obligat durchzuführende Empfindlichkeitsprüfung<br />
benötigt. Da NAT-gestützte Verfahren<br />
auch Nukleinsäuren nicht mehr<br />
lebensfähiger Bakterien detektieren, eignen<br />
sie sich nicht zur Verlaufskontrolle einer<br />
antituberkulösen Therapie.<br />
Ein zweiter Einsatzbereich molekularbiologischer<br />
Verfahren ist die exakte Speziesbe -<br />
stimmung eines in <strong>der</strong> Kultur gewachsenen<br />
Mykobakteriums. Die molekularbiologischen<br />
Verfahren haben hier gegenüber den<br />
konventionellen, vor allem biochemischen<br />
Methoden den Vorteil, dass sie schneller<br />
und zumeist auch spezifischer sind. Zudem<br />
kann mit abgetötetem, nicht-infektiösem<br />
Bakterienmaterial gearbeitet werden.<br />
Antibiotikaresistenz ist bei M. tuberculosis<br />
mit spontanen Mutationen in bestimmten<br />
Genen assoziiert. Gut validierte kommerzielle<br />
Testsysteme erlauben <strong>der</strong>zeit den<br />
Nachweis von Isoniazid- und Rifampicinspezifischen<br />
Resistenzmutationen. Da<br />
diese Tests innerhalb von 24 Stunden ein<br />
Ergebnis liefern können, sind sie deutlich<br />
schneller als die eine Woche beanspruchen-<br />
797
Medtropole | Ausgabe 21 | April 2010<br />
de konventionelle Empfindlichkeitsprüfung<br />
im Flüssigmedium. Ursprünglich nur <strong>für</strong><br />
die Anwendung an Mykobakterienkulturen<br />
vorgesehen, wurden die Testsysteme<br />
inzwischen auch <strong>für</strong> Originalmaterialien<br />
validiert, was eine zusätzliche deutliche<br />
Zeitersparnis bedeutet. Molekularbiologische<br />
Resistenztestungen stellen <strong>der</strong>zeit<br />
aber nach wie vor nur eine Ergänzung <strong>der</strong><br />
<strong>aus</strong>führlichen konventionellen Empfindlichkeitsprüfung<br />
dar.<br />
Zur Diagnostik <strong>der</strong> latenten Tuberkulose<br />
stand bis vor wenigen Jahren nur <strong>der</strong><br />
Tuberkulin-Hauttest (THT) nach Mendel-<br />
Mantoux zur Verfügung. Er nutzt als Testprinzip<br />
die verzögerte allergische Reaktion<br />
vom zellvermittelten Typ (Typ IV nach<br />
Coombs). Ein wichtiger Nachteil des THT<br />
ist, dass auch Infektionen mit nicht-tuberkulösen<br />
Mykobakterien (NTM) – aufgrund<br />
gemeinsamer Antigene von NTM und M.<br />
tuberculosis – zu einem positiven Ergebnis<br />
im THT führen können. Analog dazu sind<br />
Antigengemeinsamkeiten von M. tuberculosis<br />
und M. bovis die Ursache positiver THT-<br />
Resultate bei BCG-geimpften Personen. Zu<br />
falsch-negativen Ergebnissen führt – neben<br />
Tuberkulin-Applikationsfehlern – insbeson<strong>der</strong>e<br />
eine abgeschwächte Immunkompetenz<br />
<strong>der</strong> getesteten Person.<br />
798<br />
Zwei neu entwickelte Testverfahren beruhen<br />
dagegen auf dem Nachweis von Interferon-<br />
Gamma (IFN-γ), welches im Rahmen einer<br />
M. tuberculosis-Infektion sensibilisierte<br />
T-Lymphozyten bei einem erneuten Antigenkontakt<br />
sezernieren. In vitro werden<br />
diese Lymphozyten mit <strong>für</strong> M. tuberculosis<br />
spezifischen Peptiden stimuliert, welche<br />
bei M. bovis und den NTM (<strong>aus</strong>genommen<br />
vier eher selten beim Menschen anzutreffende<br />
Arten) nicht vorkommen. Im „QuantiFERON<br />
® -TB Gold“ <strong>der</strong> Firma Cellestis<br />
wird anschließend direkt das sezernierte<br />
IFN-γ gemessen, im „T-SPOT ® .TB“ <strong>der</strong><br />
Firma Oxford Immunotec die Anzahl <strong>der</strong><br />
IFN-γ sezernierenden T-Lymphozyten<br />
bestimmt. Beide Testsysteme haben bei<br />
immunkompetenten Personen eine dem<br />
THT vergleichbare Sensitivität, bei immunsupprimierten<br />
Patienten zeigt die bisherige<br />
Datenlage eine Überlegenheit <strong>der</strong> IFN-γ-<br />
Tests an. Insbeson<strong>der</strong>e bei BCG-geimpften<br />
Personen sind beide Testsysteme im Vergleich<br />
zum THT deutlich spezifischer.<br />
Weitere Vorteile <strong>der</strong> IFN-γ-Tests sind,<br />
dass keine Anwendungsfehler (falsche<br />
Tuberkulin-Applikation, ungenaue Ablesung)<br />
das Testergebnis beeinflussen können<br />
und dass wegen des Fehlens einer<br />
Boosterreaktion beliebige Testwie<strong>der</strong>holungen<br />
möglich sind. Allerdings benötigt man<br />
Abb. 2: M. tuberculosis, Ziehl-Neelsen-Färbung (x 1000);<br />
(Quelle: CDC/Dr. G.P. Kubica, 1979)<br />
<strong>für</strong> die Tests ein qualitätsgesichertes Labor,<br />
und die beson<strong>der</strong>en Vorgaben hinsichtlich<br />
Blutentnahme und Transport sind strikt<br />
einzuhalten. Die Kosten <strong>für</strong> die Durchführung<br />
eines IFN-γ-Tests können zudem<br />
diejenigen des THT um ein Mehrfaches<br />
übersteigen. Wie <strong>der</strong> THT können auch die<br />
neuen Tests we<strong>der</strong> zwischen einer frischen<br />
und einer schon länger bestehenden Infektion<br />
noch zwischen einer latenten und<br />
einer aktiven Tuberkulose unterscheiden.<br />
Zur Abklärung einer latenten Tuberkulose<br />
gelten <strong>der</strong>zeit folgende Empfehlungen: [5]<br />
Zunächst sollte ein THT durchgeführt<br />
werden. Ergibt die Ablesung einen Indurationsdurchmesser<br />
> 5 mm, ist anschließend<br />
ein IFN-γ-Test als Bestätigungstest zu veranlassen.<br />
Bei Personen mit bekannt positi -<br />
vem THT nach früherer BCG-Impfung und<br />
Personen mit abgeschwächter Immun kom -<br />
petenz wie HIV-Infizierten, Hämodialyse -<br />
patienten o<strong>der</strong> Patienten vor Therapie mit<br />
TNF-α-Inhibitoren [6] sollte jedoch direkt<br />
ein IFN-γ-Test durchgeführt werden. Dies<br />
gilt auch <strong>für</strong> wie<strong>der</strong>holte Umgebungsuntersuchungen<br />
bei medizinischem Personal<br />
(keine Boosterreaktion bei IFN-γ-Tests!).
Initialtherapie Erhaltungstherapie<br />
2 Monate 4 Monate<br />
Isoniazid Isoniazid<br />
Rifampicin<br />
Pyrazinamid<br />
Rifampicin<br />
Ethambutol [7]<br />
Therapie<br />
Während weltweit bedrohliche Zahlen<br />
über zunehmende Multiresistenzen von<br />
M. tuberculosis bis hin zu extrem resistenter<br />
Tuberkulose (XDR-TB) gemeldet werden,<br />
kommt man bei uns mit dem Standardschema<br />
(Tab. 1) nach wie vor gut zurecht.<br />
Monoresistenzen gegen eines <strong>der</strong> fünf<br />
Standardmedikamente, vor allem gegen<br />
INH, sehen wir gelegentlich (etwa fünf<br />
Prozent), Multiresistenzen (MDR-TB:<br />
gleichzeitige Resistenz gegen Isoniazid<br />
und Rifampicin sowie gegebenenfalls<br />
wei tere Tuberkulostatika <strong>der</strong> ersten Wahl)<br />
praktisch gar nicht.<br />
Bei Patienten <strong>aus</strong> dem Ausland, insbeson<strong>der</strong>e<br />
<strong>aus</strong> den Nachfol ge staaten <strong>der</strong> ehemaligen<br />
Sowjetunion o<strong>der</strong> auch <strong>aus</strong> Asien<br />
o<strong>der</strong> Afrika, sowie bei The rapieversagern<br />
ist aber Vorsicht geboten. Liegt ein voll<br />
empfindliches Austestungs ergebnis vor,<br />
reduziert man die Kombinationstherapie<br />
auch schon während <strong>der</strong> Initialphase auf<br />
eine Dreifachkombination (INH, RMP,<br />
PZA). Bestehen unter viermonatiger, korrekt<br />
durchgeführter Therapie noch positive<br />
Sputumkulturen, liegt definitionsgemäß<br />
ein Therapieversagen vor. Bei gleichzeitigem<br />
Vorliegen einer HIV-Infektion sollte<br />
Tab. 1: Standardschema <strong>für</strong> die Therapie <strong>der</strong><br />
Lungen tuberkulose mit den oral verfügbaren<br />
Erstlinienmedikamenten<br />
immer ein Arzt mit Erfahrung in dieser<br />
schwierig zu behandelnden Koinfektion<br />
hinzugezogen werden.<br />
Ausblick<br />
Trotz großer Erfolge bei <strong>der</strong> Bekämpfung<br />
<strong>der</strong> Tuberkulose im vergangenen Jahrhun<strong>der</strong>t<br />
vor allem in Europa und Amerika<br />
haben wir heute weltweit mehr Tuberkulosekranke<br />
als je zuvor. Es bleibt zu hoffen,<br />
dass die von <strong>der</strong> WHO und an<strong>der</strong>en<br />
Organisationen gerade in den ver-gangenen<br />
Jahren aufgelegten Programme und<br />
zur Verfügung gestellten Gel<strong>der</strong> dazu<br />
führen, dass in absehbarer Zeit neue<br />
Tuberkulostatika und wirksame Impfstoffe<br />
entwickelt werden und vor allem in den<br />
am stärksten betroffenen Regionen die<br />
erfor<strong>der</strong>liche medizinische Infrastruktur<br />
aufgebaut werden kann.<br />
Kontakt<br />
Prof. Dr. Hinrik von Wulffen<br />
Dr. Hanns Christian Lücking<br />
Literatur<br />
Labormedizin<br />
MEDILYS Laborgesellschaft mbh<br />
Zentrales Labor, Bereich Mikrobiologie<br />
c/o <strong>Asklepios</strong> <strong>Klinik</strong> Altona<br />
Paul-Ehrlich-Straße 1<br />
22763 Hamburg<br />
Tel. (0 40) 18 18-81 59 51<br />
Fax (0 40) 18 18-81 49 37<br />
E-Mail: h.wulffen@asklepios.com<br />
c.luecking@asklepios.com<br />
[1] www.rki.de/cln_169/nn_274324/DE/Content/InfAZ/T/<br />
Tuberkulose/Download/TB2007,templateId=raw,property=<br />
publicationFile.pdf/TB2007.pdf<br />
[2] Bates JH, Stead WW. The history of tuberculosis as a<br />
global epidemic. Med Clin North Am 1993; 77: 1205-17.<br />
[3] www.rki.de/cln_169/nn_274324/DE/Content/Infekt/<br />
EpidBull/Merkblaetter/Ratgeber_Mbl_Tuberkulose.<br />
html#doc200728bodyText12<br />
[4] Wallis RS. Tumour necrosis factor antagonists: structure,<br />
function, and tuberculosis risks. Lancet Infect Dis 2008; 10:<br />
601-11.<br />
[5] Diel R, Forßbohm M, Loytved G et al. Deutsches Zentralkomitee<br />
zur Bekämpfung <strong>der</strong> Tuberkulose: Empfehlungen<br />
<strong>für</strong> die Umgebungsuntersuchungen bei Tuberkulose.<br />
Pneumologie 2007; 61: 440-55.<br />
[6] Diel R, Hauer B, Loddenkämper R, Manger B, Krüger<br />
K. Empfehlungen <strong>für</strong> das Tuberkulo-sescreening vor Gabe<br />
von TNF-α-Inhibitoren bei rheumatischen Erkrankungen.<br />
Pneumologie 2009; 63: 329-34.<br />
[7] Greinert U, Jafari C, Zabel P, Lange C. Therapie <strong>der</strong><br />
Tuberkulose. Pneumologe 2007; 4: 175-86.<br />
799
ISSN 1863-8341<br />
<strong>Klinik</strong>bewertung in <strong>der</strong> vierten Dimension<br />
Einweiserzufriedenheit –<br />
ein wichtiger Indikator <strong>für</strong> die<br />
Qualität einer <strong>Klinik</strong><br />
Frie<strong>der</strong>ike Schulz<br />
Wer die richtige <strong>Klinik</strong> <strong>für</strong> eine bestimmte<br />
Erkrankung sucht, muss sich auf individuelle<br />
Erfahrungen und subjektive Urteile Dritter<br />
verlassen, denn das Thema ist äußerst komplex.<br />
Eine echte Vergleichbarkeit von Einrichtungen<br />
gestaltet sich durch unterschiedliche Standards<br />
schwierig. Auch die gesetzlich vorgeschriebenen<br />
Qualitätsberichte tragen selbst bei Experten eher zur<br />
Verwirrung bei.<br />
Viele Patienten verlassen sich daher bei <strong>der</strong><br />
Wahl eines Krankenh<strong>aus</strong>es auf die Empfehlung<br />
ihres <strong>einweisende</strong>n Arztes. Aber<br />
wie zufrieden sind <strong>einweisende</strong> <strong>Ärzte</strong> mit<br />
einer <strong>Klinik</strong>? Für uns ist diese Information<br />
als Bestandteil einer 360°-Zufriedenheitsanalyse,<br />
die Patienten, Einweiser und Mitarbeiter<br />
berücksichtigt, ein wichtiges Indiz<br />
zur Verbesserung <strong>der</strong> Qualität und Ausrichtung<br />
<strong>der</strong> Kundenorientierung. Daher<br />
starten die <strong>Asklepios</strong> <strong>Klinik</strong>en im März<br />
2010 mit dem unabhängigen Befragungsinstitut<br />
Mecon Measure & Consult GmbH<br />
eine Erhebung <strong>der</strong> Einweiserzufriedenheit.<br />
Auf Basis eines gemeinsam entwickelten<br />
Fragebogens, <strong>der</strong> <strong>aus</strong>führlich verschiedene<br />
Aspekte von <strong>der</strong> Aufnahme (z. B. Wartezeit<br />
www.medtropole.de<br />
bis zu einem Aufnahmetermin)<br />
bis zur Entlassung (z. B.<br />
Zufriedenheit mit <strong>der</strong> Entlassungsmedikation)<br />
abfragt, werden die Ergebnisse auf<br />
Abteilungsebene <strong>aus</strong>gewertet und sowohl<br />
auf Konzernebene als auch mit einem großen<br />
Vergleichspool an<strong>der</strong>er <strong>Klinik</strong>en verglichen.<br />
Darüber hin<strong>aus</strong> werden zehn Qualitätsindikatoren<br />
nicht nur intern genutzt,<br />
son<strong>der</strong>n dienen auch als Grundlage einer<br />
neuen Dimension des <strong>Klinik</strong>vergleichs.<br />
Qualitätskliniken.de<br />
Gemeinsam mit den Sana <strong>Klinik</strong>en und <strong>der</strong><br />
Rhön-<strong>Klinik</strong>um AG wird <strong>Asklepios</strong> im<br />
Sommer 2010 ein neues <strong>Klinik</strong>portal im<br />
Internet in Betrieb nehmen.<br />
Das neue Portal Qualitätskliniken.de wird<br />
den Nutzer schnell zum Ziel führen. Nach<br />
individuellen Bedürfnissen und objektiven<br />
Kriterien lassen sich hier Krankenhäuser<br />
anhand von etwa 400 Qualitätsindikatoren<br />
<strong>aus</strong> vier Dimensionen vergleichen – bei<br />
Bedarf spezifisch eingegrenzt nach Ort,<br />
Fachrichtung, Erkrankung und Behandlung<br />
und unterstützt durch ein Körperschema.<br />
Der Nutzer hat so die Möglichkeit, unterschiedliche<br />
Ergebnisse einzusehen und zu<br />
vergleichen: medizinische Ergebnisqualität,<br />
Patientensicherheit, Patientenzufriedenheit<br />
und eben auch die Einweiserzufriedenheit.