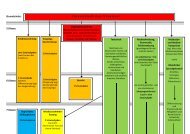
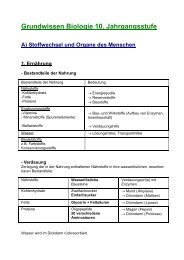
Grundwissen 9. Klasse NTG - Humboldt-gym.de
Grundwissen 9. Klasse NTG - Humboldt-gym.de
Grundwissen 9. Klasse NTG - Humboldt-gym.de
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
Die wichtigsten Säuren und Basen:<br />
Säuren:<br />
NAME FORMEL SÄUREREST NAME<br />
Salzsäure HCl Cl - Chlorid-Ion<br />
Schwefelsäure H 2 SO 4 HSO 4<br />
-<br />
SO 4<br />
2-<br />
Phosphorsäure H 3 PO 4 H 2 PO 4<br />
-<br />
2-<br />
HPO 4<br />
3-<br />
PO 4<br />
Salpetersäure HNO 3 NO 3<br />
-<br />
Hydrogensulfat-Ion<br />
Sulfat-Ion<br />
Dihydrogenphosphat-Ion<br />
Hydrogenphosphat-Ion<br />
Phosphat-Ion<br />
Nitrat-Ion<br />
Basen:<br />
Ammoniak NH 3<br />
Natronlauge<br />
Kalilauge<br />
NaOH<br />
KOH<br />
Kalkwasser (Calciumhydroxid) Ca(OH) 2<br />
<strong>9.</strong>5 Elektronenübergänge<br />
Redoxreaktionen:<br />
Redoxreaktionen sind Elektronenübertragungsreakionen. Sie laufen nach <strong>de</strong>m<br />
Donator-Akzeptor-Prinzip ab:<br />
• Oxidation: Abgabe von Elektronen; die Oxidationszahl wird erhöht<br />
• Reduktion: Aufnahme von Elektronen; die Oxidationszahl wird erniedrigt<br />
• Oxidationsmittel: Elektronenakzeptor<br />
• Reduktionsmittel: Elektronendonator<br />
z.B.<br />
Oxidation<br />
Reduktionsmittel: Fe<br />
2 Fe+ 3 Br 2 → 2 FeBr 3 Oxidationsmittel: Br 2<br />
Reduktion