Leseprobe (pdf) - Wissenschaft Online
Leseprobe (pdf) - Wissenschaft Online
Leseprobe (pdf) - Wissenschaft Online
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
O<br />
Br +<br />
O<br />
O<br />
Br<br />
Br<br />
H<br />
H<br />
Isomerisierung<br />
H<br />
α-Bromketon<br />
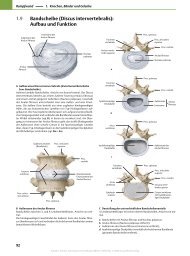
2.1 Cholesterin und verwandte Sterine 65<br />
- HBr<br />
Im nächsten Schritt erfolgt eine Isomerisierung über das entsprechende Enol<br />
zum stabileren Bromketon. Die thermodynamische Stabilität ergibt sich sowohl<br />
aus dem Dipoleffekt als auch aus der 1,3-diaxialen Wechselwirkung. Bei den 2-<br />
Brom- bzw. 4-Brom-oxo-Steroiden überwiegt der sterische Effekt. Dagegen überwiegt<br />
in sterisch nicht fixierten Verbindungen, wie z. B. im α-Bromcyclohexanon,<br />
der Dipoleffekt. Die bevorzugte Konformation der Bromverbindungen<br />
ist diejenige, in der der Substituent die axiale Position einnimmt.<br />
H<br />
Br<br />
O<br />
Die Regioselektivität bei der Bromierung von 3-Ketonen hängt von der Richtung<br />
der Enolisierung ab. In der 5α-Reihe (Cholestanon) ist die 2-Doppelbindung<br />
stabiler als das 3-Alken. Dagegen ist in der 5β-Reihe (Koprostanon) das 3-Alken<br />
bevorzugt.<br />
Cholesterinderivate sind pharmakologisch interessant aufgrund ihrer Wirkung<br />
auf die Cholesterinbiosynthese. Die Kontrolle dieser Biosynthese sollte die Cholesterinmenge<br />
im Blut reduzieren, womit eine Verhinderung bzw. Behandlung von<br />
Arteriosklerose möglich sein sollte.<br />
HO<br />
HO<br />
HO<br />
Br +<br />
Br +<br />
Br<br />
H<br />
Br<br />
O<br />
Br<br />
Br<br />
H<br />
H<br />
H