BỘ ĐỀ THI+HƯỚNG DẪN CHẤM CHÍNH THỨC CÁC SỞ GIÁO DỤC KÌ THI CHỌN HỌC SINH GIỎI CẤP TỈNH LỚP 9 THCS NĂM HỌC 2011-2012 MÔN HÓA HỌC
LINK DOCS.GOOGLE: https://drive.google.com/file/d/0B_NNtKpVZTUYSGNvaGlNdVl0LXM/view?usp=sharing
LINK DOCS.GOOGLE:
https://drive.google.com/file/d/0B_NNtKpVZTUYSGNvaGlNdVl0LXM/view?usp=sharing
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
www.twitter.com/daykemquynhon<br />
www.google.com/+DạyKèmQuyNhơn<br />
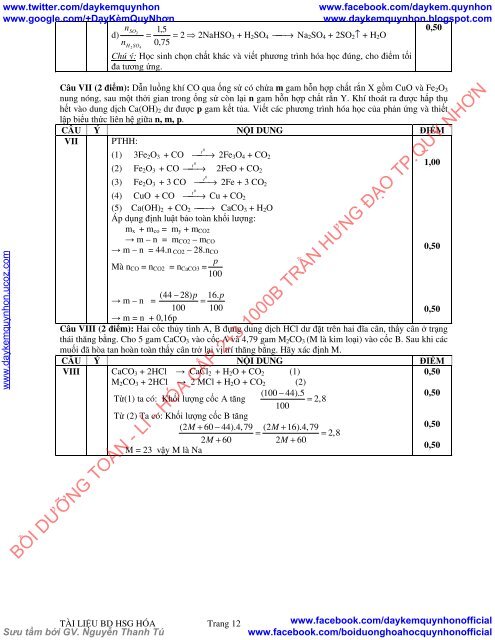
nSO<br />
1,5<br />
2<br />
d) = = 2<br />
n 0,75<br />
H 2SO4<br />
⇒ 2NaHSO 3 + H 2 SO 4 ⎯ ⎯→ Na 2 SO 4 + 2SO 2 ↑ + H 2 O<br />
www.facebook.com/daykem.quynhon<br />
www.daykemquynhon.blogspot.com<br />
0,50<br />
Chú ý: Học sinh chọn chất khác và viết phương trình hóa học đúng, cho điểm tối<br />
đa tương ứng.<br />
www.daykemquynhon.ucoz.com<br />
Câu VII (2 điểm): Dẫn luồng khí CO qua ống sứ có chứa m gam hỗn hợp chất rắn X gồm CuO và Fe 2 O 3<br />
nung nóng, sau một thời gian trong ống sứ còn lại n gam hỗn hợp chất rắn Y. Khí thoát ra được hấp thụ<br />
hết vào dung dịch Ca(OH) 2 dư được p gam kết tủa. Viết các phương trình hóa học của phản ứng và thiết<br />
lập biểu thức liên hệ giữa n, m, p.<br />
CÂU Ý NỘI DUNG ĐIỂM<br />
VII PTHH:<br />
t<br />
(1) 3Fe 2 O 3 + CO ⎯→ 2Fe 3 O 4 + CO 2<br />
t<br />
(2) Fe 2 O 3 + CO ⎯⎯→<br />
0<br />
2FeO + CO 2<br />
t<br />
(3) Fe 2 O 3 + 3 CO ⎯⎯→<br />
0<br />
2Fe + 3 CO 2<br />
t<br />
(4) CuO + CO ⎯⎯→<br />
0<br />
Cu + CO 2<br />
(5) Ca(OH) 2 + CO 2 ⎯ ⎯→ CaCO 3 + H 2 O<br />
Áp dụng định luật bảo toàn khối lượng:<br />
m x + m co = m y + m CO2<br />
→ m – n = m CO2 – m CO<br />
→ m – n = 44.n CO2 – 28.n CO<br />
p<br />
Mà n CO = n CO2 = n CaCO3 = 100<br />
⎯ 0<br />
(44 − 28) p 16. p<br />
→ m – n = =<br />
100 100<br />
→ m = n + 0,16p<br />
0,50<br />
Câu VIII (2 điểm): Hai cốc thủy tinh A, B đựng dung dịch HCl dư đặt trên hai đĩa cân, thấy cân ở trạng<br />
thái thăng bằng. Cho 5 gam CaCO 3 vào cốc A và 4,79 gam M 2 CO 3 (M là kim loại) vào cốc B. Sau khi các<br />
muối đã hòa tan hoàn toàn thấy cân trở lại vị trí thăng bằng. Hãy xác định M.<br />
CÂU Ý NỘI DUNG ĐIỂM<br />
VIII CaCO 3 + 2HCl → CaCl 2 + H 2 O + CO 2 (1)<br />
0,50<br />
M 2 CO 3 + 2HCl → 2 MCl + H 2 O + CO 2 (2)<br />
Từ(1) ta có: Khối lượng cốc A tăng<br />
(100 − 44).5<br />
0,50<br />
= 2,8<br />
100<br />
Từ (2) Ta có: Khối lượng cốc B tăng<br />
(2M<br />
+ 60 − 44).4,79 (2M<br />
+ 16).4,79<br />
0,50<br />
= = 2,8<br />
2M<br />
+ 60 2M<br />
+ 60<br />
0,50<br />
M = 23 vậy M là Na<br />
BỒI DƯỠNG TOÁN - LÍ - <strong>HÓA</strong> <strong>CẤP</strong> 2+3 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
1,00<br />
0,50<br />
TÀI LIỆU BD HSG <strong>HÓA</strong> Trang 12<br />
Sưu tầm bởi GV. Nguyễn Thanh Tú<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial