BỘ ĐỀ THI+HƯỚNG DẪN CHẤM CHÍNH THỨC CÁC SỞ GIÁO DỤC KÌ THI CHỌN HỌC SINH GIỎI CẤP TỈNH LỚP 9 THCS NĂM HỌC 2011-2012 MÔN HÓA HỌC
LINK DOCS.GOOGLE: https://drive.google.com/file/d/0B_NNtKpVZTUYSGNvaGlNdVl0LXM/view?usp=sharing
LINK DOCS.GOOGLE:
https://drive.google.com/file/d/0B_NNtKpVZTUYSGNvaGlNdVl0LXM/view?usp=sharing
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
www.twitter.com/daykemquynhon<br />
www.google.com/+DạyKèmQuyNhơn<br />
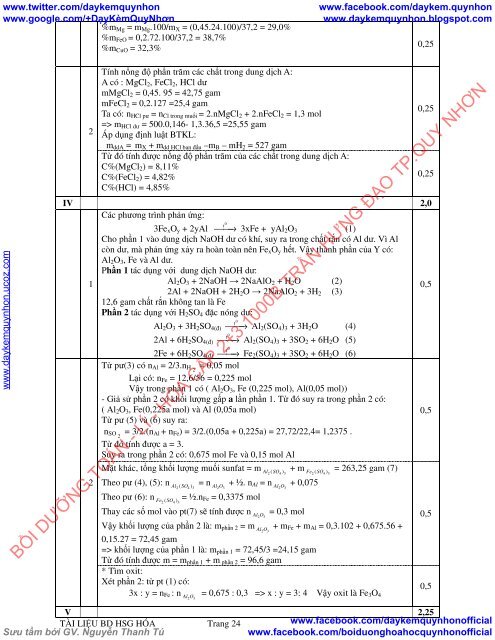
%m Mg = m Mg .100/m X = (0,45.24.100)/37,2 = 29,0%<br />
%m FeO = 0,2.72.100/37,2 = 38,7%<br />
%m CuO = 32,3%<br />
www.facebook.com/daykem.quynhon<br />
www.daykemquynhon.blogspot.com<br />
0,25<br />
www.daykemquynhon.ucoz.com<br />
2<br />
Tính nồng độ phần trăm các chất trong dung dịch A:<br />
A có : MgCl 2 , FeCl 2 , HCl dư<br />
mMgCl 2 = 0,45. 95 = 42,75 gam<br />
mFeCl 2 = 0,2.127 =25,4 gam<br />
Ta có: n HCl pư = n Cl trong muối = 2.nMgCl 2 + 2.nFeCl 2 = 1,3 mol<br />
=> m HCl dư = 500.0,146- 1,3.36,5 =25,55 gam<br />
Áp dụng định luật BTKL:<br />
m ddA = m X + m dd HCl ban đầu –m B – mH 2 = 527 gam<br />
Từ đó tính được nồng độ phần trăm của các chất trong dung dịch A:<br />
C%(MgCl 2 ) = 8,11%<br />
C%(FeCl 2 ) = 4,82%<br />
C%(HCl) = 4,85%<br />
IV 2,0<br />
Các phương trình phản ứng:<br />
1<br />
2<br />
0<br />
t<br />
3Fe x O y + 2yAl ⎯⎯→ 3xFe + yAl 2 O 3 (1)<br />
Cho phần 1 vào dung dịch NaOH dư có khí, suy ra trong chất rắn có Al dư. Vì Al<br />
còn dư, mà phản ứng xảy ra hoàn toàn nên Fe x O y hết. Vậy thành phần của Y có:<br />
Al 2 O 3 , Fe và Al dư.<br />
Phần 1 tác dụng với dung dịch NaOH dư:<br />
Al 2 O 3 + 2NaOH → 2NaAlO 2 + H 2 O (2)<br />
2Al + 2NaOH + 2H 2 O → 2NaAlO 2 + 3H 2 (3)<br />
12,6 gam chất rắn không tan là Fe<br />
Phần 2 tác dụng với H 2 SO 4 đặc nóng dư:<br />
0<br />
t<br />
Al 2 O 3 + 3H 2 SO 4(đ) ⎯⎯→ Al 2 (SO 4 ) 3 + 3H 2 O (4)<br />
0<br />
t<br />
2Al + 6H 2 SO 4(đ) ⎯⎯→ Al 2 (SO 4 ) 3 + 3SO 2 + 6H 2 O (5)<br />
0<br />
t<br />
2Fe + 6H 2 SO 4(đ) ⎯⎯→ Fe 2 (SO 4 ) 3 + 3SO 2 + 6H 2 O (6)<br />
Từ pư(3) có n Al = 2/3.n H 2<br />
= 0,05 mol<br />
Lại có: n Fe = 12,6/56 = 0,225 mol<br />
Vậy trong phần 1 có ( Al 2 O 3 , Fe (0,225 mol), Al(0,05 mol))<br />
- Giả sử phần 2 có khối lượng gấp a lần phần 1. Từ đó suy ra trong phần 2 có:<br />
( Al 2 O 3 , Fe(0,225a mol) và Al (0,05a mol)<br />
Từ pư (5) và (6) suy ra:<br />
n SO 2<br />
= 3/2.(n Al + n Fe ) = 3/2.(0,05a + 0,225a) = 27,72/22,4= 1,2375 .<br />
Từ đó tính được a = 3.<br />
Suy ra trong phần 2 có: 0,675 mol Fe và 0,15 mol Al<br />
Mặt khác, tổng khối lượng muối sunfat = m<br />
Al 2 ( SO 4 ) 3<br />
+ m<br />
Fe 2 ( SO 4 ) 3<br />
= 263,25 gam (7)<br />
Theo pư (4), (5): n<br />
Al 2 ( SO 4 ) 3<br />
= n + ½. n Al 2 O 3<br />
Al = n + 0,075<br />
Al 2 O 3<br />
Theo pư (6): n<br />
Fe 2 ( SO 4 ) 3<br />
= ½.n Fe = 0,3375 mol<br />
Thay các số mol vào pt(7) sẽ tính được n<br />
Al 2 O 3<br />
= 0,3 mol<br />
0,5<br />
Vậy khối lượng của phần 2 là: m phần 2 = m + m Al 2 O 3<br />
Fe + m Al = 0,3.102 + 0,675.56 +<br />
0,15.27 = 72,45 gam<br />
=> khối lượng của phần 1 là: m phần 1 = 72,45/3 =24,15 gam<br />
Từ đó tính được m = m phần 1 + m phần 2 = 96,6 gam<br />
* Tìm oxit:<br />
Xét phần 2: từ pt (1) có:<br />
3x : y = n Fe : n = 0,675 : 0,3 => x : y = 3: 4 Vậy oxit là Fe 0,5<br />
Al 2 O 3<br />
3O 4<br />
BỒI DƯỠNG TOÁN - LÍ - <strong>HÓA</strong> <strong>CẤP</strong> 2+3 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
0,25<br />
0,25<br />
0,5<br />
0,5<br />
V 2,25<br />
TÀI LIỆU BD HSG <strong>HÓA</strong> Trang 24<br />
www.facebook.com/daykemquynhonofficial<br />
Sưu tầm bởi GV. Nguyễn Thanh Tú<br />
www.facebook.com/boiduonghoahocquynhonofficial